丝胶蛋白应用于组织工程支架材料的研究进展
2015-03-24陈忠敏庞亚妮李江峰王富平
陈忠敏, 陈 枭, 庞亚妮, 李江峰, 王富平
(重庆理工大学 药学与生物工程学院,重庆 400054)
研究与技术
丝胶蛋白应用于组织工程支架材料的研究进展
陈忠敏, 陈 枭, 庞亚妮, 李江峰, 王富平
(重庆理工大学 药学与生物工程学院,重庆 400054)
家蚕丝胶蛋白是一种由18种氨基酸组成的优质高分子蛋白质材料,近年来逐步被应用到生物材料领域并得到重视。文章在介绍丝胶蛋白结构及其独特的溶胶-凝胶转换性能的基础上,提出应用于医学组织工程材料领域家蚕丝胶蛋白应注重性质稳定性的观点,综述了近年来丝胶蛋白在组织工程支架材料领域的研究现状与进展,指出了丝胶蛋白在医学组织工程材料领域应用时必须解决的关键问题。
丝胶蛋白; 组织工程支架材料; 生物相容性; 蛋白质结构
在器官移植供体极为缺乏的今天,组织工程的发展为需要各类器官的病患者带来了福音。组织工程的核心技术在于:模拟体内组织发生的环境,构建由功能细胞、生物材料和生物活性分子所组成的三维空间复合体,用以制造、修复直至替代组织和器官[1]。其中生物支架是为种子细胞的黏附生长、增殖、凋亡等提供场地,其性能极为重要,影响着组织器官的最终形成。现有组织工程支架存在着主动捕获细胞、诱导组织生长能力弱的关键性缺陷,功能化组织工程支架材料的开发与研究成为了热点问题。
基于生物支架材料对原材料的生物相容性有特殊要求,天然高分子材料较合成材料有明显优势。天然材料中,胶原蛋白、纤维蛋白等蛋白质类和壳聚糖等多糖类被使用得较多,蚕丝蛋白的天然优势使其在服用功能外被关注于在生物材料领域的应用。
蚕丝蛋白主要来自于家蚕,在中国已有几千年的历史。家蚕属于完全变态的鳞翅目蚕蛾科昆虫,家蚕丝蛋白是一种优质的高分子动物蛋白,包括丝素蛋白和丝胶蛋白。在蚕丝丝素和丝胶两种蛋白质中,丝胶包覆于丝素外面对丝素起保护和黏合作用,由于其结构特点,从古至今的丝绸生产中,丝胶必须在经过缫丝、精练等工艺后被除去,否则丝绸服用性能会变差。在生物材料的应用方面,人们也是将视线首先放在了属于纤维蛋白的丝素上,丝胶蛋白由于其性状变化大,性能较难调控而未受重视。随着组织工程支架材料研究的发展,丝胶所显示出和丝素蛋白不同的性能特征及优势使其越来越引起重视。本文就丝胶蛋白的结构性能及其在组织工程支架材料领域的可行性研究、应用研究等进行综述。
1 家蚕丝胶蛋白的结构与性能研究结果
蚕丝蛋白主要由丝胶和丝素两种蛋白质组成,其中丝素约占茧层质量的70%~80%,丝胶蛋白包覆于丝素外围约占茧层质量的20%~30%。研究表明,丝胶的相对分子质量因提取部位、方法,以及测定技术、方法的不同而差异较大,其相对分子质量从约为1.4万到31.4万均有报道。丝胶由18种氨基酸组成,其中含量最多的是丝氨酸、天门冬氨酸和甘氨酸,相对含量分别达到33%,15%,13%(表1[2])。丝胶氨基酸组成中含有强极性侧基(如―OH,―COOH,―NH2等)的氨基酸含量接近70%;同时,丝胶的二级结构以无规卷曲为主,含部分β折叠构象,不含或含少量α螺旋结构,这意味着丝胶内部结晶区较少,多为吸水性好的无规结构。因此,丝胶是一种水溶性较好的天然球状蛋白[2]。

表1 丝胶氨基酸组成Tab.1 Amino acid composition of sercin
蚕丝胶蛋白的分子结构中,既有酸性基团(―COOH),又有碱性基团(―NH2、―OH),可相互作用形成双极离子,呈两性性质,且其中酸性氨基酸含量略大于碱性氨基酸含量,因此丝胶是一种弱酸性蛋白。其离子存在形式随着溶液pH值的高和低,分别以负离子形式和正离子形式存在。丝胶蛋白的相对分子质量较大,其粒子直径约为1~100 nm,该大小属于胶体粒子的范围,因而丝胶显示出较好的胶凝、胶溶性质,尤其当溶液pH值接近于它的等电点时(pH值为3.8~4.5),丝胶凝聚、凝胶现象明显[3]。丝胶具有良好的吸水澎润性质,其吸水到一定程度后,丝胶蛋白质大分子的无规卷曲结构转化为β折叠,此时丝胶分子与水分子之间形成氢键结合,构成网络结构而发生胶凝作用。而当丝胶凝胶置于热水中时,氢键易被离解,网络结构被破坏,进而转化为溶液,故其为可逆性凝胶[4-5]。
关于丝胶蛋白的结构特征,朱良均等[6-7]对其进行了深入研究与探讨,比较了家蚕绢丝腺内取出的丝胶蛋白和热水溶出的丝胶蛋白横断面结构、相对分子质量及分布等,得到结论为:绢丝腺内取出的丝胶蛋白横断面呈一同心圆的层状结构;在成茧丝时会由于吐丝时牵引、嵌合、分子链切断等原因使其横断面呈大、小相对分子质量的混合构造,热水溶出丝胶呈层状结构,也是由于丝胶在热水溶出过程中分子被降解形成。正是由于这些结构特性,使得丝胶蛋白表现出了较强的性质环境易变性。而导致其性质稳定性差的因素除热水外,还有pH值、温度或有机溶剂等[8],这些因素变化时,将发生丝胶蛋白理化性质的改变,表现为溶解性下降,并导致生物活性发生变化。另一方面,张瑶琴等[9]的研究结果表明,从茧层或茧衣等上面提取丝胶蛋白时,同一方法和环境下提取的丝胶其部分性质可以保持一定的稳定,具备一定的再现性。这一结论对丝胶蛋白在组织工程材料上的开发应用等研究具有参考意义。
2 丝胶在组织工程支架材料的应用可行性研究
组织工程支架材料必须具备生物相容性和可控生物降解性,迄今为止的研究表明丝胶蛋白具有这样的性质。
2.1 丝胶蛋白质的生物相容性研究
生物相容性是一个较大的概念,现有评价技术标准中内容繁多,主要仍在于对材料的组织相容性和细胞相容性、血液相容性的评价方面。根据现有研究结果,丝胶具有良好的细胞相容性。日本学者寺田聪[10]在无血清培养基中添加丝胶蛋白,研究丝胶蛋白对动物细胞培养的效用性。结果显示,丝胶蛋白有促进杂交瘤细胞的增殖效应,而且经高压蒸汽灭菌后的丝胶蛋白,与过滤除菌后的丝胶蛋白显示出了相同的促细胞增殖效果。丝胶蛋白还显示出了显著的促人胎儿肾细胞株293、Hela细胞、Balb3T3小鼠纤维芽细胞等的促细胞生长性能。
Minoura N等[11]采用丝胶、丝素或两者混合物制得的各种膜,进行小鼠成纤细胞L929的培养,观察成纤细胞的黏附情况和增殖速度发现,由丝胶、丝素单独制备的膜上细胞均表现出良好的附着和增殖性,其对细胞黏附和增殖的促进作用与常用的哺乳动物细胞培养基(胶原质)性能相当。
坪内纮三等[12]发现丝胶蛋白作为医疗材料(器官形成材料、血管内皮形成材料),生物工程材料(细胞培养床),化妆材料(皮肤护理产品)时能促进细胞生长。
盛伟华等[13]研究了不同蚕丝蛋白材料对鼠胚表皮细胞的毒性,及其影响细胞增殖的因素等,采用了MTT法及活细胞计数法进行观察检测,结果显示鼠胚表皮细胞在不论是丝素还是丝胶的各型蚕丝蛋白材料上生长,其增殖活力与细胞对照组相当(P>0.05),其中丝胶材料细胞毒性分级为0级(无毒),且活细胞计数结果与 MTT检测结果一致,结论表明各型蚕丝蛋白材料均无明显细胞毒性,能支持鼠胚表皮细胞正常生长,具有良好的细胞相容性,但其同时也指出了微量化学试剂的残留都将会使材料带上细胞毒性。
陈忠敏等[14]分别从茧层和茧衣中提取丝胶蛋白,以及将从茧层中提取的丝胶进行酶解获取小分子丝胶蛋白多肽。采用MTT法测试了各梯度浓度下丝胶对L-929细胞的相对增殖率影响,结果表明:不同条件下提取、制备的丝胶蛋白RGR毒性评分均显示为对细胞无毒性,且随着丝胶浓度的增大对L-929细胞具有生长促进作用,如图1所示。
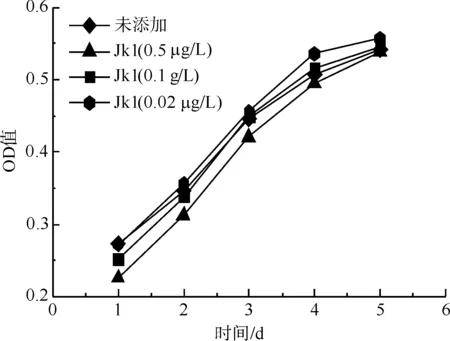
图1 L-929细胞在含不同质量浓度的茧层丝胶(Jk1)的培养基中的生长曲线Fig.1 Growth curves of L-929 cells in culture medium containing cocoon shell sericin (Jk1) of different mass concentrations
而Aramwit P等[15]对丝胶的生物相容性进行了进一步研究。Aramwit P等选取了2只小鼠做背部全层皮肤创面实验,实验结果显示:如果伤口用丝胶蛋白处理过,就很少会有炎症的发生,不仅如此,在整个的实验周期内,用丝胶蛋白处理过的创口会有明显的减小,伤口处有了很好的愈合。
Yang M等[16]制备了柞蚕丝胶膜,然后将丝胶蛋白膜浸入到磷酸钙溶液中研究其生物矿化的能力。通过抑制磷酸钙沉淀,硝酸银染色等实验进行测定,共同的实验结果表明,柞蚕丝胶蛋白具有吸附Ca的能力。SEM表明球形晶体能在丝胶蛋白膜上成核,通过FTIR和XRD可以证明这些晶体是羟基磷灰石。这就表明丝胶蛋白膜具有生物矿化的能力。除此之外,他们还利用MG-63细胞进行了细胞黏附和细胞生长活性实验,表明丝胶蛋白膜对MG-63细胞具有优异的生物相容性。
2.2 丝胶蛋白质的溶解性相关研究
组织工程支架材料必须具备可控生物降解性,但对丝胶蛋白的降解性能及降解原理的直接性研究进行得很少。由于组织工程材料在纯水或体液、血液环境下使用的情况较普遍,其水溶性大小可间接推断其降解性。早在20世纪40—80年代,日本金子英雄、小松计一等[2]就对丝胶的相对分子质量、氨基酸组成和丝胶蛋白质三级结构等进行了深入研究,提出著名的“A、B”丝胶论;后来Lucas F等[17]提出“Ⅰ、Ⅱ、Ⅲ、Ⅳ”丝胶论,指出丝胶蛋白从与丝素直接接触面开始到最外围,其水溶性是逐渐增加的,说明相对于丝素蛋白的性状同一性。现在通过缫丝废水提取,或从茧层、茧丝等中提取出来的丝胶是一个氨基酸组成、结晶结构、溶解性能均有差异的多种丝胶的混合物。这种性质差异混合丝胶的使用,是否会对其生物降解性能带来不确定性或不可控性,这方面的研究亟待开展。
张瑶琴等[9]采用同等提取条件从蚕茧茧层、茧衣中提取了丝胶蛋白质,以及采用中性蛋白酶酶解茧层丝胶制备了小分子丝胶蛋白肽,经过干燥制成样品。将样品配成质量分数为10%的悬浮液,于25 ℃中振荡保温1 h后,高速离心取上清液烘干称重,得到溶出的丝胶蛋白质量,并计算其溶解率。结果表明,从成茧中以同样提取工艺、条件下获得的丝胶性状较为稳定,具再现性。而从茧层、茧衣中提取的丝胶蛋白质溶解率约为20%,这20%左右的溶解物可能是最外层丝胶,而剩下80%的不溶解物可能是丝胶Ⅱ、Ⅲ、Ⅳ。该研究指出了丝胶溶解性与其氨基酸组成和相对分子质量大小相关,经过中性蛋白酶酶解制备的小分子量丝胶蛋白肽的溶解率是非酶解提取丝胶溶解率的4倍以上。
实际上,根据丝胶蛋白质分子三级结构,其18种氨基酸组成的球状蛋白质立体结构用X射线衍射分析时,在空间上其肽链具有结构域部分,存在较大空间缝隙,结构域间能做相对运动,这种结构可以推测其具备生物降解性。
2.3 丝胶在组织工程支架材料的应用现状及进展
丝胶蛋白作为一种天然高分子材料,具有良好的生物相容性,能够为复合细胞提供支撑,促进细胞增殖。但是丝胶蛋白力学性能较差,生物降解性能还有差异,将其应用在组织工程支架时,通常须与其他材料复合制成。
饶建伟等[18]采用丝胶、丝素共混制备丝蛋白溶液,再以氯化钠为制孔剂制备得到三维多孔的丝蛋白支架材料,扫描电镜观察发现,该支架材料孔隙均匀相互贯通;同时当丝胶蛋白的含量≥6%时支架材料的压缩回弹率可达到100%,表明该支架材料的机械性能随着丝胶蛋白含量的增加而增大,脂肪干细胞(ADSCs)-支架复合培养14 d后,进行组织学观察,结果显示:ADSCs能很好地黏附于支架材料上,细胞形态良好;材料植入SD大鼠体内60 d后进行了组织学观察,结果显示:支架材料降解缓慢,有轻微的炎症反应且含不同丝胶蛋白比例的支架浸润程度无明显的差异。这一结论为进一步研究高机械性能的丝蛋白支架材料奠定了基础。
李海滨等[19]采用聚己内酯、丝胶通过静电纺丝技术制备得到一种三维多孔支架;将人皮肤成纤维细胞附着于该支架材料上进行共培养,扫描电镜观察支架材料内部结构及细胞在支架材料上增值与黏附状况,结果显示:通过静电纺丝技术制备得到的PCL/SS支架材料,内部呈相互贯通的三维多孔结构,且纤维具有较高的精细度和均一度,同时,丝胶蛋白的二级结构并未发生明显变化;丝胶蛋白的加入,改善了支架材料的亲水性,也增强了人皮肤成纤维细胞在材料上的黏附和增殖。
王琳婷等[20]利用丝胶蛋白含有的羧基和羟基能与Ca2+紧密结合的特点,将氢氧化钙和磷酸以湿法合成的羟基磷灰石,按一定的比例加入到浓缩后的丝胶蛋白溶液中,经冷冻干燥制备成丝胶蛋白/羟基磷灰石复合支架材料,期望用于骨替代和骨缺损修复。结果表明,丝胶蛋白/羟基磷灰石复合支架材料的孔隙分散均匀,孔隙率达到了33.0%~62.5%;支架材料中的羟基磷灰石呈弱结晶态,与人体骨组织中羟基磷灰石的晶体态相似,丝胶蛋白分子呈β折叠结构;随着复合支架材料中羟基磷灰石的比例增加,材料的热分解温度提高,热学性能改善,当HA的质量分数达到50%时,弹性模量增大到15.64 MPa,呈现较好的结构性能。
陈忠敏等[21]制备了丝胶/壳聚糖/甘油磷酸钠温敏性复合凝胶拟应用于肝脏组织工程支架。研究得到了不同配比的丝胶/壳聚糖/甘油磷酸钠复合材料,其可在20 ℃以下长时间保持液态,在体温环境(37±5)℃附近、大范围的生理pH值为6.9~7.45下快速凝胶化,适合注射型组织工程支架使用。对其结构性能、细胞毒性及对BRL大鼠肝细胞促生长性能等进行了全面分析,该凝胶具备较大的贯通三维孔结构,具有较好的力学强度、良好的生物降解性,其降解速率可通过丝胶用量进行调控,安全无毒,并具备了促BRL大鼠肝细胞生长性能。
陈忠敏等[22]还制备了丝胶/聚乙二醇/淀粉凝胶膜状组织工程支架材料,丝胶/聚乙二醇质量比为3/7,添加淀粉质量分数为18 %时,凝胶膜力学性能最优;不同配比丝胶/聚乙二醇/淀粉复合凝胶膜材料均具备降解性,且降解速率可以通过丝胶/聚乙二醇比例及淀粉含量得到调控。
Nayak S[23]制备得到的以丝胶为基质通过京尼平进行交联的支架材料,通过3D培养能很好地促进皮肤成纤维细胞和角质细胞的生长,并且能够促进伤口的愈合,有重建皮肤表皮层的功能,有望应用到人工皮肤的移植。
3 结论与展望
综上所述,丝胶蛋白质是一类可持续获得的蛋白质资源,其具有凝胶化性能,水溶性、生物可降解性优于丝素。丝胶蛋白质的生物相容性很好,可促进细胞快速黏附和增殖,诱导细胞分化,促进组织长成。
作为一种含有18种氨基酸的球状蛋白质,其作为促进细胞生长、组织再生等的载体并完成了组织再生的目的后,还能被人体组织所吸收,进入人体循环代谢,提供康复营养。基于众多优势,丝胶作为组织工程支架的研究备受关注,正逐渐成为生物医学领域最有前景的生物材料之一[24-26]。
丝胶作为组织工程材料具备了一定的优势,但仍然存在对其研究不足等问题。未来对丝胶蛋白用于组织工程材料应用方面,还必须解决的问题包括:1)免疫原性;2)结构性状非均一性导致性质稳定性差;3)是否具备特异性的分子识别信号,具有促进组织生长能力;4)具备智能化主动捕获细胞,等等。
[1]熊党生.生物材料与组织工程[M].北京:科学出版社,2010:222-223. XIONG Dangsheng. Biomaterials and Tissue Engineering[M]. Beijing: Science Press,2010:222-223.
[2]小松计一.丝胶的化学与构造[M].长野:日本信州大学,1980:379-388. KOMATSU Kenichi. The Chemistry and Structure of Sericin[M]. Nagano-ken: Shinshu University,1980:379-388.
[3]李庆春.蚕丝丝胶蛋白的回收及开发应用[J].纺织科技进展,2007(2):5-10. LI Qingchun. The recovery and application of silk sericin[J]. Progress in Textile Science & Technology,2007(2):5-10.
[4]王伟,齐鲁.丝胶蛋白材料的研究与应用进展[J].丝绸,2009(11):38-41. WANG Wei, QI Lu. The sericin protein material’s research and the application progresses[J]. Journal of Silk,2009(11):38-41.
[5]朱良均,李幼禄,平林洁,等.丝胶凝胶物理性状的研究[J].蚕业科学,1997,23(1):47-52. ZHU Liangjun, LI Youlu, HIRABAYASHI Kiyoshi, et al. Study on the physical properties of sericin gel[J].Science of Sericulture,1997,23(1):47-52.
[6]朱良均,荒井三雄,平林潔.绢丝腺内丝胶与茧层丝胶性状的比较[J].日本蚕系学杂志,1995,64(3):209-213. ZHU Liangjun, ARAI Mitsuo. HIRABAYASHI Kiyoshi. Characters comparison of silk gland sericin and cocoon shell sericin[J]. Nihon Sanshigaku Zasshi,1995,64(3):209-213.
[7]朱良均,姚菊明.家蚕丝胶蛋白结构的探讨[J].科技通报,1998,14(4):234-239. ZHU Liangjun, YAO Juming. Structure of Bombyx mori sericin protein[J]. Bulletin of Science and Technology,1998,14(4):234-239.
[8]陈华,朱良均,闵思佳,等.蚕丝丝胶蛋白的结构、性能及利用[J].功能高分子学报,2001,14(3):344-348. CHEN Hua, ZHU Liangjun, MIN Sijia, et al. Structure, property and utilization of silk sericin[J]. Journal of Functional Polymer,2001,14(3):344-348.
[9]张瑶琴,陈忠敏,张艳冬,等.丝胶蛋白分子结构及其制取条件[J].中国组织工程研究与临床康复,2011,15(3):468-472. ZHANG Yaoqin, CHEN Zhongmin, ZHANG Yandong, et al. Structure and extraction conditions of sericin protein[J]. Journal of Clinical Rehabilitative Tissue Engineering Research,2011,15(3):468-472.
[10]寺田聪.丝胶对杂交瘤细胞增殖的作用[C]//化学工业学会第67届年会研究发表要旨集.北京:化学工业学会,2002:974. TERADA Satoshi. Effects of sericin on hybridoma cell proliferation[C]// The 67th Annual of the Chemical Industry Society. Beijing: The Chemical Industry Society,2002:974.
[11]MINORA N, AIBA S, GOTOH Y, et al. Attachment and growth of cultured fibroblast cells on silk protein matrices[J]. Journal of Biomedical Materials Research,1995,29(10):1215-1221.
[12]坪内纮三,山田弘生,高须阳子.含有丝胶蛋白的材料,其生产和使用方法:中国,CN01805531.1[P].2003-03-26. TSUBOUCH K, YAMADA H, TAKASU Y. The Materials Containing Sericin Protein: Its Production and Use-Method: China, CN01805531.1[P].2003-03-26.
[13]盛伟华,谢字锋,缪竞诚,等.蚕丝蛋白材料对鼠胚表皮细胞毒性的实验研究[J].苏州大学学报:医学版,2005,25(4):551-554. SHENG Weihua, XIE Yufeng, MIAO Jingcheng, et al. Study on cytotoxity of silk protein materials to rat embryo epithelial cells[J]. Suzhou University Journal of Medical Science,2005,25(4):551-554.
[14]陈忠敏,罗琴,张瑶琴,等.丝胶蛋白的细胞相容性和抗菌性能研究[J].丝绸,2012,49(11):1-5. CHEN Zhongmin, LUO Qin, ZHANG Yaoqin, et al. Cytocompatibility and antibacterial properties of sericin proteins[J]. Journal of Silk,2012,49(11):1-5.
[15]ARAMWIT P, SANGCAKUL A. The effects of sericin cream on wound healing in rats[J]. Bioscience, Biotechnology, and Biochemistry,2007,71(10):2473-2477.
[16]YANG M, MANDAL N, SHUAI Y, et al. Mineralization and biocompatibility of antheraea pernyi silk sericin film for potential bone tissue engineering[J]. Bio-Medical Materials and Engineering,2014,24(1):815-824.
[17]LUCAS F, SHAW J T B, SMITH S G. Amino-acid composition of the silk of chrysopa egg-stalks[J]. Nature,1956(178):861-863.
[18]饶建伟,沈俊,全大萍,等.三维多孔共混丝蛋白支架的性能研究[J].中国修复重建外科杂志,2009,23(10):1264-1270. RAO Jianwei, SHEN Jun, QUAN Daping, et al. Property studies on three-dimensional porous blended silk scaffolds[J]. Chinese Journal of Reparative and Reconstructive Surgery,2009,23(10):1264-1270.
[19]李海滨,李林昊,钱宇娜,等.PCL/SS纳米纤维支架的制备及相容性研究[J].生物医学工程学杂志,2011,28(2):305-309. LI Haibin, LI Linhao, QIAN Yuna, et al. Preparation and cytocompatibility study of poly(ε-caprolactone)/silk sericin nanofibrous scaffolds[J]. Journal of Biomedical Engineering,2011,28(2):305-309.
[20]王琳婷,杨明英,朱良均,等.丝胶蛋白/羟基磷灰石复合支架材料的制备及性能研究[J].蚕业科学,2010,36(4):639-644. WANG Linting, YANG Mingying, ZHU Liangjun, et al. Preparation and performance of silk sericin/hydroxyapatite composite bone scaffold[J]. Acta Sericologica Sinica,2010,36(4):639-644.
[21]陈忠敏,熊佳庆,王锐,等.一种温敏性溶胶-凝胶转化材料的制备方法:中国,CN102433006 B[P].2014-01-02. CHEN Zhongmin, XIONG Jiaqing, WANG Rui, et al. A Method of Conversion Material for Thermo- Sensitive Sol-Gel: China, CN102433006 B[P].2014-01-02.
[22]陈忠敏,熊佳庆,廖大刚,等.丝胶/PVA/玉米淀粉共混凝胶膜的制备及其体外降解调控研究[J].功能材料,2012,43(4):457-461. CHEN Zhongmin, XIONG Jiaqing, LIAO Dagang, et al. Preparation and in vitro degradation performance control of composite gel-film consisted of silk sericin/polyvinyl alcohol/maize starch[J]. Journal of Functional Materials,2012,43(4):457-461.
[23]NAYAK S, DEY S, KUNDU S C. Skin equivalent tissue-engineered construct: co-cultured fibroblasts/keratinocytes on 3D matrices of sericin hope cocoons[J]. PlOS ONE,2013,8(9):e74779.
[24]ZHANG Y Q. Applications of natural silk protein sericin in biomaterials[J]. Biotechnology Advances,2002,20(2):91-100.
[25]陈华,朱良均,闵思佳,等.蚕丝丝胶蛋白的利用研究[J],东华大学学报:自然科学版,2002,28(3):133-135. CHEN Hua, ZHU Liangjun, MIN Sijia, et al. Progress of study on the utilization of silk sericin protein[J]. Journal of Donghua University: Natural Science Edition,2002,28(3):133-135.
[26]朱良均,姚菊明,李幼禄.蚕丝蛋白-丝胶和丝素凝胶特性的比较[J].科技通报,1998,14(1):12-16. ZHU Liangjun, YAO juming, LI Youlu. Comparation of silk protein gel property of silk sericin and fibroin[J]. Bulletin of Science and Technology,1998,14(1):12-16.
Research Progress of Application of Sericin Protein in Tissue Engineering Scaffold Materials
CHEN Zhongmin, CHEN Xiao, PANG Yani, LI Jiangfeng, WANG Fuping
(College of Pharmacy and Bioengineering, Chongqing University of Technology, Chongqing 400054, China)
Sericin protein of silkworm is a high-quality macromolecular protein material composed of 18 amino acids. In recent years, it has been applied in the field of biological material gradually and importance has been attached to it. This paper puts forward that sericin protein of silkworm applied in the field of medical tissue engineering material should pay attention to stable character on the basis of introducing sericin protein structure and its unique sol-gel transformation performance, summarizes the research status and progress of sericin protein in the field of tissue engineering scaffold materials in recent years and points out key problems of the application of sericin protein in the field of medical tissue engineering materials that must be solved.
sericin protein; tissue engineering scaffold materials; biocompatibility; protein structure
doi.org/10.3969/j.issn.1001-7003.2015.04.006
2014-10-03;
2014-12-16
重庆市科委科技攻关重点项目(CSTC2012ggb 10003)
陈忠敏(1968-),教授,主要从事功能材料、组织工程材料、药物缓控释材料的研究。
TQ314.1
A
1001-7003(2015)04-0025-06 引用页码: 041104
