稻瘟菌激发子的研究进展
2015-03-20王艳丽孙国昌
余 欢,姜 华,王艳丽,孙国昌
(1.杭州师范大学生命与环境科学学院,浙江 杭州310036;2.浙江省农业科学院植物保护与微生物研究所,浙江 杭州310021)
在植物与病原菌互作过程中,激发子是致病性的关键因素,能促发植物免疫反应和促使病原物侵染[1].激发子是病原菌分泌的一类特殊的蛋白质,能在植物界面或植物细胞内起作用[2-3].一些激发子,即无毒基因分泌的蛋白,能被寄主中相应的抗性基因蛋白直接或间接的识别,触发超敏反应[4].
稻瘟病是由稻瘟菌引起的重要病害,严重影响全球粮食产量安全[5].在我国也屡有大暴发,重病地区产量损失达40%~50%,局部田块甚至颗粒无收[6].经过多年的研究,抗性品种的选育和大面积推广被证明是防治稻瘟病最经济、最有效和最安全的解决方案[3,6].但是抗瘟品种连续使用3~5年后,抗性就会明显衰退,原因之一是寄主与稻瘟菌之间的互作[6].目前,激发子的研究是国际植物与病原互作领域研究的一个热点[7-9].因此,研究瘟菌激发子特别是无毒激发子,激发子的侵染机制以及在细胞内的转移机制,有利于研究稻瘟菌与水稻互作机制,实现水稻抗病的持久化.
1 稻瘟菌激发子
关于稻瘟菌激发子,有两种猜测:大部分激发子的毒力太低以至于在常规实验中不能检测到;激发子的活动是多向的,多个激发子参与相同的毒性途径[10].目前,已鉴定出15个稻瘟菌激发子(表1),其中9个是AVR 基因产物,能被水稻抗性基因R 产物识别,触发高敏反应[8],4 个活体营养相关分泌蛋白(BAS1,BAS2,BAS3,BAS4),以及最近鉴定出来的Slp1和MC69[4,11].然而,除了Slp1之外,这些激发子在稻瘟菌中的毒力活性仍是未知的[10].
1.1 非无毒基因分泌的激发子
Slp1在真菌细胞壁和水稻细胞膜界面积累,能结合几丁质,阻止几丁质诱导的免疫防御反应;Slp1对稻瘟菌毒性是必需的,并对组织侵染和病斑扩散表现出强烈的影响[12].Saitoh等[10]对稻瘟菌侵染的早期阶段的78个分泌蛋白进行大规模的断裂分析,鉴定出了基因MC69,编码54个氨基酸,N 端含有信号肽.MC69在稻瘟菌的附着胞侵入和致病性有重要作用,活细胞成像表明MC69在分生孢子和侵染的所有阶段表达,但并不转移进水稻细胞质.黄瓜炭疽菌中MC69的缺失使得该病菌对黄瓜叶片和本氏烟草叶片的致病性减弱.因此,MC69是稻瘟菌侵染单子叶植物和黄瓜炭疽菌侵染双子叶植物所必须的致病蛋白.然而,MC69的致病性或毒性仍是未知的[10].对BSA 进行荧光标记显示BSA1-4是以不同的模式分泌进入细胞,BAS1,BAS2随着无毒基因优先在活体营养界面复合物BIC处积累,然后转移进已经侵染的水稻细胞中,甚至移动到临近的未侵染的细胞中;BAS3位于细胞壁附近,BAS4围绕不断延伸的IH[11].
1.2 无毒基因分泌的激发子
在9个无毒基因编码的激发子中,ACE1编码长4035个氨基酸的多肽,是聚酮合酶和非核糖体多肽酶的复合物,这两种酶都与真菌的次生代谢相关[13].突变实验表明Ace1生物合成活性对无毒基因是必须的,很可能是稻瘟菌转移进水稻细胞后触发高敏反应过程中激发子的产物[13].Li等[20]通过图位克隆方法从菌株81278ZB15分离得到无毒基因Avr Piz-t,编码长108个氨基酸的分泌蛋白,该蛋白功能未知,在稻瘟菌和其他已测序的真菌中没有同源性蛋白.Park等[19]的研究表明AVRPiz-t在转基因水稻中的异位表达抑制flg22和几丁质诱导产生的活性氧以及提高对稻瘟菌的敏感性,暗示了AVRPiz-t可以抑制PTI信号途径;蛋白互作实验表明AVRPiz-t抑制水稻环指状E3泛素连接酶APIP6的活性;并提出一种新的机制:真菌激发子通过作用于寄主泛素蛋白酶系统来抑制寄主的PTI信号途径.
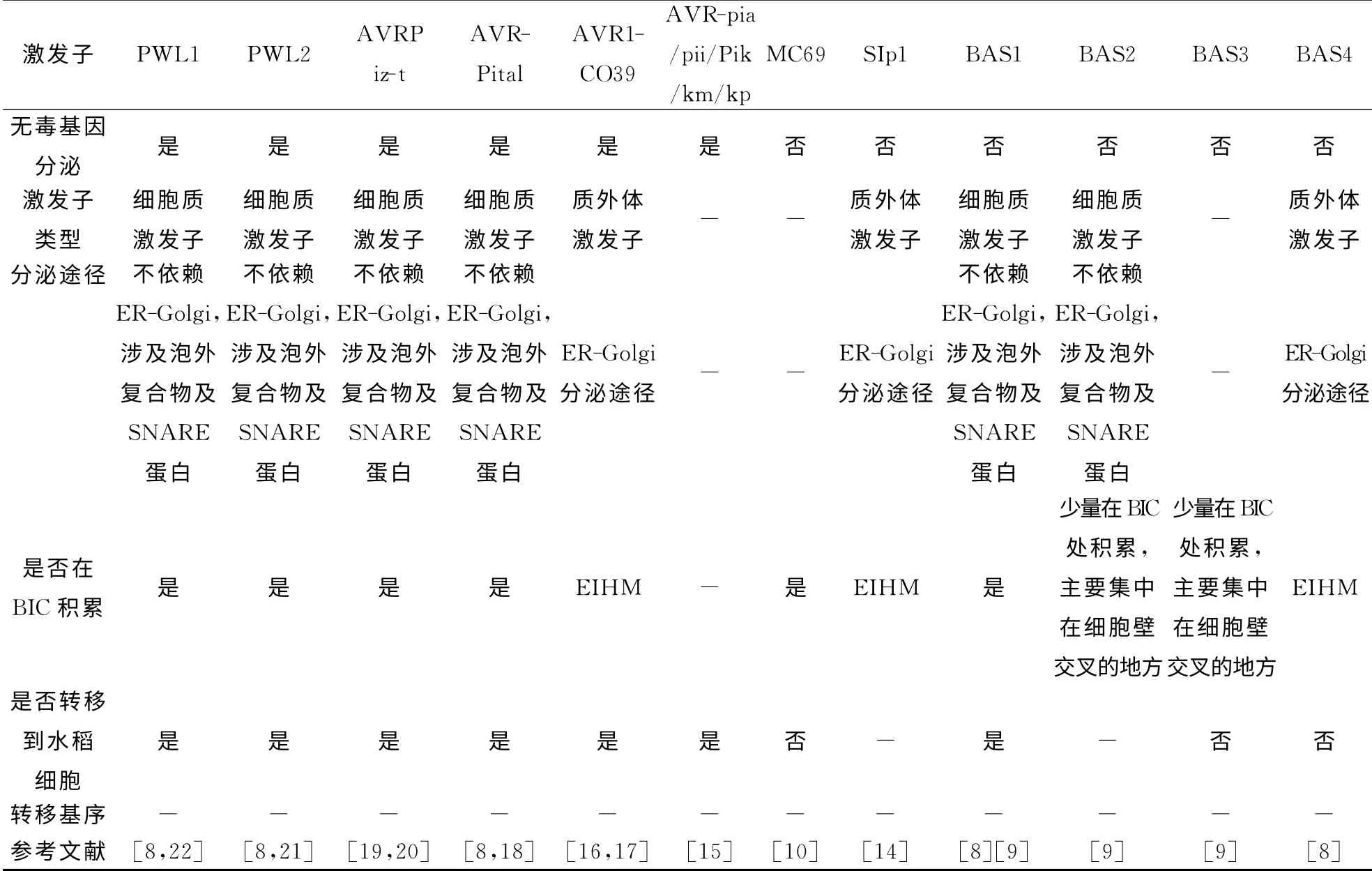
表1 稻瘟菌激发子的特征Tab.1 The characteristics of rice blast effector
2 激发子的分泌
丝状真菌稻瘟菌可以引起稻瘟病.稻瘟菌侵染寄主时,孢子先形成一个专门的侵染结构附着胞,产生巨大的细胞膨压穿过植物表皮[5],形成薄的管状初始菌丝(PH),初始菌丝随后膨大形成球根状的侵染菌丝(IH)[23].从形态学上来看,IH 限制在隔膜连接处,类似人类真菌病原物念珠菌产生的假丝状真菌[24].IH 随后在第一次入侵的细胞中扩展,逐渐占据整个细胞,然后侵入到邻近的细胞中.
对稻瘟菌分泌机制进行突变分析表明,激发子进入内质网后存在不同的分泌途径,例如,内质网分子伴侣LHS1是激发子的分泌所必需的,该基因发生突变后在BIC处不能累积激发子及不能形成Pita介导的HR 反应;ATP2可以编码位于高尔基体的P类型的ATP酶,仅与激发子的分泌和一些胞外酶有关,对缺失该基因的突变体进行研究发现,激发子的分泌可能是通过胞吐作用进行的[9].经过研究,Giraldo等[14]发现在稻瘟菌侵入水稻时,激发子蛋白的分泌有两条途径:质外体激发子包括Bas4,Bas113,Slp1,围绕IH 在EIHM 上积累,遵循常规的内质网—高尔基体分泌途径,对BFA 敏感,依赖高尔基体;细胞质激发子包括Pwl2,AVR-Pita,Bas1,Bas107也在EIHM 中积累并围绕初始菌丝和第一次形成的球根状的IH 细胞,但不会围绕在接下来形成的IH 细胞,这些细胞质激发子遵循非常规的分泌途径,对BFA 不敏感,涉及泡外复合物和SNARE蛋白.真菌泡外复合物Exo70和Sec5在稻瘟菌细胞质激发子的分泌机制中起作用,并导致这些激发子在BIC上的积累,这两个复合物突变后细胞质激发子分泌减少,但是在水稻细胞中仍能观察到,表明在该分泌系统中出现功能冗余[14].
Khang等利用活细胞成像技术定位了一个新结构,活体营养界面复合物(BIC),BIC 的形成分两个阶段,第一阶段与EIHM 膜帽相关,向初始菌丝和IH 顶点扩展;第二阶段与初始菌丝分化形成球根状的IH相关[8,23].在稻瘟菌入侵的第一个水稻细胞中形成的BIC可以通过其大小(直径大于1μm)和预测的位置(初始菌丝延伸形成的第一个侵入菌丝的侧面)所确定;而在随后侵染的水稻细胞中形成的BIC 只能通过荧光定位[8].Giraldo等提出证据表明BIC是由植物衍生出来的界面结构,位于真菌细胞膜和细胞壁外富含植物细胞膜和内质网的区域;此外,与BIC相关的球根状IH 细胞分泌细胞质激发子,通过BIC,转移到水稻细胞质.T-SNARESso1在BIC的正常形成中起重要作用,Sso1发生突变后,在初始菌丝中可以观察到第二个类似BIC的结构[14].在每个稻瘟菌新侵入的水稻细胞中,激发子首先在BIC处积累,当IH 在不断生长至整个细胞过程中,激发子会继续合成并转移到BIC,激发子在BIC处的优先积累与其启动子与信号肽编码序列相关[8].
3 激发子在寄主中的转移
植物病原菌,细菌、真菌、卵菌亚纲通过转移激发子蛋白进入寄主细胞,引起寄主内在的免疫反应[25].细菌是通过一个类型III的分泌系统(T3SS)转移进植物细胞质,而真菌和卵菌亚纲的转移机制虽不清楚,但与细菌有相似的过程[16,25].像RXLR 和LXLFLAK 这样的保守转移基序在卵菌亚纲中已经得到鉴定[25-26].在卵菌亚纲中激发子的N 端检测到高度保守的RXLR 基序,而且存在于所有已知的无毒基因中[27].在真菌中,转移基序对激发子进入细胞来说是必需和有效的,目前,已被鉴定的有4个:小麦黄斑叶枯病菌中的Tox A[28];共生担子真菌类双色蜡蘑中的MISP7[29];亚麻锈菌中的Avr L567和Avr M[30].然而,这些结构域没有任何的序列相似性或结构上的特性[16].在稻瘟菌中一些激发子也含有类似Lx AR 基序,但是这些基序在激发子转移过程中的功能仍然是未知的[19].
Kang等通过质壁分离观察到PWL2:FPs(图1A)转移到水稻细胞的细胞质中,并且在临近的没有侵染菌丝的水稻细胞中也观察到荧光;而BAS4:FPs(图1B)围绕侵染菌丝,不转移到水稻细胞中[8].同样,活细胞成像显示在BIC和水稻细胞核中均可以看到AVRPiz-t:mCherry:NLS发出的红色荧光,但是在临近的未侵染的水稻细胞核中没有观察到侵染菌丝,这一现象表明侵染菌丝可能先于AVRPiz-t转移到临近的未侵染的水稻细胞中[19].在稻瘟菌激发子转移过程中,effector:FPs融合蛋白会优先在BIC 处积累,表明该结构具有重要作用,并且,激发子转移到BIC时需要启动子的参与[8].相反,AVR1-CO39(图1C)的转移不需要启动子的参与,AVR1-CO39也不在BIC积累,而是分泌到位于真菌细胞壁和植物细胞膜的界面EIHM 处,随后AVR1-CO39通过某种机制进入植物细胞,该机制依赖于一种仍未知的转移基序,这种转移基序不同于之前描述的真菌序列如Tox A 中的RGD 基序或Avr L567中的疏水基序,这些基序在AVR1-CO39中没有.也不同于RXLR-like基序,尽管它在AVR1-CO39中存在,它对无毒性不是必须的,即AVR1-CO39通过某种不依赖于病原菌系统的机制被独立转运到水稻细胞中[16].
此外,N 端的信号肽序列,尽管在功能上高度保守,但能引导不同的分泌目标途径,决定转移的效率,甚至有后剪切功能[8].研究表明AVR1-CO39的信号肽是有功能的且指导其分泌[16].

图1 激发子转移示意图Fig.1 Model for effector translocation by M.oryzae
4 稻瘟菌无毒激发子与水稻的互作
稻瘟菌无毒基因编码的激发子与水稻抗病蛋白符合经典的“基因对基因”假说[31-32],当无毒基因发生变异后,具有对应抗病基因的寄主不能识别该变异菌株,导致病害的发生[33].AVR-Pita与Pita是稻瘟菌-水稻系统中第一个直接互作的例子[34].Jia等[35]通过酵母双杂交实验和体外结合实验的分析,发现AVRPita176可以直接与Pita的LRR 结合,当AVR-Pita176蛋白酶基序或Pita的LRD 单个氨基酸发生替换时会导致抗性的消失,并且这两个区域的相互作用也随之消失.而AVR-Pik与Pik的酵母双杂交实验则表明Pik的LRR 与AVR-Pik不发生相互作用,Pik的CC 结构域能与AVR-Pik发生相互作用,这在本氏烟草叶片中通过免疫共沉淀实验也得以证明[36].这为稻瘟菌-水稻相互作用的研究提供了新的方向.
此外,由于绝大数R 蛋白通过辅助蛋白间接地与病原物Avr相互作用,因此又提出了间接相互作用模式;另有学者提出转录调控模式,该模式中有些AVR 蛋白通过激活R 基因启动子调控元件,进而激活R 基因的大量表达,产生过敏性坏死[37].
5 展望
激发子在植物-真菌系统中占有非常重要的作用.近年来,稻瘟菌激发子的研究已取得较大进步.但是由于激发子从稻瘟菌转移到水稻中的过程精细复杂,仍有许多问题亟待解决.如绝大多数稻瘟菌激发子在侵染过程中确切的作用和在水稻中起作用的方式是未知的;卵菌亚纲中细胞质激发子N 端的RXLR 基序是激发子转移到植物细胞中所必须的,而稻瘟菌某些激发子也含有类似Lx AR 基序,但他们在转移过程中的作用仍然不清楚[19],甚至到目前为止,没有一篇文献报道稻瘟菌转移过程中依赖哪种转移基序(表1).此外,稻瘟菌无毒蛋白与水稻抗性蛋白之间的互作模式仍不完善,需要通过实验进一步的证明.因此,全面深入了解稻瘟菌激发子分泌及转移过程有利于研究水稻-稻瘟菌互作模式,从而形成更有针对性的水稻育种体系.
[1]Oliva R,Win J,Raffaele S,etal.Recent developments in effector biology of filamentous plant pathogens[J].Cell Microbiol,2010,12(6):705-715.
[2]Hogenhout S A,Van der Hoorn R A,Terauchi R,etal.Emerging concepts in effector biology of plant-associated organisms[J].Molecular plant-microbe interactions,2009,22(2):115-122.
[3]Liu J,Wang X,Mitchell T,etal.Recent progress and understanding of the molecular mechanisms of the rice-magnaporthe oryzae interaction[J].Molecular plant pathology,2010,11(3):419-427.
[4]Liu W,Liu J,Ning Y,etal.Recent progress in understanding PAMP-and Effector-triggered immunity against the rice blast fungus magnaporthe oryzae[J].Molecular plant,2013,6(3):605-620.
[5]Talbot N J,Wilson R A.Under pressure:Investigating the biology of plant infection by magnaporthe oryzae[J].Nature Reviews Microbiology,2009,7(3):185-195.
[6]孙国昌,杜新法,陶荣祥.水稻稻瘟病防治研究进展和21世纪初研究设想[J].植物保护,2000,26(1):33-35.
[7]郑月琴,林艳,何燕华,等.稻瘟菌效应蛋白研究进展[J].分子植物育种,2013,11(3):451-459.
[8]Khang C H,Berruyer R,Giraldo M C,etal.Translocation of magnaporthe oryzae effectors into rice cells and their subsequent cell-tocell movement[J].The Plant Cell Online,2010,22(4):1388-1403.
[9]Valent B,Khang C H.Recent advances in rice blast effector research[J].Current opinion in plant biology,2010,13(4):434-441.
[10]Saitoh H,Fujisawa S,Mitsuoka C,etal.Large-scale gene disruption in magnaporthe oryzae identifies mc69,a secreted protein required for infection by monocot and dicot fungal pathogens[J].PLoS pathogens,2012,8(5):e1002711.
[11]Mosquera G,Giraldo M C,Khang C H,etal.Interaction transcriptome analysis identifies magnaporthe oryzae bas1-4 as biotrophy-associated secreted proteins in rice blast disease[J].The Plant Cell Online,2009,21(4):1273-1290.
[12]Mentlak TA,Kombrink A,Shinya T,etal.Effector-mediated suppression of chitin-triggered immunity by magnaporthe oryzae is necessary for rice blast disease[J].The Plant Cell Online,2012,24(1):322-335.
[13]Böhnert HU,Fudal I,Dioh W,etal.A putative polyketide synthase/peptide synthetase from magnaporthe grisea signals pathogen attack to resistant rice[J].The Plant Cell Online,2004,16(9):2499-2513.
[14]Giraldo M C,Dagdas Y F,Gupta Y K,etal.Two distinct secretion systems facilitate tissue invasion by the rice blast fungus magnaporthe oryzae[J].Nature Communications,2013(4):1996.
[15]Yoshida K,Saitoh H,Fujisawa S,etal.Association genetics reveals three novel avirulence genes from the rice blast fungal pathogen magnaporthe oryzae[J].Plant Cell,2009,21(5):1573-1591.
[16]Ribot C,Césari S,Abidi I,etal.The magnaporthe oryzae effector AVR1-CO39 is translocated into rice cells independently of a fungalderived machinery[J].The Plant Journal,2013,74(1):1-12.
[17]Farman M L,Leong S A.Chromosome walking to the avr1-co39 avirulence gene of magnaporthe grisea:Discrepancy between the physical and genetic maps[J].Genetics,1998,150(3):1049-1058.
[18]Orbach M J,Farrall L,Sweigard J A,etal.A telomeric avirulence gene determines efficacy for the rice blast resistance gene pi-ta[J].The Plant Cell Online,2000,12(11):2019-2032.
[19]Park C-H,Chen S,Shirsekar G,etal.The magnaporthe oryzae effector avrpiz-t targets the ring e3 ubiquitin ligase apip6 to suppress pathogen-associated molecular pattern-triggered immunity in rice[J].The Plant Cell Online,2012,24(11):4748-4762.
[20]Li W,Wang B,Wu J,etal.The magnaporthe oryzae avirulence gene avrpiz-t encodes a predicted secreted protein that triggers the immunity in rice mediated by the blast resistance gene piz-t[J].Molecular Plant-Microbe Interactions,2009,22(4):411-420.
[21]Sweigard J A,Carroll A M,Kang S,etal.Identification,cloning,and characterization of pwl2,a gene for host species specificity in the rice blast fungus[J].The Plant Cell Online,1995,7(8):1221-1233.
[22]Kang S,Sweigard J A,Valent B.The pwl host specificity gene family in the blast fungus magnaporthe grisea[J].MPMI-Molecular Plant Microbe Interactions,1995,8(6):939-948.
[23]Kankanala P,Czymmek K,Valent B.Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus[J].The Plant Cell Online,2007,19(2):706-724.
[24]Crampin H,Finley K,Gerami-Nejad M,etal.Candida albicans hyphae have a spitzenkörper that is distinct from the polarisome found in yeast and pseudohyphae[J].Journal of Cell Science,2005,118(13):2935-2947.
[25]Whisson S C,Boevink P C,Moleleki L,etal.A translocation signal for delivery of oomycete effector proteins into host plant cells[J].Nature,2007,450:115-118.
[26]Schornack S,van Damme M,Bozkurt T O,etal.Ancient class of translocated oomycete effectors targets the host nucleus[J].Proceedings of the National Academy of Sciences of the USA,2010,107(40):17421-17426.
[27]Stassen J H,Ackerveken G V D.How do oomycete effectors interfere with plant life?[J].Current Opinion in Plant Biology,2011,14(4):407-414.
[28]Manning V A,Hamilton S M,Karplus P A,etal.The arg-gly-asp-containing,solvent-exposed loop of ptr toxa is required for internalization[J].Molecular plant-microbe interactions,2008,21(3):315-325.
[29]Plett Jonathan M,Kemppainen M,Kale Shiv D,etal.A secreted effector protein of laccaria bicolor is required for symbiosis development[J].Current Biology,2011,21(14):1197-1203.
[30]Dai Y,Jia Y,Correll J,etal.Diversification and evolution of the avirulence gene avr-pita1 in field isolates of magnaporthe oryzae[J].Fungal Genetics and Biology,2010,47(12):973-980.
[31]Flor H H.Current status of the gene-for-gene concept[J].Annual review of phytopathology,1971,9(1):275-296.
[32]SiluêD,Notteghem J L,Tharreau D.Evidence of a gene-for-gene relationship in the oryza sativa-magnaporthe grisea pathosystem[J].Phytopathology,1992,82(5):577-580.
[33]吴云雨,鲍永美,张红生.水稻与稻瘟病菌互作的分子机制研究进展[J/OL].中国科技论文在线[2012-01-10].http://www.paper.edu.cn/html/releasepaper/2012/01/271/.
[34]石军,龙美西,曲广林,等.稻瘟病菌无毒基因研究进展[J].中国生物工程杂志,2006,26(12):112-116.
[35]Jia Y,Mc Adams S A,Bryan G T,etal.Direct interaction of resistance gene and avirulence gene products confers rice blast resistance[J].The EMBO Journal,2000,19(15):4004-4014.
[36]Kanzaki H,Yoshida K,Saitoh H,etal.Arms race co-evolution of magnaporthe oryzae avr-pik and rice pik genes driven by their physical interactions[J].The Plant Journal,2012,72(6):894-907.
[37]姚琳,王剑,卢代华,等.稻瘟病菌无毒基因研究进展[J].中国农学通报,2014,30(4):232-237.
