海豚链球菌胞外产物的抗原性及免疫保护效果研究*
2015-03-20唐小千绳秀珍战文斌
孙 敏,唐小千,赵 娜,绳秀珍,战文斌
(中国海洋大学海水养殖教育部重点实验室, 山东 青岛 266003)
海豚链球菌胞外产物的抗原性及免疫保护效果研究*
孙 敏,唐小千,赵 娜,绳秀珍**,战文斌
(中国海洋大学海水养殖教育部重点实验室, 山东 青岛 266003)
以健康牙鲆(Paralichthysolivaceus)为攻毒对象,检测了5株海豚链球菌(Streptococcusiniae)菌株的毒力特性。结果显示,菌株NUF849、NUF812、NUF701、NUF693和NUF633对牙鲆的半数致死浓度分别为3.0×105、1.1×106、4.2×107、1.2×107和2.4×107CFU/mL。以平板玻璃纸法分别制备5株海豚链球菌的胞外产物,SDS-PAGE分析其蛋白组成。结果显示,5株海豚链球菌胞外产物均存在14、20、27、30、38、46、57和68kDa等主要蛋白条带,而36kDa蛋白条带仅存在于毒力较强的NUF849、NUF812和NUF693菌株。以强毒株NUF849的胞外产物免疫健康牙鲆,并在免疫后28d进行攻毒,取攻毒后存活牙鲆的血清对5株海豚链球菌的胞外产物进行western-blot检测。结果显示,制备的抗血清可与5株菌共有的46、50、62及88kDa蛋白条带发生阳性反应。以制备的强毒株NUF849和弱毒株NUF701胞外产物分别免疫牙鲆,在免疫后42d以菌株NUF812对免疫牙鲆进行攻毒。结果显示,菌株NUF849和NUF701胞外产物对牙鲆感染的相对免疫保护率分别为32.4%和16.2%。研究结果为揭示海豚链球菌胞外产物的毒力特性和亚单位疫苗候选蛋白的筛选提供了参考数据。
海豚链球菌;牙鲆;胞外产物;抗原性;免疫保护
海豚链球菌(Streptococcusiniae)是养殖鱼类的重要细菌性病原,可感染多种海水和淡水鱼类,由其引发的疾病在世界范围内均有暴发与流行,常见于养殖的牙鲆(Paralichthysolivaceus)、大菱鲆(Scophthalmusmaximus)、鰤鱼(Naucratesductor)、美国红鱼(Sciaenopsocellatus)、罗非鱼(Oreochromisnilotica)、虹鳟(Oncorhychusmikiss)、斑点叉尾鮰(Ictaluruspunctatus)等[1-7],给水产养殖业造成了巨大的经济损失。在众多的鱼类疾病防治措施当中,接种疫苗不仅可以有效防控鱼类传染性疾病的发生,同时又能避免微生物产生耐药性,降低水体污染等问题,已逐渐发展成为鱼类疾病防控的主流手段[8-9]。然而,要研制切实有效的海豚链球菌疫苗,就需要对该菌的毒力特性及其致病机理等方面进行深入的研究。
胞外产物(Extracellular products, ECPs)是细菌在生长与繁殖过程中不断向环境中释放的代谢产物,主要含有各类活性酶和毒素等,目前已有报道的链球菌胞外产物主要有蛋白酶、DNA酶、透明质酸酶、溶血素、3-磷酸甘油脱氢酶、类M蛋白、纤连蛋白、烯醇化酶及溶血素等[10],它们是链球菌致病力的重要组成部分,同时具有良好抗原性,因此是制备亚单位与基因疫苗的重要候选材料。另有研究显示,同种细菌的不同分离株在胞外产物的组成、含量及其致病力方面会存在一定差异[11-13],因此通过比较研究各毒力差异菌株胞外产物的组成情况,可为深入了解细菌各胞外产物组分的活性及其致病力与致病机理提供重要参考,同时也将为细菌亚单位及基因疫苗的开发提供基础数据。然而,目前有关海豚链球菌不同菌株间的胞外产物组成差异情况及其与致病力之间的相互性研究却少有涉及。为此,本研究选择5株海豚链球菌对其毒力特性进行检测,分析其胞外产物的蛋白组成及抗原性,同时比较了强毒株与弱毒株胞外产物的免疫保护效果,以期为了解链球菌致病特性及筛选亚单位疫苗候选组分提供基础数据。
1 材料与方法
1.1 实验用鱼与菌株
健康牙鲆购自日照某养殖场,体重(20±5)g,蓄养于40cm×40cm×70cm水槽内,水温(23±1)℃,全天充气,日换水2/3,每日投喂1%鱼体重的饲料,暂养7d后用于实验。所用的5株海豚链球菌菌株NUF849、NUF812、NUF701、NUF693和NUF633由实验室保藏[14]。
1.2 攻毒试验
为了检测5株海豚链球菌对牙鲆的毒力特征,将冻存的链球菌经血平板28℃活化24h后转接于脑心浸液(BHI)琼脂平板富集培养,以0.01mol/L无菌磷酸盐缓冲液(PBS,pH=7.4)洗脱,3000g离心15min,重复3次,弃上清,以无菌PBS将5株菌的浓度分别调整为1.0×109、1.0×108、1.0×107、 1.0×106及1.0×105CFU/mL,腹腔注射牙鲆,每尾0.1mL,每个浓度组20尾。对照组注射等量无菌PBS。攻毒后连续观察14d,记录各组的死亡情况,以改良寇氏法计算半数致死浓度(LD50)[15]。
1.3 胞外产物的制备
采用平板玻璃纸法制备胞外产物[16],具体步骤为将活化后的菌株接种于BHI肉汤,28℃静置培养24h;取1mL液体培养物涂布于铺覆灭菌玻璃纸的BHI平板(直径15cm),28℃培养60h;无菌PBS洗下菌苔,收集菌悬液离心(8000g,20min,4℃);上清经0.22μm微孔滤膜除菌,并以截留分子量为8~14kDa的透析袋于超纯水中4℃透析,冻干,以PBS重悬,考马斯亮蓝法测定蛋白浓度后,分装贮存于-20℃备用。
1.4 牙鲆抗血清的制备
将制备的菌株NUF849的胞外产物蛋白浓度调整至2mg/mL,然后与等体积的弗氏完全佐剂(CFA)混合,腹腔注射免疫牙鲆,每尾注射0.2mL。在免疫后第28d,以1.0×108CFU/mL的菌株NUF849对免疫牙鲆进行攻毒,每尾注射0.1mL。7d后对存活的牙鲆进行尾静脉取血,将血液于室温静置1h,4℃静置过夜,3000g离心30min获取抗血清,分装于-80℃保存。以相同方法获取健康牙鲆血清。
1.5 SDS-PAGE与Western-blot
对制备的5株海豚链球菌的胞外产物在两块平行凝胶上进行SDS-PAGE,每泳道上样10μg,将其中一块凝胶以考马斯亮蓝G-250进行染色,脱色后观察各菌株胞外产物蛋白的组成情况。另一凝胶电转移至0.45μm孔径的硝酸纤维素膜,转移后将膜用以PBS配置的5%脱脂奶粉在37℃条件下封闭1h;PBST(含0.05%吐温-20的PBS)洗涤后,加入以PBS稀释50倍的牙鲆抗菌株NUF849胞外产物的血清,37℃孵育1h;PBST洗涤后,加入实验室前期研制的鼠抗牙鲆IgM单克隆抗体[17],37℃孵育1h;PBST洗涤后,加入碱性磷酸酶标记的羊抗鼠IgG(1:5000,v/v)在37℃条件下孵育1h。以PBST洗涤后,加入新鲜配制的四氮唑蓝/5-溴-4-氯-3吲哚-磷酸盐(NBT/BCIP)发色液,室温暗处显色。以健康牙鲆血清代替牙鲆抗血清作为对照。
1.6 免疫保护试验
为了比较海豚链球菌不同菌株胞外产物对牙鲆的免疫保护效果,分别以菌株NUF849及NUF701的胞外产物免疫牙鲆,免疫方式如1.4部分所述,以注射等体积的 PBS作为对照,每组40尾牙鲆。在免疫后第42天,各免疫组牙鲆分别以菌株NUF812进行攻毒,腹腔注射0.1mL浓度为1×108CFU/mL的菌液,连续观察20d并统计死亡情况,按下列公式计算相对免疫保护率(RPS):
RPS (% ) = (对照组死亡率-免疫组死亡率) /对照组死亡率×100%。
2 结果
2.1 5株海豚链球菌的毒力特征
基于攻毒试验各浓度组的死亡率结果计算得知,海豚链球菌菌株NUF849、NUF812、NUF701、NUF693和NUF633对牙鲆的LD50分别为3.0×105、1.1×106、4.2×107、1.2×107和2.4×107CFU/mL(见表1)。根据各株链球菌对健康牙鲆的毒力差异情况判定得知,NUF849和NUF812为毒力较强的菌株,NUF701、NUF693和NUF633为毒力较弱的菌株。
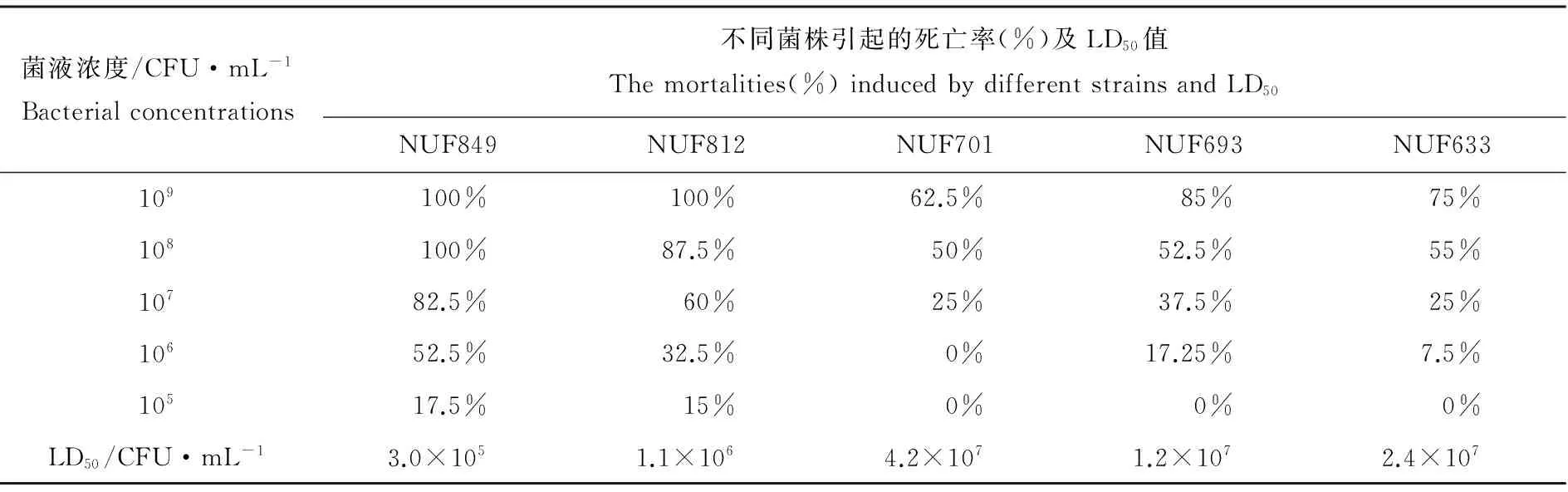
表1 5株海豚链球菌对牙鲆的毒力特征Table 1 The virulence of 5 S. iniae strains against P.olivaceus
2.2 5株海豚链球菌胞外产物蛋白组成分析
SDS-PAGE结果显示,5株海豚链球菌胞外产物的蛋白组成具有较高的相似度,约有20多条蛋白条带,主要集中在分子量为25~66kDa的区间范围内,它们都具有分子量为14、20、27、30、38、46、57和68kDa等主要蛋白条带。但是,在毒力较强的NUF849、NUF812与NUF693菌株中均有一条分子量约为36kDa的蛋白条带,而毒力较弱的NUF701和NUF633菌株中此蛋白条带不明显(见图1)。
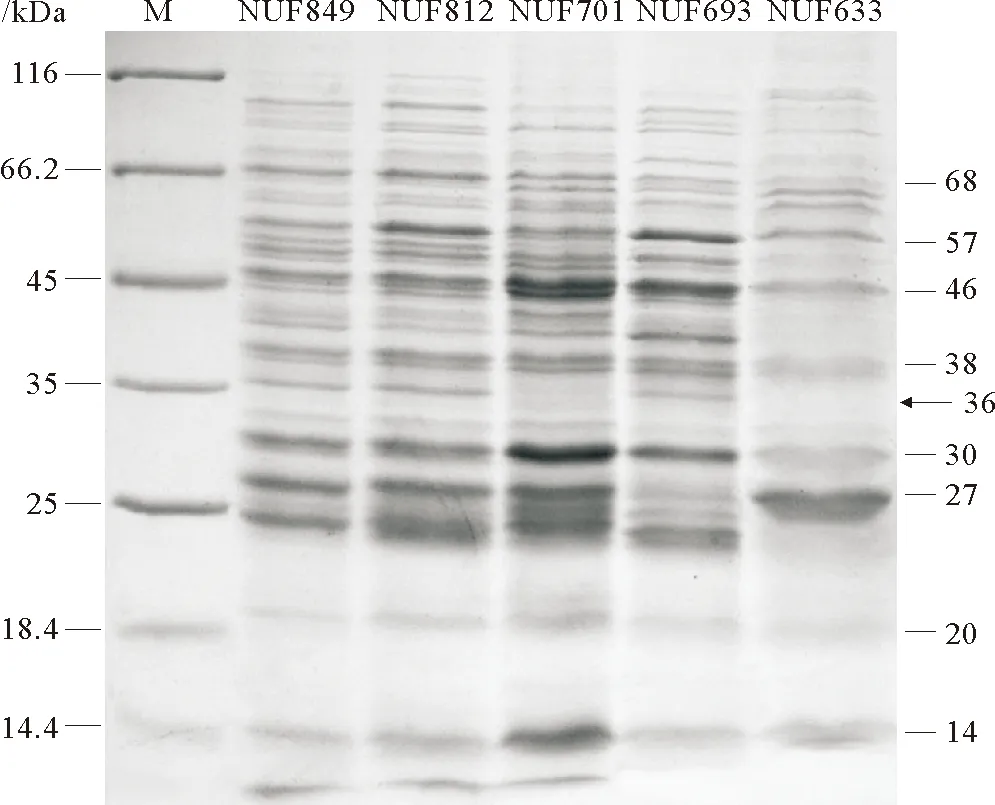
图1 5株海豚链球菌胞外产物的SDS-PAGE图谱Fig.1 SDS-PAGE of ECPs of 5 S. iniae strains
2.3 5株海豚链球菌胞外产物的抗原性分析
Western-blot结果显示,通过免疫菌株NUF849胞外产物制备的牙鲆抗血清可与5株菌胞外产物的多条蛋白发生阳性反应,发生反应的条带分子量集中分布于25~66kDa范围内,其共同的抗原反应条带的分子量分别为46、50、62和88kDa,另外抗血清可与除弱毒菌株NUF693以外的4株链球菌的24、30及38kDa的蛋白发生明显的阳性反应(见图2)。以阴性牙鲆血清作为对照的western-blot分析结果显示,健康牙鲆血清仅可与弱毒株NUF693与NUF633中分子量为60kDa蛋白条带发生较为明显的反应(见图3)。
2.4 菌株NUF849与NUF701胞外产物的免疫保护效果
为了比较海豚链球菌不同菌株胞外产物对牙鲆的免疫保护效果,分别以菌株NUF849及NUF701的胞外产物免疫牙鲆,以注射PBS作为对照,在免疫后第42天,各免疫组牙鲆分别以菌株NUF812进行攻毒。攻毒后,注射PBS组牙鲆在攻毒后第2天便开始出现死亡,直至攻毒后第17天死亡率达到92.5%。然而,免疫强毒株NUF849胞外产物的牙鲆在攻毒后,死亡率显著低于对照组,直至感染后第17天死亡率为62.5%,其相对免疫保护率为32.4%,免疫弱毒株NUF701胞外产物的牙鲆在攻毒后,死亡率显著略高于强毒株免疫组牙鲆,直至感染后第17天死亡率为77.5%,其相对免疫保护率为16.2%(见图4)。免疫组与对照组死亡牙鲆表现出典型链球菌感染症状,即体色发黑、解剖可见黄色或血样腹水,肝脏充血,脾肿大,肾脏色深,肠腔积液。
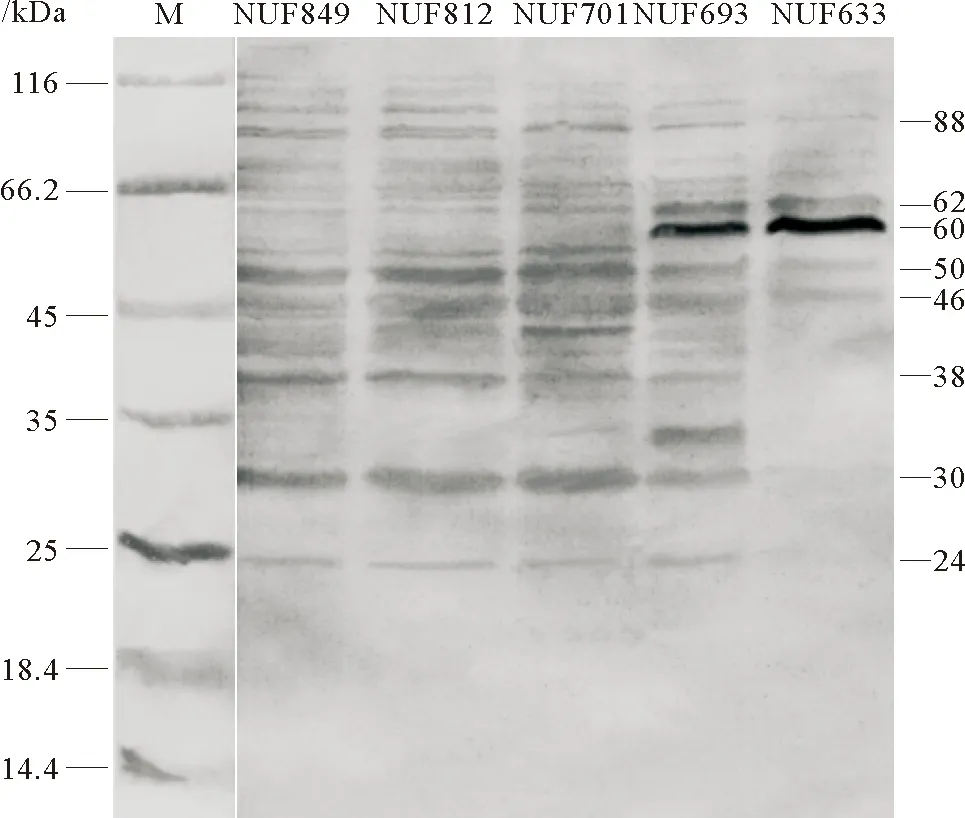
图2 牙鲆抗菌株NUF849胞外产物血清与5株海豚链球菌胞外产物反应的Western-blot结果Fig.2 Western-blot of ECPs of 5 S. iniae strains using antiserum against ECPs of strain NUF849

图3 牙鲆阴性血清与5株海豚链球菌胞外产物反应的Western-blot结果Fig.3 Western-blot of ECPs of 5 S. iniae strains using negative serum

图4 牙鲆免疫NUF849和NUF701胞外产物后再经NUF812菌株攻毒的累计死亡率曲线Fig.4 The mortality curve of P. olivaceus challenged with strain NUF812 after pre-immunization with ECPs of strain NUF849 and NUF 701
3 讨论
利用毒力差异菌株在蛋白和基因水平上开展对比研究是揭示其毒力关键因子及其致病特性的重要技术途径[18-21]。本研究选取了5株海豚链球菌进行攻毒试验,结果显示其对牙鲆的半致死浓度存在显著差异,推测其毒力大小差异可能与菌株毒力因子的分泌种类、含量及调控机制等存在密切联系。进而对分离的5株链球菌胞外产物的蛋白组成进行了分析,结果显示5株海豚链球菌胞外产物在组成上具有较高的同源性,存在多条共有蛋白条带,但是分子量为36kDa的蛋白条带仅存在于毒力较强的NUF849、NUF812和NUF693菌株胞外产物中,推测其可能与海豚链球菌的毒力存在密切关系,有待对其开展进一步的分子鉴定与特性分析研究。曾有研究发现海豚链球菌胞外产物的组成与菌株毒力之间存在密切相关性[22]。为了进一步验证不同菌株间胞外产物的差异性,本文分别以强毒株NUF849与弱毒株NUF701的胞外产物免疫牙鲆,以另一强毒株NUF812进行攻毒,结果显示强毒株NUF849胞外产物对牙鲆的相对免疫保护率显著高于弱毒株NUF701,结果表明海豚链球菌不同毒力株在胞外产物的组成及其各组分丰度上存在一定差别,进而使各免疫组牙鲆表现出不同的免疫保护力。
Western-blot分析结果显示,制备的牙鲆抗菌株NUF849血清可与5株海豚链球菌共有的46、50、62及88kDa蛋白条带发生阳性反应,同时还可以与强毒株NUF849及NUF812的24、30及38kDa等主要蛋白条带发生阳性反应,这些共有条带可作为制备具有交叉免疫保护效果疫苗的候选材料。另外,本研究还发现海豚链球菌弱毒株NUF693与NUF633有一分子量约为60kDa的条带可与阴性牙鲆血清发生阳性反应,推测其可能为链球菌的Ig结合蛋白,由于前期研究已证实部分链球菌在其细胞壁表面存在链球菌G蛋白,它能特异性结合IgG的Fc端[23]。
[1] 杜佳银. 海水养殖鱼类链球菌病 [J]. 渔业现代化,2001,5: 28-29.
[2] 杜佳银. 大菱鲆链球菌病 [J]. 河北渔业, 2001(4): 36-37.
[3] 纪荣兴, 胡石柳. 杜氏鰤链球菌病及其他常见病害防治的研究 [J]. 福建水产, 1998(1): 27-32.
[4] 沈智华, 钱冬, 许文军, 等. 美国红鱼(红拟石首鱼)海豚链球菌分离、鉴定及致病性研究 [J]. 水生生物学报, 2005, 29(6): 678-683.
[5] Austin B, Robertson P A. Recovery of Strepstococcus milleri from ulcerated koi carp (Cyprinus carpio))in the U. K [J]. Bull Eur Assoc Fish Pathol, 1993, 13: 207-209.
[6] 王琼秋. 罗非鱼链球菌性皮炎的分离鉴定 [J]. 中国预防兽医学报, 2001, 23(2): 150-152.
[7] 郭建坤, 杨雪珍, 景建江, 等. 中药治疗虹鳟鱼链球菌病报告 [J]. 淡水渔业, 1999, 29(12): 150-152.
[8] Håstein T, Gudding R, Evensen O. Bacterial vaccines for fish-an update of the current situation worldwide [J]. Dev Biol (Basel), 2005, 121: 55-74.
[9] Sommerset I, Krossøy B, Biering E, et al. Vaccines for fish in aquaculture [J]. Expert Rev Vaccines, 2005, 4(1): 89-101.
[10] 陆承平. 兽医微生物学[M]. 北京: 中国农业出版社, 2001: 204-212.
[11] Liuxy P C, Lee K K, Chen S N. Pathogenicity of different isolates of Vibrio harveyi in tiger prawn, Penaeus monodon [J]. Lett Appl Microbiol, 1996, 22: 413-416.
[12] Beaz-Hidalgo R, Alperi A, Buján N, et al. Comparison of phenotypical and genetic identification of Aeromonas strains isolated from diseased fish [J]. Syst Appl Microbiol, 2010, 33: 149-153.
[13] Kim M S, Choi S H, Lee E H, et al. α-enolase, a plasmin (ogen) binding protein and cell wall associating protein from a fish pathogenic Streptococcus iniae strain [J]. Aquaculture, 2007, 265: 55-60.
[14] 汪笑宇, 战文斌, 刑婧, 等. 豚链球菌和停乳链球菌类M蛋白及其抗原性分析 [J]. 水产学报, 2008, 32(6): 945-949.
[15] 邹玉霞, 张培军, 莫照兰, 等. 大菱鲆出血症病原菌的分离和鉴定 [J]. 高技术通讯, 2004, 14(4): 89-93.
[16] Liu P C, Chen Y C, Lee K K. Pathogenicity of Vibrio alginolyticus isolated from diseased small abalone Haliotis diversicolor supertexta [J]. Microbios, 2001, 104(408): 71-77.
[17] Li Q, Zhan W B, Xing J, et al. Production, characterization and applicability of monoclonal antibodies to immunoglobulin of Japanese flounder(Paralichthys olivaceus) [J]. Fish & Shellfish Immunology, 2007, 23: 982-990.
[18] Tadahiro N, Tadao H, Keizo Torii, et al. Two-dimensional gel electrophresis analysis of the abundance of virulent exoproteins of group a streptococcus caused by environmental changes [J]. Arch Microbiol, 2004, 181: 74-81.
[19] Pasnik D J, Evans J J, Panangala V S, et al. Antigenicity of Streptococcus agalactiae extracellular products and vaccine efficacy [J]. Journal of Fish Disease, 2005, 28(4): 205-212.
[20] 张爱玲, 王兴龙, 李吉平, 等. 2型猪链球菌强毒株与无毒株胞外蛋白的双向电泳图谱比较分析 [J]. 中国预防兽医学报, 2008, 30(4): 250-254.
[21] Bastardo A, Sierralta V, León J, et al. Phenotypical and genetic characterization of Yersinia ruckeri strains isolated from recent outbreaks in farmed rainbow trout Oncorhynchus mykiss (Walbaum) in Peru [J]. Aquaculture, 2011, 317: 229-232.
[22] Shin G W, Palaksha K J, Kim Y R, et al. Application of immunoproteomics in developing Streptococcus iniae vaccine for olive flounder (Paralichthys olivaceus) [J]. Journal of Chromatography B, 2007, 849: 315-322.
[23] 黄雪年, 许杨, 李燕萍. 链球菌G蛋白IgG结合域(GBx)的融合表达及其IgG结合活性的比较分析 [J]. 中国生物工程杂志, 2009, 29: 64-68.
责任编辑 朱宝象
Studies on the Antigenicity and Immunoprotecive Efficacy of Extracellular Products from Some Strains of Streptococcus iniae
SUN Min, TANG Xiao-Qian, ZHAO Na, SHENG Xiu-Zhen, ZHAN Wen-Bin
(The Key Laboratory of Mariculture of Ministry of Education, Ocean University of China, Qingdao 266003, China)
The virulence of 5Streptococcusiniaestains against healthy flounder (Paralichthysolivaceus) was tested through challenge experiment. The results showed thatLD50of strain NUF849, NUF812, NUF701, NUF693 and NUF633 was 3.0×105, 1.1×106, 4.2×107, 1.2×107and 2.4×107CFU/mL, respectively. The extracellular products (ECPs) of the five stains ofS.iniaewere obtained using cellophane plate culture technique with their protein composition profiled through SDS-PAGE. Eight distinct bands with molecular weight (MW) of 14, 20, 27, 30, 38, 46, 57 and 60kDa were detected in five strains; however, a band with MW of 36kDa was only detected in more virulent strains including NUF849, NUF812 and NUF693. Healthy flounder were vaccinated with the ECPs from more virulent strain NUF849, and the anti-sera were obtained from the vaccinated and NUF849 challenge survived fish individuals. Western-blotting showed that the anti-sera could react with four common bands of the ECPs (46, 50, 62 and 88kDa) from 5S.iniaestrains. Healthy flounder were vaccinated with the ECPs from NUF849 and NUF701, respectively. On day 42 post-vaccination, flounder were challenged with strain NUF812, and the relative percentage survival (RPS) of NUF849 and NUF701 ECPs vaccinated groups were 34.2% and 16.2%, respectively.Our results provided primary data for illustrating the viru-lence characteristics ofS.iniaeECPs and the screening of subunit vaccine candidates.
Streptococcusiniae;Paralichthysolivaceus; extracellular proteins; antigenicity; immune protection
国家自然科学基金项目(31172429;31302216);国家科技支撑计划项目(2012BAD17B01);山东省自然科学基金项目(ZR2011CQ022)资助
2014-02-20;
2014-05-03
孙 敏(1988-),女,硕士生,从事水产动物病害与免疫学研究。E-mail:smfelicia@163.com
** 通讯作者: E-mail:xzsheng@ouc.edu.cn
S94
A
1672-5174(2015)04-035-05
10.16441/j.cnki.hdxb.20140038
