蛹虫草胞外多糖的制备、结构分析及其免疫活性
2022-01-06王亚非张明泽王亚慧沈明浩
于 悦,陈 卓,王亚非,张明泽,王亚慧,艾 楠,沈明浩,*,姜 斌,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.讷河市人民医院,黑龙江 讷河 161300)
蛹虫草俗名蝉花,为子囊菌门、肉座菌目、虫草菌科的一类食药兼用的虫生真菌[1-2],我国早期炮制著作——《雷公炮炙论》中记载蛹虫草具有“主小儿天吊、惊痫、瘈疭、夜啼、心悸”等疗效。国内外研究证实蛹虫草中含有多糖、虫草酸、甘露醇、麦角甾醇及核苷类等生物活性物质,具备抗氧化、提高机体免疫力和降血糖等功效[3-6],应用领域遍及食品、药品工业等,不仅用于餐桌上的健康佳肴,还已开发出蛹虫草多糖酸奶、口服液和调味品[7-9]等一系列产品。由于其营养价值高、价格低廉,作为新一代食品原材料,其活性功能有待深入开发并加以利用。
近年来,蛹虫草多糖由于产量高、生物活性显著而成为研究热点。其中蛹虫草胞外多糖来源稳定、发酵周期短、不受地域限制并易于规模生产,已在开发增强免疫功能的健康食品中得到了广泛的应用。目前研究显示,从蛹虫草中提取到的胞外多糖分子质量范围为1.56~36.00 kDa[10-12],具有清除自由基、诱导癌细胞分化、抗肿瘤、抗肝细胞氧化损伤等生物活性。但目前对蛹虫草胞外多糖没有进行更加系统的分离纯化,且多糖组分对免疫活性调节的机制研究还鲜见报道,对开发和利用蛹虫草胞外多糖资源造成了一定的限制。所以本研究在阐明蛹虫草胞外多糖的提取纯化工艺及对多糖结构分析的基础上,探究其免疫调节机制,对蛹虫草胞外多糖资源的开发具有积极意义。
1 材料与方法
1.1 动物、材料与试剂
清洁级BALB/c雄鼠(体质量(21±2)g),购自辽宁长生生物技术有限公司,许可证编号:SCXK(辽)2020-0001。
蛹虫草菌株CICC 14014由中国工业微生物菌种保藏管理中心提供,甘油于-20 ℃冰箱中保存备用。
DEAE-Sephacel阴离子交换柱、Sephadex G-200葡聚糖凝胶柱、MTS细胞增殖检测试剂盒 美国Sigma公司;白细胞介素(interleukin,IL)-2、IL-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α、干扰素(interferon,IFN)-γ、免疫球蛋白(immunoglobulin,Ig)G、IgM、IgA试剂盒 江莱生物技术有限公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的抗小鼠白细胞分化抗原3(CD3+)、别藻蓝蛋白(allophycocyanin,APC)标记的抗小鼠白细胞分化抗原19(CD19+) 美国eBioscience公司;右旋糖酐分子质量标准套(批号:140637~646-201203) 中国食品药品检定研究院。
1.2 仪器与设备
UVmini-1280紫外分光光度计、IRAffinity-1傅里叶变换红外光谱仪、LC-20A高效液相色谱仪 日本岛津公司;CX31光学显微镜 日本奥林巴斯公司;LSRFortessa流式细胞仪 美国BD公司;MuLtiskan FC酶标仪 美国赛默飞世尔科技有限公司。
1.3 方法
1.3.1 蛹虫草胞外多糖的制备与纯化
种子液培养基:取20 g马铃薯汁、2 g葡萄糖、1.5 g蛋白胨,溶解于100 mL蒸馏水中;固体培养基另加1.5 g琼脂;用于发酵的液体培养基另加150 mg KH2PO4和MgSO4及10 mg VB1;以上pH值均为6.8。
使用固体培养基活化蛹虫草菌株,于24 ℃培养箱中活化7 d,并从中取出1 cm2菌株到液体培养基,在同等温度150 r/min的摇床中培养3 d获取种子液,再将100 mL种子液转接至1 L发酵培养基中,按如上条件继续培养5 d,取发酵液4 000 r/min离心20 min,收集上清液加3 倍95%乙醇溶液沉淀12 h,先使用活性炭除去色素,再采用Sevae法除蛋白[13],然后通过截留分子质量为3 500 Da的透析袋分离小分子杂质,最后采用DEAE-Sephacel层析柱(3.6 cm×30 cm)进行分离,上样质量浓度为20 mg/mL,分别使用蒸馏水和0.1、0.3、0.5 mol/L NaCl溶液进行梯度洗脱,流速为1.0 mL/min。苯酚-硫酸法跟踪检测洗脱液,收集多糖洗脱峰,选择多糖含量最高的组分,采用Sephadex G-200层析柱(1.5 cm×90 cm)[14]进一步纯化,上样质量浓度为5 mg/mL,洗脱剂为蒸馏水,流速为0.5 mL/min。苯酚-硫酸法跟踪检测洗脱液的多糖质量浓度,收集多糖洗脱峰,浓缩、冻干后蛹虫草胞外多糖组分,制得蛹虫草胞外多糖纯品。
1.3.2 蛹虫草胞外多糖的结构分析
1.3.2.1 多糖含量测定
采用硫酸-苯酚法,通过绘制葡萄糖标准曲线对蛹虫草胞外多糖进行含量测定[15]。
1.3.2.2 多糖分子质量测定
应用高效液相色谱法测定蛹虫草胞外多糖分子质量[16]。采用示差折光检测器和Shodex OHpak SB-803 HQ色谱柱(8.0 mm×300 mm,6 μm),设置柱温40 ℃,进样量20 μL,流动相为质量分数0.9% NaCl溶液,流速为1.0 mL/min。取右旋糖酐分子质量D0、D1、D2、D3、D4对照品配制溶液(质量浓度5.0 mg/mL)过0.45 μm滤膜后上机,测定其保留时间。根据保留时间与分子质量,由GPC软件计算回归方程。同法测定多糖溶液(质量浓度2.0 mg/mL)的出峰时间,根据标准曲线计算蛹虫草胞外多糖分子质量。
1.3.2.3 红外光谱分析
将多糖与已恒质量的溴化钾按质量比1∶100混合研磨、压片,利用傅里叶变换红外光谱仪在4 000~400 cm-1范围内扫描[17]。
1.3.3 蛹虫草胞外多糖的免疫活性研究
1.3.3.1 免疫损伤小鼠的模型构建及分组
小鼠随机均分6 组,空白组不建模,其他5 组腹腔注射40 mg/kgbw的环磷酰胺,连续5 d,以构建小鼠免疫损伤模型[18]。5 d后随机抽取各组小鼠称质量并制备脾脏切片,以体质量明显降低,切片中白、红髓分界模糊,且白髓中脾小体结构分散为造模成功。空白和模型组灌胃生理盐水;阳性组灌胃剂量为25 mg/kgbw的匹多莫德;蛹虫草胞外多糖低、中、高剂量组灌胃剂量各为25、50、100 mg/kgbw蛹虫草胞外多糖,实验期21 d。
1.3.3.2 蛹虫草胞外多糖对免疫损伤小鼠体质量变化及免疫器官指数的测定
实验期间分别在第1、5、9、13、17、21天称量小鼠体质量,实验结束时取小鼠脾脏、胸腺,称质量,并按公式(1)计算免疫器官指数[18]。

1.3.3.3 蛹虫草胞外多糖对小鼠脾脏组织形态的影响
无菌取脾,利用质量分数4%多聚甲醛固定包埋后切片(厚度为5 μm)进行苏木精-伊红染色,中性树胶封片。在光学显微镜下观察组织形态变化,并用CCDNC6051摄影系统拍照[19]。
1.3.4 蛹虫草胞外多糖对小鼠脾淋巴细胞增殖的影响
1.3.4.1 MTS法检测小鼠T、B淋巴细胞增殖率
冰上无菌取脾制备脾细胞悬液[20]。刀豆蛋白(concanavalin A,ConA)实验组(诱导T淋巴细胞增殖)加180 μL脾细胞悬液(1.5×106个/mL)和20 μL终质量浓度为5 μg/mL的ConA,脂多糖(lipopolysaccharide,LPS)实验组(诱导B淋巴细胞增殖)加180 μL脾细胞悬液(1.5×106个/mL)和20 μL终质量浓度为10 μg/mL的LPS,空白对照组加200 μL脾细胞悬液(1.5×106个/mL),每组做3个复孔,37 ℃、5% CO2培养箱培养36 h,再加10 μL MTS试剂继续在CO2培养箱中培养3 h,于490 nm波长处测定吸光度,按公式(2)计算细胞增殖率[21]。

1.3.4.2 流式细胞仪法检测小鼠脾淋巴细胞中T、B淋巴细胞占比
取100 μL脾淋巴细胞悬液(2×106个/mL)置于流式细胞仪测试管中,再依次加入5 μL FITC CD3+(标记T淋巴细胞)和5 μL APC CD19+抗体(标记B淋巴细胞),4 ℃避光放置30 min。用流式细胞仪检测T、B细胞在脾脏细胞中的占比,采用FlowJo VX软件进行数据分析[22]。
1.3.5 蛹虫草胞外多糖对小鼠血清细胞因子水平的影响
眼球采血,2 000 r/min离心15 min后取上清液,检测细胞因子IL-2、IFN-γ、TNF-α和IL-6质量浓度,具体按试剂盒操作。
1.3.6 蛹虫草胞外多糖对小鼠血清免疫球蛋白水平的影响
取各组小鼠血清检测免疫球蛋白IgG、IgM和IgA含量,具体按试剂盒操作。
1.4 数据处理与分析
2 结果与分析
2.1 蛹虫草胞外多糖的质量浓度
葡萄糖标准曲线如图1所示,标准曲线方程为y=0.01x-0.010 2,R2=0.999 2,线性关系良好。由回归方程计算出蛹虫草胞外多糖质量浓度为3.15 mg/mL。
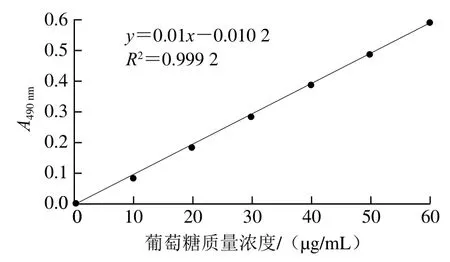
图1 葡萄糖标准曲线Fig. 1 Standard curve for glucose determination
2.2 蛹虫草胞外多糖的纯化结果
采用DEAE-Sephacel层析柱联合Sephadex G-200层析柱对蛹虫草胞外多糖进行纯化,如图2所示,在第24~30管得到了一个完整对称的吸收峰,经计算(带入2.1节中标准曲线方程),得到多糖的纯度为86.13%。
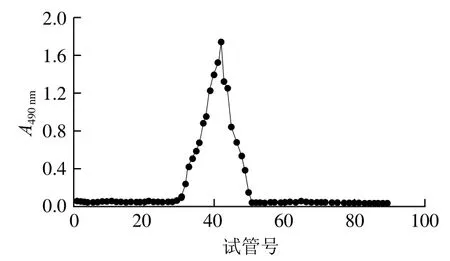
图2 蛹虫草胞外多糖纯化洗脱曲线Fig. 2 Elution curve of Cordyceps militaris exopolysaccharide
2.3 蛹虫草胞外多糖的分子质量
由图3可见,蛹虫草胞外多糖溶液相色谱图呈现一个锐利对称峰,将保留时间(X)16.686 min带入回归方程lgmw=-0.17X3+0.85X2-14.75X+90.48(R2=0.999 4)计算得出蛹虫草胞外多糖的分子质量为3.67 kDa。
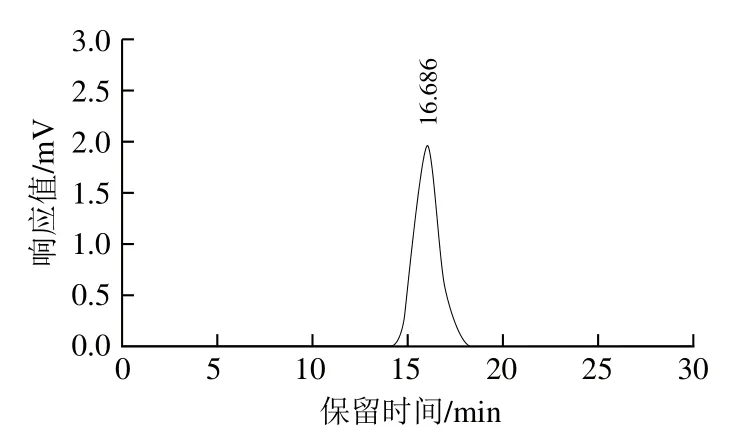
图3 蛹虫草胞外多糖的高效液相色谱图Fig. 3 HPLC chromatogram of the exopolysaccharide from Cordyceps militaris
2.4 蛹虫草胞外多糖的红外光谱分析
如图4所示,3 363.86 cm-1处为氢键缔合的O—H伸缩振动峰[23];2 924.09 cm-1和2 895.15 cm-1处为次甲基的C—H伸缩振动峰[24];以上是糖类特征吸收峰,由此推断蛹虫草胞外多糖符合糖类的一般结构特征。1 404 cm-1处为C—H的弯曲振动峰[25];1 080.14 cm-1处出现吸收峰表明有吡喃糖环的存在,说明结构中可能存在α-(1→6)糖苷键[26];844.82 cm-1处是β-糖苷键的特征峰[27]。综上所述,蛹虫草胞外多糖中既有α-糖苷键构型,同时又有β-糖苷键构型的吡喃糖存在。
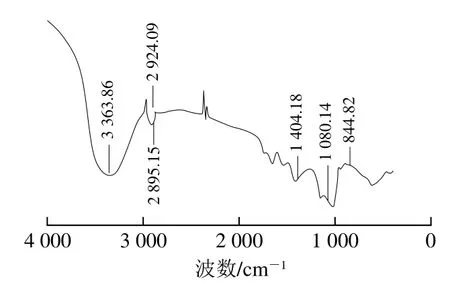
图4 蛹虫草胞外多糖的傅里叶变换红外光谱图Fig. 4 FTIR spectrum of the exopolysaccharide from Cordyceps militaris
2.5 蛹虫草胞外多糖对免疫抑制小鼠体质量及免疫器官指数的影响
如图5A所示,在实验第5天,发现造模小鼠体质量急剧降低,与未注射环磷酰胺的小鼠体质量差异极显著(P<0.01),表明造模成功。治疗期间蛹虫草胞外多糖剂量组小鼠体质量逐渐增加,最终恢复至与空白组水平基本相近,表明蛹虫草胞外多糖可缓解因环磷酰胺导致的小鼠体质量减轻,具有一定的免疫调节能力。
免疫器官指数如图5B所示,与空白组相比,模型组小鼠的胸腺和脾脏指数极显著降低(P<0.01),可见环磷酰胺对小鼠的胸腺和脾脏具有严重的损伤作用。经给药后,阳性组小鼠基本恢复到与空白组无显著差异,蛹虫草胞外多糖组随剂量增加免疫器官指数呈逐渐增加的趋势,高剂量蛹虫草胞外多糖组小鼠免疫器官指数与空白组无显著差异,由此说明蛹虫草胞外多糖具有改善脾脏和胸腺损伤的作用。
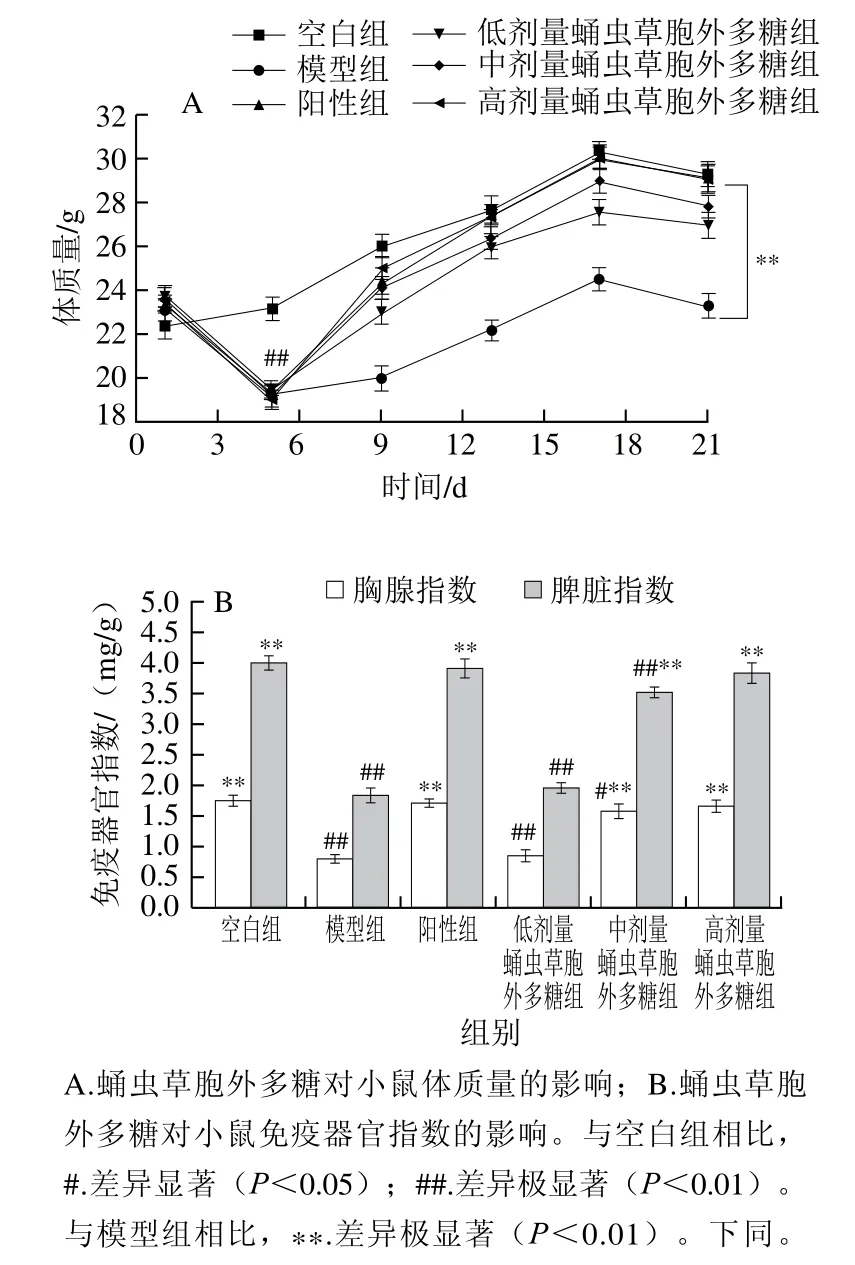
图5 蛹虫草胞外多糖对小鼠体质量和免疫器官指数的影响Fig. 5 Effect of the extracellular polysaccharide from Cordyceps sinensis on body mass and immune organ indexes in immunosuppressed mice
2.6 蛹虫草胞外多糖对小鼠脾脏组织形态学的影响
如图6所示,模型组小鼠脾脏红髓与白髓之间边界不分明,淋巴鞘结构疏松(图6B),与叶蕾[28]阐述的现象一致,证明造模成功。空白组(图6A)及阳性组(图6C)小鼠红、白髓分界明显,白髓中存在较多结构完整的脾小体,红髓中脾索整体相连,脾窦明显。低剂量蛹虫草胞外多糖组红髓与白髓之间边界不分明(图6D)。中剂量蛹虫草胞外多糖组(图6E)和高剂量蛹虫草胞外多糖组(图6F)白髓部分变得更清晰、边缘区增厚、脾小体结构完整,组织形态逐渐恢复至与空白组和阳性组接近,这表明蛹虫草胞外多糖可有效缓解由环磷酰胺导致的脾组织结构异常。
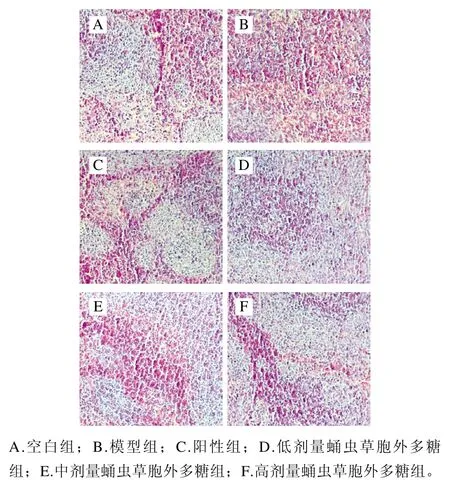
图6 蛹虫草胞外多糖对小鼠脾脏组织形态学的影响Fig. 6 Effect of the exopolysaccharide from Cordyceps militaris on morphology of spleen tissues in immunosuppressed mice
2.7 蛹虫草胞外多糖对小鼠脾淋巴细胞的影响
2.7.1 小鼠脾淋巴细胞增殖率
小鼠T、B淋巴细胞增殖率见图7,与空白组相比,模型组小鼠T、B淋巴细胞增殖率均极显著降低(P<0.01),证明环磷酰胺对鼠T、B淋巴细胞有严重的损害作用。经给药后,蛹虫草胞外多糖剂量组的B淋巴细胞增殖率升高,并随给药剂量增加,呈现剂量效应关系,高剂量组效果最佳;而蛹虫草胞外多糖剂量组的T淋巴细胞增殖率随着给药剂量的增加呈逐渐下降趋势,但低剂量组与模型组相比对T淋巴细胞的增殖有一定的促进作用。由此推测蛹虫草胞外多糖对B淋巴细胞的增殖有促进效果,对T淋巴细胞增殖存在低剂量促进高剂量抑制的现象。
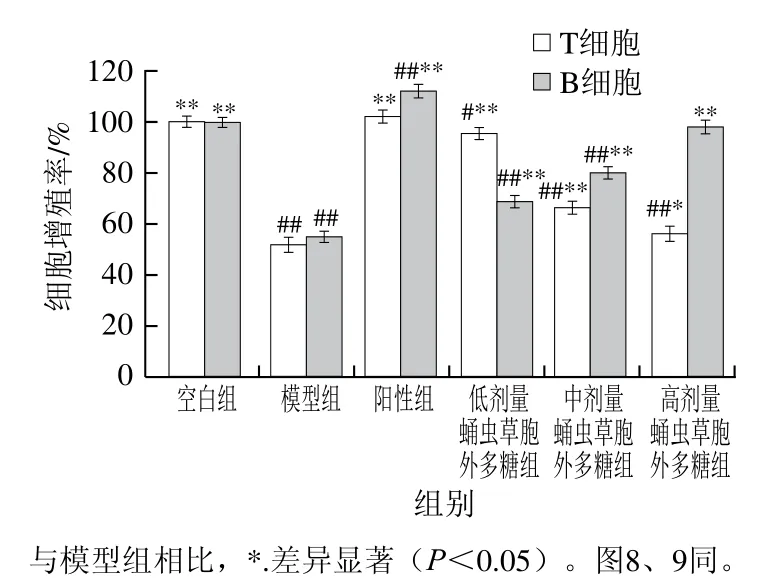
图7 蛹虫草胞外多糖对小鼠T、B细胞增殖率的测定Fig. 7 Proliferation rates of T and B cells in mice administered with the extracellular polysaccharide from Cordyceps militaris
2.7.2 小鼠脾淋巴细胞中T、B细胞占比
由图8可知,模型组小鼠脾脏T、B淋巴细胞占比极显著低于空白组(P<0.01),说明环磷酰胺对小鼠T、B细胞损伤作用严重。与模型组相比,低、中、高剂量蛹虫草胞外多糖组小鼠T淋巴细胞占比分别增加了(11.08±0.21)%、(23.84±0.32)%和(4.97±0.17)%,B淋巴细胞占比分别增加了(18.45±0.23)%、(31.21±0.28)%和(40.51±0.32)%,可见,随蛹虫草胞外多糖剂量增加,B淋巴细胞占比升高,而T淋巴细胞占比先增加后降低,说明蛹虫草多糖可有效促进B淋巴细胞增殖。
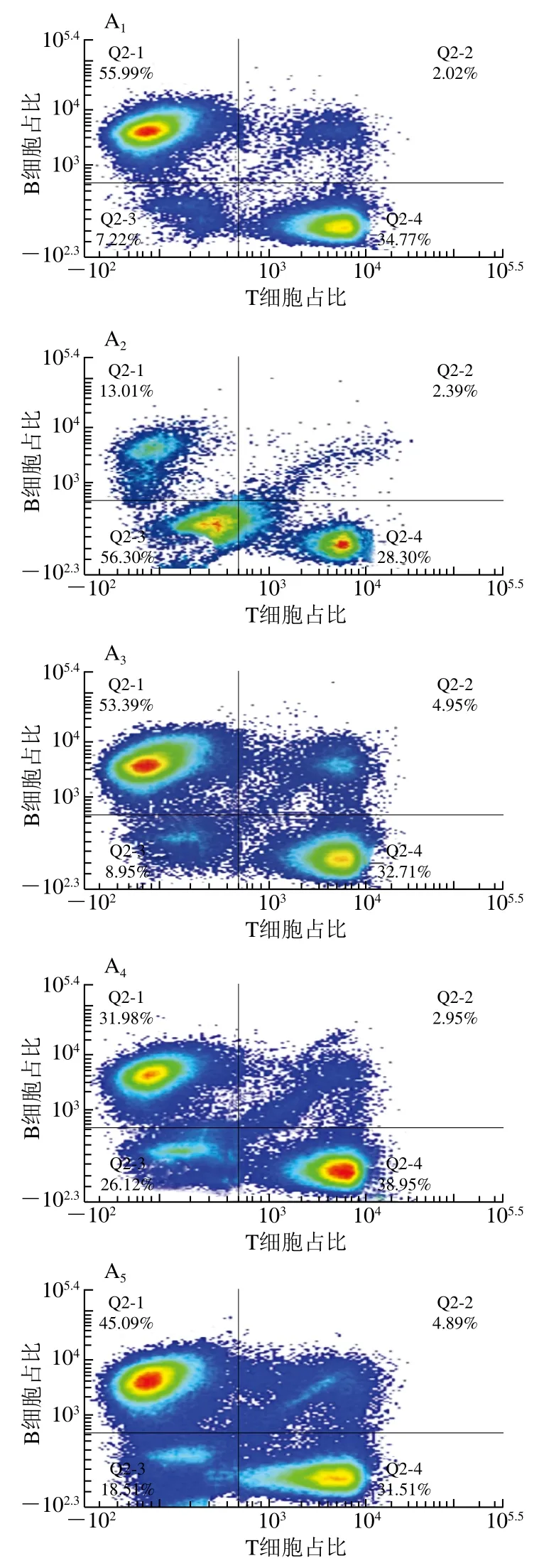
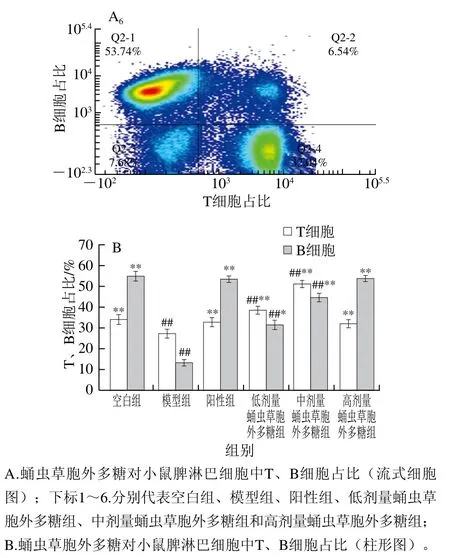
图8 蛹虫草胞外多糖对小鼠脾淋巴细胞中T、B细胞占比的影响Fig. 8 Effect of the extracellular polysaccharide from Cordyceps militaris on the proportions of T and B cells in spleen lymphocytes of mice
2.8 蛹虫草胞外多糖对小鼠血清中细胞因子水平的影响
如图9所示,模型组小鼠细胞因子IL-2、IFN-γ、IL-6、TNF-α质量浓度均极显著低于空白组(P<0.01),证明造模成功。随给药剂量增加,蛹虫草胞外多糖剂量组IL-6和TNF-α的质量浓度逐渐递增至正常水平,而IL-2和IFN-γ的质量浓度随给药剂量增加呈下降趋势。可见蛹虫草胞外多糖可有效调节环磷酰胺所致的细胞因子分泌异常。
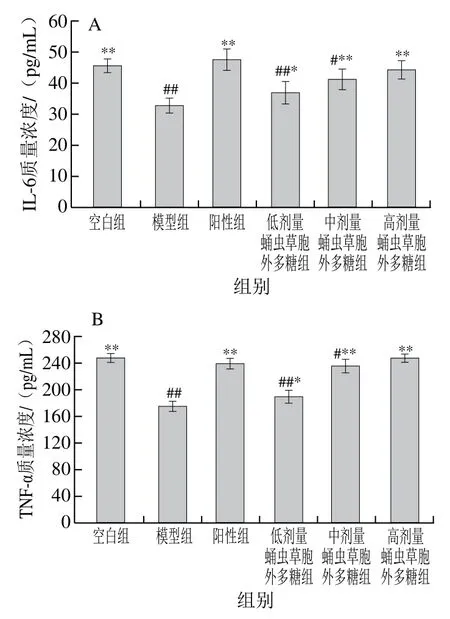
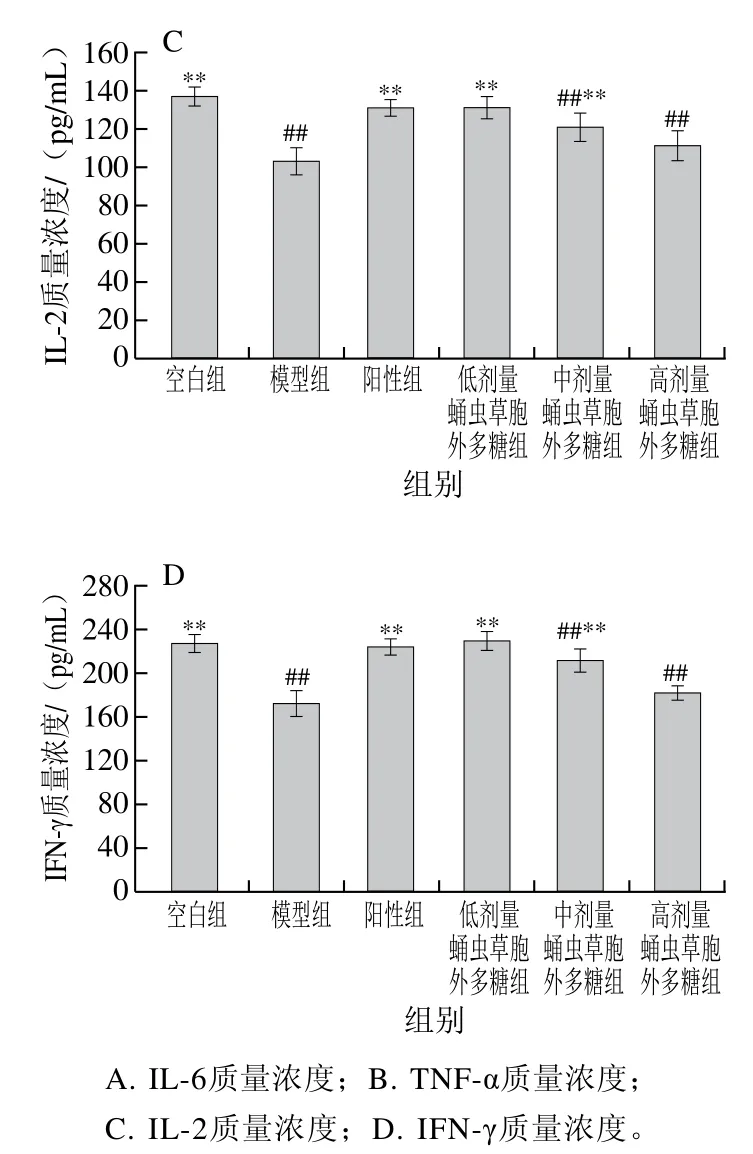
图9 蛹虫草胞外多糖对小鼠血清细胞因子质量浓度的影响Fig. 9 Effect of the extracellular polysaccharide from Cordyceps militaris on cytokine levels in serum of mice
2.9 蛹虫草胞外多糖对免疫抑制小鼠血清中免疫球蛋白水平的影响
如图10所示,模型组小鼠血清IgG、IgA及IgM质量浓度极显著低于空白组(P<0.01),可知环磷酰胺对小鼠血清细胞因子存在较大影响,蛹虫草胞外多糖剂量组的IgG、IgA及IgM质量浓度随给药剂量的增加而递增,表明蛹虫草胞外多糖可改善由环磷酰胺导致的小鼠免疫球蛋白质量浓度降低。
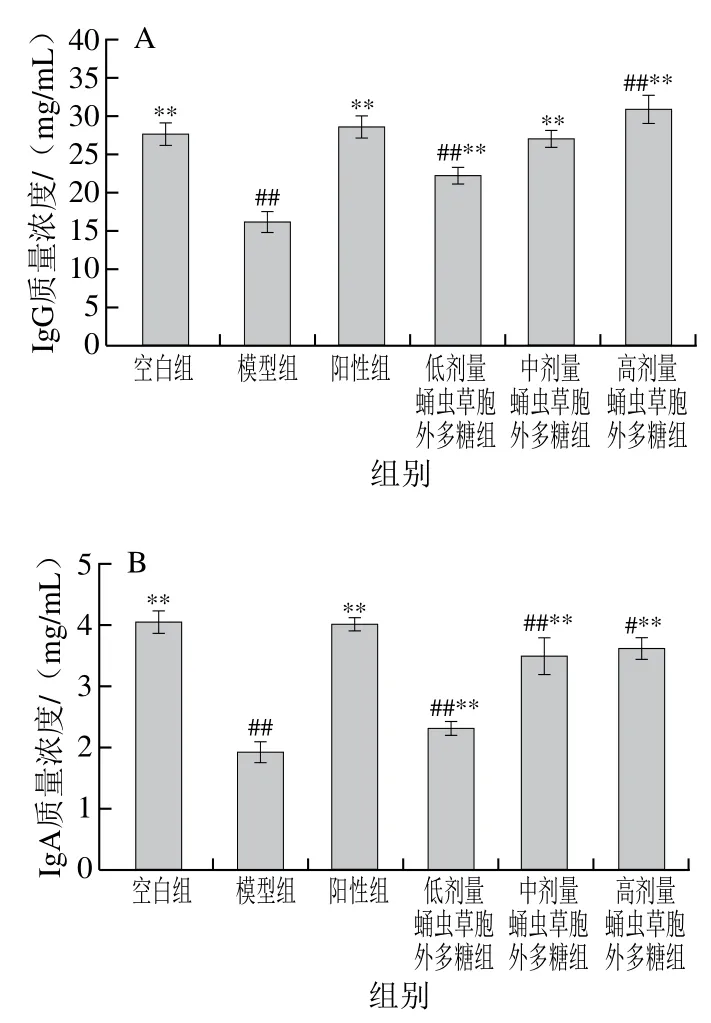
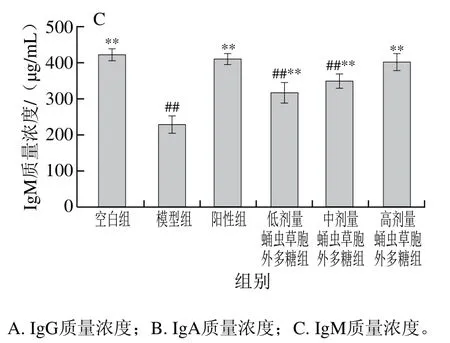
图10 蛹虫草胞外多糖对小鼠的血清免疫球蛋白质量浓度的影响Fig. 10 Effect of the extracellular polysaccharide from Cordyceps militaris on serum immunoglobulin levels in mice
3 讨 论
环磷酰胺作为一种典型的化疗药物和免疫抑制剂,对治疗癌症具有良好的疗效,但在化疗过程中可产生恶心、消化道不适、免疫低下和骨髓抑制等诸多不良反应[29]。故采用天然食品制备功能性食品或营养佐剂替代化学或生物合成药物来预防和缓解环磷酰胺所带来的免疫损伤已成为研究热点。目前研究显示,蛹虫草胞外多糖具有较强的免疫调节活性,王永敏等[11]分离得到分子质量为3.49×104kDa的蛹虫草胞外多糖,且其具备调节机体免疫的活性。本研究从蛹虫草菌株发酵液中分离得到3.67 kDa的低分子质量多糖,研究表明,随给药剂量的增加,蛹虫草胞外多糖促进了B淋巴细胞的增殖,对T淋巴细胞的增殖先促进后抑制。此结果表明蛹虫草胞外多糖改善小鼠免疫功能的作用机制主要是参与小鼠的体液免疫,进而增加小鼠体质量,预防脾脏和胸腺萎缩,此结果与徐廷万等[30]的研究结果一致。
本实验考察了蛹虫草胞外多糖对免疫球蛋白分泌水平的影响,结果表明,蛹虫草胞外多糖可有效提高血清免疫球蛋白的质量浓度,并通过逆转免疫紊乱来维持体内平衡,从而增强体液免疫。其中,对IgG和IgM作用显著,前者在免疫球蛋白中相对含量最高,后者作用于抗感染的初始阶段[31]。因此,血清中免疫球蛋白的质量浓度可体现机体的体液免疫功能。其次,本实验也考察了TNF-α和IL-6的水平,其变化趋势与免疫球蛋白相似,表明蛹虫草胞外多糖可以恢复环磷酰胺导致的TNF-α和IL-6水平下降,进而改善机体免疫功能。对细胞因子IFN-γ和IL-2的水平影响结果显示,蛹虫草胞外多糖低剂量组对其分泌发挥促进作用,中、高剂量组存在一定的抑制作用,水平略有下降,但仍高于模型组水平,可能是因为IFN-γ和IL-2主要由Th1细胞分泌用于介导细胞免疫。以上研究证明蛹虫草胞外多糖能有效缓解由环磷酰胺导致的免疫功能低下,且主要通过调节体液免疫来增强机体的免疫功能。可在使用环磷酰胺治疗癌症的过程中,作为免疫增强佐剂以达到增强机体免疫功能的目的,进而加快患者术后恢复。且由于其具有营养保健功效,还可作为人们日常生活中提高免疫力的保健食品进行推广。详细的作用机制仍需进一步研究论证。
4 结 论
本实验从蛹虫草发酵液中提取得到的蛹虫草胞外多糖质量浓度为3.15 mg/mL,经分离纯化后得到单一多糖分子质量为3.67 kDa,纯度可达86.13%。该多糖可修复环磷酰胺导致的BALB/c小鼠免疫功能损伤,明显提高免疫器官指数,能够有效促使T细胞(低剂量时)、B细胞增殖和IgG、IgA、IgM、TNF-α、IL-6、IL-2、IFN-γ的分泌,免疫调节效果显著。此研究为开发蛹虫草发酵液资源建立了部分理论支撑。
