葡聚糖微球在生物医药领域中的应用
2015-03-15李明生靳冬武马忠仁冯玉萍
张 健,李明生,靳冬武,张 磊,马忠仁,3,冯玉萍*
(1.西北民族大学生命科学与工程学院, 甘肃兰州730030; 2.西北民族大学 生物工程与技术国家民委重点实验室, 甘肃兰州730030; 3.甘肃省动物细胞工程技术研究中心, 甘肃兰州730030)
葡聚糖微球在生物医药领域中的应用
张健1,2,李明生2,3,靳冬武1,张磊1,马忠仁1,2,3,冯玉萍1,2*
(1.西北民族大学生命科学与工程学院, 甘肃兰州730030; 2.西北民族大学 生物工程与技术国家民委重点实验室, 甘肃兰州730030; 3.甘肃省动物细胞工程技术研究中心, 甘肃兰州730030)
[摘要]葡聚糖微球自开发以来,已广泛地应用于组织工程、细胞培养、蛋白分离纯化等方面.其既可以作为药物的控释载体,又可以作为种子细胞扩增培养的载体.目前,在生物制药领域下游分离纯化技术越来越受到关注的背景下,作为柱层析凝胶和分离层析介质的葡聚糖微球也越来越受到科学家的青睐.文章对葡聚糖微球自研究以来的重大历史性突破及当代科学前沿的应用成果加以总结和介绍,着重介绍了葡聚糖微球在医药、疫苗开发、凝胶层析三个方面的应用现状.
[关键词]葡聚糖微球;药物控释;细胞培养;分离纯化
葡聚糖是以葡萄糖为基本组成单位的多糖.根据D-葡萄糖残基结合方式的不同而分为多种,在自然界的动植物及微生物中均广泛分布.其中代表性的有细菌的多缩葡萄糖、褐藻类的海带多糖(laminarin)、地衣类的木聚糖(xylan)、高等植物的纤维素(cellulose)、直链淀粉(amylose)、支链淀粉(amylopoectin)、动物的糖原(glycogen)等.葡聚糖分子量相对较高,肉眼可见白色粉末状,在水中具有较强的右旋特性.其结构多为D-葡萄吡喃糖以α,1→6键连接,极少可见1→2、1→3、1→4键的连接,可作为血浆的替代品.葡聚糖无毒性且具有良好的生物黏附性、生物相容性、生物降解性和胶凝特性,因此是良好的微球制备原料,在生物医药领域具有广泛的应用前景,对其开发研究具有重要的理论与实际意义.
葡聚糖微球是以葡聚糖为原料,经适当的工艺路线制成.在细胞培养方面,自Van Wezel[1]将DEAE-Sephadex A 50第一次作为细胞培养用微载体应用于贴壁细胞的悬浮培养以来,国际市场上研发、出售的微载体种类已多达十几种.目前常用的商品化微载体大致有三种:CytodexTM,Cytopore和Cytoline[2].CytodexTM是以葡聚糖为原料制备的适合细胞生长的微载体,并已广泛应用于动物细胞生物反应器大规模培养等细胞工程领域.在蛋白质分离纯化方面,以葡聚糖微球为基础,已经开发出适合柱层析Sephadex系列的交联葡聚糖凝胶及DEAE-Sephadex A、QAE-Sephadex A等分离层析介质.在医用方面,自20世纪40年代,由Pillemer[3]博士首次发现并报道酵母细胞壁有一种物质具有提高免疫力的作用.经过Diluzio博士进一步研究并从面包酵母中分离出β-葡聚糖开始,人们对其研究不断深入.目前,葡聚糖已广泛地应用于药物控释载体、人工肝细胞研发和组织修复等方面.
1葡聚糖微球的制备及改性方法
葡聚糖是一类天然非动物原性的高分子聚合物,以聚合物微源料的微球常常将其制成O/W、W/O等乳液后,采用适当的方法进行固化.常用的方法包括乳化交联、反省悬浮聚合、包埋、喷雾干燥、微流动聚焦等.而葡聚糖多采用前三种方法,进行微球的制备.
1.1 反相悬浮聚合法
该方法是制备葡聚糖多孔微球的一种常用方法.首先,将葡聚糖单体分子溶解于水或碱液中,然后匀速加入到含有乳化剂的均匀有机油相中,搅拌一段时间,使葡聚糖分子快速均匀地分散,随后加入交联剂.在碱性条件下,葡聚糖分子上的糖羟基可与交联剂中的某些官能团发生反应,从而形成网状交联产物,在分散剂的作用下聚合成凝胶多孔结构,最终形成葡聚糖多孔微球.分散剂的作用主要是更好地降低水相与油相分子之间的表面张力,防止乳滴之间的聚合作用,使水相分子在油相中更好地均匀分散[4].包建民[5]等通过反相悬浮聚合的原理制备了葡聚糖凝胶微球,将所制葡聚糖微球通过脂质体与药物分离实验来测定其凝胶分离性能.结果表明,所制交联葡聚糖凝胶微球具有良好的球形度、分散性以及吸水溶胀性,并具有优良的凝胶过滤分离性能.
1.2 乳化交联法
乳化交联法是微球制备中常用的一种方法,主要是通过机械搅拌乳化的方式制备成O/W、W/O、O/W/W、W/O/W型乳液,再通过物理或化学方法进行交联固化,从而得到微球.乳化交联法合成葡聚糖微球是将用碱液溶解好的葡聚糖溶液匀速加入含有表面活性剂和分散介质的溶液中,形成油包水微乳液体系.表面活性剂使得粒子均匀分散于反应介质体系中.当加入交联剂时,葡聚糖分子可与交联剂发生交联反应,从而形成结构稳定的微球.CytodexTM系列微载体就是采用此种方法制备,是目前细胞培养用微载体中的主流商品化的微载体,如图1所示.
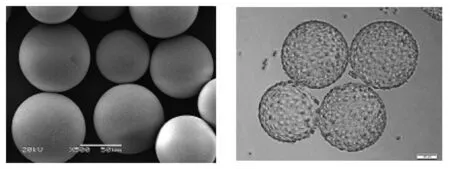
图1Cytodex-1扫描电镜图图2葡聚糖微载体细胞培养图
1.3 包埋法
包埋法是制备磁性高分子微球最早的一类方法,它是将磁性粒子分散于高分子溶液中,通过雾化、絮凝、沉积、蒸发等手段制得磁性高分子微球[6].其磁性粒子(磁核)与外壳层的结合主要通过范德华力(包括氢键)、磁粒表面的金属离子与高分子链的螯合作用以及磁性粒子表面功能基与高分子壳层功能基形成的共价键.天然高分子磁性微球均采用这种方法制备.目前,市场上应用最广的葡聚糖微球类的核磁共振成像对比剂Feridex I.V.TM (Advanced Magnetic, Cambridge, MA, USA)就是采用包埋法将核心为20 nm氧化铁,外包60 nm葡聚糖的磁性颗粒,并已完成了前期的临床试验[7].
1.4 改性方法
尽管葡聚糖微球在诸多领域具有非常广阔的应用前景,但是由于它表面的功能基团单一,无法满足各领域的需求,因此人们纷纷对其表面进行改性,使葡聚糖微球表面含有不同的功能基团. 目前主要的改性方法包括共混改性、共聚改性、分子修饰改性等[8].葡聚糖由于其表面的多羟基机构,使其具有羧化、醛化等多种化学反应,经过不同功能基团的改性,可以适用于分离纯化、离子交换层析、细胞培养、药物控释等多种领域,具有广阔的应用前景.目前市场销售的改性后的葡聚糖微球主要是由美国GE公司销售的Sephadex系列葡聚糖凝胶微球和Cytodex系列微载体.对于葡聚糖微球的改性主要方法为分子修饰改性方法.通常采用DEAE(2-二乙氨基氯乙烷盐酸盐)对葡聚糖微球上的羟基进行取代反应,使之带上正电荷.Van Wezel[1]在1967年就首次成功进行了DEAE与Sephadex A-50的改性实验,从而使带负电的葡聚糖微球改性成为适合细胞生长的正电荷微球,为细胞大规模培养奠定了基础.
2葡聚糖微球在生物医学领域中的应用
2.1 疫苗研发上的应用
利用葡聚糖微球制备相应的细胞载体技术已经相对成熟,但是在国内,大规模的应用还是存在一定问题,限制了我国葡聚糖微球制备技术在疫苗产业中的发展.如何开发具有国内自主知识产权及安全、可靠、稳定的大规模生产工艺是目前的研究重点.
2.1.1细胞培养上的应用
1962年,CaPstiok等[9]对BHK细胞的研究工作为现代动物细胞大量培养技术的发展奠定了基础.随着生物技术的不断革新,如何进行细胞的高密度培养,成为了各国学者关注的焦点.1967年,Van Wezel[1]首次提出了“微载体”培养细胞的概念,并用DEAE-Sephadex A-50作为微载体,成功地进行了细胞的高密度培养.经过不断的改进,目前国内外除了传统的纤维素、塑料、明胶、玻璃和葡聚糖几大类微载体外,国外又相继开发出多种高分子有机材料的微载体,如液体微载体、聚苯乙烯微载体、PHEMA微载体、甲壳质微载体、藻酸盐凝胶微载体等[10].国外一些大的疫苗企业早已经广泛地使用微载体技术大规模培养动物细胞.由于国内微载体研究较晚,至今无大规模商品化,限制了我国疫苗企业的发展.
葡聚糖微载体无毒性且具有良好的生物黏附性、生物相容性、生物降解性和胶凝特性,因此是良好的微载体制备原料.此外,葡聚糖微载体属于非动物源性材料,与明胶微载体相比,在生物制药领域具有更加广泛的应用前景,对其的开发研究具有重要的理论与实际意义.
2.1.2商品化及组织工程学上的应用
葡聚糖微载体商品化最早出现于上世纪80年代,由Famarcia公司开发的Cytodex系列[11].目前,固体微载体被广泛应用,包括实心微载体和大孔微载体.Cytodex系列微载体属于固体微载体中的实心微载体.此种微载体对细胞在微球表面吸附、铺展和病毒感染细胞等方面有较好作用[12],有利于放大过程中球转球的接种工艺的实施[13].其中Cytodex1、Cytodex2由于其表面的特殊小电荷分子,使其更适合细胞的吸附和生长[14];Cytodex3的表面则覆盖有一层胶原蛋白,使其与机体内环境更加接近[14].Cytodex系列微载体的优点是细胞在微载体上可长时间培养,并且其贴壁生长速度较一般微载体要快,但与大孔微载体相比,其比表面积和可获得的细胞浓度相对较小,细胞在搅拌过程中易受流动剪切力等动力学因素破坏[14].
2.2 分离纯化上的应用
无论是天然产物还是通过生物技术手段制得的产品,对于目标产物都要进行提取分离和纯化.作为天然多糖类的葡聚糖是应用最早、最广泛的一种.它含有丰富的羟基,因此具有良好的亲水性能,可进行多种多样的化学反应.作为天然的植物性源料,葡聚糖与生物大分子具有很好的相容性,从而可以提高目标产物的活性回收率.
2.2.1凝胶层析上的应用
在凝胶过滤层析方面,应用最广的是交联葡聚糖凝胶(Sephadex).首见于20世纪80年代中期,被作为一种优良的固体吸附剂,广泛用于色谱分离,固相吸附及分析等领域[15];在生物化学中则广泛用于蛋白质、核酸、酶和多糖类高分子物质的分离, 是生物大分子分离纯化技术中不可缺少的一类介质[15].交联葡聚糖凝胶作为分子筛的介质,根据目标分离产物的直径进行过筛,极少涉及表面吸附问题[15].目前,商品化的葡聚糖凝胶主要是GE公司销售的Sephadex系列.根据交联度的不同可以形成孔径不同的G型凝胶系列.孔径较小的凝胶适用于脱盐或肽及其他小分子;孔径大的则适用于蛋白质和其他大分子的分离[17].对于分子量在100万以上的生物分子,一般不采用此种凝胶分离.目前市场上还开发出了用于DNA或低聚核苷酸的Sephadex.
曾家豫[18]等利用G-25、G-50、G-75、G-100、G-125的Sephadex,对纤维素酶粗酶液进行分离.结果表明5种葡聚糖凝胶中G-75具有良好的分离效果,其回收率可以提高到41.6%,比活力可以提高到原来的4.9倍.张慧丽[19]等用Sephadex LH-20层析法对人参粗品进行两次分离纯化,再用Sephadex LH-20柱进一步纯化,得到人参皂苷Re,收率58.6%,纯度96.2%.该法简化了传统的分离方法对样品的复杂处理,克服了层析柱中原介质不能重复利用及再生繁琐的弊端,具有省时、省力的优点[20].
2.2.2离子交换层析上的应用
在离子交换层析方面, G 类交联葡聚糖凝胶上引入二乙氨基乙基可以制得弱碱性阴离子交换剂-二乙氨基乙基葡聚糖凝胶( DEAE- Sephadex A) .在 G 类交联葡聚糖凝胶上引入二乙基-(2-羟丙基) 氨基乙基可以制得强碱性阴离子交换剂-季铵乙基交联葡聚糖胶 A( QAE-Sephadex A)[16].如果引入羧甲基可制得弱酸性阳离子交换剂-羧甲基交联葡聚糖凝胶,此类交换剂既具有离子交换的性质, 又具有 G 类葡聚糖凝胶的优点[21].引入磺酸乙基、磺酸丙基可制得强酸性阳离子交换剂-SE-葡聚糖凝胶C-25、SP-葡聚糖凝胶C-25[16].在葡聚糖凝胶 G-25上引入羟丙基可制得既具有亲水性, 又具亲脂性的交联葡聚糖凝胶LH-20[22].
杭长标[23]等用DEAE-Sephadex A-50对门冬酰胺酶进行了分离纯化,结果表明DEAE-Sephadex A-50与Sephadex G-150柱层析相比,一次纯化的收率可以达到85%以上,纯度在98%左右,可以很好地满足工业化生产要求,有效提高了层析收率、产品纯度和合格率.
2.3 医学上的应用
目前,微球在医学上的应用主要包括靶向应用、栓塞治疗、缓控释应用等[24].葡聚糖因其具有较好的生物相容性和可降解性,所以在药物控释及栓塞治疗方面具有其独特优势,现已广泛地应用于生物技术和医药等很多领域[25].
2.3.1药物控释
经过适当的工艺,可以将葡聚糖包裹于药物四周制成直径为几微米到几百微米的微小球状实体.此种方法的优点在于:①掩盖药物的不良气味,从而提高患者用药的顺应性.②载缓慢溶解释放和定向植入,长时间稳定地释放药物.③靶向作用,以维持局部药物的浓度.④减少用药量,延长了药物作用时间,减少给药次数.⑤有效减少了不良反应的发生.
综上所述,将药物制成微球剂型,既起到靶向的作用,又达到缓释的目的,具有重要的临床应用价值.Sophie R.Van Tomme[26]等通过混合分散带相反电荷的交联葡聚糖微球制备了一种适用于药物传递和组织工程应用的凝胶.这种体系最重要的应用是作为药物活性蛋白的基体.J.A. Cadee[27]等采用皮下注射的方式,考察了葡聚糖微球进入大鼠体内后,其粒径、初始含水量和甲基丙烯酸酯取代度等对组织反应的影响.通过 6 周观察表明,非降解性和降解性的葡聚糖微球都表现出很好的耐性,在药物传输系统中具有较大的潜在应用价值.
2.3.2临床上的应用
临床上,由于葡聚糖微球具有粒径均一、状态稳定、表面无褶皱且不易破碎等特点,因此可以作为永久末梢性栓塞剂[28].目前,用于临床研究和治疗的葡聚糖栓塞剂是干燥的葡聚糖Sephadex G-50 微球用生理盐水充分溶胀的葡聚糖微球悬液[29].张福成等采用下凝胶色谱法检测溶胀性的方法,对葡聚糖栓塞微球的稳定性分析发现,高压灭菌、室温长期放置及在患者体内,其溶胀体积均会保持一定的稳定性,不会发生后续溶胀而损伤血管组织,从而保证了该制剂栓塞范围的准确性和使用的安全性[30].杨东强[31]等通过建立兔 VX2肝移植瘤动物模型,使用葡聚糖微球和碘化油栓塞剂对新西兰大白兔进行介入栓塞治疗,观察兔子的生存时间、肝功能及 CT 灌注值变化,发现葡聚糖微球组平均生存时间比碘化油组有所延长,说明其介入治疗效果上,葡聚糖微球组优于碘化油组.两个治疗组相比,空白对照组的平均生存时间明显延长,说明介入治疗对肿瘤有明显的治愈效果.
3结论
近年来,随着现代生物技术的快速发展,利用微载体进行动物细胞的大规模培养已经成为了一种发展趋势.微载体在国外已经实现了产业化,一些大的疫苗企业已经广泛地使用生物反应器进行动物细胞的微载体大规模培养.在国内,生物反应器微载体培养技术主要采用进口微载体.因此开发国产化的微载体势在必行.在分离纯化方面,虽然以葡聚糖微球为基础的层析介质已经开发出来,但是相应的技术手段还不成熟,距离大规模的生产还有一定距离,亟需科研人员的努力探索.在医药方面,加速临床类的葡聚糖微球的开发已成为科学家研究的重点,安全、可靠、稳定的葡聚糖微球在临床上越来越受到关注.葡聚糖是一类天然的高分子物质,对人体无毒害作用,但是经过化学方法后,其安全性还有待进一步的验证.所以,在临床应用方面开发更稳定、更高效、更安全的葡聚糖类微球,将是未来研究的重点.
参考文献:
[1] Van Wezel A L. Growth of cell-strains and primary cells on micro-carriers in homogeneous culture[J]. Nature, 1967, 216 (5110): 64-65 .
[2] 吴浩飞,杨晓明,黄仕和. Vero细胞作为基质的病毒性疫苗研制进展[J]. 微生物学免疫进展, 2011, 39(3):56-63.
[3] Pillemer L, Ecker E E. Anticomplementary factor in fresh yeast[J]. The Journal of Biological Chemistry, 1941, 137 (1): 139-142.
[4] 杨振平, 韩杰,宋瑶君 . 交联葡聚糖凝胶微球的制备: 微球表面形态的影响因素与控制[J].华东化工学院学报, 1990, 16(4):375-380.
[5] 包建民, 王勇尊, 李优鑫. 反相悬浮聚合法制备交联葡聚糖凝胶微球及其在脂质体与药物分离中的应用[J]. 现代化工, 2014,34(11):55-60.
[6] 崔梦楠, 田伟, 马素娟等. 磁性微球在细胞与生物大分子分离纯化中的应用[J]. 动物医学进展, 2014, 35(8):74-78.
[7] 刘瑶, 张海丽, 韩德艳. 葡聚糖磁性微球在生物医学领域的应用[J].化学与生物工程,2007, 24(9):5-8.
[8] 朱利会, 陈爱政, 王士斌. 肺部给药用高分子多孔微球的制备及改性研究进展[J]. 化工进展, 2014, 33(7):1832-11837.
[9] 王佃亮, 肖成祖, 陈昭烈, 等. 微载体高密度培养Vero细胞的研究[J]. 生物工程学报, 1996, 12 (2): 164-170.
[10] 郭燕华, 郭勇, 罗立新. 微载体培养技术的研究进展[J]. 生物工程进展, 2001, 21 (5): 56.
[11] 周燕, 刘宝林, 杨波, 等. 微载体培养技术的研究进展[J]. 中国组织工程研究与临床康复, 2010, 14 (16):2945-2948.
[12] Nq Y C, Berry J M, Butler M. Optimization of physical parameters for cell attachment and growth on macroporous miorocarriors[J]. Biotechnol Bioeng, 1996, 50 (6): 627-635.
[13] 张立, 严春, 范卫民, 等. Vero细胞的微载体培养[J]. 华东理工大学学报, 1998, 24 (6): 659-663.
[14] 过琴媛, 王辉, 沈心亮. 微载体培养动物细胞技术的研究进展[J]. 微生物学免疫学进展, 2007, 35 (1): 73-75.
[15] 韩宝三, 沈柏用, 彭承宏等. 微载体cytodex 3大量扩增成人骨髓间充质干细胞的初步研究[J]. 上海交通大学学报(医学版), 2006,26(6):581-585.
[16] 彭悦, 聂基兰. 交联葡聚糖凝胶吸附性能及应用[J]. 江西化工, 2001, 2: 20-24.
[17] Hagel L, Janson J C, nRytien L. Protein Purification[J]. New York:VCH Publishers, 1989,63.
[18] 曾家豫, 冯克宽, 王渭霞等. 葡聚糖凝胶层析法分离纯化纤维素酶的研究[J]. 西北师范大学学报(自然科学版), 1998, 34 (4): 70-72.
[19] 张慧丽, 孙印石, 郑毅男. 葡聚糖凝胶LH-20柱层析法分离人参皂苷Re的研究[J]. 吉林农业大学学报, 2005, 27 (3): 293-295.
[20] 黄星, 卢滇楠, 阎匿明, 等. 蛋白质体外折叠技术研究现状与展望[J]. 化工进展, 2002, 21 (12): 875-878.
[21] 林洁刁. 流动注射液滴荧光法用于水溶性维生素的分析研究[D]. 江西: 南昌大学, 2005.38.
[22] 党建章, 聂小忠, 梁丽琴. Sephadex LH-20纯化橄榄苦苷[J]. 中药材, 2010, 33 (1): 119-121.
[23] 杭长标, 万文光. 门冬酰胺酶用DEAE-Sephadex A-50层析法纯化的研究[J]. 中国医药工业杂志, 2002, 33 (3): 119-120.
[24] 陈晓慧, 杨峥维. 微球制剂的研究进展[J]. Proceeding of Clinical Medicine,2012, 21(7):534-538.
[25] 代春丽. 大孔葡聚糖微球的制备及蛋白吸附研究[D]. 天津:天津大学,2011.9.
[26] T omme S R, Steenbergen M J, Smedt S C, et al. Self-gelling hydrogels based on oppositely charged dextran microspheres[J]. Biomaterials, 2005, 26(14): 2129-2135.
[27] Cadee J A, Brouwer L A, Otter W, et al. A comparative biocompatibility study of microspheres based on crosslinked dextran or poly(lactic-co-glycolic)acid after subcutaneous injection in rats[J]. Journal of Biomedical Materials Research, 2011, 4(56): 601-609.
[28] 石红建, 王杰, 石海彬, 等. 葡聚糖微球经微导管栓塞术中应用参数的实验研究[J]. 南通医学院学报, 2003, 23 (1): 6-7.
[29] 吴梧桐. 生物制药工艺学[M]. 北京: 中国医药科技出版社, 2005.143-152.
[30] 张福成, 卢彦芳, 安静等. 葡聚糖栓塞微球溶胀特性的研究[J]. 中国药房, 2011, (5):402-404.
[31] 杨东强.葡聚糖微球与碘油介入栓塞兔 VX2 肝移植瘤的对比研究[A]. 第八届中国肿瘤学术大会暨第十三届海峡两岸肿瘤学术会议论文汇编[C].2014,280.
Dextran microspheres used in the biomedical field
ZHANG Jian1, 2, LI Ming-sheng2, 3, JIN Dong-wu1, ZANG Lei1,
MA Zhong-ren1, 2, 3, FENG Yu-ping1, 2*
(1. Life Science and Engineering College of Northwest University for Nationalities, Lanzhou 730030, China; 2. Key Laboratory of Bioengineering & Biotechnology of State Ethnic Affair Commission, Northwest University For Nationalities, Lanzhou 70030, China; 3. Engineering Technology Research Center for Animal Cell of Gansu Province, Lanzhou 730030, China)
[Abstract]Dextran microspheres has been widely used in tissue engineering, cell culture, protein separation and purification and others since it was developed. Dextran microspheres can be used as controlled release drug carriers and seed cells amplified carrier culture. Currently, the downstream separation and purification technology of biopharmaceuticalin became more and more attention, so as the column chromatography and gel chromatography separation medium of dextran microspheres have also been more and more scientists attention. This article summarized and introduced to the major historic breakthrough of dextran microspheres and the applications of the results of contemporary scientific frontier after its first development. The article also focused on the three aspects application status of dextran microspheres in medicine, vaccine development and gel chromatography. Finally, the paper summarized and predicted the applications of dextran microspheres in the biomedical field.
[Key words]Dextran; Ccontrolled drug delivery; Cell culture; Separation and purification
[作者简介]张健(1988—),男,黑龙江哈尔滨人,硕士研究生,主要从事生物材料的开发与应用方面的研究.
[通讯作者]*
[基金项目]西北民族大学研究生科研(实践)创新项目资助(Yxm2014189);教育部“长江学者和创新团队发展计划”项目(IRT13091);国家外专项目(GDW20146200235);兰州市人才创新创业项目(2014-RC-50).
[收稿日期]2015-08-20
[中图分类号]Q81
[文献标识码]A
[文章编号]1009-2102(2015)03-0027-06
