蛋氨酸对瓦氏黄颡鱼幼鱼肝脏及血浆中谷草转氨酶和谷丙转氨酶活力的影响❋
2015-03-15王香丽麦康森张彦娇艾庆辉
王香丽, 麦康森, 徐 玮, 张彦娇, 艾庆辉
(中国海洋大学农业部水产动物营养与饲料实验室,教育部海水养殖重点实验室,山东 青岛 266003)
蛋氨酸对瓦氏黄颡鱼幼鱼肝脏及血浆中谷草转氨酶和谷丙转氨酶活力的影响❋
王香丽, 麦康森, 徐 玮, 张彦娇, 艾庆辉❋❋
(中国海洋大学农业部水产动物营养与饲料实验室,教育部海水养殖重点实验室,山东 青岛 266003)
本文旨在研究人工饲料中蛋氨酸对瓦氏黄颡鱼幼鱼肝脏及血浆中谷草转氨酶和谷丙转氨酶活力的影响。在基础饲料中分别添加0.0、0.3、0.6、0.9、1.2和1.5g/100 g的晶体DL-Met,以L-Glu作为等氮替代物,配制6组等氮等脂饲料(Met的实测值为0.40、0.73、1.04、1.33、1.70和1.98g/100 g饲料),在室内循环水系统中进行为期70d的生长实验。实验表明,随着饲料中蛋氨酸含量的增加,肝脏谷丙转氨酶(GPT)活力显著升高,并在蛋氨酸含量为1.70g/100g饲料时,活力达最大值(P<0.05);肝脏谷草转氨酶(GOT)活力与GPT活力有相似的变化趋势,但各处理组间无显著性差异(P>0.05)。随着饲料中蛋氨酸含量的增加,血浆中的GPT活力呈现先升高后平稳的变化趋势,且拐点出现在蛋氨酸含量为1.04g/100 g(P<0.05)饲料组,而血浆中GOT活力呈现先升高后降低的变化趋势,且最大值出现在蛋氨酸含量为0.73g/100 g(P<0.05)饲料组。研究表明,当饲料中蛋氨酸含量不足或过量时,都会影响瓦氏黄颡鱼幼鱼转氨酶的活力,从而在一定程度上影响鱼体的氨基酸代谢。
瓦氏黄颡鱼; 肝脏; 幼鱼; 蛋氨酸; 谷草转氨酶; 谷丙转氨酶
蛋氨酸作为机体主要的含硫氨基酸,是鱼类生长的必需氨基酸之一。在动物体上,蛋氨酸功能主要表现为:参与机体蛋白代谢、参与机体硫代谢以及参与机体转甲基反应[1-2]。研究表明,在多种鱼类中,当饲料蛋氨酸含量不足或过量时,不仅会导致鱼体生长和饲料转化率下降[3-5],而且还会降低实验鱼的存活率[6-7]。饲料氨基酸主要通过转氨基作用和脱氨基作用在体内被进一步代谢转化,鱼类则主要通过联合脱氨基作用满足机体需要,谷丙转氨酶(Glumtaic-pyruvic transaminase,GPT)和谷草转氨酶(Glutamic oxalacetic transaminase, GOT)是氨基酸代谢中的2个关键酶,它们的活力大小不仅反映了氨基酸代谢程度的强弱[8],而且也显示了肝功能的正常与否[9]。在大豆浓缩蛋白替代鱼粉实验中,过高替代量会显著降低瓦氏黄颡鱼肝脏中GPT和GOT的活力[10],即影响了肝脏内的氨基酸代谢平衡。在蛋氨酸需求及MHA替代蛋氨酸实验中,蛋氨酸有效含量不足会显著升高建鲤和金鲳鱼血浆中GPT和GOT的活力,对鱼体肝脏造成了一定程度的损伤,抑制肝脏的正常生理功能[11-12]。
瓦氏黄颡鱼(Pelteobagrusvachelli)又名江黄颡,肉食性鱼类,因其肉味鲜美,无肌间刺等深受消费者喜爱[13],是长江、淮河等流域的主要养殖对象之一。目前有关瓦氏黄颡鱼研究多集中于主要营养素对鱼体生长的影响等方面[14-16],而关于饲料中蛋氨酸对瓦氏黄颡鱼幼鱼血浆及肝脏中代谢酶(GOT和GPT)活力影响的研究仍属空白;因此,本文探讨了瓦氏黄颡鱼配合饲料中不同蛋氨酸水平对血浆和肝脏转氨酶(GOT和GPT)活力的影响,以进一步了解蛋氨酸在鱼类营养中的作用。
1 材料和方法
1.1 实验饲料设计
以瓦氏黄颡鱼幼鱼鱼体氨基酸组成为标准,添加相应晶体氨基酸使基础料中除蛋氨酸外其他氨基酸均达到鱼体氨基酸水平,分别在基础料中梯度添加0.0、0.3、0.6、0.9、1.2和1.5g/100g的晶体DL型蛋氨酸(DL-Met),以L型谷氨酸(L-Glu)作为等氮替代物,配制6组等氮等脂实验饲料(蛋氨酸的实测值为0.40、0.73、1.04、1.33、1.70和1.98g/100g饲料)(见表1)。饲料保存于-20℃冰箱中,待正式实验开始时,破碎成适宜大小颗粒进行投喂。
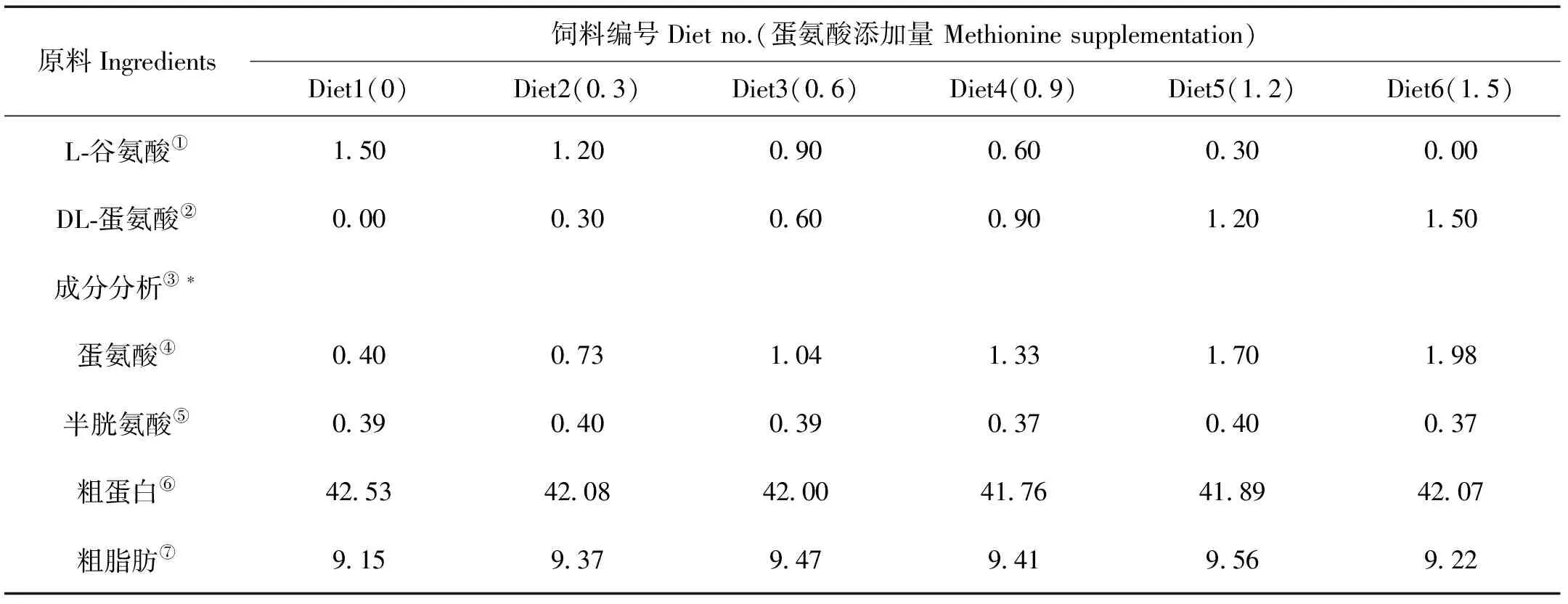
表1 实验饲料配方和化学成分分析表(干物质)[17]
注:*:3个重复的平均值。Note:*:Means of three analysis.
①Glutamic acid; ② DL-methionine;③Proximate composition (dry matter); ④Methionine; ⑤Cysteine; ⑥Crude protein; ⑦Crude lipid
1.2 养殖过程
实验鱼购自四川眉山,选用当年人工孵化的同一批苗种,在潍坊学院室内循环养殖水系统进行为期70d的养殖实验。基础料驯化投养10d后,挑选健康无病、规格一致的幼鱼(初始平均体重(1.53±0.10)g)随机分为6组,每组3个重复,每个重复为50尾鱼,7:00和19:00手工缓慢投喂至表观饱食。实验过程水温25~28℃,pH为7.2~7.6,溶氧量不低于6.0mg/L。
1.3 分析与统计
1.3.1 样品采集 养殖实验结束后,对实验鱼饥饿处理24h,以丁香酚(1∶10000)麻醉,对每个桶的鱼进行计数、称重。从每桶中抽取10尾鱼,以1mL无菌注射器从鱼体尾静脉取血,转移至2mL的抗凝采血管中,4℃静置6h后3000r/min离心10min,分离血浆并暂存于液氮中。同时每桶另取3尾鱼的肝脏,暂存于液氮中。所有样品均转移至-80℃以备后期分析。
1.3.2 常规分析 饲料经破碎后105℃烘干至恒重,参照AOAC法进行常规分析。采用凯氏定氮法测定粗蛋白含量;采用索氏抽提法测定粗脂肪含量。蛋白含量和脂肪含量均重复测定2次,取平均值为测定结果。
1.3.3 含硫氨基酸(蛋氨酸和半胱氨酸)分析 含硫氨基酸采用高效液相色谱法(HPLC)测定。饲料经冷冻干燥后,取样品0.2g,加入6mol HCl 6mL,在110℃下水解22~24h后滤纸过滤,经0.5mol NaHCO3冲洗后定容至50mL,色谱分离后经邻苯二甲醛(Orthophthaldehyde,Sigma)衍生后,用高效液相色谱仪(HPLC,HP1100,USA)进行氨基酸分析。饲料中蛋氨酸和半胱氨酸含量均重复测定2次,取平均值为测定结果。
1.3.4 GOT与GPT分析 肝脏和血浆中的GOT、GPT活力均采用南京建成生物工程研究所的试剂盒测定,具体操作如下。
样本前处理:
①血浆样本待测:直接取样测定。②肝脏组织样本:准确称取组织重量,按重量(g)∶体积(mL)=1∶9的比例,加入9倍体积的生理盐水,冰水浴条件下机械匀浆,2500 r/min,离心10min,取上清液待测。
操作流程:
a.将基质液20μL(37℃已预温)与待测样品5μL混匀后放入测定孔中,将基质液20μL(37℃已预温)放入对照孔中,均37℃水浴30min。
b.将2,4-二硝基苯肼液20μL放入测定孔中,将2,4-二硝基苯肼液20μL与待测样品5μL混匀后放入对照孔中,均37℃水浴30min。
c.轻轻水平摇匀96孔板,室温放置15min后,在510nm波长下用酶标仪测各孔OD值(绝对OD值=测定孔OD值-对照孔OD值),查标准曲线,求得相应GOT或GPT活力。GOT/GPT活力 组织中GOT/GPT活力(U/gprot)=通过标准曲线得匀浆液GOT/GPT活力(U/L)÷待测匀浆液蛋白浓度(gprot/L)。
GOT测定原理 GOT能使α-酮戊二酸和天门冬氨酸移换氨基和酮基,生成谷氨酸和草酰乙酸。草酰乙酸在反应过程中可自行脱羧成丙酮酸。丙酮酸与2,4二硝基苯肼反应生成2,4二硝基苯棕,在碱性溶液中呈红棕色,于505nm比读吸光度并计算酶活力。
GPT测定原理 GPT在37℃及pH=7.4条件下,作用于丙氨酸及α-酮戊二酸组成的底物,生成丙酮酸及谷氨酸。反应30min后(固定时间)加入2,4二硝基苯肼盐酸溶液,既中止反应,同时2,4二硝基苯肼与酮酸中羰基加成,生成丙酮酸苯腙。苯腙在碱性条件下呈红棕色,于505nm比读吸光度并计算酶活力。
卡门氏单位 1mL液体,反应液总容量3mL,340nm波长,1cm光径,25℃,1min内所生成的丙酮酸,使NADH氧化成NAD而引起吸光度每下降0.001为1个门卡氏单位(1门卡氏单位=0.482U/L,25℃)。
肝脏蛋白含量采用微量考马斯亮蓝法测定,试剂盒来自南京建成生物工程研究所,具体操作参照试剂盒说明书进行。
1.3.5 统计方法 采用SPSS 17.0对所有数据进行单因素方差分析,如果差异显著,则进行Tukey多重比较,显著性分析为P<0.05。
2 结果
2.1 饲料中蛋氨酸含量对肝脏GPT和GOT活力的影响
随着饲料中蛋氨酸含量的增加,GPT活力呈现先升高后降低的变化趋势(P<0.05),且最大值出现在蛋氨酸含量为1.70g/100g饲料(Diet 5)组(见图1)。GOT活力与GPT活力具有相似的变化趋势,但各个处理组间无显著性差异(P>0.05)(见图2)。
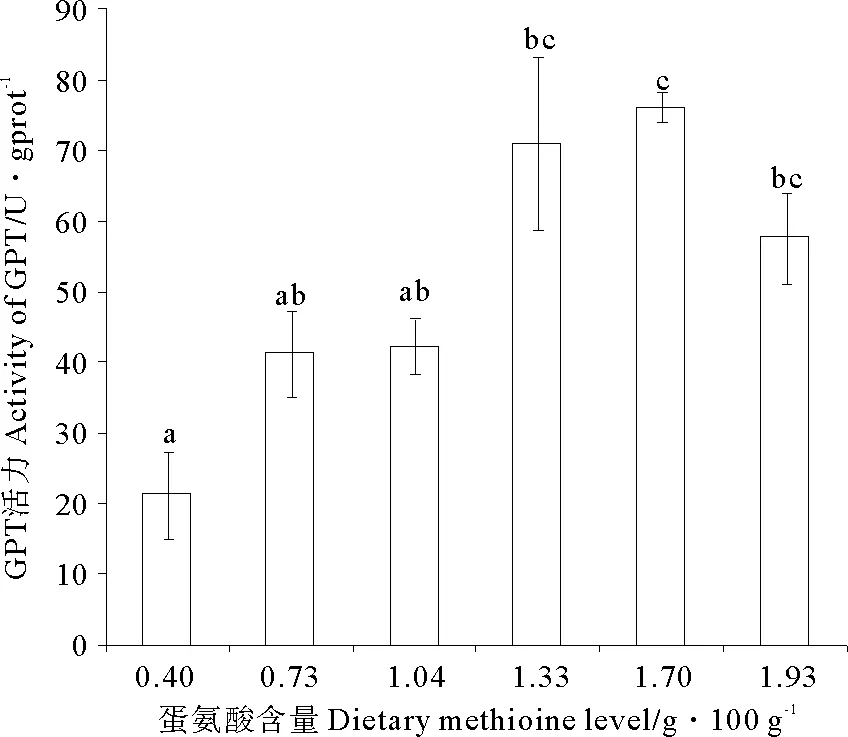
(图中数值为平均值±标准误(n=3)。各处理的不同字母表示显著影响(P<0.05,Tukey′s检验)。Values are means (n=3), with their standard errors represented by vertical bars.a, b, cMean values for the same enzyme with unlike letters were significantly different (P<0.05, Tukey′s test).)
图1 饲料蛋氨酸对瓦氏黄颡鱼肝脏中谷丙转氨酶活力的影响
Fig.1 Effects of dietary methionine on hepatic activities of glutamic-pyruvic transaminase
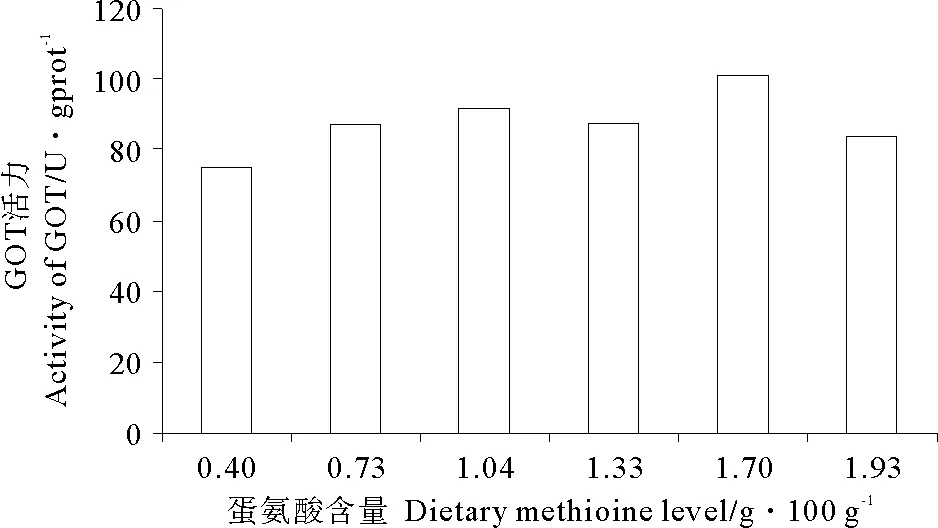
(图中数值为平均值±标准误(n=3,P>0.05,Tukey′s检验)。Values are means (n=3,P>0.05, Tukey′s test).)
图2 饲料蛋氨酸对瓦氏黄颡鱼肝脏中谷草转氨酶活力的影响
Fig.2 Effects of dietary methionine on hepatic activities of glutamic oxalacetic transaminase
2.2 饲料中蛋氨酸含量对血浆GPT和GOT活力的影响
随着饲料中蛋氨酸含量的增加,GPT活力逐渐升高,且在饲料蛋氨酸含量为1.04g/100g(Diet 3)时达到最大值,而后呈现平稳的变化趋势,且1.04g/100g(Diet 3)到1.98g/100g(Diet 6)组GPT活力无显著性差异(P>0.05)(见图3)。随着饲料中蛋氨酸含量的增加,GOT活力呈现先升高后降低的变化趋势(P<0.05),且最大值出现在Met含量为0.73g/100g(Diet 2)组(见图4)。
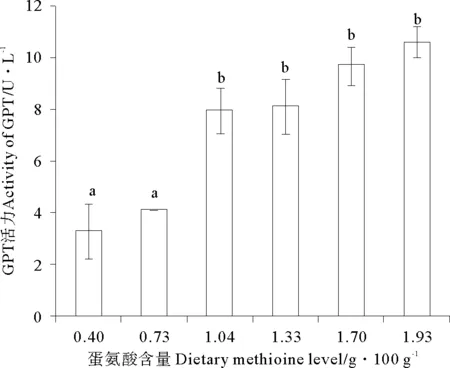
(图中数值为平均值±标准误(n=3)。各处理的不同字母表示显著影响(P<0.05,Tukey′s检验)。Values are means (n=3), with their standard errors represented by vertical bars.a, bMean valuesfor the same enzyme with unlike letters were significantly different (P<0.05, Tukey′s test).)
图3 饲料蛋氨酸对瓦氏黄颡鱼血浆中谷丙转氨酶活力的影响
Fig.3 Effects of dietary methionine on plasmatic activitie of glutamic-pyruvic transaminase
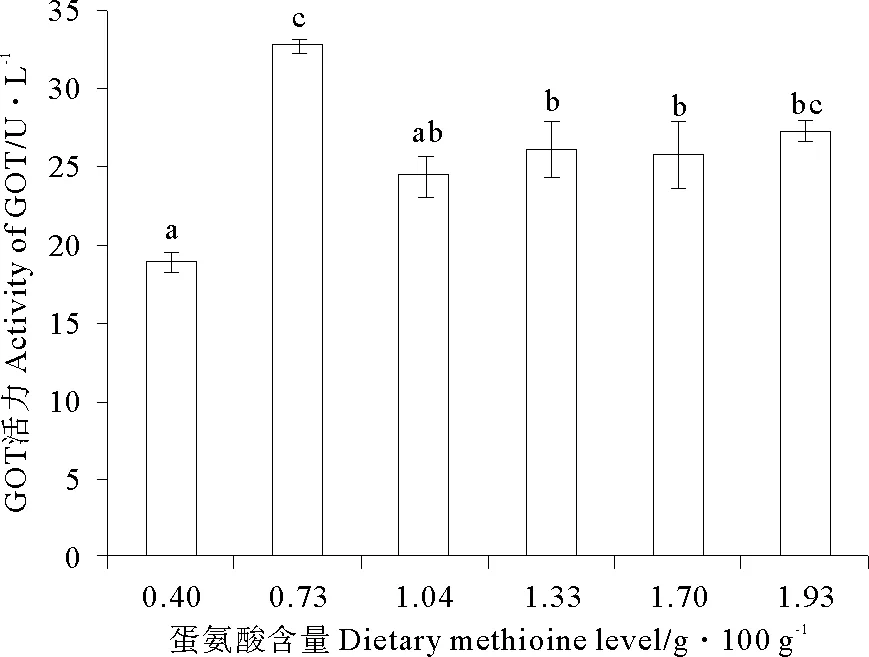
(图中数值为平均值±标准误(n=3)。a,b,c各处理的不同字母表示显著影响(P<0.05,Tukey′s检验)。Values are means (n=3), with their standard errors represented by vertical bars.a,b,cMean values for the same enzyme with unlike letters were significantly different (P<0.05, Tukey′s test).)
图4 饲料蛋氨酸对瓦氏黄颡鱼血浆中谷草转氨酶活力的影响
Fig.4 Effects of dietary methionine on plasmatic activities of glutamic oxalacetic transaminase
3 讨论
本实验中,随着饲料中蛋氨酸含量的增加,肝脏中GPT与GOT活力均呈现先升高后降低的变化趋势,且最高值均出现在蛋氨酸含量为1.70g/100g饲料组,实验结果在一定程度上显示了鱼体肝脏氨基酸代谢状况。转氨酶(GOT和GPT)的主要作用是催化氨基酸生成酮酸,从而保持机体稳态。当饲料中氨基酸(底物)不足时,GPT活力和GOT活力较低,转氨作用较弱;当底物含量适宜时,GPT活力和GOT活力相应升高,转氨作用相应增强;当底物含量过量时,GPT活力和GOT活力相应降低,转氨作用相应减弱,这或许是因为饲料氨基酸吸收时间的跨度或小肠绒毛上转运蛋氨酸载体数目有限[18]。本实验肝脏的GPT活力和GOT活力的最高值出现在蛋氨酸含量为1.70g/100g饲料组;这表明适宜的蛋氨酸含量时GPT和GOT活力最高,氨基酸代谢最快,而过高或过低的蛋氨酸含量均不利于机体氨基酸代谢。类似的结果也出现在花鲈[19]的研究上,当菜籽粕替代鱼粉含量较高,即饲料氨基酸较不平衡影响了肝脏中氨基酸代谢的稳态,进而表现为实验鱼肝脏中GPT和GOT活力显著降低。
正常情况下血清中的转氨酶活性值很低;当组织中毒病变或受损组织范围较大时,血清中的GPT和GOT浓度会相应上升且活性也会相应增强[20]。大量医学实验表明GPT和GOT是肝细胞受损最灵敏指标之一,血清中微量的转氨酶活力即可表征肝功能已受到损伤[21]。因此,血清中GOT和GPT活力的变化是反应肝功能正常与否的重要指标。本实验中随着饲料中蛋氨酸含量的增加,血浆中GPT活力呈现先升高后平稳的变化趋势,蛋氨酸含量为1.04g/100g(Diet 3)饲料组为拐点。随着饲料中蛋氨酸含量的增加,血浆中GOT活力呈先升高后降低的变化趋势,且最大值出现在蛋氨酸含量为0.73g/100g(Diet 2)饲料组。实验结果表明,在蛋氨酸含量不足时,影响机体蛋白质代谢,进而导致肝脏损伤;类似的结果也出现在建鲤[11]和金鲳鱼[12]等鱼类研究中,当饲料中蛋氨酸含量过低或蛋氨酸羟基类似物(MHA)替代蛋氨酸比例过高时,鱼体肝脏受损,进而导致血浆中GPT和GOT活力均显著升高。
本实验研究表明,当饲料中蛋氨酸含量不足或过量时,都会影响瓦氏黄颡鱼幼鱼转氨酶的活力,从而在一定程度上影响氨基酸代谢。
致谢:本实验的养殖和分析过程中得到了杨英豪、张凯凯、左然涛和门珂珂的大力协,在此表示感谢!
[1] Mehler A H. Amino acid metabolism Ⅱ: metabolism of the individual amino acids[M].Textbook of Biochemistry: With Clinical Correlation. USA: John Wiley and Sons Inc, 1986: 462-464.
[2] Tulli F, Messina M, Calligaris M, et al. Response of European sea bass (Dicentrarchuslabrax) to graded levels of methionine (total sulphur amino acids) in soya protein-based semi-purified diets [J]. Brit J Nutr, 2010, 104: 664-673.
[3] Goff J B, Gatlin D M. Evaluation of different sulfur amino acid compounds in the dietof red drum,Sciaenopsocellatus, and sparing value of cysteine for methionine [J]. Aquaculture, 2004, 241: 465-477.
[4] Zhou Q C, Wu Z H, Tan B P, et al. Optimal dietary methionine requirement for juvenile cobia (Rachycentroncanadum) [J]. Aquaculture, 2006, 258: 551-557.
[5] Mai K S, Wan J L, Ai Q H, et al. Dietary methionine requirement of juvenile yellow croakerPseudosciaenacroceaR[J]. Aquaculture, 2006, 251: 564-572.
[6] Twibell R G, Wilson K A, Brown P B. Dietary sulfur amino acid requirement of juvenileyellow perch fed the maximum cystine replacement value for methionine [J]. J Nutr, 2000, 130: 612-616.
[7] Ahmed I, Khan M A, Jafri A K. Dietary methionine requirement of fingerling Indian major carp,Labeorohita(Hamilton) [J]. Aquaculture International, 2003, 11: 449-462.
[8] 王桂芹, 李子平, 牛小天, 等. 饲料能量和维生素 B_6 对乌鳢生长和蛋白质代谢酶活性的影响[J]. 中山大学学报(自然科学版), 2011, 50(4) : 96-99.
[9] Yan Q, Xie S, Zhu X, et al. Dietary methionine requirement for juvenile rockfish,Sebastesschlegeli[J]. Aquac Nutr, 2007, 13: 163-169.
[10] 杨英豪. 大豆浓缩蛋白对瓦氏黄颡鱼幼鱼摄食、生长、消化和蛋白质代谢的影响[D]. 青岛: 中国海洋大学, 2011.
[11] Feng L, Xiao W W, Liu Y, et al. Methionine hydroxyl analogue prevents oxidative damage and improves antioxidant status of intestine and hepatopancreas for juvenile Jian carp (Cyprinuscarpiovar.Jian) [J]. Aquacult Nutr, 2011, 17: 595-604.
[12] Niu J, Du Q, Lin H Z, et al. Quantitative dietary methionine requirement of juvenile golden pompanoTrachinotusovatusat a constant dietary cystine level [J]. Aquacult Nutr, 2013, 19: 677-686.
[13] 万松良, 黄永涛, 刘敏, 等. 瓦氏黄颡鱼的含肉率及营养成分分析[J]. 水利渔业, 2008, 28(3): 59-61.
[14] 封福鲜, 艾庆辉, 徐玮, 等. 精氨酸和赖氨酸对瓦氏黄颡鱼幼鱼生长和非特异性免疫力的影响[J]. 水产学报, 2011, 123(31): 420.
[15] 张世亮. 饲料中糖结构、糖水平及糖脂比对瓦氏黄颡鱼幼鱼生长及糖代谢的影响[D]. 青岛: 中国海洋大学, 2011.
[16] 郑珂珂, 朱晓鸣, 韩冬, 等. 饲料脂肪水平对瓦氏黄颡鱼生长及脂蛋白脂酶基因表达的影响[J]. 水生生物学报, 2010, 34(4): 815-821.
[17] Wang X L, Ai Q H, Mai K S, et al. Effects of dietary methionine on survival, growth performance, metabolicand immune enzymes, molecular cloning and expression of methionine metabolism genes of juvenile darkbarbel catfish (Pelteobagrusvachelli) at a constant dietary cystine level [J]. Aquaculture, (unpublished).[18] Bröer S. Amino acid transport across mammalian intestinal and renal epithelia[J]. Physiological Reviews, 2008, 88(1): 249-286.
[19] Cheng Z Y, Ai Q H, Mai K S, et al. Effects of dietary canola meal on growth performance, digestion and metabolism of Japanese seabass,Lateolabraxjaponicas[J]. Aquaculture, 2010, 305(1): 102-108.
[20] 郑永华, 蒲富永. 贡对鲤鲫鱼组织转氨酶活性的影响[J]. 西南农业大学学报, 1997, 19(1): 41-45.
[21] Lin L, Zeng X L, Zhang J. Effect of profenofos poisoning on liver lipid peroxidation and liver function in rabbits [J]. Chinese Journal of Clinic Rehabilitation, 2004, 8(21): 4380-4381.
责任编辑 朱宝象
Influence of Dietary Methionine on the Activity of Liver and Plasma Glutamic-Pyruvic and Glutamic Oxalacetic Transaminases of Juvenile Darkbarbel Catfish (Pelteobagrusvachelli)
WANG Xiang-Li, MAI Kang-Sen, XU Wei, ZHANG Yan-Jiao, AI Qing-Hui
(The Key Laboratory of Aquaculture Nutrition and Feed, Ministry of Agriculture, The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
A 10-week feeding trialina recirculation rearing system was tried in order to determine the influence of dietary methionine on the activity of glutamic-pyruvic and glutamic oxalacetic transaminasesin the liver and plasma of juvenile darkbarbel catfish (Pelteobagrusvachelli). Six nitrogen and lipid contents identicaldiets were formulated by supplementing 0.0%, 0.3%, 0.6%, 0.9%, 1.2% and 1.5% of methionine, making the final dietary methionine content to be 0.40%, 0.73%, 1.04%, 1.33%, 1.70% and 1.98%, respectively. The results showed that when dietary methionine increased, the activity of glutamic-pyruvic transaminase (GPT) in liver increased significantly (P<0.05), reaching the highest when the content of diet methionine was 1.70%, while the activity of glutamicoxalacetictransaminase (GOT) in liver increased in the same trend as that of GPT although no significantdifferencewas found among diets. As dietary methionine increased, the activities of plasma GPTincreased first and then turned to be stable when the content of methionine was 1.04% (P<0.05). Similarly, the activity of plasma GOTfirst increased, reaching the hig-hest when the content of methionine was 0.73% and then decreased (P<0.05). In conclusion, the activity of two transaminases wassignificantly influenced by dietary methionine.
Pelteobagrusvachelli; pliver; juvenile fish; methionine; gutamic oxalacetic transaminase; glutamic-pyruvic transaminase
国家重点基础研究发展计划项目(2009CB118702)资助
2014-03-25;
2014-05-28
王香丽(1988-),女,硕士生,主要从事水产动物营养生理研究。E-mail: diezang1988@163.com
❋❋ 通讯作者: E-mail:qhai@ouc.edu.cn
S963.71
A
1672-5174(2015)09-049-05
10.16441/j.cnki.hdxb.20140097
