沉积物表面酸碱性质测定方法研究❋
2015-03-15葛成凤郭君乐朱佳美曹晓燕
路 敏, 葛成凤, 郭君乐, 朱佳美, 曹晓燕,2❋❋
(中国海洋大学 1. 化学与化工学院; 2. 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100)
沉积物表面酸碱性质测定方法研究❋
路 敏1, 葛成凤1, 郭君乐1, 朱佳美1, 曹晓燕1,2❋❋
(中国海洋大学 1. 化学与化工学院; 2. 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100)
本文选取胶州湾和长江口某站点的沉积物,对沉积物表面酸碱性质的测定方法进行了研究。在现有碱返滴定的基础上提出了双返滴定的模式,以酸返滴定进行空白消除,有效地简化了操作与计算过程。通过与碱返滴定和两边滴定的结果对照发现双返滴定更适合沉积物表面酸碱性质的研究,同时考察了双返滴定过程中不同条件对测定结果的影响,并针对本文样品确定了最佳实验条件。
沉积物;表面酸碱性质;双返滴定
沉积物可吸附海水中的营养盐、金属离子、表面活性剂和各种有毒有机化合物等多种物质,对其在海洋中的迁移和转化具有重要作用。营养盐及污染物在沉积物界面上的吸附与固-液界面反应密切相关,而颗粒物表面的酸碱性质决定着其表面电荷,对固-液界面反应过程的研究至关重要[1]。表面电位滴定是沉积物表面酸碱性质研究最常用的表征手段,可获得不同pH下沉积物的表面电荷密度、表面羟基位密度及零电荷点(Point of zero charge, PZC)等重要信息,同时也是定量描述沉积物表面性质和构建表面反应的基础。在假定表面质子化机制和表面位类型的基础上,借助计算机软件,如FITEQL4.0等,可得到表面的质子结合常数、位密度等重要常数[2]。很多学者已对表面电位滴定技术在单矿物、氧化物和沉积物等表面性质测定中的应用进行了研究。早期的实验过程可称为碱返滴定[3-4]:首先将样品用标准硝酸溶液酸量滴定至一定pH值,之后用标准氢氧化钠溶液滴定至一定pH值,其中空白实验用的多是与样品实验组成相同的上清液[5-7],此法操作和计算均比较简单,但未考虑基质溶解的影响,因此改用酸量滴定上清液作为空白[1,8-12]以减少样品基质溶解的影响,但是操作和空白酸滴定的体积计算变得复杂。孙中溪等曾使用两边滴定的方式[3-4,12-14],与碱返滴定对照发现该方式可大大降低铝氧化物溶解等其他界面反应。
本文在以上工作基础上对沉积物表面酸碱电位滴定方法进行了系统探讨,为了解决由于基质的溶解而不易扣除空白的问题,同时简化操作与计算,在碱返滴定实验的基础上增加了酸返滴定过程,并以此进行空白校正。通过考察不同滴定方式的重现性、可操作性、表面位浓度的拟合结果与测定结果的吻合度等因素,确定了适合沉积物表面性质研究的方案,并对其实验条件进行了优化。
1 实验部分
1.1 实验原理
当体系中溶解、沉淀反应不起主导作用时,溶液中游离氢离子的浓度主要受表面化学反应制约。在对沉积物进行酸碱滴定时,通常首先将沉积物酸化至pH=3左右(酸量滴定),然后用NaOH溶液返滴定至pH=10左右(碱返滴定),其间氢离子在沉积物表面的吸附量可从滴加的H+或OH-和游离的H+或OH-之差得出。
滴定过程中每一个滴定点酸的总浓度定义为Ht(mol·L-1)[13]:
Ht=CA-CB=(Vat×Ca-Vb×Cb)/(V0+Vat+Vb)。式中:CA和CB为每个滴定点加入酸和碱的浓度(mol·L-1);Ca、Cb分别为所使用的酸和碱的浓度(mol·L-1);V0、Vat、Vb分别为悬浮液初始体积、初始酸化时耗酸的总体积和每一滴定点滴加碱的体积。将所得Ht与相应的pH作图可得到滴定曲线pH-Ht图。
滴定过程中表面吸附质子的量为:
qH-qOH=(Ht-[H+]+[OH-])/CS(mol·g-1)。
式中:qH和qOH分别为滴定过程中颗粒表面H+和OH-的吸附量(mol·g-1);[H+]和[OH-]分别为由pH所得的H+和OH-浓度;CS为实验体系中悬浮液的固液比(g·L-1)。
滴定体系的表面位浓度Hs(mol·L-1)可用实时Gran图等价点处滴定剂加入的体积(Veb)推算。
根据表面络合理论,固体表面可视为一种聚合酸[5],水合氧化物在水溶液中呈现水化羟基表面,常记为≡SOH。对于水体沉积物,其表面除了含有—OH外,还可能含有—COOH、—SH、—NH2等,因此,本文将天然水体沉积物表面记为≡SH。这种表面可质子化或去质子,即存在下述离解平衡[15]:
(1)
≡SH↔≡S-+H+。
(2)
根据酸碱滴定数据,用计算机软件FITEQL4.0来计算优化沉积物的表面酸碱平衡常数和表面位浓度Hs。计算中将有关的表面配位反应平衡式、双电层电容、需优化的平衡常数依次输入计算矩阵,所需的实验数据为每个滴定点的pH、Ht和Hs。因本实验体系为高离子强度介质(≥0.1mol·L-1),故计算中采用恒电容双电层模型[1]。
1.2 材料与方法
1.2.1 沉积物样品 为了使酸碱滴定实验方法适用于不同沉积环境和不同组成的沉积物,本文选用青岛胶州湾沉积物a(2008年采集)和长江口沉积物b(2013年采集)作为测试样品,取样后冷冻保存,测试前室温解冻、风干研磨后筛分。其部分理化性质列于表1。
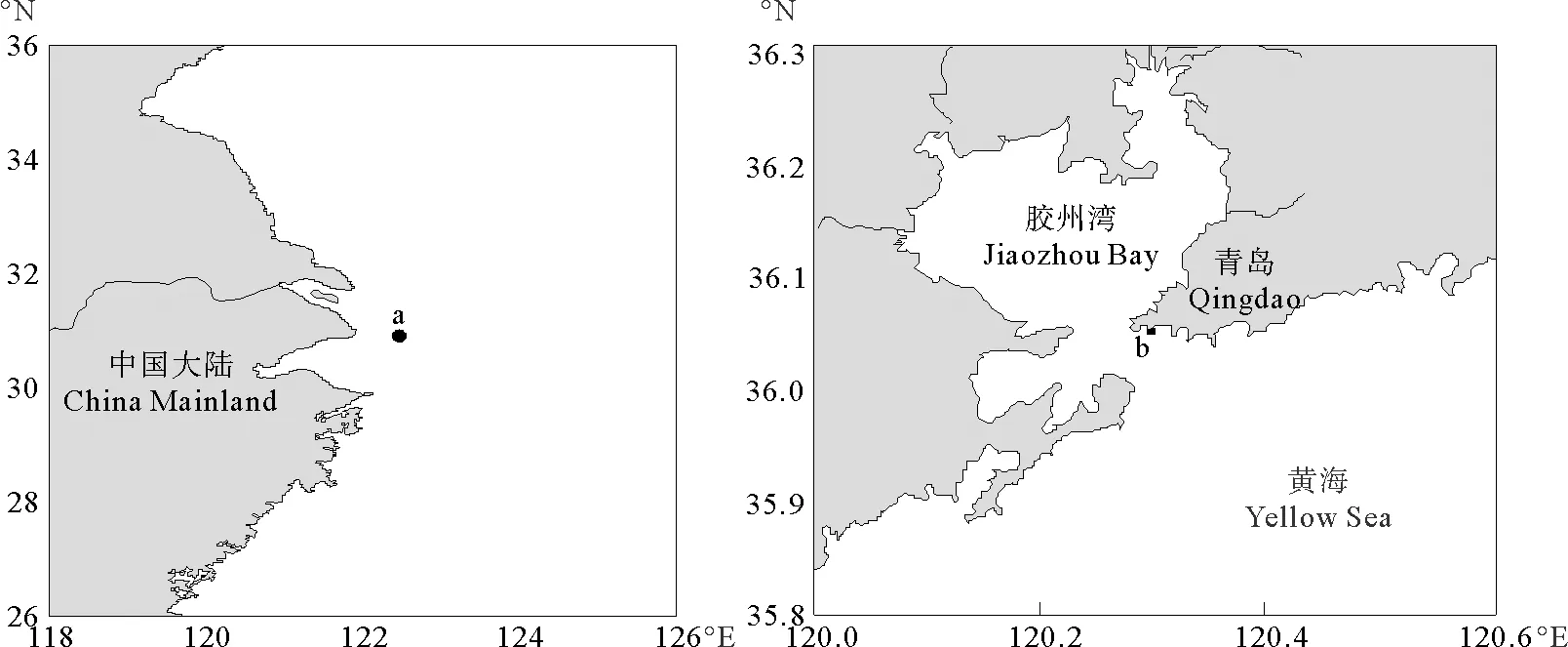
图1 长江口及胶州湾取样站位图Fig.1 Sites for sediment sampling in Changjiang Estuary and Jiaozhou Bay
陈静生等研究指出,小于63μm粒级的颗粒物代表了水体颗粒物中粉砂和黏土部分,在水体中的时间和空间分布比较均匀[17],用于沉积物表面酸碱性质的研究较为合理,因此本实验选用200目以下(小于74μm)的样品进行研究。
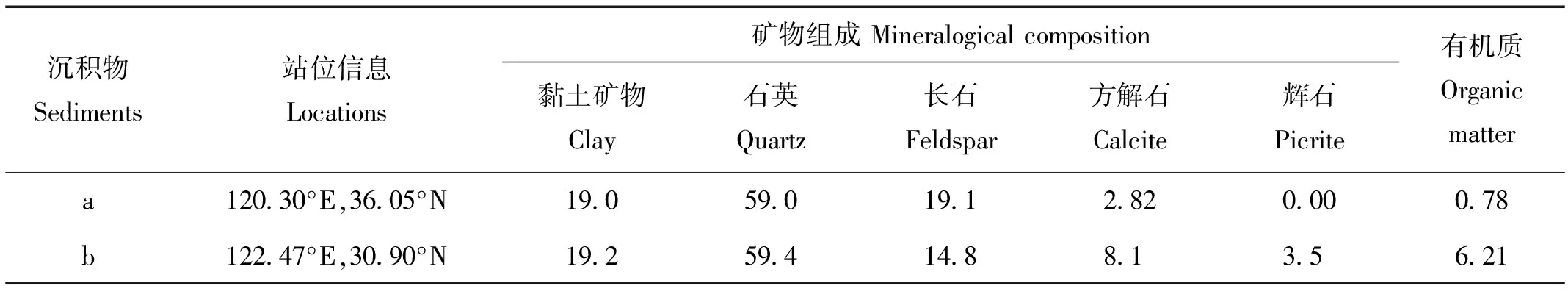
表1 沉积物样品的主要组成
1.2.2 实验方法 首先对不同电位滴定方式下的结果进行比较,确定更适合沉积物表面性质研究的方案,然后对其滴定条件如悬浮液固液比、初始酸化条件和悬浮液介质等进行了考察。
电位滴定方式包括碱返滴定、两边滴定及双返滴定3种,采用长江口沉积物样品。
将0.2g准确称重的沉积物样品置于滴定杯中,加入40mL0.7mol·L-1NaNO3溶液水化15h。酸碱滴定采用瑞士万通809自动电位滴定仪,等量等当点滴定(MET, Monotonic equivalence point titrations)法控制酸碱加入量,电势信号漂移设为0.1mV·min-1,所使用的NaOH和HNO3溶液均为标定后的标准溶液,浓度分别为0.0933和0.4236mol·L-1,实验中温度通过恒温水浴保持在(25.0±0.2)℃范围内,并始终通氮气保护。
1.2.2.1 碱返滴定 利用HNO3将沉积物悬浮液酸化至pH=3左右,搅拌使样品与介质中H+交换完全,然后用NaOH滴定至pH>10。空白实验为与样品实验相同离子强度时的酸量滴定上清液[1,6-9]。
1.2.2.2 两边滴定 从样品水化后的初始pH值开始分别滴加HNO3至pH=3或NaOH至pH=10,将所得数据组合后得到完整的酸碱滴定曲线,空白实验为NaNO3溶液的空白滴定[13]。
1.2.2.3 双返滴定 鉴于沉积物样品实验过程中基质溶解以及空白扣除时滴定体积换算的复杂性等问题,本文尝试如下滴定方式:用自动电位滴定仪先滴加HNO3至pH=3左右(酸量滴定),搅拌使样品与介质中H+交换完全,然后用NaOH滴定至pH=10左右(碱返滴定),搅拌使样品与介质中OH-交换完全,之后用HNO3返滴定至第一次酸量滴定的pH(酸返滴定)。使用碱返滴定曲线得到各滴定点上的Ht。1.2.2.4 双返滴定实验条件优化 悬浮液固液比:对沉积物a和b分别选取固液比2.5、5.0、10.0和20.0g·L-1和2.5、5.0和7.5g·L-1进行对比优化。
悬浮液初始酸化条件:对沉积物a和b分别设置初始pH为3.0、4.0、4.5、5.0和3.0、4.0、6.0进行酸化处理。
支持电解质:分别对其组成和NaNO3溶液浓度进行优化,具体条件设置见2.2.3。
2 结果与讨论
2.1 酸碱滴定方式比较
双返滴定方式消耗H+的滴定曲线如图2所示。
初期的酸量滴定包含了基质溶解、沉积物表面反应和调节体系pH等酸消耗反应,前两者导致滴定曲线呈现显著的缓冲现象,其中基质溶解主要是碳酸盐的溶解,且其在pH=4时溶解已完全[18-19]。碱返滴定和酸返滴定曲线几乎重合,说明初期基质溶解反应已完全,并达到稳定状态,不再影响后续的滴定过程。表面位浓度由碱返滴定的实时Gran图确定的等价点处消耗碱的体积进行计算。酸返滴定与碱返滴定类似:滴加的H+或OH-分别中和体系中多余的OH-或H+、参与表面上各种受体反应以及调节体系pH,故以酸返滴定酸的消耗对酸量滴定消耗酸的总体积(Vat)进行校正,以消除基体溶解消耗酸带来的误差,其优点是不再重新滴定酸量上清液作为空白,简化了操作及计算,同时解决了基质溶解对表面性质测定的影响,可为具有基质溶解的其它体系的研究提供参考。
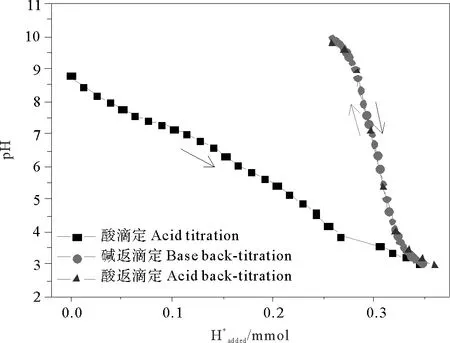
图2 沉积物b双返滴定中H+的消耗曲线Fig.2 H+ consumption curves of sample b obtained by two-back-titration method
图3为3种滴定方法下沉积物样品的pH-Ht和实时Gran图。由pH-Ht图可看出双返滴定和碱返滴定曲线的重现性优于两边滴定。这可能与沉积物基质溶解有关,双返滴定和碱返滴定首先将沉积物样品酸化至一定pH值,基质溶解反应已完全,并达到稳定状态,不再影响后续的滴定,而两边滴定却包含了基质溶解的影响。
由实时Gran图通过线性回归确定的滴定零点,可得到滴定过程中H+和OH-与表面反应的等当量点即滴定零点Ve b1、Ve b2。碱返滴定中滴加的OH-分别用于中和样品或空白体系中的H+(Ve b1之前)、与表面上或溶液中各种受体反应(介于Ve b1和Ve b2之间)以及调节体系pH(Ve b2之后)。根据等当量点可计算悬浮液中固体表面位浓度Hs(mol·L-1)
Hs=
[(Veb2样品-Veb1样品)×Cb-(Veb2空白-Veb1空白)×Cb]/V0。
表2列出了由3种滴定方式所得曲线经FITEQL4.0拟合后的酸度常数及Hs值。
从表2中可看出,这3种滴定方式得到的表面酸度常数较一致。与其它两种滴定方式相比,双返滴定方式表面位浓度的拟合结果与测定结果能较好地吻合。3种方式所得的表面位浓度在具体数值上存在差异,由两边滴定所得的测定数值和拟合结果均较大,究其原因,认为是其酸滴定过程基质溶解等反应在计算和拟合时无法扣除所致;由碱返滴定的测定结果明显大于其拟合结果,推测可能是空白的扣除存在误差所致。
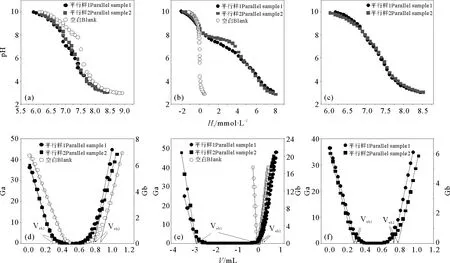
((a)(d)碱返滴定,(b)(e)两边滴定,(c)(f)双返滴定,Gran图中Ga、Gb分别为酸性和碱性一侧的Gran函数。(a)(d)base back-titration,(b)(e)two-side titration,(c)(f)two-back-titration, Ga and Gb are Gran values of acidic side and alkaline side during titration.)
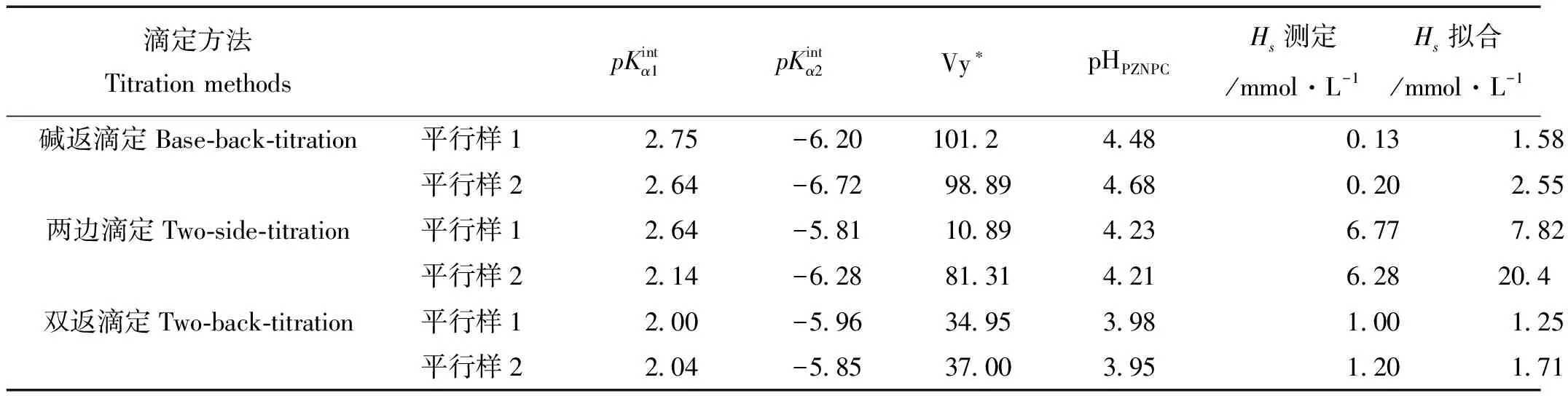
图3 不同滴定方法下沉积物b的pH-Ht图和实时Gran图Fig.3 pH vs. Ht and Gran plots of sample b obtained by different titration methods
Note:*:Vy是拟合过程的总体方差。*:Vy denotes the fitting variance.
综合考虑实验结果的重现性,实验的可操作性,数据处理的方便性以及拟合结果与计算结果的吻合度等因素,认为双返滴定方式更适合沉积物表面性质的研究。
2.2 双返滴定实验条件优化
2.2.1 悬浮液固液比 悬浮液的固液比决定滴定时间的长短,较高的固液比虽然能较好地反映沉积物表面性质,但由于滴定过程对温度和体系所处气氛的要求严格,过长的滴定时间会直接影响滴定体系的稳定性,进而影响测定结果的准确性。本实验选取不同的固液比进行研究,介质采用0.7mol·L-1NaNO3溶液,初始酸化pH值为3。图4所示为2种沉积物在不同固液比时的滴定曲线。
由图4可见,a、b 2种沉积物表面反应pH范围略有差别,后者较宽。在表面反应pH范围内随着悬浮液固液比的增大,缓冲容量明显增强,与此同时反应时间也明显增长,沉积物a、b分别在固液比为2.5、5.0、10.0、20.0g·L-1和2.5、5.0、7.5g·L-1下的全程反应时间依次为:4.1、6.0、7.8、10.1h和7.3、10.7、18.3h。为便于控制滴定过程中各种条件,进行表面性质研究反应时间不宜过长。
由沉积物a滴定曲线可见,固液比为2.5g·L-1时,虽反应时间最短但悬浮液缓冲不明显,考察不同沉积物时,表面酸碱性质差异较小、可比性差;固液比为20.0g·L-1时,反应时间较长,可控性差;固液比为5.0、10.0g·L-1时,缓冲容量及反应时间均适中,该情况下,优先选择反应时间较短者以便于控制实验条件,故对于沉积物a的考察悬浮液固液比选取5.0g·L-1较合理。
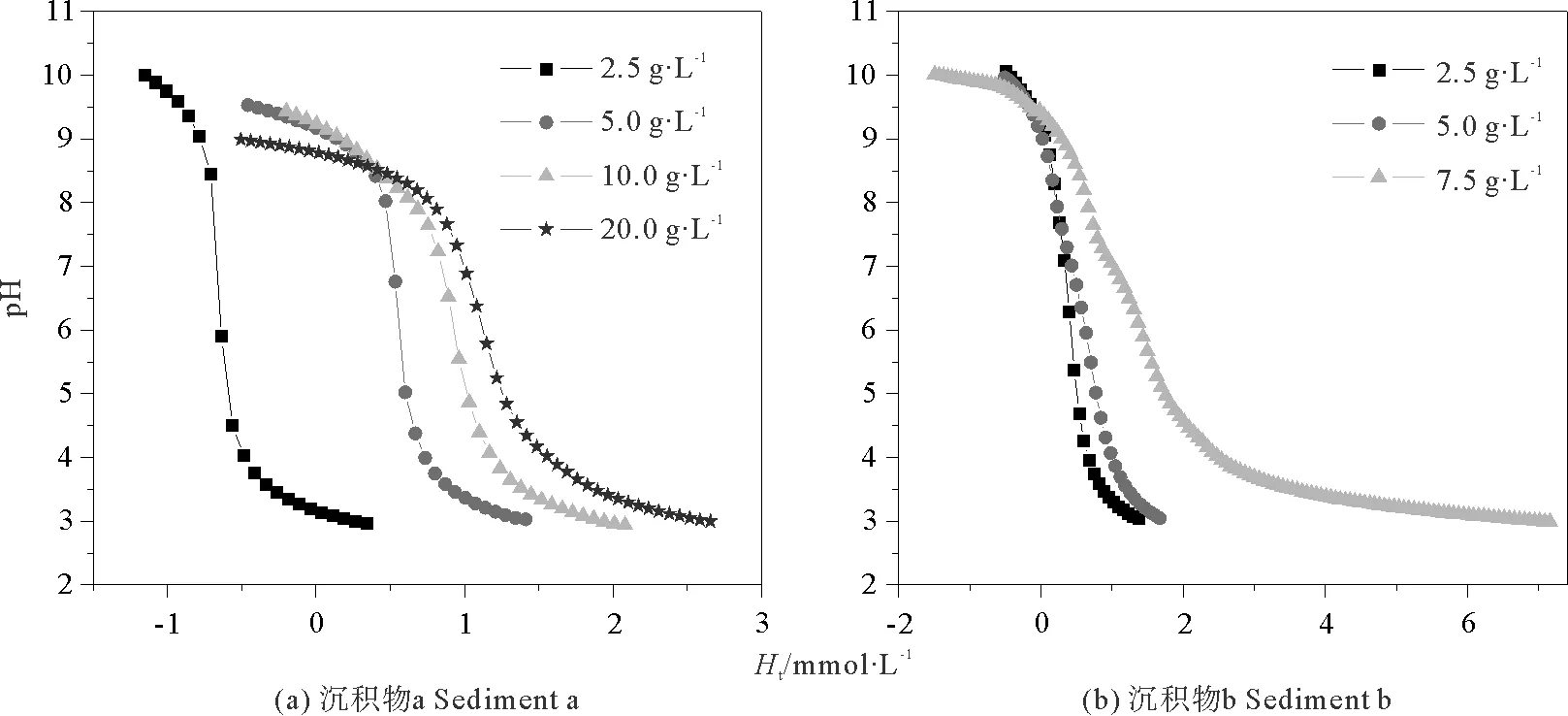
图4 不同固液比时沉积物a、b的pH-Ht图Fig.4 pH vs. Ht plots of sample a and sample b at different solid-liquid ratios
由沉积物b滴定曲线可见,悬浮液固液比为5.0、7.5g·L-1时,反应时间均较长,实验可控性差;固液比为2.5g·L-1时,缓冲容量及反应时间均较合理,故对于沉积物b的考察悬浮液固液比选取2.5g·L-1较合理。
2.2.2 悬浮液初始酸化条件 沉积物悬浮液的初始酸化条件对沉积物表面充分的质子化反应很重要,同时也影响沉积物中矿物的溶出,而后者会影响沉积物的表面性质及其测定,故有必要对初始酸化条件进行研究。介质选用0.7mol·L-1的NaNO3溶液,沉积物a、b悬浮液固液比分别选用5.0和2.5g·L-1。
沉积物在不同初始酸化条件下表面反应碱消耗的体积可由Gran图等当量点计算,如表3所示。由表3可见沉积物悬浮液酸化至pH为4(a、b沉积物分别为4.2和4.1)与酸化至pH为3表面反应耗碱体积相同,且之后随初始酸化pH值升高,表面反应耗碱体积减小,故初始酸化至pH=3~4时表面质子化反应已充分。同时,碳酸盐等基质溶解已完全,不再影响后续的滴定过程。由此可见初始酸化pH=3~4均是合理的。
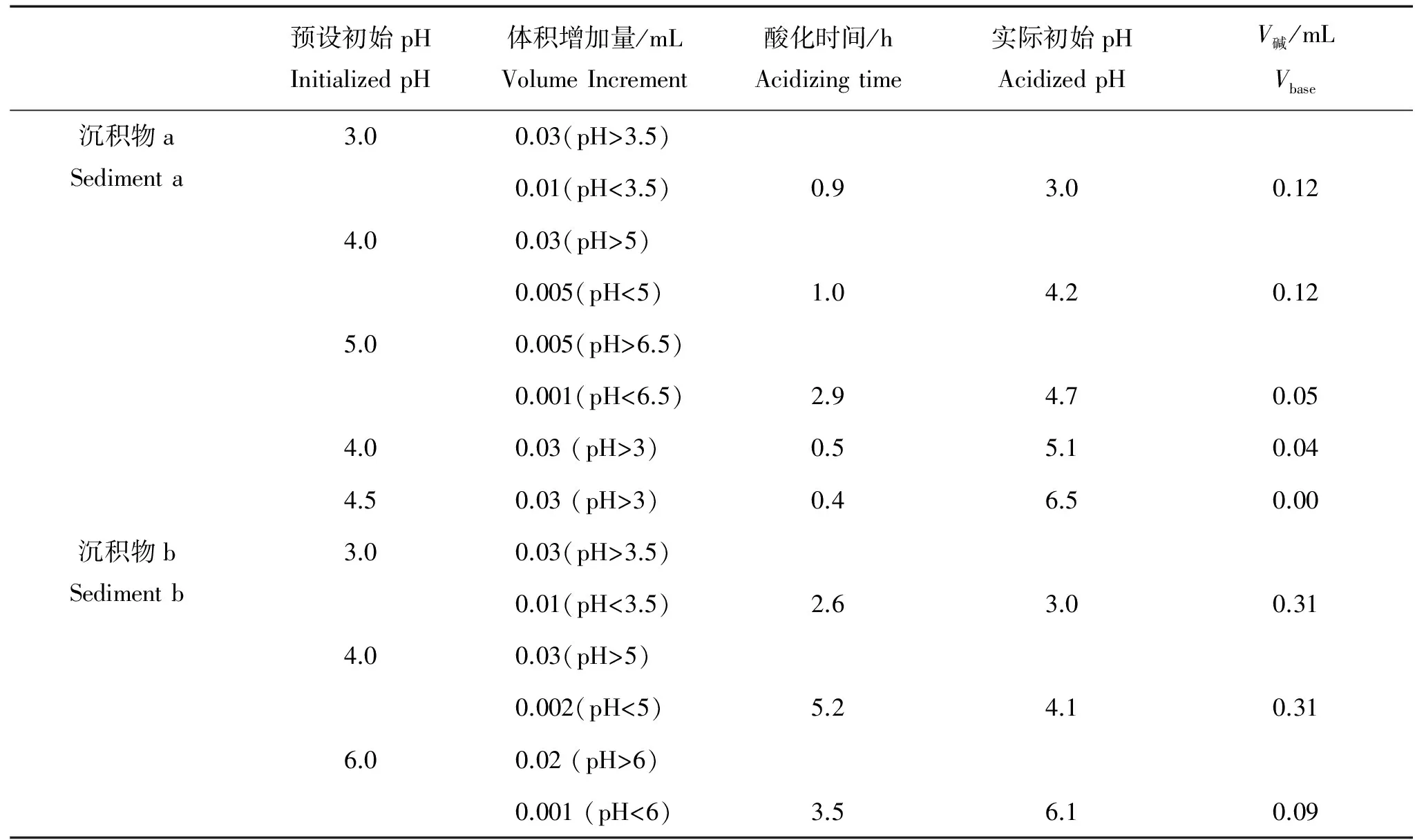
表3 初始酸化条件及表面反应中的碱消耗量
初始酸化滴定条件设置如表3所示,由表3可见初始酸化预设pH=3时实际pH值与预设值吻合良好。而其它初始预设pH>3的实验,实际pH值与预设值则难以吻合,且酸化过程体积增加量、酸化时间等条件难以控制,原因是此时的缓冲容量较低,预设pH难以较准确达到,导致实验的可操作性较差。
综合考虑表面质子化反应的充分性和矿物溶解对表面性质测定的影响以及可操作性,初始酸化至pH为3是合理的。
2.2.3 支持电解质 鉴于沉积物的介质会影响沉积物颗粒的双电层结构,进而影响沉积物的表面电荷和表面性质,为了真实地描述自然环境中沉积物的表面性质,本部分分别选取天然海水(NSW)、人工海水(ASW)以及与天然海水盐度相当的0.7mol·L-1的NaNO3溶液作为介质,考察其对沉积物表面性质测定的影响。其中人工海水配方参照Martin[20]的方法,组成为:24.7g NaCl,13.0g MgCl2·6H2O,9.0g Na2SO4·10H2O溶于954g H2O中。沉积物a、b悬浮液固液比分别选用5.0和2.5g·L-1,初始酸化pH值均为3。两种沉积物的qH-qOH~pH图及沉积物b的实时Gran图和消耗H+滴定曲线分别如图5和6所示。
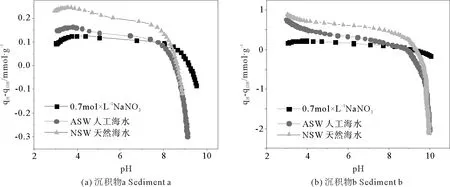
图5 不同介质下沉积物a、b的qH-qOH~pH图Fig.5 qH-qOH vs. pH plots of sample a and sample b in different media
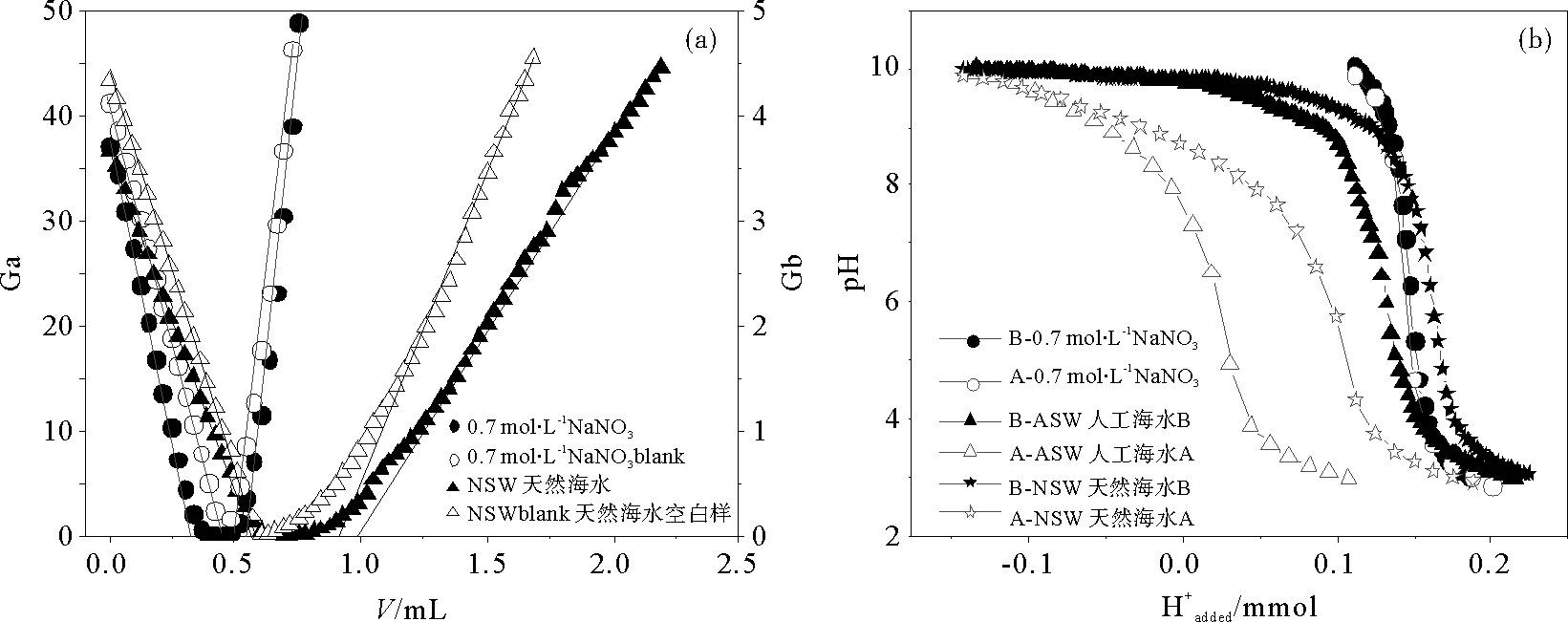
(Ga、Gb分别为酸性和碱性一侧的Gran函数,(b)中B-、A-分别为碱返滴定和酸返滴定。Ga and Gb are Gran values of acidic side and alkaline side during titration. B-and A- ( in(b))mean base back-titration and acid back-titration .)
图6 沉积物b的实时Gran图和H+消耗曲线
Fig.6 Gran plots and H+consumption curves of sediment b
由图5可见,在表面反应pH范围内,沉积物表面的质子吸附量在3种介质中呈现如下规律,即NSW>ASW>0.7mol·L-1NaNO3。
由沉积物b的实时Gran图可见,NSW空白滴定也产生了明显缓冲而在双返滴定中难以扣除,这可能是导致表面质子吸附量增大的原因。由消耗H+的滴定曲线可见NSW和ASW作为介质的酸返滴定和碱返滴定曲线不重合,说明这两种介质与滴入的酸碱具有相互作用,如天然海水的缓冲效应,人工海水的沉淀作用等致使测试体系在第一步滴酸之后未达到稳定状态,除表面反应外还存在消耗酸和碱的反应,而在双返滴定中难以扣除。综上,以0.7mol·L-1的NaNO3溶液作为双返滴定的介质进行沉积物表面性质的理论研究较合理。
考虑介质浓度对沉积物表面酸碱性质将产生影响,本文考察了5种不同浓度NaNO3介质中的qH-qOH~pH曲线,结果如图7所示。
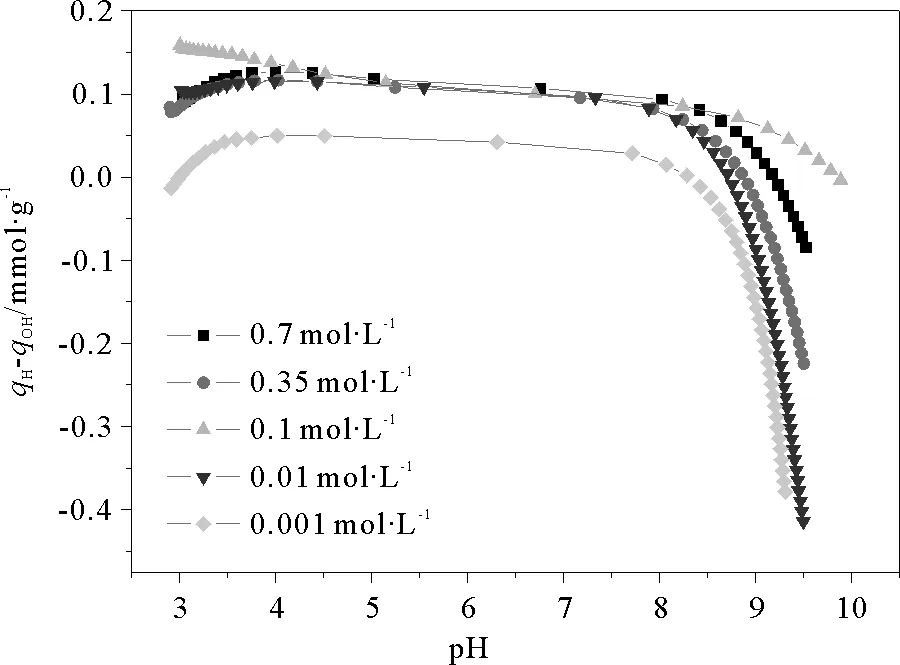
图7 沉积物a在不同浓度的NaNO3介质中qH-qOH~pH曲线Fig.7 Plots of qH-qOH vs. pH of sediment a in NaNO3 medium at different concentrations
由图7可见在低浓度(小于0.01mol·L-1)NaNO3介质中,介质浓度增大,沉积物表面质子吸附量增大,而在较高浓度(0.01~0.7mol·L-1)NaNO3介质中,沉积物表面质子吸附量受介质浓度影响较小。
3 结论
(1)综合考虑实验结果的重现性,实验的可操作性,数据处理的方便性以及拟合结果与计算结果的吻合度等因素,双返滴定方式更适合于沉积物表面性质的研究。
(2)悬浮液的固液比决定滴定时间的长短,进而影响滴定体系的稳定性以及结果的准确性,沉积物进行表面性质比较时应使其反应时间不宜太长、增强可控性且使所选固液比充分反映其表面性质。
(3)综合考虑表面质子化反应的充分性、矿物溶解对表面性质测定的影响和实验的可操作性,初始酸化pH值定为3较合理。
(4)在双返滴定中,沉积物表面性质的理论研究可0.7mol·L-1的NaNO3溶液作为支持电解质。
致谢:感谢济南大学孙中溪教授在FITEQL4.0软件使用方面的指导以及对在有关实验过程中提出的宝贵建议。
[1] 刘文新, 储昭升, 汤鸿霄, 等. 黄土表面酸碱性质的研究[J]. 环境科学学报, 2003, 23(1): 6-10.
[2] 杨敏, 豆小敏, 张昱, 等. 固液界面吸附机制与模型[J]. 环境科学学报, 2006, 26(10): 1581-1585.
[3] 杨晓芳. 原位红外光谱研究含氧离子纳米氧化物微界面吸附过程与机理[D]. 北京: 中国科学院生态环境研究中心, 2010.
[4] Yang X, Sun Z, Wang D, et al. Surface acid-base properties and hydration/dehydration mechanisms of aluminum (hydr) oxides[J]. Journal of colloid and interface science, 2007, 308(2): 395-404.
[5] 文湘华, 杜青, 汤鸿霄, 等. 乐安江沉积物对重金属的吸附模式研究[J]. 环境科学学报, 1996, 16(1): 13-22.
[6] Du Q, Sun Z, Forsling W, et al. Acid-base properties of aqueous illite surfaces[J]. Journal of Colloid and Interface Science, 1997, 187(1): 221-231.
[7] 文湘华, 杜青. 天然水体沉积物的表面特征[J]. 环境化学, 1996, 15(2): 92-106.
[8] 王向天, 汤鸿霄. 高岭土和二氧化硅的表面酸碱性质定量模式计算[J]. 哈尔滨建筑大学学报, 2001, 34(3): 56-59.
[9] 刘文新, 汤鸿霄. 不同地域天然伊利石表面酸碱特性的比较[J]. 环境科学学报, 2001, 21(6): 695-700.
[10] Zhou Y, Liu R, Tang H, et al. Sorption interaction of phenanthrene with soil and sediment of different particle sizes and in various CaCl2solutions[J]. Journal of colloid and interface science, 2004, 270(1): 37-46.
[11] Liu W, Sun Z, Forsling W, et al. A comparative study of surface acid-base characteristics of natural illites from different origins[J]. Journal of Colloid and Interface Science, 1999, 219(1): 48-61.
[12] 孙中溪, 郭淑云. 纳米四氧化三铁表面酸碱性质研究[J]. 高等学校化学学报, 2006, 27(7): 1351-1354.
[13] 刘嘉, 张卫民, 黄佩佩, 等. α-Fe2O3, γ-Al2O3, SiO2混合体系的表面配位反应[J]. 物理化学学报, 2011, 27(1): 186-192.
[14] Yang X, Wang D, Sun Z, et al. Adsorption of phosphate at the aluminum (hydr) oxides-water interface: role of the surface acid-base properties[J]. Colloids and Surfaces a: Physicochemical and engineering aspects, 2007, 297(1): 84-90.
[15] 王飞越, 陈静生. 中国东部河流沉积物样品表面性质的初步研究[J]. 环境科学学报, 2000, 20(6): 682-687.
[16] 吴宏海, 刘佩红, 高嵩, 等. 高岭石-水溶液的界面反应特征[J]. 地球化学, 2005, 34(4): 106-112.
[17] 陈静生, 王飞越, 陈江麟, 等. 论小于 63μm 粒级作为水体颗粒物重金属研究介质的合理性及有关粒级转换模型研究[J]. 环境科学学报, 1994, 14(4): 419-425.
[18] 田玉红, 张正斌, 刘莲生, 等. 南海沉积物吸附能力影响因素的研究[J]. 广西工学院学报, 1999, 10(2): 93-97.
[19] 汤鸿霄, 薛含斌, 田宝珍, 等. 逐级化学分离法对水体沉积物各组分吸附作用模式的研究[J]. 环境科学学报, 1982, 2(4): 279-292.
[20] Martin D F . Marine Chemistry, vol. 1: Analytical methods (2nd ed )[M]. New York: Marcel Dekker, Inc, 1972: 143158.
责任编辑 徐 环
Studies on the Measurement of Sediment Surface Acid-Base Properties
LU Min1, GE Cheng-Feng1, GUO Jun-Le1, ZHU Jia-Mei1, CAO Xiao-Yan1, 2
(Ocean University of China, 1. College of Chemistry and Chemical Engineering; 2. Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Qingdao 266100, China)
The titration methods for sediment surface acid-base properties were studied with the sediments obtained from Jiaozhou Bay and Changjiang Estuary. Two-back-titration mode was proposed based on the base-back-titration. In this mode, the blank can be deducted by acid-back-titration which can make the operation and calculation much simpler. Compared with base-back-titration and two-side-titration, two-back-titration was more suitable for studying sediment surface acid-base properties. In addition, the effects of measurement conditions on the process and result were investigated for two-back-titration, and the most proper condition was determined for the samples studied in this paper.
sediment; surface acid-base properties; two-back-titration
国家重点基础研究发展计划项目(2011CB409802);山东省自然科学基金项目(ZR2013DM018);海洋化学理论与工程技术教育部重点实验室(中国海洋大学)访问学者基金项目资助
2014-06-30;
2014-10-25
路 敏(1989-),女,硕士。E-mail:lumin1220@163.com
❋❋ 通讯作者: E-mail:caoxy@ouc.edu.cn
P734.4
A
1672-5174(2015)09-078-08
10.16441/j.cnki.hdxb.20140225
