2种多溴联苯醚(BDE-47、BDE-209)对褶皱臂尾轮虫单一和联合毒性效应研究❋
2015-03-15沙婧婧悦2李晓红徐宁宁唐学玺
沙婧婧, 王 悠, 王 鸿, 陈 悦2, 李晓红, 徐宁宁, 唐学玺❋❋
(1. 中国海洋大学海洋生命学院,山东 青岛 266003;2. 国家海洋局第二海洋研究所,浙江 杭州 310012)
2种多溴联苯醚(BDE-47、BDE-209)对褶皱臂尾轮虫单一和联合毒性效应研究❋
沙婧婧1, 王 悠1, 王 鸿1, 陈 悦2, 李晓红1, 徐宁宁1, 唐学玺1❋❋
(1. 中国海洋大学海洋生命学院,山东 青岛 266003;2. 国家海洋局第二海洋研究所,浙江 杭州 310012)
为丰富海洋环境中多溴联苯醚污染对浮游动物毒性效应的研究,本文采用不同浓度的2种多溴联苯醚BDE-47和BDE-209作为胁迫因子,以褶皱臂尾轮虫(Brachionusplicatilis)为受试生物,研究其单一及联合急性毒性效应。研究显示:单一急性毒性作用时,BDE-47胁迫对轮虫的48、72和96hLC50分别为2.113、0.376、0.163mg/L,均小于BDE-209各相应的LC50值,分别为11.162、1.237、0.295mg/L,说明BDE-47对褶皱臂尾轮虫的急性毒性大于BDE-209;二者联合作用时,分别采用浓度1∶1和毒性1∶1进行试验,应用Marking相加指数法计算AI(Additive index),评价二者对轮虫的联合毒性,2种试验配比方式得到的结果类似,暴露时间分别为24、48h时AI>0,联合作用结果均为协同作用;72、96h时AI<0,均表现为拮抗作用。结果表明,96h内随着暴露时间的增加,BDE-47和BDE-209对其联合毒性作用从协同作用转变为轻微的拮抗作用。
BDE-47;BDE-209;褶皱臂尾轮虫;急性毒性;联合毒性
多溴联苯醚(Polybrominated diphenyl ethers,PBDEs)是一类新型的持久性有机污染物,根据溴原子在苯环上的个数和位置不同,共有209种同系物[1]。PBDEs作为阻燃剂,被广泛应用于石油、塑料、纺织品、家用电器等领域[2]。多溴联苯醚具有高亲脂性和生物积累性,能够通过食物链逐级放大,对动物及人类健康构成威胁。随着全球消耗量的不断增加,大量PBDEs通过各种途径最终进入海洋,使海洋环境中的PBDEs浓度急剧上升。因此,近年来世界各国政府和研究者对PBDEs特别是其对海洋环境污染方面的关注日益增多[3]。
在PBDEs中,2,2′,4,4′-四溴联苯醚(BDE-47)是在动物和人体组织中含量最高、对生物和人体毒性较强的同系物之一[4]。研究表明,生物对BDE-47的吸收速率大于其他的多溴联苯醚[5]。BDE-47是海洋生物体内含量最高的PBDEs同系物[6]。十溴联苯醚(BDE-209)挥发性低、脂溶性高,且具有环境稳定性。目前在生存环境中,其含量远高于其他类型的PBDEs。BDE-209在我国海域分布较为广泛,其中珠江三角洲及南海沿岸的生物受BDE-209污染程度已相当于或略高于世界范围内其他的河口地区[7-11]。进入生物体的BDE-209可在相关酶的介导下进行代谢,代谢产物主要有低溴代的多溴联苯醚、甲氧基取代的多溴联苯醚(MeO-BDE)以及羟基取代的多溴联苯醚(OH-BDEs)等[12]。BDE-209本身的毒性不高,但其代谢产物的毒性远大于其本身[13]。BDE-209作为目前唯一仍在全球范围内广泛使用的多溴联苯醚阻燃剂,其环境行为和生物效应已逐渐成为生态毒理领域的研究热点[14]。
环境中的生物体通常暴露于多组分污染物共存的混合体系而非简单的单一体系。目前,人们对于许多污染物的单一毒性已有了解,然而对于环境中实际存在的多种污染物的联合毒性作用及其机理的研究还很有限,且由于联合毒性实验的复杂性,研究进展较为缓慢。多种污染物共同作用于生物体时,在机体可呈现复杂的交互作用,往往会引起与单一毒物作用完全不同的毒性反应,因此,研究毒物联合作用的生物学效应,并将此应用于指导混合污染物的危险性评价具有重要意义[15]。
褶皱臂尾轮虫(Brachionusplicatilis)是浮游动物的重要种类之一,广泛分布于淡水及海水水域中。它易培养、繁殖快、大小适宜、营养丰富,是理想的生物饵料[16]。此外,其对毒性物质敏感,是毒理试验中一种较为理想的受试动物[17]。关于污染物对轮虫的毒性效应有过较多的报道,但海洋生物体内含量最高的低溴代BDE-47和海洋环境中广泛存在的高溴代BDE-209对轮虫的联合毒性效应研究尚未见诸报道。本文针对多溴联苯醚难溶于水的特性,采用二甲亚砜作为助溶剂进行毒性实验,并对PBDEs的实际溶解浓度进行测定,研究了不同浓度的2种具有典型代表性的多溴联苯醚(BDE-47、BDE-209)对褶皱臂尾轮虫的单一急性毒性和联合毒性效应,旨在丰富海洋中PBDEs污染对浮游动物毒性效应的研究内容,为海洋环境和生物资源保护提供基础资料和理论依据,并为最终筛选出可用于PBDEs污染评价的敏感指标提供参考。
1 材料和方法
1.1 材料
1.1.1 饵料微藻的培养 饵料为自养小球藻(Chlorellaautotrophica),由中国科学院海洋研究所提供。采用f/2培养液培养[18]。培养温度为(20±1)℃,盐度30±1,光照强度60μmol photons·m-2·s-1,光暗周期12h∶12h。每天定时摇动培养瓶3次,防止微藻附壁生长和下沉。
1.1.2 实验动物的预培养 受试生物为褶皱臂尾轮虫,由中国海洋大学水产学院提供的休眠卵孵化。挑选活泼健壮携非混交卵雌体,在实验室智能光照培养箱(GXZ型,江南仪器,宁波,中国)内培养2个月待用。培养条件:温度(25±1)℃,光照60μmol·m-2·s-1,盐度30±1。海水小球藻的投喂密度为1.0×106cells/mL。400mL的烧杯为培养容器,培养液体积200mL。驯化培养时轮虫接种密度为10只/mL,预培养48h。取活泼健壮携非混交卵雌体置入另外同样条件的烧杯中培养,观察卵的孵出情况,取2h内孵出的幼体为实验材料开展后续实验。
1.1.3 主要试剂及配制 实验用海水经沉淀,0.45μm滤膜过滤,121.3℃灭菌20min,冷却后使用。BDE-47全称2,2′,4,4′-Tetrabromodiphenyl ether,化学式为C12H6Br4O,分子量是485.8,为美国AccuStandard公司生产的白色粉末状固体产品,纯度为100%。BDE-209全称Decabromodiphenyl ether(GC/MS级),化学式为C12Br10O,分子量是959.2,为德国Dr. Ehrenstorfer实验室生产的白色粉末状固体,纯度为99.5%。由于多溴联苯醚在海水中溶解度极低,故以二甲亚砜(DMSO)作为助溶剂。本实验所采用的DMSO为Sigma-Aldrich公司生产,GC级,纯度≥99.0%。
试剂母液的配制:将50mg BDE-47溶于DMSO,25mL棕色容量瓶定容,配制成浓度为2×103mg·L-1的BDE-47母液。将100mg BDE-209溶于DMSO,50mL容量瓶定容,配制成浓度为2×103mg·L-1的母液。4℃下避光保存待用。实验时,用过滤海水依次稀释成设定的实验浓度梯度。
1.2 助溶剂无明显效应浓度值(No observed effect concentration,NOEC)测定
采用等比级数法,以4.9%、6.5%、8.7%、10%、12%、16%(v/v)的DMSO设置实验梯度,每个浓度设置3个重复。实验以不加入DMSO的一组为空白对照组。试验在24孔加盖培养板中进行,每孔放入10只活泼健壮的轮虫幼体(虫龄<2h),并注入不同浓度的DMSO-海水溶液1mL。在温度(25±1)℃的恒温培养箱中进行,培养板加盖,留缝隙,每12h悬浮沉积于孔底部的藻类饵料,每24h更换50%测试液,并投喂1.0×106cells/mL的小球藻饵料。每隔24h用解剖镜观察轮虫的存活情况并计数。轮虫死亡的判定方法依据美国实验材料学会(ASTM,American Society of Testing Materials)制定的轮虫急性毒性试验标准指南[19],即以轮虫纤毛和体内运动停止、内部组织皱缩、轮盘缩回作为判定死亡的标准,若质疑其是否死亡,再观察5s,如果咀嚼囊和足的活动停止,则视为死亡。得出死亡率,运用概率单位法计算DMSO对褶皱臂尾轮虫的96h-NOEC值(死亡率≤10%时对应的浓度值)。
1.3 急性毒性实验
根据助溶剂DMSO对褶皱臂尾轮虫的NOEC值测定结果配制BDE-DMSO-海水溶液。根据24、48、72、96h预实验结果进行PBDEs浓度梯度设置,分别设置6~8个浓度,BDE-47和BDE-209最高浓度均分别达到其在海水中的最高溶解度,每个浓度梯度设置3个重复,另设海水空白对照和助溶剂DMSO对照,助溶剂对照组中DMSO的含量与最高浓度组中DMSO的体积比浓度相同。在相应的孔中添加1mL配制好的各浓度BDE-DMSO-海水溶液。其它培养条件、轮虫死亡判定标准及计数方法同1.2所述。分别在24、48、72、96h用解剖镜观察并记录轮虫的存活数和死亡数。采用概率单位法计算半致死浓度LC50及其95%置信区间。96h急性毒性实验结束时,立即从海水对照组和PBDEs试验组中分别取出轮虫个体,用载玻片制成标本,在Olympus倒置显微镜下拍摄,观察其形态结构的变化。
1.4 运动抑制实验
在急性毒性实验的基础上,参照《水质物质对蚤类(大型蚤)急性毒性测定方法》进行褶皱臂尾轮虫24h运动抑制实验,得到抑制率,计算24h 的EC50。根据预实验结果将BDE-47浓度梯度设置为2.0、6.0、10、14、18和22mg·L-1,将BDE-209设置为6.0、10、20、40、60和80mg·L-1共6个浓度梯度,每个浓度梯度设置3个重复,设置空白对照和助溶剂对照组,其余实验条件均同1.3所述。
实验进行24h后在解剖镜下观察并记录褶皱臂尾轮虫运动受抑制情况,运动抑制的判断标准[20]为轻轻摇动试验容器,若轮虫个体15s之内不能运动,则认为其运动能力受到抑制,得出运动抑制率,计算24hEC50。
1.5 气相色谱-质谱联用法(GC-MS)测定实际浓度
样品的前处理 本实验首先取适量的样品以丙酮∶正己烷1∶1混合溶剂萃取,之后进行旋转蒸发,置换溶剂为正己烷,对萃取物采用由硅胶和氧化钼组成的多段柱进行净化,将过柱后的样品继续旋蒸,再用氮吹仪浓缩后进行GC-MS分析。
测定条件参数 色谱柱(TG-5MS,15m,0.25mm,0.1μm),程序升温:160℃ 2min,35℃ 1min,320℃ 10min,检测器采用EI离子源,选择离子扫描,传输线温度:300℃,离子源温度:250℃。载气类型:氦气,横流模式,载气流速:1.5mL·min-1。进样模式:SSL进样口,300℃,不分流进样,进样量:1μL。采用外标法,根据GC-MS测定结果得到PBDEs(x)与其积分面积(y)之间的标准曲线,从而测得实验设置的BDE-47和BDE-209浓度所对应的在海水溶液中的实际浓度值(见表2)。
1.6 联合毒性试验
在急性毒性实验的基础上,以单一化合物的96hLC50值为1个毒性单位,分别按浓度1∶1和毒性1∶1以等对数间距设置6~8个试验质量浓度(见表1),毒性1∶1采用等毒性配比法[21]。试验方法及不同暴露时间下的混合LC50值计算方法与急性毒性试验相同。
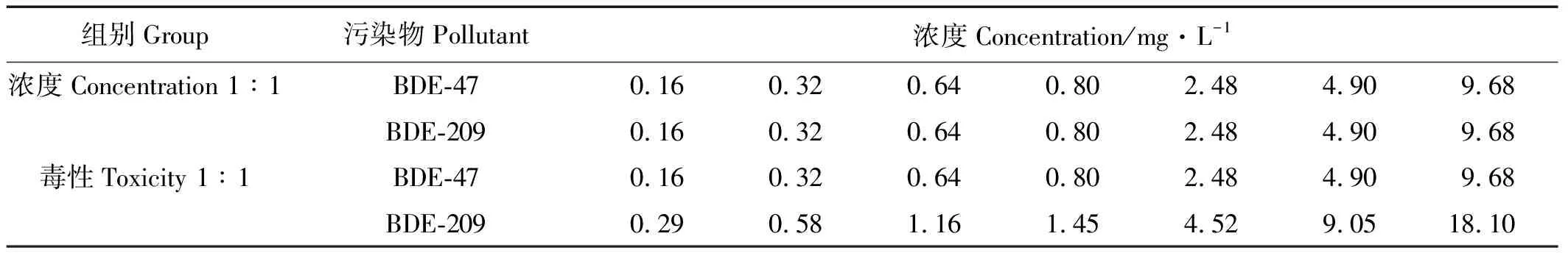
表1 BDE-47和BDE-209对褶皱臂尾轮虫联合毒性实验浓度梯度设置
1.7 联合毒性评价方法:Marking相加指数法
采用目前水生毒理学研究中应用较为广泛的Marking相加指数法[22-23]进行联合毒性效应的评价。在求得联合毒性的LC50值以后,应用下列公式求S值:
式中:S为水生生物毒性相加之和;An、Bn分别代表受试毒物单一毒性的LC50值;Am、Bm为混合毒物联合毒性的LC50值。根据S值求得相加指数(Additive index,AI),当S≤1时,相加指数AI=(1/S)-1;当S>1时,AI=S(-1)+1。以AI值评价混合毒物的联合毒性效应,当AI>0时,为协同作用;AI<0时,为拮抗作用;AI=0时,为相加作用。
1.8 数据的处理和分析
采用SPSS Statistics 17.0统计分析软件对数据进行分析,得出助溶剂DMSO对褶皱臂尾轮虫的NOEC值、BDE-47和BDE-209对轮虫的急性毒性效应的概率单位与浓度对数的回归方程及其24、48、72、96h的LC50和95%置信区间。
2 结果
2.1 助溶剂DMSO对褶皱臂尾轮虫的NOEC值
根据助溶剂DMSO作用96h后对轮虫的致死情况(见图1),将浓度换算成浓度对数,将死亡率换算成概率单位Probit,运用概率单位法得出DMSO概率单位与体积比浓度对数的回归曲线方程:y=2.46x-1.29,R2=0.99,且DMSO对褶皱臂尾轮虫的96h-NOEC值为1.01%,后续实验中均保证各浓度组DMSO体积比浓度不超过1.01%。
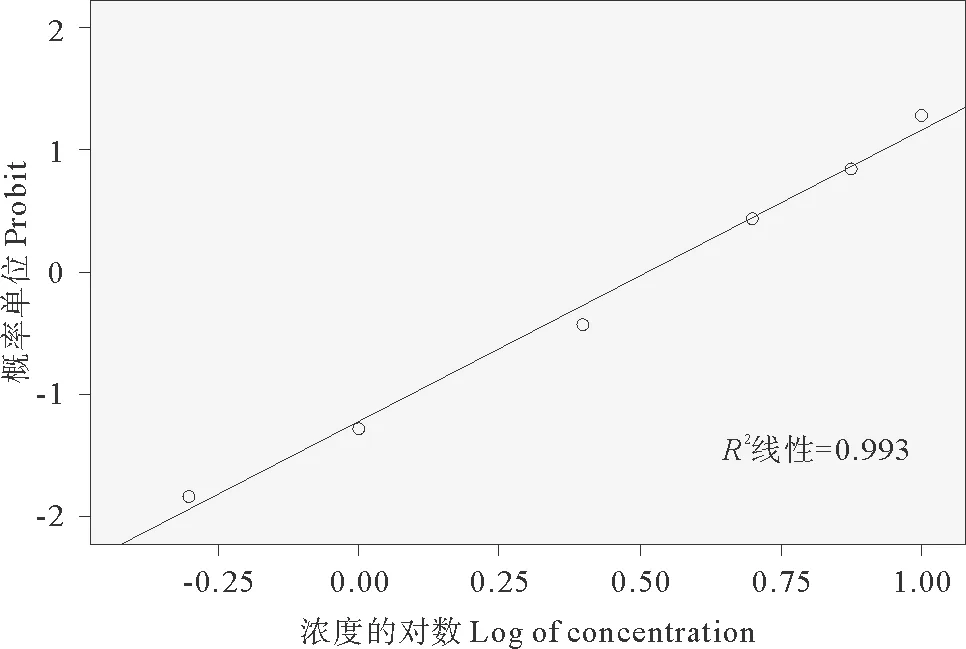
图1 助溶剂DMSO对褶皱臂尾轮虫的96h-NOEC值测定Fig.1 Determination of 96 h-NOEC of DMSO on rotifer B. plicatilis
2.2 BDE-47和BDE-209对褶皱臂尾轮虫的急性毒性作用
根据急性毒性试验结果,随着BDE-47浓度的升高,褶皱臂尾轮虫的死亡率升高,但在24h实验内直至其达到最大溶解度的最高浓度组,BDE-47各浓度组的轮虫均未死亡超过半数。因此,在25℃左右时,BDE-47对褶皱臂尾轮虫的半致死浓度24hLC50>22 mg·L-1。急性毒性实验开始后,在24h实验内直至BDE-209达到其最大溶解度的最高浓度组,均没有对轮虫产生急性致死作用。据此得出在25℃左右时,BDE-209对褶皱臂尾轮虫的半致死浓度24hLC50>80mg·L-1,其海水溶液短时间内毒性极低。BDE-47和BDE-209作用24h对褶皱臂尾轮虫幼虫存活的影响见表1。急性毒性实验中,可以明显观察到,高浓度组存活的褶皱臂尾轮虫运动能力显著下降,多附着在孔侧壁和底部,个体较不活泼。
根据接下来实验进行到48、72、96h时用解剖镜观察记录的轮虫存活数和累积死亡数,将浓度换成浓度对数,将死亡率换成概率单位,则得到BDE-47和BDE-209对褶皱臂尾轮虫的48、72、96h剂量效应方程、LC50及其95%置信区间(见表3)。结果表明,不同暴露时间下48、72、96h轮虫死亡率的概率单位(y)与PBDEs质量浓度的对数(x)的关系均为直线回归,BDE-47和BDE-209对轮虫的单一毒性死亡与施毒剂量具有良好的相关性,随着暴露时间的增加,LC50值越小;而且BDE-47在24、48、72和96h的LC50值均比BDE-209的LC50值小,说明BDE-47对褶皱臂尾轮虫的急性毒性比BDE-209更强。
96h急性毒性实验结束时,通过在倒置显微镜下观察海水对照组、BDE-47试验组和BDE-209试验组的轮虫个体,发现BDE-209试验组轮虫个体形态结构变化与对照组相差不大,而BDE-47试验组的轮虫个体则发生了明显的变化。图2为实验进行到96h在倒置显微镜下拍摄的海水对照组的正常轮虫个体和2 mg·L-1BDE-47作用下处于中毒状态的轮虫个体。与正常个体相比,BDE-47试验组中毒的轮虫个体形态发生明显变化,具体表现为:内部结构模糊,不透明度增加;尾足拖曳或粘附于孔板底部;正常个体形态类似圆柱形,而中毒个体偏向梨形变化,轮盘和背甲萎缩。
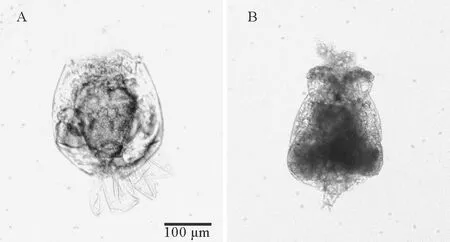
图2 96h正常轮虫个体(A)和BDE-47中毒轮虫个体(B)Fig.2 A normal 96 h-rotifer (A) and a rotifer of BDE-47 poisoning for 96 h (B)
2.3 BDE-47和BDE-209对褶皱臂尾轮虫的运动抑制作用
BDE-47和BDE-209对褶皱臂尾轮虫24h运动抑制实验结果显示,BDE-47在24h内对褶皱臂尾轮虫具有显著的运动抑制效应,而BDE-209则无明显作用。BDE-47和BDE-209作用24h对褶皱臂尾轮虫幼虫的运动抑制情况见表2。运用概率单位法得出BDE-47对褶皱臂尾轮虫运动抑制的24hEC50值为9.695 mg·L-1(y=2.132x-2.104,R2=0.945),95%置信区间为8.240~11.305。
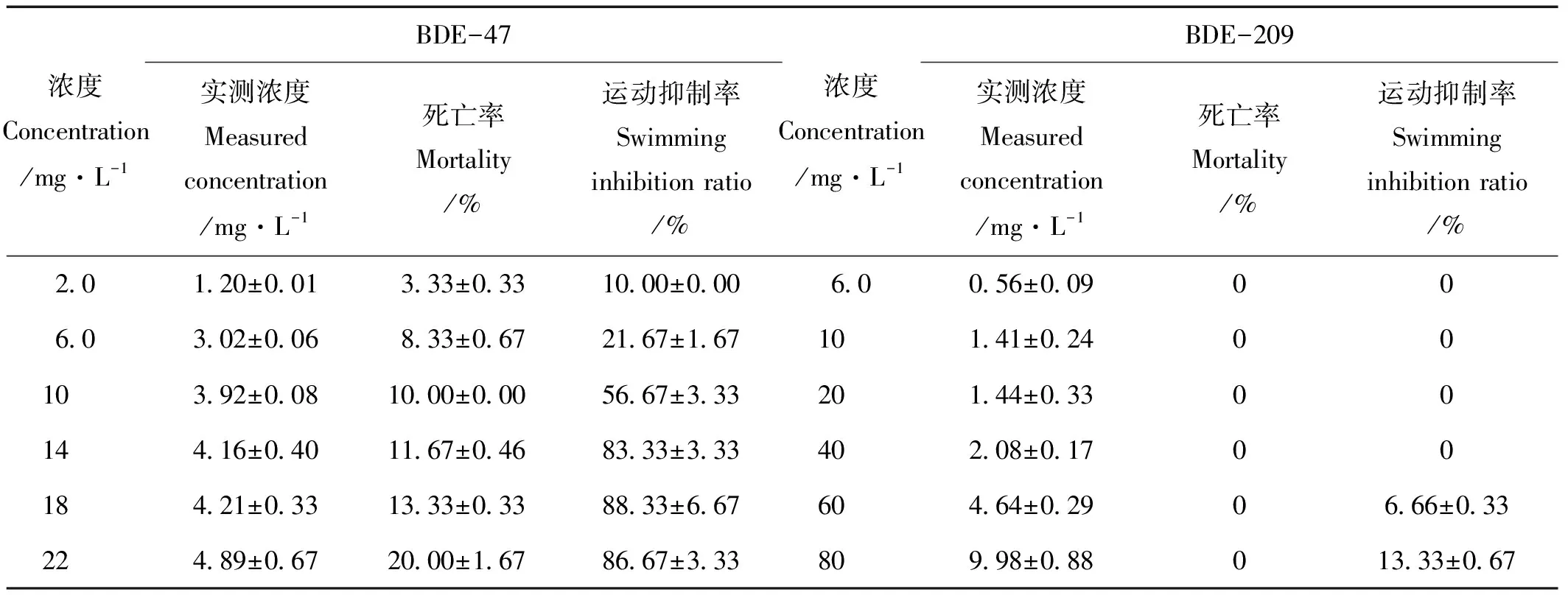
表2 BDE-47和BDE-209的24h急性毒性胁迫对褶皱臂尾轮虫幼虫存活和运动的影响
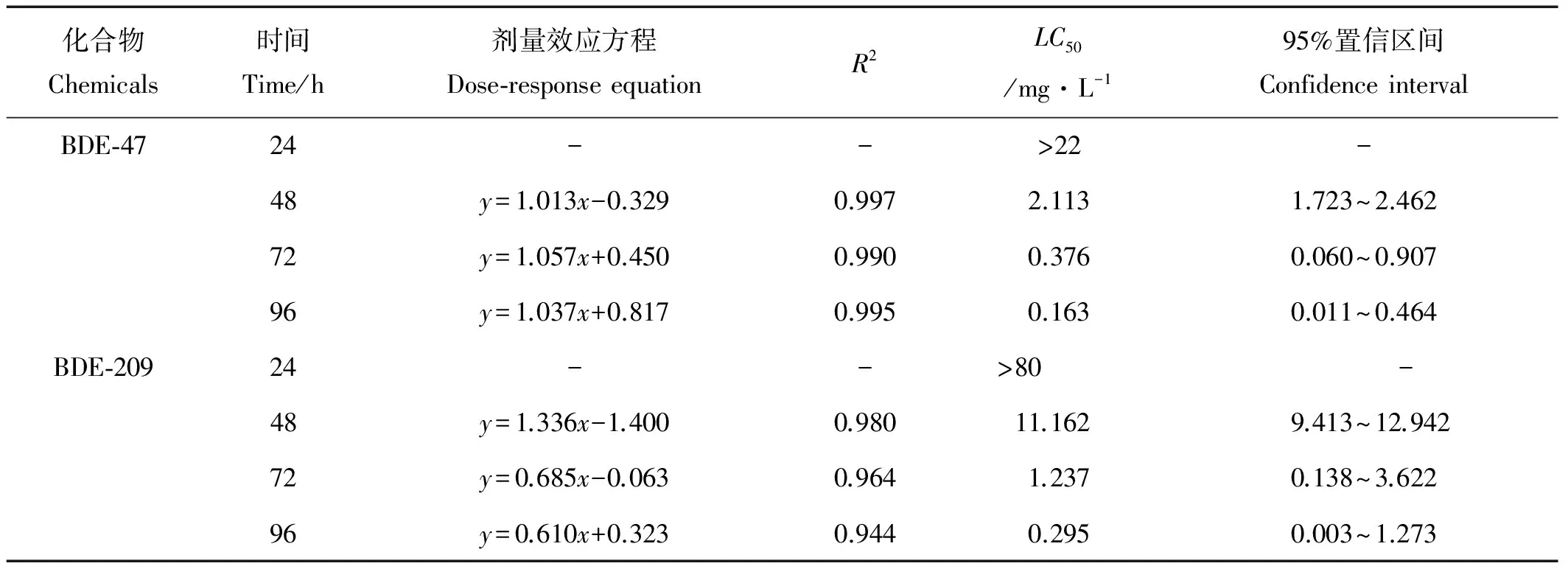
表3 BDE-47,BDE-209对褶皱臂尾轮虫的单一急性毒性实验结果
2.4 联合毒性试验
2.4.1 BDE-47和BDE-209浓度1∶1时对褶皱臂尾轮虫的联合毒性 BDE-47和BDE-209浓度1∶1时对褶皱臂尾轮虫的联合毒性试验结果见表4。
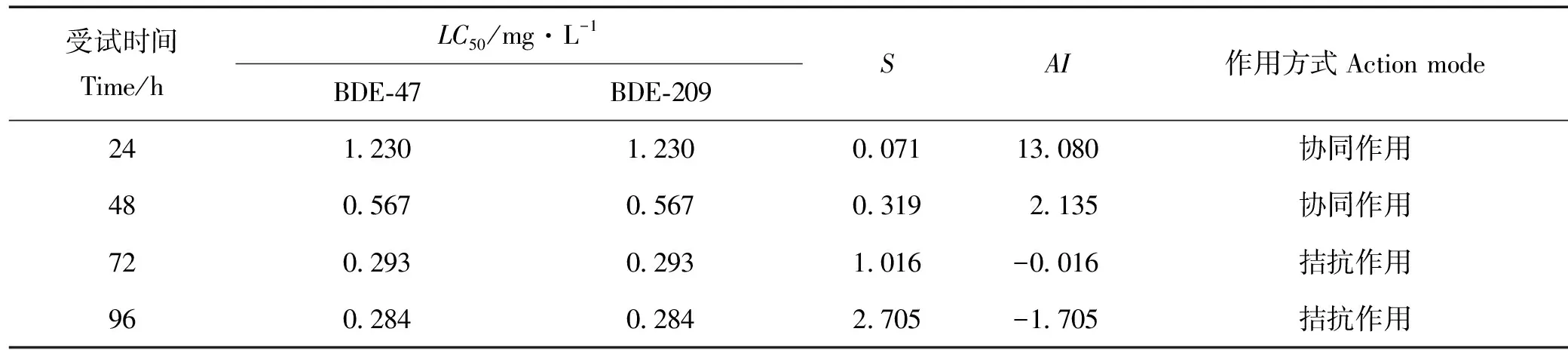
表4 BDE-47和BDE-209浓度1∶1时对褶皱臂尾轮虫的联合毒性试验结果
在单一毒性实验的基础上,采用BDE-47和BDE-209单一毒性所得96hLC50值为1个毒性单位,进行浓度1∶1的联合毒性实验。由表4结果可知,BDE-47和BDE-209对褶皱臂尾轮虫的联合毒性作用随着污染物的暴露时间不同而存在不同的作用方式。当采用浓度1∶1进行试验时,暴露时间为24、48h的相加指数AI>0,联合作用方式表现为协同作用,即在短时间内BDE-47的存在大大增加了BDE-209的毒性,同时BDE-209的存在也大大增加了BDE-47的毒性;而暴露时间为72和96h时,相加指数AI<0,联合作用方式则为拮抗作用。随着暴露时间的增加,二者联合毒性作用从毒性剧增的协同作用转变为了轻微的拮抗作用,即BDE-209的存在减弱了BDE-47的毒性,同时,BDE-47的存在也减弱了BDE-209的毒性。
2.4.2 BDE-47和BDE-209毒性1∶1时对褶皱臂尾轮虫的联合毒性 BDE-47和BDE-209毒性1∶1时对褶皱臂尾轮虫的联合毒性试验结果见表5。
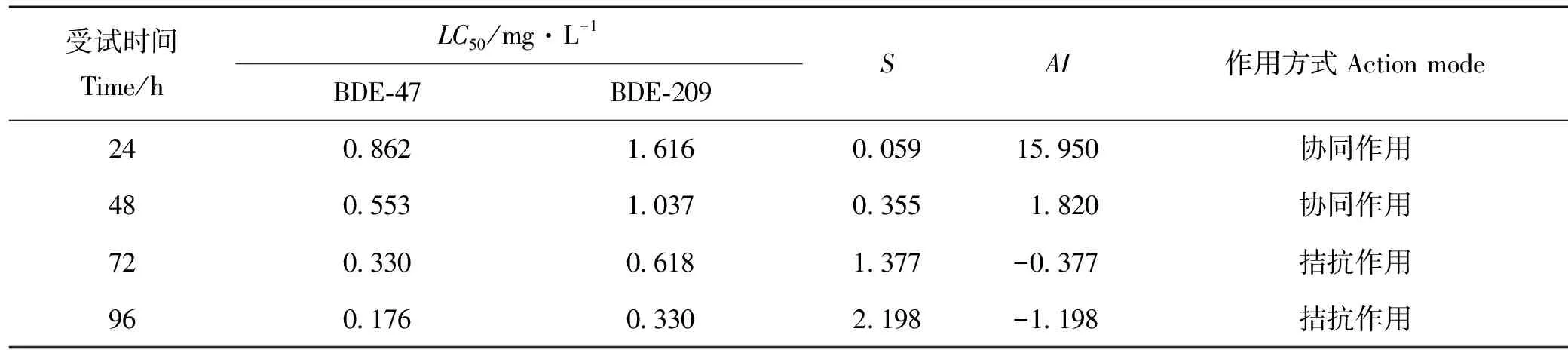
表5 BDE-47和BDE-209毒性1∶1时对褶皱臂尾轮虫的联合毒性试验结果
当采用毒性1∶1进行试验时,BDE-47和BDE-209对褶皱臂尾轮虫联合毒性作用24、48h时,AI>0,评价结果为协同作用,而暴露时间为72和96h时,AI<0,联合作用方式为拮抗作用,与浓度1∶1联合毒性试验结果相似。
3 讨论
3.1 BDE-47和BDE-209的单一急性毒性
急性毒性试验处在毒理学研究的早期阶段,对阐明受试物的毒性作用和了解其毒性靶器官具有重要意义。由于水生动物生存在水体中这一特殊性,可以从水体中直接吸附、吸收和摄入污染物,接触急性毒性试验是其急性毒性试验研究的主要形式之一。PBDEs作为一类溴系阻燃剂(Brominated flame retardants,BFRs),其水溶性很低[24]。本研究的助溶剂实验结果表明,在24h内BDE-47和BDE-209通过采用助溶剂DMSO,直至在海水中达到其最大溶解度,褶皱臂尾轮虫均未出现死亡。因此,其海水溶液毒性极低,在受试时间24h内未出现急性致死效应。
本实验研究了BDE-47和BDE-209对褶皱臂尾轮虫的单一急性毒性效应,结果显示随着二者浓度的增大和时间的延长,毒性效应会增强,其对轮虫的毒性影响存在剂量-效应关系和时间-效应关系。随着暴露时间的增加,LC50值越小,毒性效应越强;BDE-47在48~96h的LC50值均比BDE-209的LC50值小;BDE-47对褶皱臂尾轮虫具有显著的运动抑制效应,且在作用96h后,轮虫的形态和功能都发生了明显的改变,而BDE-209则无明显作用。以上结果说明在同等的实验条件下,BDE-47对褶皱臂尾轮虫的急性毒性比BDE-209更强。本实验研究结果与此前国内外研究PBDEs对其他生物作用的实验结果类似,曾有研究者报道过几种低溴代联苯醚对海洋桡足类急性毒性:Berithlltz等[25]测得BDE-47对美丽猛水蚤(Nitocraspinipes)96h-LC50值为72μg/L,Wollenberger等[26]通过急性毒性试验得到BDE-28、99对汤氏纺水蚤(Acartiatonsa)48h-LC50值分别为108、705μg/L。然而,相比于低溴代的BDE-28、47、99,高溴代的BDE-209毒性要小一些。张泽光等[27]研究发现BDE-209在24和48h内不足以引起大型蚤死亡,48h-EC50>10mg/L,属于低毒;BDE-209暴露浓度为1mg/L时,对大型蚤的生长和繁殖没有显著影响。原因可能是BDE-209分子中溴原子数目多,空间位阻大,较难进入生物体内部,因而毒性相对较小[28]。
3.2 BDE-47和BDE-209的联合毒性效应探讨
近年来,国内外很多学者对于各种污染物对生物的联合毒性效应研究做了大量工作。在本研究中,BDE-47和BDE-209对褶皱臂尾轮虫的联合胁迫无论是在浓度1∶1条件下还是毒性1∶1条件下,均在不同时间表现出不同的联合毒性效应。目前已有一些研究表明,联合毒性作用可能随着暴露时间的不同而不同。如陈碧鹃等[29]在进行乙醛、对苯二甲酸、乙二醇对鲢、草鱼的联合毒性实验发现,混合毒物对草鱼幼鱼的作用随着实验时间的不同,联合毒性效应亦不同。王桂燕等[30]发现Cd2+和对二氯苯对草鱼的联合毒性在24、48、72h为拮抗作用,而96h为协同作用。王春凤等[31]研究表明汞和硒在浓度1∶1时对剑尾鱼的联合毒性作用24h为拮抗作用,48和96h为协同作用。王琳等[32]报道Cd2+分别与苯并芘、PCB1254对幼贝的联合作用24h,联合毒性表现为拮抗作用,48、72、96h为协同作用。修瑞琴等[33]对斑马鱼进行氟与硒的联合毒性实验发现,在浓度1∶1的情况下,作用24h为拮抗作用,48h为相加作用,而96h为协同作用。修瑞琴等[34]还在对斑马鱼进行镉和锌离子的联合毒性研究时发现,当浓度1∶1时,暴露时间为24、48和96h联合作用结果为协同作用,而当毒性1∶1时,暴露时间为24、48h为协同作用,96h时为拮抗作用。因此,联合毒性作用方式很大程度上取决于受试毒物的种类和特性,且表现为随暴露时间的不同而不同。
联合毒性作用方式还可能随着毒物剂量的不同而不同。Lu等[35]研究了BDE-47和BDE-99对金鱼体内一系列酶的活性的影响,结果显示,当同时处于较低剂量时,两者之间产生协同作用,当同时处于较高剂量时,则为拮抗作用。因此,本实验中所采用的BDE-47和BDE-209剂量也可能对此实验结果产生了一定的影响。
BDE-47和BDE-209的致毒机理和作用机制具有一定的相似性。本研究中,BDE-47和BDE-209对褶皱臂尾轮虫的联合毒性作用24、48h时为协同作用,而暴露时间为72、96h时为拮抗作用。环境污染物对生物的毒性作用机制之一即造成生物体酶的过氧化胁迫。据此推断二者在造成酶活性下降,破坏抗氧化防御系统时,共同作用于生物体,产生活性氧自由基,对细胞造成损伤,因而毒性增强,表现为协同作用;而之后可能由于发生了某种形式的竞争,共同竞争作用位点,也可能发生了某种化学作用,从而降低了2种毒物的有效浓度,表现为联合毒性的拮抗作用。国内外已有相关研究表明,PBDEs能够诱导生物体内产生活性氧(Reactive oxygen species,ROS),而抗氧化酶防御系统成分的变化能够指示机体受到氧化胁迫的程度[36-37],因此,抗氧化酶可以作为PBDEs的生物标记物[38-40]。张喆等[11]发现BDE-209可以诱导紫红笛鲷产生氧化应激效应,CAT和SOD则在氧自由基清除中发挥作用;吴伟等[41]采用BDE-47和BDE-209分别处理鲫鱼肝脏组织,组织中CAT、GPx活性随二者的质量浓度增加而逐渐下降,说明BDE-47和BDE-209均对鲫鱼肝脏产生了氧化损伤,具有生化毒性影响;铜锈环棱螺(Bellamyaaeroginosa)的肝胰脏长时间暴露于BDE-47,可导致CAT活性显著下降,表现出显著的剂量或时间依赖效应[42]。可见,化学结构和性质相近的同类有机化合物,通常会以相似的方式和途径作用于生物体。然而,影响联合毒性作用的因素较多,包括生物因素、环境因素等,有关BDE-47和BDE-209对褶皱臂尾轮虫的联合毒性作用的途径和机理尚需进一步的研究与探讨。李子文等[43]研究表明,BDE-209和PCB-153均具有遗传毒性,在致大鼠肝细胞DNA蛋白质交联(DPC)上会产生拮抗作用。BDE-209和PCB-153分别是PBDEs和PCB家族的主要同系物,并且同时存在于环境和人体组织中。因此,有关专家指出,PBDEs与其它环境污染物,如与结构性质相似的多氯联苯(PCB)等污染物之间形成的复合污染及联合毒性效应方面的研究也是今后工作的重点[44]。海洋环境污染通常以复合污染的形式出现,因此,污染物对海洋生物的联合毒性效应已成为亟待解决的研究课题,这对于海洋污染监测具有重要意义。
由于具有高亲脂性,PBDEs在实际海洋水体中的水溶性非常低,溶解态BDE-47的浓度约为0.07 mg·L-1,溶解态BDE-209的浓度仅为0.02~0.03 mg·L-1[24]。然而,相关学者指出,在较短时期内能够产生毒理观察效应的BDE-47和BDE-209设计暴露水平往往须高于目前报道中的实际环境浓度[25]。本研究通过GC-MS对实验体系中的BDE-47与BDE-209进行了实际溶解浓度的测定,结果显示,实验体系中的实际浓度远低于实验设计所配置的浓度,结果也证实了BDE-47和BDE-209均难溶于水,且BDE-209比BDE-47溶解度更低。在本研究中,轮虫主要通过海水介质接触PBDEs,因此认为轮虫吸收途径是通过体表直接吸收。在自然环境中,轮虫吸收PBDEs的主要途径可能还有摄食。生物在实际环境中可能暴露于一系列PBDEs,同系物之间会发生转化,从而产生更强大的毒性效应。本研究对此后相关的PBDEs生物富集以及更低浓度长期暴露方面的研究具有一定的参考价值和意义。
[1] 刘汉霞, 张庆华, 江桂斌, 等. 多溴联苯醚及其环境问题[J]. 化学进展, 2005, 17(3): 554-562.
[2] Rahman F, Langford K H, Scrimshaw M D, et al. Polybrominated diphenyl ether (PBDE) flame retardants [J]. The Science of the Total Environment, 2001, 275: 1-17.
[3] Ikonomou M G, Rayne S, Fischer M, et al. Occurrence and congener profiles of polybrominated diphenyl ethers (PBDEs) in environmental samples from coastal British Columbia, Canada [J]. Chemosphere, 2002, 46: 649-663.
[4] Michael I, Sierra R, Richard F. Exponential increases of the brominated flame retardants, polybrominated diphenyl ethers, in the Canadian Arctic from 1981 to 2000. Environmental Science and Technology, 2002, 36(9): 1886-1892.
[5] Stapleton H M, Letcher R J, Li J, et al. Dietary accumulation and metabolism of polybrominated diphenyl ethers by juvenile carp (Cyprinuscarpio) [J]. Environmental Toxicology and Chemistry, 2009, 23: 1939-1946.
[6] Lema S C, Schultz I R, Scholz N L, et al. Neural defects and cardiac arrhythmia in fish larvae following embryonic exposure to 2, 2′,4,4′-tetrabromodiphenyl ether (PBDE 47) [J]. Aquatic Toxicology, 2007, 82(4): 296-307.
[7] 陈社军, 麦碧娴, 曾永平, 等. 珠江三角洲及南海北部海域表层沉积物中多溴联苯醚的分布特征[J]. 环境科学学报, 2005, 25(9): 1265-1271.
[8] Wang Z, Ma X D, Lin Z S, et al. Congener specific distributions of polybrominated diphenyl ethers (PBDEs) in sediment and mussel (Mytilusedulis) of the Bo Sea, China [J]. Chemosphere, 2009, 74(7): 896-901.
[9] Mai B, Chen S, Luo X, et al. Distribution of polybrominated diphenyl ethers in sediments of the Pearl River Delta and adjacent South China Sea [J]. Environmental Science & Technology, 2005, 39(10): 3521-3527.
[10] 向彩红, 罗孝俊, 余梅, 等. 珠江河口水生生物中多溴联苯醚的分布[J]. 环境科学, 2006, 27(9): 1732-1737.
[11] 张喆, 王学峰, 马胜伟, 等. 十溴联苯醚 (BDE-209) 对紫红笛鲷鳃抗氧化酶活性的影响[J]. 生态毒理学报, ISTIC, 2013, 8(1): 42-48.
[12] Hakk H, Letcher R J. Metabolism in the toxicokinetics and fate of brominated flame retardants—a review [J]. Environment International, 2003, 29(6): 801-828.
[13] Thuresson K, Höglund P, Hagmar L, et al. Apparent half-lives of hepta-to decabrominated diphenyl ethers in human serum as determined in occupationally exposed workers[J]. Environmental Health Perspectives, 2006: 176-181.
[14] Shen H P, Huang C J, Lu F, et al. Comparative toxicity of PCBs and PBDEs using human cancer cell lines and zebrafish embryos[J]. Asian Journal of Ecotoxicology, 2009, 4(5): 625-633.
[15] 徐亚同. 主要畜产品污染物毒性发光细菌快速检测技术研究[D], 华东师范大学, 2008.
[16] 李庆彪, 宋全山.生物饵料培养技术[M]. 北京: 农业出版社, 1999.
[17] 凯思斯·J.水污染的生物监测[M]. 北京: 中国环境科学出版社, 1989: 100-105.
[18] 陈明耀. 生物饵料培养[M]. 北京: 中国农业出版社, 1995: 65-71.
[19] American Society for Testing and Materials. E 1440-91. Standard Guide for Acute Toxicity Test with the Rotifer Brachionus [S]. America: ASTM, 2002: 806-813.
[20] 中华人民共和国国家质量监督检验疫总局. GB/T13266-91 水质物质对蚤类(大型蚤)急性毒性测定方法[S]. 北京: 中国标准出版社, 1991.
[21] Fulladosa E, Murat J C, Villaescusa I. Study on the toxicity of binary equitoxic mixtures of metals using the luminescent bacteria Vibrio fischeri as a biological target [J]. Chemosphere, 2005, 58(5): 551-557.
[22] 修瑞琴, 许永香. 水生毒理联合效应相加指数法[J]. 环境化学, 1994, 13(3): 269-271.
[23] Marking L L. Method for assessing additive toxicity of chemical mixtures [J]. Aquatic Toxicology and Hazard Evaluation, 1977, 634: 99-108.
[24] Alcock R E, Sweetman A, Jones K C. Assessment of organic contaminant fate in waste water treatment plants I: Selected compounds and physicochemical properties [J]. Chemosphere, 1999, 38(10): 2247-2262.
[25] Breitholtz M, Nyholm J R, Karlsson J, et al. Are individual NOEC levels safe for mixtures? A study on mixture toxicity of brominated flame retardants in the copepodNitocraspinipes[J]. Chemosphere, 2008, 72: 1242-1249.
[26] Wollenberger L, Dinan L, Breithol M. Brominated flame retardants: activities in a crustacean development test and in an ecdysteroid screening assay [J]. Environmental Toxicology and Chemistry, 2005, 24: 400-407.
[27] Bragigand V, Triquet C A, Parlier E, et al. Influence of biological and ecological factors on the bioaccumulation of polybrominated diphenyl ethers in aquatic food webs from French estuaries [J]. Science of the Total Environment, 2006, 368(2): 615-626.
[28] 张泽光, 黄满红, 陈东辉, 等. 十溴联苯醚对大型蚤和发光菌的毒性研究[J]. 环境工程, 2013, 1: 299-302.
[29] 陈碧鹃, 袁有宪, 王会平. 乙醛、对苯二甲酸、乙二醇对鲢、草鱼的联合毒性[J]. 中国水产科学, 2001, 8(1): 73-76.
[30] 王桂燕, 胡筱敏, 周启星, 等. 对二氯苯和镉对草鱼(Ctenopharyngodonidellus)的联合毒性效应研究[J]. 环境科学, 2007, 28(1): 156-159.
[31] 王春凤, 方展强. 汞和硒对剑尾鱼的急性毒性及其安全浓度评价[J]. 环境科学与技术, 2005, 28(2): 32-34.
[32] 王琳, 潘鲁青, 苗晶晶. 汞、镉和苯并芘、多氯联苯对栉孔扇贝幼贝单一与联合毒性的研究[J]. 海洋环境科学, 2010, 29(4): 535-540.
[33] 修瑞琴, 高世荣, 许永香, 等. 氟与硒对鱼类联合毒性的研究[J]. 中国环境科学, 1995, 15(5): 348-350.
[34] 修瑞琴, 许永香. 镉和锌离子对斑马鱼的联合毒性[J]. 卫生研究, 1996, 25(2): 101-102.
[35] Lu G H, Qi P D, Chen W. Integrated biomarker responses ofCarassiusauratusexposed to BDE-47, BDE-99 and their mixtures[J]. Int J Environ Res, 2013, 7(3): 807-816.
[36] 齐彭德, 陆光华, 梁艳, 等. 多溴联苯醚的生物效应研究[J]. 环境科学与技术, 2011, 34(11): 11-17.
[37] 靳晓敏, 吴垠, 杨松, 等. 两种菊酯类农药对鲤血清 CAT 和 SOD 的影响[J]. 农业环境科学学报, 2006, 25(3): 615-618.
[38] Shao J, Eckert M L, Lee L E J, et al. Comparative oxygen radical formation and toxicity of BDE-47 in rainbow trout cell lines [J]. Marine Environmental Research, 2008, 66(1): 7-8.
[39] Giordano G, Kavanagh T J, Costa L G. Neurotoxicity of a polybrominated diphenyl ether mixture (DE-71) in mouse neurons and astrocytes is modulated by intracellular gluthatione levels [J]. Toxicology Applied Pharmacology, 2008, 232(2): 161-168.
[40] Chen J S, Chun L F, Sun W W, et al. Assessment of the neurotoxic mechanisms of decabrominated diphenyl ether (PBDE-209) in primary cultured neonatal rat hippocampal neurons includes alterations in second messenger signaling and oxidative stress [J]. Toxicology Letters, 2010, 192(3): 431-439.
[41] 吴伟, 聂凤琴, 瞿建宏. 多溴联苯醚对鲫鱼离体肝脏组织中CAT和GSH-Px的影响[J]. 生态环境学报, 2009, 18(2): 408-413.
[42] 周科, 马陶武, 朱程, 等. 2, 2, 4, 4 -四溴联苯醚(BDE-47)污染沉积物对铜锈环棱螺肝胰脏的SOD、CAT和EROD活性的影响[J]. 环境科学学报, 2010, 30(8): 1666-1673.
[43] 李子文, 李师登, 张凤娇, 等. BDE-209 和 PCB153 在致大鼠肝细胞 DNA 蛋白质交联 (DPC) 上的拮抗作用[J]. 生态毒理学报, 2011, 6(2): 138-142.
[44] 孙福红, 周启星. 多溴二苯醚的环境暴露与生态毒理研究进展[J]. 应用生态学报, 2005, 16(2): 379-384.
责任编辑 高 蓓
Study on Single and Joint Toxic Effects of Two PBDEs(BDE-47, BDE-209)on RotiferBrachionusplicatilis
SHA Jing-Jing1, WANG You1, WANG Hong1, CHEN Yue2,LI Xiao-Hong1, XU Ning-Ning1, TANG Xue-Xi1
(1. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China; 2. The Second Institute of Oceanography, Soa, Hangzhou 310012, China)
In order to enrich the research about the impact of polybrominated diphenyl ethers (PBDEs) on zooplankton in the marine environment, the toxic effects of single and joint BDE-47 and BDE-209 in different concentrations on rotiferBrachionusplicatiliswere examined under controlled laboratory conditions. The toxicity tests of BDE-47 showed that theLC50values for 48, 72 and 96 h of BDE-47 forB.plicatiliswere 2.113, 0.376, 0.163 mg/L, respectively. They were all less than those of BDE-209 which were 11.162, 1.237, 0.295 mg/L, respectively. Therefore, BDE-47 was found to be more toxic toB.plicatilisthan BDE-209 under laboratory conditions. The joint toxic effects of BDE-47 and BDE-209 were examined with setting up the concentration as 1∶1 and the toxicity as 1∶1. The Marking additive index method was used to evaluate the joint toxicity. The results of the two ways were similar, which showed that the joint toxic effects of BDE-47 and BDE-209 were synergistic at 24 and 48 h, while the joint toxic effects changed to antagonistic at 72 and 96 h. We concluded that as the increase of exposure time within 96 h, the joint toxic effects of BDE-47 and BDE-209 changed from synergy to mild antagonism.
BDE-47; BDE-209;Brachionusplicatili; acute toxicity; joint toxicity
国家自然科学基金项目(41276140);国家自然科学基金委员会-山东省人民政府海洋科学研究中心联合资助项目(U1406403):海洋生态与环境科学资助
2014-10-15;
2015-04-10
沙婧婧(1987-),女,博士生,主要从事海洋生态学和生态毒理学研究。E-mail:shajingjingouc@163.com
❋❋ 通讯作者: E-mail:tangxx@ouc.edu.cn
P734.4
A
1672-5174(2015)09-069-09
10.16441/j.cnki.hdxb.20140314
