宫颈癌对阴道内环境及常见菌群的影响
2015-03-01刘晓霞何茵芳
刘晓霞 何茵芳
宫颈癌对阴道内环境及常见菌群的影响
刘晓霞 何茵芳
目的比较正常人群与宫颈癌人群阴道内环境及常见菌群的差异性,为预防和诊断宫颈癌提供一种新型的标志物或手段。方法采用病例对照研究方法进行配对样本量设计,选取经过病理检查确诊的50名宫颈癌患者,按照年龄、文化程度、收入水平、婚姻及性生活情况进行配对选取50名健康体检者,共同采集阴道内分泌物样本,利用五联检试剂及非厌氧的菌群培养方式检测阴道内环境及阴道内常见菌群,数据分析采用t检验或卡方检验。结果宫颈癌组的PH值为(4.8±0.03),明显高于对照组的(4.0±0.03)。乳酸杆菌、霉菌、滴虫在宫颈癌患者中的检出率分别为88%、74%和42%,与对照组比较都存在统计学差异;但在革兰阴性菌和革兰阳性菌的对比上无明显差异性。在宫颈癌患者和健康人群中都可检出大肠埃希菌、产酸克雷伯菌、表皮葡萄球菌、粪肠球菌和尿肠球菌,但宫颈癌患者中检出的特殊类型的菌种有奇异变形杆菌、阴沟肠杆菌和易变微球菌等。宫颈癌患者革兰氏阴性菌需氧菌群多样性指数低于对照组,但革兰氏阳性菌需氧菌群多样性却高于对照组。结论宫颈癌患者阴道PH值较正常人群明显升高,且不同微生物的检出比例和菌群多样性与正常人群存在明显不同。
宫颈癌;阴道内环境;菌群
(The Practical Journal of Cancer,2015,30:1135~1138)
子宫颈癌是常见的妇科肿瘤之一,发生发展是一个由量变到质变、渐变到突变的反应过程,这个过程存在很多年,是预防和筛查宫颈癌的绝好时机[1]。乳酸杆菌是阴道内的主导菌种,现已有研究发现利用乳酸杆菌携带VLPs病毒颗粒进行黏膜疫苗可治疗宫颈癌[2],提示阴道环境内菌种的组成与特性很有可能会给宫颈癌患者带来新的治疗思路。
1 资料与方法
1.1 对象选取
取自2010至今来我院妇科确诊的50例宫颈癌患者为实验组,并根据年龄、经济状况、文化程度和婚姻
及性生活史采取配对条件,选取这段时间来我院进行常规体检的50名妇女作为对照组,具体情况见表1。

表1 2组人员基本配对资料
1.2 实验方法
1.2.1 采集方法妇科医生用女性专用无菌拭子在阴道后穹窿处及宫颈管内转动数周后,停留数秒,采集分泌物置密闭无菌管内送检验科检测,每个患者上采集得到2份相同含有分泌物的试管,分别标号1、2号。
1.2.2 检测方法五联试剂由郑州安图生物公司提供,将样本1号滴于洁净试管内,把所采集的分泌物拭子置入试管内并将其中的水分挤压干净,测定其PH值,后将其滴入专用反应卡各孔中,按要求滴加试剂或放入37℃温箱,判定结果;样本2号接种于血平板等,按照《全国临床检验操作规程》进行操作,菌落生长后经初步分类,根据需要采取API鉴定条,培养48~72 h后不生长判定为阴性。所用平板和鉴定条及微生物鉴定仪均为法国生物梅里埃公司产品。
1.3 统计学方法
所有数据采用EPI data3.1进行录入及逻辑纠错,采用SPSS 18.0进行数据t检验及χ2检验,取P<0.05为差异具有统计学意义。
2 结果
2.1 阴道内环境及菌种情况
宫颈癌组的PH值为(4.8±0.03),明显高于对照组的(4.0±0.03),且差异具有统计学意义。乳酸杆菌在宫颈癌患者中的检出率为88%,低于对照组乳酸菌的检出率(χ2=6.383,P<0.05),并且宫颈癌患者中霉菌和滴虫的检出比例分别为74%和42%,都高于对照组,且差异存在统计学意义(χ2=33.980、9.722,P均<0.05),但在革兰阳性需氧菌和革兰阴性需氧菌上分别占到72%和82%,与对照组未表现出差异性(χ2=0.421、1.974,P均>0.05)。见表2。
2.2 菌种情况
2组人员的阴道分泌物经过菌培养后,表现出了不同的菌种特点。宫颈癌患者革兰阴性菌中检出大肠埃希菌、奇异变形杆菌、阴道加德纳菌、产酸克雷伯菌、阴沟肠杆菌、铜绿假单胞菌,而对照组革兰阴性菌中检出大肠埃希菌、产酸克雷伯菌、嗜麦芽窄食单胞菌、普通变形杆菌、醋酸钙不动杆菌和摩根摩根菌,相比于各组的革兰阴性菌,革兰阳性菌的种类较少,宫颈癌组患者主要为表皮葡萄球菌、粪肠球菌、尿肠球菌、易变微球菌和金黄色葡萄球菌,但对照组除了前三者共同以外,也存在一种特殊类型的细菌为纹带棒状菌。见表3。

表2 2组人员阴道内环境及菌种比较(例,%)
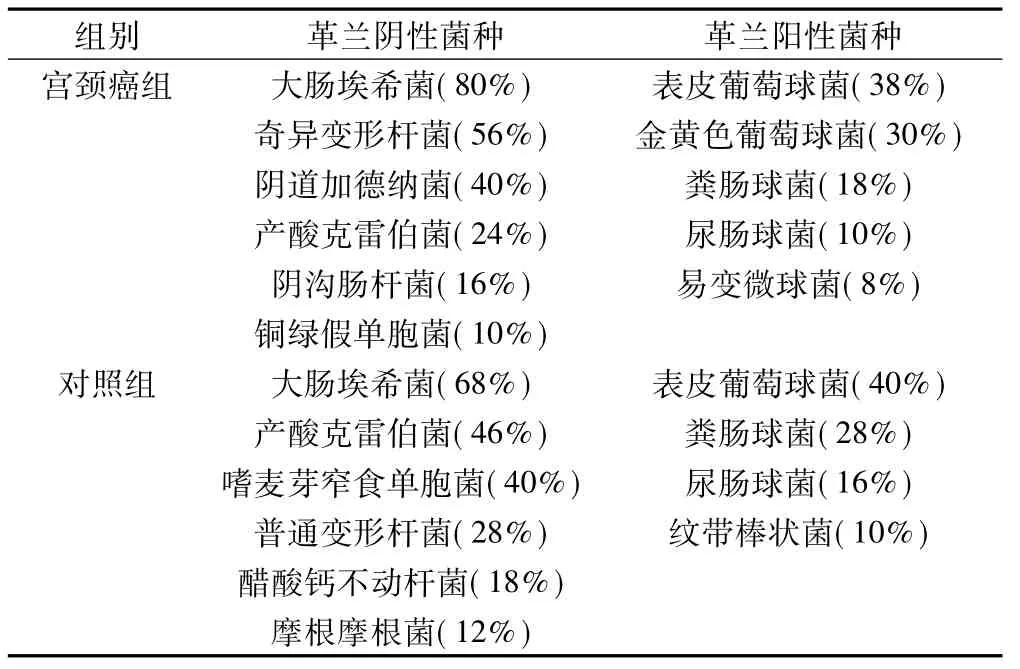
表3 2组人员菌种分类
2.3 菌群多样性情况
菌群多样性的计算是运用Shannon指数进行计算,把每个菌种的检出比例当成菌种浓度,计算公式为H'=-∑c*Inc,c指菌种浓度。按革兰染色的不同分别进行计算,结果显示宫颈癌患者革兰阴性菌群多样性指数为1.763,低于对照组的1.905;而革兰阳性菌群的多样性系数为1.470,高于对照组的1.246。
3 讨论
人乳头瘤病毒(HPV)是一种与宫颈癌发生发展密切相关的乳突病毒,近年来关于其基因分型检测与宫颈癌的关系研究比较成熟[3],但却还没有研究探讨阴道内菌群与宫颈癌的相关关系。人类是与其身体内存在的复杂微生物群共同相互依存的生命体,并且人体内有些部位的细菌种类,如肠道和口腔也表现出了其特殊的菌种,现已确定的是与人体密切相关的细菌细胞数是人体本身细胞总数的10倍,细菌所代表的基因组信息是人类全基因组的1000倍,而且现如今的研究表明这些细菌与人类的健康以及部分疾病的发生密切相关[4]。
自1892年Doderlein从正常怀孕的女性阴道内分离出乳酸杆菌后[5],妇科医生一直认为阴道内细菌的变化与某些有症状的女性分泌型疾病存在联系,并且研究发现一种阴道加德纳菌与非特异性的女性阴道炎存在明显相关[6],来自美国华盛顿研究小组的发现重新证实了这种非特异性阴道炎不仅与加德纳菌的丰富度增加有关,而且与一系列厌氧菌和支原体的数量增高存在明显关系,基于此次实验结果,研究者将伴有此种细菌改变的综合征称为“细菌性阴道炎”[7],并根据不同的主导菌种进行了划分和标准的指定。正常情况下,乳酸杆菌占到阴道内全部微生物的90%,它能分解阴道上皮糖原变成乳酸,控制阴道PH值在3.5~4.5,使条件致病菌难以繁殖。杨仙芳的研究发现产后血性恶露的时间越长,阴道PH值越高,更易遭受条件致病菌的繁殖和阴道疾病的发生[8]。本次研究中宫颈癌患者的阴道内PH值要明显高于正常人群,提示阴道内PH值与女性健康情况存在联系。其次,乳酸杆菌的数量使其能大量粘附于阴道上皮上,维持阴道的定植能力,阻止有害微生物的入侵;再者,乳酸杆菌可以产生过氧化氢,从而抑制部分细菌生长[9]。所以一般情况下,阴道内存在大量的乳酸杆菌经常被认为是健康的象征[10],医院就女性泌尿生殖道感染常用抗生素治疗,但抗生素的过度使用会造成乳酸杆菌数量的下降,造成阴道内天然屏障的破坏和耐药性的增高[11],所以,研究阴道内微生物的情况,研发益生菌合剂来替代抗生素治疗有望成为一种新型且有效的治疗模式。
研究表明,阴道内菌群可受到多种外界因素影响,如环境中暴露因素、菌种之间的竞争作用或卫生条件及个人健康状况等[12],并且PH值和细菌种类的变化会增加感染HPV的风险[13],而HPV是已知的引发宫颈癌的重要危险因素。本研究中宫颈癌患者的阴道内菌群变化明显,但未检验患者感染HPV情况,故缺乏验证。一项动物学研究结果显示,乳酸杆菌活菌治疗细菌性和真菌性混合感染阴道炎的疗效明显[14],同样一项关于宫颈癌患者阴道微生物分布情况的调查发现,正常宫颈和慢性宫颈炎组中乳酸杆菌定植密度较高,各种病原体感染率较低,而在CIN或宫颈癌组中乳酸杆菌定植密度较低且伴有各种病原体感染率较高,可见乳酸杆菌与其他病原体存在拮抗作用[15]。本研究发现宫颈癌组中乳酸杆菌检出率下降,而霉菌、滴虫的感染率升高,也部分支持了乳酸杆菌对阴道菌群的影响,其机制可能是因为其产生乳酸维持阴道内酸环境或产生其他抑制其余微生物生长的物质引起。
此外,阴道菌群在预防妇科疾病,如细菌性阴道炎、真菌性阴道炎、性传播疾病,甚至是艾滋病中也起到关键作用[16]。尽管多项研究已表明了阴道菌群的重要性,但其具体机制的研究尚在起步阶段。阴道菌群的动力学变化会随着妇女月经周期的改变而发生变化,而且在女性不同的生理时期,比如出生、怀孕或绝经等不同时间段,阴道内菌群也在动态变化着,它与机体内激素水平及健康状态相互影响,并反映出结构和功能的改变,研究其变化和功能将有助于我们深入了解什么才是真正的“健康”。
本文研究结果在支持了以上众多观点的同时,发现了宫颈癌患者在需氧菌的多样性系数上存在差异,并且检验出了部分特殊菌种形态,比如阴道加德纳菌、阴沟肠杆菌等,但宫颈癌患者却只在革兰阳性需氧菌的多样性上显示增高,革兰阴性多样性的系数较健康人群有所降低,提示阴道内菌种可能存在相互制约的现象,并且革兰阳性菌的种类的增多可能与其强侵袭型及细菌壁厚的高环境适应性有关,但此次研究仅限于实验室可培养的细菌种类,细菌之间的关系作用多变复杂,更何况有超过99%的细菌现如今无法得到体外培养,所以,利用基因分析技术,提高对菌群的检出率将是今后研究人体内部微生物群落组成及功能的重要方向。
综上所述,宫颈癌患者阴道PH值较正常人群明显升高,且不同微生物的检出比例和菌群多样性与正常人群存在明显不同。
[1]李翠玲,李晶,张莹,等.宫颈癌早期筛查3种方法的比较研究〔J〕.中国伤残医学,2013,21(11):151-152.
[2]Aires KA,Cianciarullo AM,Carneiro SM,et al.Production of human papillomavirus type 16 L1 virus-like particles by recombinant Lacto-bacillus casein cells〔J〕.Appl Environ Microbiol,2006,72(1):745-752.
[3]王建红.526例女性人乳头瘤病毒与阴道内三种微生物感染状况相关性分析〔J〕.中国保健营养(中旬刊),2013,23(7):667.
[4]Martin DH.The Microbiota of the vagina and its influence on women's health and disease〔J〕.Am J Med Sci,2012,343(1):2-9.
[5]Hillier S,Marrazzo J,Holmes KK,et al.Sexually transmitted diseases〔M〕.4th ed.New York:McGraw Hill Medical,2008:737-768.
[6]Gardner HL,Dukes CD.Haemophilus vaginalis vaginitis:a newly defined specific infection previously classified nonspecific vaginitis〔J〕.Amer J Obstet and Gyn,1955,69 (5):962-976.
[7]Spiegel CA,Amsel R,Eschenbach D,et al.Anaerobic bacteria in nonspecific vaginitis〔J〕.New Eng J Med,1980,303(11):601-607.
[8]杨仙芳.468例产褥期妇女阴道pH值检测情况〔J〕.现代预防医学,2005,32(3):274.
[9]戴钟英.阴道内环境的形成、生活行为和习惯与阴道炎的关系〔J〕.中华全科医师杂志,2006,5(12):718-719.
[10]Hickey RJ,Zhou X,Pierson JD,et al.Understanding vaginal microbiome complexity from an ecological perspective〔J〕.Transl Res,2012,160(4):267-282.
[11]Iannitti T,Palmieri B.Therapeutical use of probiotic formulations in clinical practice〔J〕.Clin Nutr,2010,29(6): 701-725.
[12]Bolton M,Van Der Straten A,Cohen C.Probiotics:potential to prevent HIV and sexually transmitted infections in women〔J〕.Sex Transm Dis,2008,35(3):214-225.
[13]于妍妍,金哲,刘艳霞,等.宫颈高危HPV感染与阴道内环境相关因素分析〔J〕.疑难病杂志,2011,10(9): 673-675.
[14]李新宇,高纪伟,徐兰芳,等.乳杆菌活菌对金葡菌、大肠埃希菌和白色假丝酵母菌实验性混合感染阴道炎的疗效研究〔J〕.抗感染药学,2011,8(3):183-187.
[15]逯彩虹,李保红,李小斌,等.宫颈癌患者阴道微生物的分布特点〔J〕.中国医科大学学报,2011,40(3):267-271.
[16]王小林,李胡斌,陈秀平,等.宫颈癌患者腔内后装放疗后阴道分泌物的细菌学调查及药敏分析〔J〕.现代实用医学,2009,21(7):765-766.
The Effect of Cervical Cancer on Vaginal Environment and Common Flora
LIU Xiaoxia,HE Yinfang.The Affiliated Hospital of Shangluo Vocational&Technical College,Shangluo,726000
ObjectiveTo compare the differences of vaginal environment and common flora between cervical cancer patients and healthy patients,and provide a new indicator or method in preventing and curing cervical cancer.MethodsA casecontrol study was conducted in all 50 cervical cancer patients and 50 paired healthy patients.The paired criteria were age,degree of education,income,marriage and sexual life.The vaginal environment and common flora were detected and analyzed by 5 inspection reagents and non-anaerobic bacteria culture.T test and χ2test were used to compare the differences between the 2 groups.ResultsPH value(4.8±0.03)in cervical cancer patients was higher than that(4.0±0.03)in healthy patients.The detection rate of lactic acid bacillus,mould and trichomonad were 88%,74%,42%respectively,which showed significant differences between the 2 groups.However,there were no differences in gram-positive aerobic bacteria and gram-negative aerobic bacteria between the 2 groups.The common floras in both groups were E.coli,klebsiella oxytoca,staphylococcus epidermidis,enterococcus faecalis and enterococcus faecium.But some unique types of bacteria were also found in cervical cancer patients,such as bacillus milabilis,enterobacter cloacae,micrococcus varians et al.The Shannon index of gram-negative bacteria in cervical cancer patients was lower than that of the control group,but showed higher values in Shannon index of gram-positive bacteria.ConclusionVaginal PH value in cervical cancer patients is much higher than the healthy patients.There has significant difference in vaginal environment and diversity of bacteria between cervical cancer patients and healthy patients.
Cervical cancer;Vaginal environment;Flora
10.3969/j.issn.1001-5930.2015.08.009
R737.33
A
1001-5930(2015)08-1135-04
2015-01-23
2015-05-28)
(编辑:甘艳)
726000陕西省商洛职业技术学院附属医院(刘晓霞); 726000陕西省商洛市中心医院(何茵芳)
