Sam68蛋白对宫颈癌细胞增殖的影响研究
2015-02-22汪兰
汪 兰
广东药学院基础学院,广东广州 510006
子宫颈癌属于常见的妇科疾病之一,随着人们生活水平、生活质量的提高,宫颈癌发病率呈逐年上升的趋势发展,据有关研究表明,宫颈癌占女性生殖器官癌瘤中的第一位[1]。宫颈癌在世界各国均有大量的患病人群,发病率与死亡率极高[2],根据地区的不同,观察发现子宫颈癌患病人群的发展趋势,可将其总结为乡村高于城市,山区高于平原。一旦患有子宫颈癌,将给女性患者的身体健康带来极大的威胁[3],依据此类事实,本文将我院一年来收治的宫颈癌患者共56 例和宫颈良性肿瘤患者44例进行研究,通过检测子宫颈癌中Sam68 蛋白、核增殖抗原、皮钙黏附蛋白等项目的表达,对Sam68蛋白在宫颈癌细胞增殖的影响进行了深入的研究和探讨,相关报道如下。
1 资料与方法
1.1 一般资料
本组选择我院于2012 年12 月~2013 年12月收治的宫颈癌患者共56 例和宫颈良性肿瘤患者44 例,前者作为观察组,后者作为对照组,同时每位患者均经临床资料、病理学及实验室检查证实存在宫颈组织病变,对每一名患者肿瘤组织中Sam68 蛋白、核增殖抗原(Ki67)、皮钙粘附蛋白(E-cadherin)指数变化进行分析和比较。100例患者均为女性,年龄23 ~78 岁,平均年龄(53.2±6.7)岁,两组患者病情、年龄、病程比较均无明显差异(P >0.05),可以进行对比分析。
1.2 方法
本次研究使用的试剂为Sam68 蛋白单克隆抗体(由上海瑞奇生物科技有限公司生产制造)[4],免疫组化 Power Vision 二步法试剂盒PV-6002(由北京欣兴唐生物科技有限公司生产制造), DAB 显色试剂盒(由北京康为世纪生产制造)[5];严格按照试剂盒及Sam68 蛋白说明书进行操作,Sam68 蛋白、E-cadherin采用免疫组化PV 二步法染色,Sam68 蛋白抗浓度为1 ∶10[7],E-cadherin 抗浓度为1 ∶200[8]。
1.3 诊断结果
在实验室显微镜下观察Sam68 蛋白的性质,若其胞核、胞浆染色呈棕黄色则为阳性,根据免疫组化半定量计分法对Sam68 蛋白阳性染色程度进行计分,无着色为0 分,浅黄色为1 分,棕黄色为2 分,棕褐色为3 分[9];根据阳性细胞比例进行计分,阳性细胞比例≤5%计0 分,阳性细胞比例在5%~10%间计1 分,阳性细胞比例在11%~50%间计2 分,阳性细胞比例在51%~80%间计3 分,阳性细胞比例大于80%计4 分[10];根据Sam68 蛋白染色与阳性细胞比例的乘积判断其阳性结果,0 分即为-,1 ~4分即为+,5 ~12 分即为++~+++。
在实验室显微镜下观察E-cadherin 的性质,若其胞核、胞浆染色呈棕黄色则为阳性,根据免疫组化半定量计分法对E-cadherin 阳性染色程度进行计分,计分情况与Sam68 蛋白阳性染色计分方法相同;根据E-cadherin 阳性细胞占细胞总数的平均值判断其阳性率,小于10%即为-,10%~50%即为+,大于50%即为++~+++。ki67 检测方法与E-cadherin 基本相同。
1.4 统计学方法
应用SPSS16.0 统计学软件对上述治疗进行数据的分析,计量资料采用()表示,进行t 检验,计数资料进行x2检验,检验水准为α=0.05,相关性分析采用 Spearman 秩相关分析法[11],P <0.05 时为差异具有统计学意义。
2 结果
本组选取的宫颈癌患者共56 例和宫颈良性肿瘤患者44 例,对两组患者肿瘤组织中Sam68 蛋白、Ki67、E-cadherin 指数变化情况进行分析和比较后,对于所取得的成果比较满意,Sam68 蛋白表达与TNM 分期、肿瘤大小有关,差异有显著统计学意义(P <0.05);Sam68 蛋白表达与患者年龄、分化程度无关,差异无明显统计学意义(P >0.05);Sam68 的表达水平临床病理因素的关系,如表1。Sam 68 蛋白在乳腺癌和乳腺良性肿瘤中表达,差异有显著统计学意义(P <0.05)。见图1。

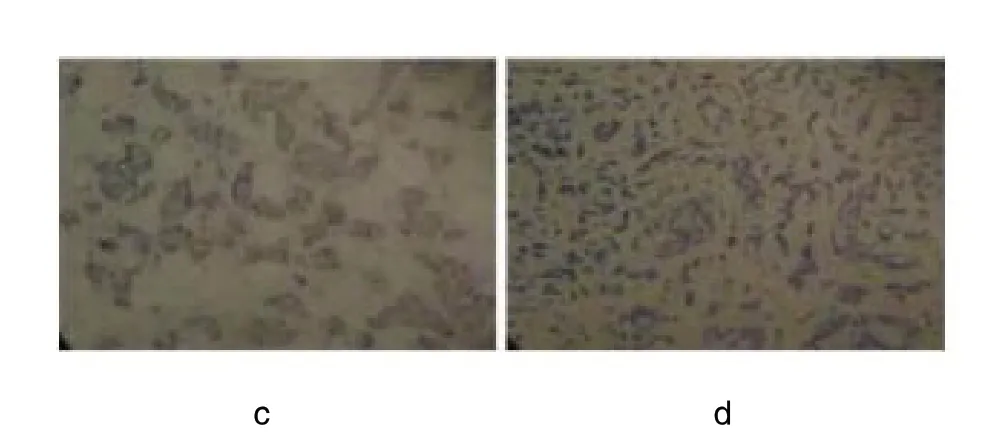
图1 乳腺癌组织中 Sam68 蛋白表达情况(×400)。Sam68 蛋白在乳腺癌组织中,a 为强阳性表达;b 为度阳性表达;c 为弱阳性表达;d 为阴性表达

表1 Sam68的表达水平临床病理因素的关系
本次研究,两组患者Sam68 蛋白 E-cadherin 阳性例数为82(82%),基于Spearman 秩相关分析法的基础上,观察到Sam68 蛋白与E-cadherin 表达呈负相关的关系, r=-0.247,P=0.021。两组患者Sam68 蛋白与E-cadherin 的表达关系综合比较,见表2。
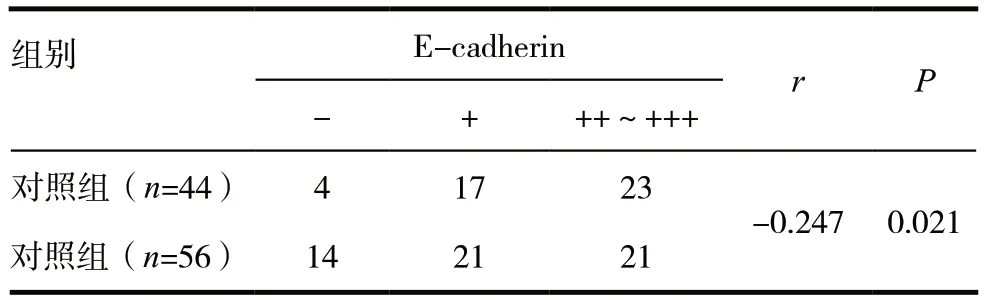
表2 两组患者Sam68蛋白与E-cadherin的表达关系综合比较
采用Spearman 秩相关分析法,观察到Sam68蛋白与Ki67 表达呈正相关的关系,r=-0.236,P=0.027。两组患者Sam68 蛋白与ki67 的表达关系综合比较见表3。

表3 两组患者Sam 68 蛋白与Ki67 表达关系综合比较
3 讨论
子宫颈癌是一种常见的妇科疾病,由于该病具有较高的发病率与致死率,严重威胁着女性的生命健康,根据相关研究数据显示,国内宫颈癌死亡率占总癌症死亡率的第四位[12]。近年来,子宫颈癌发病率越来越高,世界各地区均存在着许多子宫颈癌患者,该病好发于40 ~50 岁的女性,在临床上子宫颈癌的治疗方法比较单一[13],主要依赖于手术治疗,患者处于早期子宫颈癌发展阶段,通常采用子宫切除术进行治疗。若发展到子宫颈癌晚期的患者,一般都会采用根治性治疗方式[14],并联合外照射及近距离照射,此种治疗方法虽然能够在一定程度上控制病情,提高患者生存率,但是易于出现局部复发的情况[15]。
随着科技与医学水平的提高,治疗子宫颈癌患者由20 世纪90 年代的化疗联合标准放疗方式,直至变为今天的联合放化疗方式[16],能够最大限度的提高患者生存率,降低复发率与病死率,延长患者生存周期。早期子宫颈癌患者若采用单纯放疗就可得到良好的治疗效果,甚至治愈,但是采用联合放化疗,则治疗效果相对不足,并且存在一定的风险性,易于产生一系列毒副后果。联合放化疗适用于治疗子宫颈癌晚期患者,虽然会出现局部复发率,但治疗效果相对理想[17]。
在子宫颈癌的检测中Sam68 蛋白具有较高的诊断意义,子宫颈癌患者体内Sam68 蛋白指数相对较高,尤其表现在对宫颈癌组织的表达[18]上,本次研究对100 例患者进行治疗后,子宫颈癌患者Sam68 蛋白表达水平明显高于宫颈良性肿瘤患者,并且与E-cadherin 表达呈正相关的关系,与Ki67 表达呈负相关的关系,由此可证明,Sam68 蛋白对宫颈癌细胞增殖有着明显的作用关系。同时观察Sam68 的表达水平临床病理因素的关系,发现Sam68 蛋白表达与TNM 分期、肿瘤大小有关,与患者年龄、分化程度无关。
本次研究结果与大量实验数据结果基本相似,这就说明,Sam68 蛋白在正常宫颈组织中的表达明显低于宫颈癌组织,Sam68 的表达及其胞质中的定位与宫颈癌组织转移有着密切的关联,因此,在临床上Sam68 蛋白能够作为检测早期宫颈癌总生存时间、无病生存时间的重要指标,并且具有一定的临床预测价值。与此同时,子宫颈癌患者下调Sam68 的表达水平具有抑制 Akt/GSK-3β/Snail 向上皮间质转化[19],从而抑制宫颈癌组织及细胞的浸润和转移,是一种有效的预测宫颈癌组织淋巴结转移的独立预测因子。
根据大量研究表明,Sam68 蛋白有着控制细胞恶化、抑制肿瘤组织发展、促进恶性细胞凋亡的特性,随着研究的逐渐深入,发现Sam68 的表达水平与宫颈癌病理因素、预后有着密切的联系,从E-cadherin、Ki67 等癌细胞增殖抗原中可发现,Sam68 蛋白确实具备促进宫颈癌细胞增殖的作用。
在早期宫颈肿瘤转移的过程中,上皮细胞间质化出现的首要特性是E-cad 蛋白表达水平消除或不明显,Sam68 蛋白能够根据不同途径调控其下游分子GSK-3β、Snail 转录因子[20],从而对E-cad herin 蛋白表达水平造成影响。本次研究,Sam68 蛋白与E-cadherin 表达呈负相关的关系,r=-0.247;P=0.021,与Ki67 表达呈正相关的关系,r=-0.236;P=0.027,这就说明Sam68 蛋白对E-cadherin、Ki67有着不同的影响。
综上所述,研究既往的有关实验数据,我们会发现有许多临床指标与子宫颈癌的预后息息相关,例如分子功能影像学指标、离体标本相关指标、宫颈癌肿瘤内环境指标、与宫颈癌细胞生物学特性相关指标等,但由于许多指标的检测过程太过复杂,存在一定的局限性,而在宫颈癌组织中Sam68 蛋白的表达明显高于正常宫颈组织,因此,Sam68 蛋白对宫颈癌细胞增殖具有促进作用。
[1] 王力扬.Sam68 对结直肠癌细胞增殖、侵袭和迁移能力的影响[D].广州:南方医科大学,2014:39-45.
[2] 元敏,夏婷,胡小戊等.乳腺癌组织Sam68 蛋白与临床预后的相关性研究[J].实用医学杂志,2013(8):1293-1295.
[3] 吴喆.评价宫颈癌预后生物学指标的最新进展[J].岳阳职业技术学院学报,2013(5):91-95.
[4] 章乐虹,元敏,曹腾飞.乳腺癌组织Sam68 表达与腋淋巴结状态的相关性研究[J].中国现代医学杂志,2013(31):47-51.
[5] 王迟鹃,许华,张海瑞.沉默Sam68 基因对Jurkat 细胞增殖影响的研究[J].中国实验血液学杂志,2014(4):894-898.
[6] Shaker,Mohammed,Yokoyama.Aberrant Expression of Disintegrin-Metalloprotease Proteins in the Formation and Progression of Uterine Cervical Cancer[J].EN,2011,22(11):782-783.
[7] 张娴.宫颈癌组织中RASSF2A 基因启动子甲基化状态及其临床意义[D].济南:山东大学,2014:46-52.
[8] 张晓丽.LKB1 对宫颈癌细胞转录谱的影响及抑癌机制研究与CIP2A 调控宫颈腺癌多药耐药的研究[D].济南:山东大学,2014:53-57.
[9] 李瑛花.siRNA 沉默HPV16 E6 对宫颈癌细胞p63 蛋白的影响[D].长沙:中南大学,2012:40-42.
[10] Huizhen Zhong,Xia Liu,Meng Lou.Gemcitabine and carboplatin demonstrate synergistic cytotoxicity in cervical cancer cells by inhibiting DNA synthesis and increasing cell apoptosis [J].OncoTargets and Therapy,2013,15(3):34-37.
[11] 董倩.叶酸、DNMT1 对宫颈癌细胞生长的影响及与HPV16 的关系[D].太原:山西医科大学,2012:32-34.
[12] 王妍,何慧仪.宫颈癌相关基因的研究进展[J].中华肿瘤防治杂志,2011(16):1316-1320.
[13] 王艳,李鸥,白娣斯.白介素-10 基因的表观遗传与宫颈癌研究进展[J].中国妇幼保健,2012(3):462-464.
[14] Nonkululeko N.Mthembu,Lesetja Raymond Motadi.Apoptotic potential role of Agave palmeri and Tulbaghia violacea extracts in cervical cancer cells [J].Molecular Biology Reports,2014,21(4):417-419.
[15] Chan Kyo Kim,Sung Yoon Park,Seung Jae Huh.Blood oxygenation level-dependent MR imaging as a predictor of therapeutic response to concurrent chemoradiotherapy in cervical cancer: a preliminary experience[J].European Radiology,2014,18(9):245-247.
[16] Li Lianqin,Zhang Yong-Gang,Chen Chun-Ling.Antiapoptotic role of peroxiredoxin III in cervical cancer cells.[J].FEBS open bio,2013,28(3):5-7.
[17] Li Xiaolei,Wu Zhiqiang,Han Weidong.Characterization of Adult α- and β-Globin Elevated by Hydrogen Peroxide in Cervical Cancer Cells That Play A Cytoprotective Role Against Oxidative Insults.[J].PL o S One,2013,16(3):79-81.
[18] D.Feng,Z.Cao,C.Ling.Combination of Valproic Acid and ATRA Restores RARβ2 Expression and Induces Differentiation in Cervical Cancer through the PI3K/Akt Pathway[J].Current Molecular Medicine,2012,10(5):121-123.
[19] A.Bruning,M.Vogel,A.Burges.Bortezomib Targets the Caspase-Like Proteasome Activity in Cervical Cancer Cells,Triggering Apoptosis That Can be Enhanced by Nelfinavir[J].Current Cancer Drug Targets,2011,11(7):114-117.
[20] Haitao Bai,Shengfang Ge,Jian Lu.Hypoxia inducible factor‐1α‐mediated activation of survivin in cervical cancer cells[J].Journal of Obstetrics and Gynaecology Research,2012,28(9):390-392.
