短期高脂饮食改变大鼠对蔗糖的喜好和甜味觉的敏感性
2015-02-18孙慧玲闫君宝李金容闫剑群
孙慧玲,闫君宝,吕 波,孙 波,李金容,闫剑群
(1.西安交通大学医学部附属口腔医学院,陕西西安 710004;2.西安交通大学医学部病理与生理学系,陕西西安 710061;3.河南科技大学医学院生理学教研室,河南洛阳 471023)
肥胖症是一种由多种因素引起的代谢性疾病,目前已成为全球性健康问题。该病是引起致命性心血管疾病的主要危险因素之一,一旦罹患即难以逆转[1-2]。因此,探索有效预防肥胖症发病的策略即成为当前亟待解决的课题。
可口性食物的过量摄入是导致肥胖发生的重要因素。为了评估高热量食物摄入对机体产生的长期影响及导致肥胖的发病机制,研究者们应用了多种动物模型对之进行了广泛研究[3]。研究表明,长时间喂养高脂饲料会导致啮齿动物出现食欲过盛、体质量增加、高血糖和胰岛素抵抗症状,从而导致肥胖代谢综合征[3-7]。高脂肪饮食引起食欲过盛的效应可能是不同的代谢机制发生改变的结果,包括脂肪代谢产物激活的迷走神经传入通路的异常[5]、下丘脑神经肽表达的改变[8],也有可能是肥胖者口腔味觉感知敏感性的变化所致。例如,Otsuka Long-Evans Tokushima Fatty(OLETF)大鼠由于缺乏缩胆囊素(cholecystokinin,CCK)1受体(CCK-1)而表现出体质量明显增加和食欲过盛[9]、对美味敏感性的增强和提高[9-10],这表明OLETF大鼠的食欲过盛,不仅是产生饱感的外周调控机制障碍的结果,也可能受到味觉感受机制异常的影响。
味觉感知会影响饮食行为进而影响体质量,甜味觉感知与内环境的相互作用是机体维持内环境稳态的重要基础之一。甜味觉感知引导动物对富含能量的甜味食物的摄入,并参与调节机体代谢及能量平衡;同时,机体的营养与代谢状态又对甜味觉信息的感知与整合进行调制[7]。目前该领域的研究集中于探讨甜味感知和体质量之间的关系[11]。研究发现高脂饮食可以增强大鼠蔗糖的摄入动机[12-13],也有研究表明长时间高脂饮食诱导肥胖的小鼠对蔗糖的接纳度降低[14],动物对蔗糖的“喜好”既可以因高脂诱导的肥胖而改变,也可由因遗传倾向性肥胖而改变[15]。味觉阈值,是感知味质的最低浓度,可以反应味觉的敏感性。阈值高,则敏感性低,反之亦然。甜味觉敏感性的高低一定程度上决定了动物寻找和发现高能量食物的能力。目前,对于甜味觉的敏感性是否也受到高脂饮食的调控尚未见诸报道。本研究观察了短期高脂饮食喂养后,大鼠对蔗糖溶液味觉敏感性及喜好的变化,以及某些代谢特征的改变,旨在探讨短期高脂饮食诱导的肥胖与甜味敏感性感知变化之间的关系。
1 材料与方法
1.1 实验动物 刚断乳的雄性Sprague-Dawley大鼠34只,体质量45~65g,平均(55.22±0.94)g,由西安交通大学医学部实验动物中心提供。大鼠单笼饲养在长、宽、高分别为29cm×18.5cm×16.5cm的塑料笼里。室温(22±2)℃,光暗各12h(7am亮,7pm暗)。行为学的检测在光亮时段完成。大鼠自由摄食及饮水。每周记录摄食及体质量。
1.2 动物分组 大鼠正常饲料(chow diet)(10.7%脂肪)(AIN-76rodent diet)喂养适应1周后,所有大鼠高脂饲料(high fat diet)(46.4%脂肪)(在正常饲料基础上加10%猪油,15%蛋黄粉,0.3%猪胆盐)喂养2周。之后将体质量增加最高的10只定义为肥胖易感鼠(obesity prone,OP),而体质量增加最低的10只定义为肥胖抵抗鼠(obesity resistant,OR)[16]。体质量增加介于中间的14只定义为正常对照组(control)。对照组大鼠正常饲料喂养至第8周实验结束,OP及OR鼠高脂饲料喂养共8周。3组分别如下:正常饲料喂养的对照组(C-C,n=14);肥胖易感高脂喂养组(H-P,n=10);肥胖抵抗高脂喂养组(H-R,n=10)。
1.3 饮水训练 为了建立条件性味觉厌味(conditioned taste aversion,CTA),动物分组4周后,所有大鼠给予蒸馏水(distilled water,DW)自由饮用3d,有刻度的饮水瓶置于饲养笼的前端,倾斜放置,两瓶的金属饮水口相距5cm。然后进行饮水训练:即每只大鼠上午给予30min(9∶30~10∶00)及下午给予60min(16∶00~17∶00)的双瓶蒸馏水,其余时间禁水。记录每日上午30min的摄水量。在上午饮水前1h及饮水30min期间将饲料移开,包括蔗糖阈值的检测。训练持续7d直到稳定的饮水量建立。
1.4 条件性厌味的建立 训练之后,随机将大鼠分为条件组和对照组(非条件组)。第1天上午,所有大鼠给予30min 0.2mol/L的双瓶蔗糖溶液(Amresco,USA),随后立即腹腔注射0.15mol/L的 LiCl(2mL/100g)(条件组)或0.15mol/L的 NaCl(非条件组)。下午继续给予60min的双瓶蒸馏水。参照以前研究改良的3次条件建立的方法,建立大鼠0.2 mol/L蔗糖的CTA[17]。甜味的摄入伴随胃肠不适的感觉导致对甜味的不喜好,这就建立了CTA。CTA的建立在随后的连续2天(第2天,第3天)又做了2次。第4天,30min的双瓶选择(0.2mol/L sucrose vs.DW)实验检测了0.2mol/L蔗糖CTA的建立。
1.5 蔗糖检测阈值的测量 条件建立后,进行一系列的30min双瓶选择实验(第5天至第13天),即在30min的实验中,同时给予大鼠两种溶液:蔗糖溶液及蒸馏水,大鼠根据其喜好接受或拒绝该溶液。30 min液体摄入前后的误差为0.1g。蔗糖喜好值为摄入的蔗糖溶液量除以摄入的总液体量(蔗糖与蒸馏水的摄入之和)。双瓶的位置及放入顺序每日变换以避免放置或位置误差。蔗糖溶液是以浓度递减的顺序给予的,即先给0.07mol/L,然后是0.05mol/L,以此类推,接着分别是0.04、0.03、0.02、0.01、0.009、0.007、0.005mol/L。所有蔗糖溶液都是在室温(22~25℃)下用相同来源蒸馏水配制的。下午给予60min蒸馏水。检测阈值测量结束(第14天)时用0.2mol/L蔗糖及蒸馏水双瓶选择实验确定CTA仍然存在。
参照曾经改良的CTA方法[18]建立对0.2mol/L蔗糖的厌恶。条件组及对照组分别进行一系列浓度溶液测试。蔗糖检测阈值定义为大鼠条件组与对照组之间喜好值有统计学差异的最低浓度。蔗糖检测阈值越高,则其敏感性越低,反之,亦然。CTA的方法可以有效地测量味觉的检测阈值[19]。
1.6 统计学分析 所有数据以均值±标准误表示。CTA建立第1天0.2mol/L蔗糖溶液的摄入量运用单因素方差分析之后用Fisher's post-hoc(LSD)分析比较。CTA检测实验前、实验后0.2mol/L蔗糖喜好值的比较运用双因素方差分析。不同浓度喜好分数的比较以及体质量增加的比较采用重复测量方差分析。检验水准取0.05。所用统计软件为SPSS 16.0。
2 结 果
2.1 CTA的建立 图1A、图2A和图3A分别显示,与对照组(NaCl-注射组)比较,条件组大鼠(LiCl-注射组)蔗糖溶液的摄入量显著降低。统计分析表明药物(LiCl与NaCl)与条件建立的时间有交互作用:C-C组[F(2,18)=63.519,P<0.000 1];H-P组[F(2,10)=15.09,P=0.001];H-R 组[F(2,14)=6.358,P=0.011]。条件建立的第1天,条件组与对照组的蔗糖溶液的摄入量无显著差异:C-C组[F(1,12)=1.782,P=0.209];H-P组[F(1,9)=1.394,P=0.272];H-R 组[F(1,9)=1.23,P=0.3]。然而,在随后的第2天及第3天,与相对应的对照组比,条件组的蔗糖溶液的摄入量减少(P<0.01)。CTA在双瓶实验开始前及结束时仍然存在,与NaCl-注射组比,任一组的LiCl-注射组的蔗糖溶液摄入量都少(P<0.01,图1B、图2B、图3B)。
2.2 蔗糖检测阈值
2.2.1 正常对照组 图1显示的是正常对照组大鼠LiCl-注射组与NaCl-注射组大鼠对不同测试浓度的蔗糖喜好值的平均值。方差分析显示出药物的主效应:C-C组[F(1,11)=71.758,P<0.000 1],以及浓度与药物的交互作用:C-C组[F(8,88)=3.261,P=0.003]。图1表明,LiCl-注射组大鼠蔗糖溶液浓度从0.07mol/L至0.01mol/L时,喜好值显著降低[F(1,6)=27.765,P=0.001]。相反,当蔗糖浓度等于或低于0.009mol/L时,正常饲料喂养的对照组(C-C)LiCl-注射组与NaCl-注射组的蔗糖喜好值无显著性差异。本实验中,检测阈值定义为LiCl-注射组与NaCl-注射组大鼠蔗糖喜好值没有在统计学差异时的最低浓度。基于这个定义,我们的实验结果显示C-C组大鼠的蔗糖检测阈值为0.01~0.009mol/L之间(图1)。
2.2.2 高脂饲料喂养对大鼠蔗糖检测阈值的影响考虑到SD大鼠高脂喂养一段时间有的表现为肥胖,有的表现为不肥胖,即肥胖抵抗,所以分别检测了高脂喂养的肥胖易感大鼠(H-P)及高脂喂养的肥胖抵抗大鼠(H-R)的蔗糖阈值。图2和图3分别显示的是高脂饲料喂养的肥胖易感大鼠(H-P)和肥胖抵抗大鼠(H-R)LiCl-注射组与NaCl-注射组大鼠对不同测试浓度的蔗糖溶液的喜好值的平均值。药物×浓度的方差分析显示出了药物的主效应:H-R组[F(1,8)=204.601,P<0.000 1],H-P组[F(1,8)=94.172,P=0.001]。图2和图3分别表明,与NaCl-注射组比较,高脂喂养的抵抗鼠(H-R)及易感鼠(H-P)LiCl-注射组大鼠的蔗糖喜好值显著降低,但当蔗糖浓度等于或低于0.07 mol/L时,H-R及H-P组大鼠LiCl-注射组与NaCl-注射组的蔗糖喜好值没有统计学差异。
2.3 高脂饲料喂养对大鼠蔗糖喜好的影响 当蔗糖浓度为0.2mol/L(P=0.035)或0.01mol/L(P=0.01)饮食对蔗糖的喜好有主效应作用。当蔗糖浓度为0.2mol/L 时,仅 H-R 与 C-C 有 差 异 (P=0.014),当蔗糖浓度为0.01mol/L 时,H-R(P=0.046)及 H-P(P=0.019)均与C-C有差异。在测试浓度为(0.09、0.009mol/L)时任意两组的两两比较均无统计学差异(P>0.05,图4)。
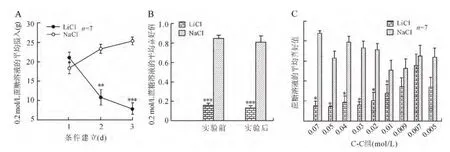
图1 正常饲料喂养的对照组SD大鼠蔗糖的检测阈值Fig.1 Sucrose detection thresholds in chow-fed control rats

图2 高脂饲料喂养的OP大鼠蔗糖的检测阈值Fig.2 Sucrose detection thresholds in HFD-fed OP rats

图3 高脂饲料喂养的OR大鼠蔗糖的检测阈值Fig.3 Sucrose detection thresholds in HFD-fed OR rats

图4 高脂喂养的OR及OP大鼠、正常对照大鼠的蔗糖喜好值Fig.4 Sucrose preference scores of HFD-fed and chow-fed rats
2.4 高脂饲料喂养对大鼠代谢特征的影响
2.4.1 体重增加及热量摄入 分组(H-P、H-R、C-C)×周(1-8)ANOVA 分析显示:组[F(2,51)=79.95,P<0.000 1],周[F(7,357)=1 653.93,P<0.000 1]及组×周的交互作用[F(7,357)=34.42,P<0.000 1]均有显著效应(图5)。而且,第8周末H-P组总能量摄入[(5 607.6±67.9)Kcal]高于 H-R 组[(5 173.4±129.1)Kcal](P=0.002),而 H-P组与C-C组[(5 458.2±92.0)Kcal]之间无差异(P=0.31,图6A)。
2.4.2 食物效率 食物效率为食物摄入的热量(kcal)与体质量的比值。第8周末,H-P组食物效率(0.000 72±0.000 02)比 H-R组(0.000 54±0.000 01)高(P<0.000 1);H-P组比 C-C组(0.005 8±0.000 02)食物效率高(P<0.000 1);H-R组与C-C组比,食物效率无统计学差异(P=0.23,图6B)。

图5 高脂喂养的OR及OP大鼠、正常对照大鼠的体质量增加Fig.5 Body weight gain in HFD-fed OP and HFD-fed OR rats versus chow-fed rats

图6 总摄入热量和食物转化率Fig.6 Total calories intake and feed efficiency
3 讨 论
肥胖是由于遗传因素与环境因素共同作用下能量失衡的结果,而这种能量失衡就是摄入明显高于消耗。LEVIN等[20]发现,高脂(脂肪提供的热能比例大于40%)饲料喂养的同种系的大鼠,有些发生肥胖,而有些不发生肥胖。他们将前者称为肥胖易感(obesityprone,OP),后者称为 肥 胖 抵抗(obesity-resistant,OR)。同样的现象也见于人类:在相同的饮食环境下(高脂),有些个体容易发生肥胖,而另外一些仍能保持正常体重。这表明,基因背景是导致肥胖及肥胖抵抗发生的重要因素。本实验所用的高脂饲料,其脂肪提供的热能比例是46.35%。从图5可以看出,这种高脂饲料喂养SD大鼠8周后,肥胖易感鼠的体重明显高于肥胖抵抗鼠,说明本实验用高脂饲料建立起来的肥胖易感及肥胖抵抗大鼠的模型是成功的,这与LEVIN等[20]的研究结果基本上是一致的。
基因背景的差异导致肥胖及肥胖抵抗发生,而肥胖易感及肥胖抵抗与能量代谢及摄食行为密切相关。高脂饮食可以增强大鼠蔗糖的摄入动机[12-13],而长期的高脂饮食可以降低饮食诱导的肥胖小鼠对蔗糖的接纳程度[14],且其对蔗糖的味觉喜好可以因高脂诱导的肥胖及遗传易感的肥胖而改变[15]是蔗糖摄入及体重调节的一个重要影响因素。对蔗糖刺激反应的甜味敏感性的行为学指标之一就是蔗糖的检测阈值。本文对高脂饲料诱导的OP、OR大鼠,以及正常饲料喂养的大鼠的蔗糖的检测阈值进行了测量,研究结果显示高脂喂养8周的情况下,OP大鼠的蔗糖敏感性与OR大鼠无差异,但二者都比正常饲料喂养的大鼠的蔗糖检测阈值低,这表明了对蔗糖刺激反应的甜味敏感性可能与饮食结构有关,高脂饮食可降低大鼠的甜味觉检测阈值,使其对甜味刺激的敏感性增加,从而更易于寻找和发现高能量食物,从而导致肥胖。
遗传因素也能影响个体的基础代谢率和食物的热效应及运动,即能量的消耗是受遗传因素影响的,个体间不同的能量消耗差异可以高达40%[21]。PAGLIASSOTTI等[22]已经揭示,OP大鼠具有较强的碳水化合物转化能力及合成储藏脂肪的能力,从而具有较高的饲料转化效能。CHANG等[23]研究显示,高脂喂养的OR大鼠24h呼吸商显著低于OP大鼠,表明OR大鼠脂肪氧化比例高,且能调节能量的使用,以便适应饮食中能量来源的变化,降低身体脂肪的积累。OR大鼠的自发活动水平比OP大鼠高,这可能是OR大鼠维持低体重的原因之一[24];OR大鼠的能量利用率低,这可能与其高水平的自发身体活动及快速脂肪转化有关[22]。ABDOULAYE 等[25]报道OR大鼠与OP大鼠比较,棕色脂肪功能较强。棕色脂肪的主要功能是通过产热维持体温,而体温的维持与能量平衡有关。产热及静息代谢率的增加也是OR低体重的原因之一。本实验的结果显示,高脂喂养的OP大鼠的能量总摄入以及食物转化效率均高于OR大鼠,这与PAGLIASSOTTI等[22]的研究是一致的。
综上,本研究结果表明高脂饮食可降低大鼠的甜味觉检测阈值,使其对甜味刺激的敏感性增加,从而更易于寻找和发现高能量食物。其中,高脂喂养的OP大鼠的能量总摄入以及食物转化效率均高于OR大鼠。高脂饮食诱发肥胖的一个可能机制是通过增加甜味敏感性来实现的。
[1]LOW S,CHIN MC,DEURENBERG-YAP M.Review on epidemic of obesity[J].Ann Acad Med Singapore,2009,38(1):57-59.
[2]STUNKARD AJ.Current views on obesity[J].Am J Med,1996,100(2):230-236.
[3]TSCHÖP M,HEIMAN ML.Rodent obesity models:an overview[J].Exp Clin Endocrinol Diabetes,2001,109(6):307-319.
[4]CLEGG DJ,BENOIT SC,REED JA,et al.Reduced anorexic effects of insulin in obesity-prone rats fed a moderate-fat diet[J].Am J Physiol Regul Integr Comp Physiol,2005,288(4):R981-986.
[5]LIN S,THOMAS TC,STORLIEN LH,et al.Development of high fat diet-induced obesity and leptin resistance in C57Bl/6J mice[J].Int J Obes Relat Metab Disord,2000,24(5):639-646.
[6]SHAFAT A,MURRAY B,RUMSEY D.Energy density in cafeteria diet induced hyperphagia in the rat[J].Appetite,2009,52(1):34-38.
[7]BUETTNER R,SCHÖLMERICH J,BOLLHEIMER LC.Highfat diets:modeling the metabolic disorders of human obesity in rodents[J].Obesity(Silver Spring),2007,15(4):798-808.
[8]LA FLEUR SE,VAN ROZEN AJ,LUIJENDIJK MC,et al.A free-choice high-fat high-sugar diet induces changes in arcuate neuropeptide expression that support hyperphagia[J].Int J Obes(Lond),2010,34(3):537-546.
[9]MARCO A,SCHROEDER M,WELLER A.Microstructural pattern of palatable food intake from weaning to adulthood in male and female OLETF rats[J].Behav Neurosci,2009,123(6):1251-1260.
[10]SAVASTANO DM,COVASA M.Adaptation to a high-fat diet leads to hyperphagia and diminished sensitivity to cholecystokinin in rats[J].J Nutr,2005,135:1953-1959.
[11]SALBE AD,DELPARIGI A,PRATLEY RE,et al.Taste preferences and body weight changes in an obesity-prone population[J].Am J Clin Nutr,2004,79:372-378.
[12]FIGLEWICZ DP,BENNETT JL,NALEID AM,et al.Intraventricular insulin and leptin decrease sucrose self-administration in rats[J].Physiol Behav,2006,89(4):611-616.
[13]FIGLEWICZ DP,JAY JL,ACHESON MA,et al.Moderate high fat diet increases sucrose self-administration in young rats[J].Appetite,2013,61(1):19-29.
[14]JOHNSON AW.Dietary manipulations influence sucrose acceptance in diet induced obese mice[J].Appetite,2012,58(1):215-21.
[15]SHIN AC,TOWNSEND RL,PATTERSON LM,et al.“Liking”and“wanting”of sweet and oily food stimuli as affected by high-fat diet-induced obesity,weight loss,leptin,and genetic predisposition[J].Am J Physiol Regul Integr Comp Physiol,2011,301(5):R1267-1280.
[16]LEVIN BE.Arcuate NPY neurons and energy homeostasis in diet-induced obese and resistant rats[J].Am J Physiol,1999,276(2 Pt 2):R382-387.
[17]CURTIS KS,STRATFORD JM,CONTRERAS RJ.Estrogen increases the taste threshold for sucrose in rats[J].Physiol Behavi,2005,86(3):281-286.
[18]LU B,YAN JQ,YANG XJ.Effects of sodium depletion on detection thresholds for salty taste in rats[J].Physiol Behav,2009,97(3-4):463-469.
[19]CLARKE SNDA,KOH MT,BERNSTEIN IL.NaCl detection thresholds:Comparison of Fischer 344 and Wistar rats[J].Chemical Senses,2001,26(3):253-257.
[20]LEVIN BE,TRISCARI J,SULLIVAN AC.Relationship between sympathetic activity and diet-induced obesity in two rat strains[J].Am J Physiol,1983,245(3):R364-371.
[21]VAN BAAK MA.Exercise training and substrate utilisation in obesity[J].Int J Obes,1999,23:S11-S17.
[22]PAGLIASSOTTI MJ,PAN D,PRACH P,et al.Tissue oxidative capacity,fuel stores and skeletal muscle fatty acid composition in obesity-prone and obesity-resistant rats[J].Obes Res,1995,3(5):459-464.
[23]CHANG S,GRAHAM B,YAKUBU F,et al.Metabolic differences between obesity-prone and obesity-resistant rats[J].Am J Physiol,1990,259(6 Pt 2):R1103-1110.
[24]TESKE JA,BILLINGTON CJ,KOTZ CM.Neuropeptidergic mediators of spontaneous physical activity and non-exercise activity thermogenesis[J].Neuroendocrinology,2008,87(2):71-90.
[25]ABDOULAYE D,WETZLER S,GOUBERN M,et al.Comparison of energy balance in two inbred strains of rats:Fischer F344 prone to obesity and Lou rats resistant to obesity[J].Physiol Behav,2006,87(2):245-250.
