促红细胞生成素对缺氧复氧心肌细胞caspase-3表达及Omi/HtrA2转位变化和Omi/HtrA2沉默时对其的影响
2015-02-18张杰波刘映峰
张杰波,刘映峰,缪 绯,刘 芃
(南方医科大学珠江医院心血管内科,广东广州 510282)
在急性心肌梗死患者的再灌注治疗中,现阶段所采用溶栓或冠脉介入治疗,都可能发生心肌缺血/再灌注 损 伤 (myocardial ischemia reperfusion injury,MIRI)。缺血/再灌注(I/R)的机制至今仍未完全阐明,临床上尚无有效的治疗方法。促红细胞生成素(EPO)的生物多效性已被广泛证实,在I/R、炎症、神经创伤等多种生物模型中,EPO具有明显组织保护作用,尤其见于MIRI[1-2]。本研究通过体外培养乳鼠心肌细胞株,建立H/R细胞损伤模型,观察EPO对细胞凋亡及Omi/HtrA2转位的影响,并用特异性siRNA干扰片段干扰Omi/HtrA2表达,以探讨Omi/HtrA2在EPO抗凋亡调控机制中的核心作用。
1 材料与方法
1.1 材料与试剂 H9C2细胞株(南方医科大学珠江医院实验室提供);胎牛血清、DMEM-高糖培养基、青霉素、PBS磷酸钾缓冲液、重组人促红素注射液(CHO细胞)购自山东科兴生物制品有限公司;cell-Titer96AQ单溶液细胞增殖检测试剂盒购自Promega Corporation;乳酸脱氢酶(LDH)细胞毒性检测试剂盒购自赛默飞世尔科技公司;cleaved caspase-3多抗、GAPDH 单抗、COX IV 单抗、Omi/HtrA2单抗购自Cell Signaling Technology;Pluslight ECL kit(ECL发光试剂盒)购自Forevergen bioscience;线粒体胞质分离试剂盒购自QIAGEN公司;HRP标记二抗购自永诺生物公司。Trizol购自Invitrogen;ReverTra Ace qPCR RT Kit购自 Toyobo Biochemicals(Japan);GoTaq®qPCR Master Mix购自Promega。
1.2 EPO对H9C2细胞缺氧-复氧的影响
1.2.1 实验分组 将H9C2细胞分为:①对照组(Ctrl):细胞用DMEM-高糖培养基正常培养26h,不作任何处理;②缺氧复氧组(H/R组):将待处理细胞、厌氧袋及氧气指示剂放入厌氧罐,将厌氧罐置于细胞培养箱,待氧气指示剂从浅紫色变成粉红色,开始计时缺氧时间,缺氧时间定为2h,重新将细胞放置培养箱即为复氧状态,复氧24h;③H/R+EPO组(EPO):同 H/R组缺氧处理2h后,分别加入5、10、20IU/mL的EPO,然后复氧24h。
1.2.2 细胞上清液LDH浓度的检测 各组细胞培养结束后,提取上清液按照LDH细胞毒性检测试剂盒说明书操作测量细胞LDH释放率:

1.2.3 Western blot检测cleaved caspase-3表达提取细胞蛋白,用Bradford法定量后,采用150g/L聚丙烯酰胺凝胶电泳后,将蛋白转至PVDF膜上,50 g/L脱脂牛奶封闭后,将相应的一抗cleaved caspase-3(cell signaling #9661,1∶1 000),4℃ 过夜后,用TBST每次7min洗2次后,用相应稀释好的二抗(HRP标记二抗,1∶5 000,Forevergen)室温下孵育1~2h,TBST每次7min洗涤3次后,进行化学发光显影(ECL,Forevergen)。用Image J分析目标条带的吸光度值。以GAPDH(HC301,1∶5 000)作为内参照,比较不同处理后的蛋白表达差异。
1.2.4 Western blot检测线粒体及细胞质 Omi/HtrA2蛋白表达 选取EPO 20IU/mL组细胞为实验对象,按照线粒体胞质分离试剂盒说明书,分离H9C2细胞胞质及线粒体,采用 Western blot检测线粒体和胞质中Omi/HtrA2蛋白。
1.3 si-HtrA2干扰细胞及对缺氧-复氧的影响
1.3.1 si-HtrA2细胞转染和干扰效果检测 si-HtrA2片段及对照片段[3-4]由上海吉玛制药技术有限公司设计合成,干扰序列:5′-GAGGTGATTGGAGTGAACACCATGA-3′,对 照 序 列:5′-AACAGTCGCGTTTGCGACTGG-3′。
采用小分子干扰脂质体法提前48h进行细胞转染,按Trizol试剂盒提供的操作步骤提取细胞总RNA,按照RT-PCR试剂盒进行cDNA逆转录及qPCR扩增操作。Omi/HtrA2上游引物为5′-AGTGCGAGTGAGGCTACCTA-3′,下游引物为5′-TGG CAACAACAAACTCCCCT-3′;GAPDH 作为内参,上游引物5′-GCAAGAGAGAG GCCCTCAG-3′,下游引物5′-TGTGAGGGAGATGCTCAGTG-3′。反应结束后,用 MiniOpticon System and Opticon Monitor软件进行qPCR的相对定量分析。收集蛋白用Western blot检测Omi/HtrA2蛋白表达水平以验证HtrA2的干扰效果。
1.3.2 Omi/HtrA2干扰处理及对LDH 和caspase-3的影响 成功转染48h后将细胞分组:①Ctrl组:转染对照片段,正常培养26h,不作任何处理;②H/R组:转染对照片段,缺氧2h,复氧24h;③si-HtrA2组:转染干扰片段,缺氧2h,复氧24h。各组细胞上清液LDH释放率及cleaved caspase-3表达的检测方法同前文1.2。
1.4 统计学处理 应用SPSS 13.0软件进行统计分析,计量资料进行正态性检验,符合正态分布以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用LSD法检验,P<0.05为差异有统计学意义。
2 结 果
2.1 EPO对LDH浓度的影响 H/R组细胞上清液LDH浓度较Ctrl组明显上升,EPO处理组较H/R组下降,随着EPO浓度的升高,LDH释放逐渐下降,各组间差异均有统计学意义(P<0.05,图1)。
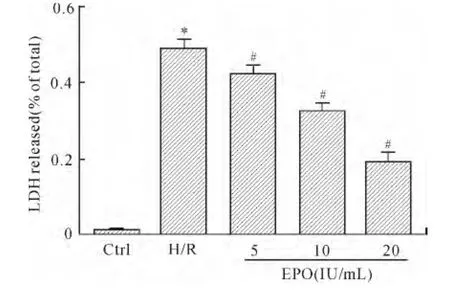
图1 各组细胞上清液LDH释放率Fig.1 The release rate of lactate dehydrogenase(LDH)in cell supernatant in all groups
2.2 EPO对细胞cleaved caspase-3表达的影响cleaved caspase-3在H/R组细胞中表达较Ctrl组升高(P<0.05),在EPO处理组中表达较 H/R组下降,且下降趋势具有浓度依赖关系,各组间差异均有统计学意义(P<0.05,图2)。

图2 EPO对培养细胞H9C2细胞的cleaved caspase-3表达的影响Fig.2 Effect of EPO on the expression of cleaved caspase-3 in cultured H9C2cell line
2.3 EPO对H9C2细胞胞质及线粒体Omi/HtrA2蛋白表达的影响 Ctrl组Omi/HtrA2蛋白主要在线粒体(Mito)中表达,在细胞胞质(Cyto)中表达较少;H/R组Omi/HtrA2蛋白表达在胞质中表达较多(向胞质发生转位);EPO(20IU/mL)组 Omi/HtrA2在线粒体中表达较多(向胞质转位减少),以上差异均有统计学意义(P<0.05,图3)。

图3 各组H9C2细胞胞质及线粒体Omi/HtrA2的相对表达水平Fig.3 Expression of Omi/HtrA2was measured in cytoplasm and mitochondria in H9C2
2.4 Omi/HtrA2干扰效果检测 H/R 组的 Omi/HtrA2蛋白和mRNA表达与Ctrl组相比无明显变化,差异无统计学意义(P>0.05,图4);干扰Omi/HtrA2组较Ctrl组及H/R组均明显减少,差异有统计学意义(P<0.05,图4)。提示si-HtrA2能有效干扰 Omi/HtrA2表达。

图4 Omi/HtrA2干扰时细胞Omi/HtrA2蛋白(A)和mRNA(B)表达的变化Fig.4 Expression of Omi/HtrA2(A)and mRNA (B)
2.5 干扰Omi/HtrA2后H/R细胞上清液LDH浓度的变化 H/R组细胞上清液LDH浓度较对照组明显上升,si-HtrA2组细胞较H/R组下降,各组间差异均有统计学意义(P<0.05,图5)。

图5 干扰Omi/HtrA2后H9C2细胞培养上清液LDH的释放率Fig.5 LDH release assay after silencing of Omi/HtrA2in cell supernatant
2.6 Omi/HtrA2干扰对细胞cleaved caspase-3表达的影响 H/R组细胞表达cleaved caspase-3较对照组升高(P<0.05),si-HtrA2组表达较 H/R组下降,各组间差异均有统计学意义(P<0.05,图6)。
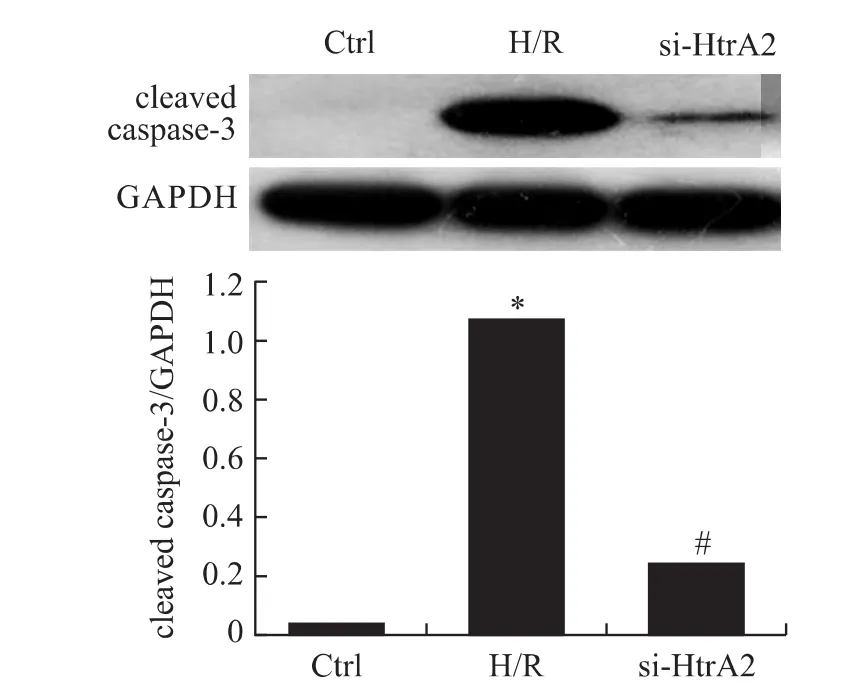
图6 各组细胞cleaved caspase-3的相对表达水平Fig.6 Relative expression level of cleaved caspase-3in different groups
3 讨 论
细胞凋亡是MIRI的重要机制,其凋亡过程受基因调控,主要由caspase级联反应过程控制。而caspase-3作为该级联反应共同的下游关键因子,执行死亡程序,被称为“杀手”蛋白。EPO是在人体肾脏及肝脏分泌的一种耐热酸性糖蛋白激素,它主要作用于红系祖细胞,促进其增生、分化和成熟,对体内红细胞的分化成熟发挥至关重要的作用。但近来研究发现,EPO具有抗氧化、抗凋亡、抗炎、促进上皮细胞增生等作用[5-7]。在以往的动物实验中,EPO被证实可以减轻急性心肌梗死大鼠模型的心肌梗死面积和透壁程度[8-9],BULLAR 等[9]在 大 鼠离体心缺 血35 min再灌注2h的实验中,发现EPO能够减少MIRI;CAI等[10]在大鼠离体心 MIRI实验中发现EPO能够促进心脏功能恢复,减少细胞凋亡。然而,EPO抗细胞凋亡的作用机制尚不明确。本研究中H9C2细胞经过H/R处理后LDH、caspase-3表达增加,而EPO可减少H/R细胞的LDH、caspase-3的表达,提示EPO对H/R诱导的H9C2心肌细胞凋亡有保护作用。
Omi/HtrA2蛋白是一种新发现的促凋亡蛋白,在细胞正常生理情况下存在于线粒体膜间隙,当细胞受到凋亡信号刺激时,包含458个氨基酸残基的完整Omi/HtrA2通过自我加工,去除N末端133个氨基酸残基的跨膜部分,形成成熟的 Omi/HtrA2[11],穿过线粒体膜进入胞质,通过与X-连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)结合,竞争性抑制XIAP与caspase-9的结合,进而激活处于下游的caspase-3蛋白表达。
成熟野生型Omi/HtrA2转位可以有效诱导caspases的活性以及增加XIAP的降解[12],而利用RNA干扰(RNA interference,RNAi)抑制 Omi/HtrA2的表达则可以出现相反的现象,进而抑制细胞凋亡。CILENTI等[13]发现,在用顺铂处理的肾细胞中Omi/HtrA2表达明显升高,且伴随着XIAP的含量降低。用RNAi技术破坏内生性Omi/HtrA2,顺铂介导的肾细胞凋亡明显减少。说明Omi/HtrA2在顺铂介导的肾细胞凋亡中起到重要作用,通过RNAi阻断Omi/HtrA2蛋白可减少凋亡。本实验结果显示,H/R组caspase-3蛋白及胞质中Omi/HtrA2蛋白表达较Ctrl组明显增强,EPO组caspase-3蛋白及胞质中Omi/HtrA2蛋白表达水平虽然高于Ctrl组,但较H/R组明显减少;H/R组细胞经RNAi干扰Omi/HtrA2后,LDH释放下降,caspase-3蛋白表达减少,提示当胞质中Omi/HtrA2蛋白减少,凋亡蛋白酶(caspase)激活受到抑制。这表明EPO在H/R心肌细胞中可能是通过抑制Omi/HtrA2蛋白从线粒体到胞质的转位,抑制caspases酶联反应,减少细胞凋亡的发生。这为临床MIRI的治疗提供了新的实验依据及干预靶点。
[1]SOLLING C.Organ-protective and immunomodulatory effects of erythropoietin—An update on recent clinical trials[J].Basic Clin Pharmacol Toxicol,2011,110(2):113-121.
[2]KOWALCZYK M,BANACH M,MIKHAILIDIS DP,et al.Erythropoietin update 2011[J].Med Sci Monitor,2011,17(11):RA240-RA247.
[3]PATZEL V,RUTZ S,DIETRICH I,et al.Design of siRNAs producing unstructured guide-RNAs results in improved RNA interference efficiency[J].Nat Biotechnol,2005,23(11):1440-1444.
[4]SHEN WG.RNA interference and its current application in mammals[J].Chinese Med J,2004,117(7):1084-1091.
[5]LOMBARDERO M,KOVACS K,SCHEITHAUER BW.Erythropoietin:a hormone with multiple functions[J].Pathobiology,2011,78(1):41-53.
[6]ISHII Y,SAWADA T,MURAKAMI T,et al.Renoprotective effect of erythropoietin against ischaemia reperfusion injury in a non-human primate model[J].Nephrol Dial Transpl,2011,26(4):1157-1162.
[7]CARRAWAY MS,SULIMAN HB,JONES WS,et al.Erythropoietin activates mitochondrial biogenesis and couples red cell mass to mitochondrial mass in the heart[J].Circ Res,2010,106(11):1722-1730.
[8]邱炯,赵玉伟,李法琦,等.促红细胞生成素对心肌缺血再灌注损伤大鼠心肌的保护作用[J].吉林大学学报:医学版,2012,38(5):912-917.
[9]BULLARD AJ,GOVEWALLA P,YELLON DM.Erythropoietin protects the myocardium against reperfusion injury in vitro and in vivo[J].Basic Res Cardiol,2005,100(5):397-403.
[10]CAI Z,SEMENZA GL.Phosphatidylinositol-3-kinase signaling is required for erythropoietin-mediated acute protection against myocardial ischemia/reperfusion injury[J].Circulation,2004,109(17):2050-2053.
[11]LI W,SRINIVASULA SM,CHAI J,et al.Structural insights into the pro-apoptotic function of mitochondrial serine protease HtrA2/Omi[J].Nat Struct Mol Biol,2002,9(6):436-441.
[12]SRINIVASULA SM,GUPTA S,DATTA P,et al.Inhibitor of apoptosis proteins are substrates for the mitochondrial serine protease Omi/HtrA2[J].J Biol Chem,2003,278(34):31469-31472.
[13]CILENTI L,KYRIAZIS GA,SOUNDARAPANDIAN MM,et al.Omi/HtrA2 protease mediates cisplatin-induced cell death in renal cells[J].Am J Physiol Renal Physiol,2005,288(2):F371-F379.
