急性游泳运动对高脂膳食诱导肥胖小鼠海马小胶质细胞激活、炎症反应及氧化应激的影响
2015-02-14张宪亮彭海霞
张宪亮,徐 波,彭海霞,贺 强,何 标,季 浏
急性游泳运动对高脂膳食诱导肥胖小鼠海马小胶质细胞激活、炎症反应及氧化应激的影响
张宪亮1,2,徐 波1,2,彭海霞2,贺 强1,何 标2,季 浏1,2
目的:探讨急性游泳运动对高脂膳食诱导肥胖小鼠海马小胶质细胞活化、炎症反应及氧化应激的影响。方法:采用8周高脂膳食干预诱导C57BL/6小鼠肥胖模型,造模成功后随机分为安静对照组(SC)、运动对照组(EC),安静肥胖组(SO)和运动肥胖组(EO),EC和EO分别进行急性游泳运动。运动后8 h后取海马,用RT-PCR检测4组小鼠海马内炎症因子(TNF-α、 IL-1-β、IL-6、IL-10)mRNA表达;试剂盒检测海马内NO、MDA、SOD水平;流式细胞仪分析小鼠海马内活化的小胶质细胞数量。结果:1)8周高脂膳食诱导小鼠体重极显著性增加(P<0.01)、糖耐量显著性下降(P<0.05)。2)与SC组比较,SO组TNF-α、IL-6 mRNA表达极显著提高(P<0.01),EC组IL-10极显著性降低(P<0.01);与SO组比较,EO组TNF-α、IL-1β极显著性降低,IL-6显著性降低(P<0.05)。3)与SC组比较,SO组NO含量极显著性提高(P<0.01),MDA含量显著性提高(P<0.05),SOD和Mn-SOD活力显著性降低;与SO组比较,EO组NO含量显著性降低(P<0.05),SOD活力极显著性提高(P<0.01),Mn-SOD活力显著性提高(P<0.05)。4)与SC组比较,SO组海马内CD11b+/CD45hi细胞与CD11b+/CD45lo细胞比值极显著上调(P<0.01),与SO组比较,EO组海马内CD11b+/CD45hi细胞与CD11b+/CD45lo细胞比值显著性下调(P<0.05)。结论:急性游泳运动抑制了高脂膳食诱导肥胖小鼠海马内小胶质细胞的激活、减少了炎症反应,降低了氧化应激。
急性游泳运动;小胶质细胞;炎症反应;氧化应激;一氧化氮
引言
目前,全世界约有10亿人伴有超重或肥胖等症状,肥胖已经成为一个公共健康问题[29]。肥胖不但是糖尿病、高血压、中风、心脏病等疾病的独立危险因素,也损害了脑认知功能,加剧了阿尔茨海默病等神经退行性疾病的发病风险[3]。回顾以往的研究发现,胰岛素抵抗可能是高脂膳食诱导脑认知功能下降的原因之一[12,17,30]。近10年来,研究证实,肥胖与长期的慢性炎症密切相关,这种亚急性炎症反应可能通过循环系统等特异性组织的白介素或细胞因子的高表达参与了肥胖介导的并发症的发生发展[13]。
近来,一些研究人员开始研究高脂膳食对神经炎症及认知功能的影响。Pistell等[28]发现,高脂膳食损害了脑认知功能,并发现其与脑内炎症反应加剧及BDNF水平降低有关。Thirumangalakudi等[31]发现,8周高脂膳食激活了脑内小胶质细胞,增加了海马内促炎因子(TNF-α、IL-1-β、 IL-6)表达,损害了小鼠空间记忆能力。 Freeman等[9]也发现,高饱和脂肪酸膳食、高不饱和脂肪酸膳食和高胆固醇膳食均可以激活小胶质细胞,诱发炎症反应,改变海马形态,其中高饱和脂肪酸膳食影响最大。小胶质细胞是中枢神经系统内一种静息态的巨噬细胞,其对微环境变化较为敏感,介导了神经炎症反应。高脂膳食可以导致胞体较小、分枝较细的静息态小胶质细胞向胞体较大、分枝较多的可分泌促炎因子的活化态小胶质细胞转变,增加促炎因子或细胞因子等的表达,诱发炎症反应[11]。因此,小胶质细胞激活可能是高脂膳食诱导海马内长期慢性炎症反应的关键过程。
高脂膳食可以激活海马小胶质细胞,诱导炎症反应,但目前并不清楚是否可以逆转高脂膳食诱导的海马内小胶质细胞激活。研究发现,适宜的体育运动可以减轻由衰老[6]、中风[2]、高血压[19]等引起的脑内炎症反应,但目前并无运动对高脂膳食诱导海马炎症反应影响的研究。仅有Yi等[37]通过对低密度脂蛋白受体(low-density lipoprotein receptor deficient,ldlr-/-)敲除鼠进行高脂膳食,随后进行26周的跑台运动干预,并采用免疫组织化学方法检测下丘脑Iba阳性表达细胞,发现运动可以逆转高脂膳食诱导的下丘脑小胶质细胞激活及炎症反应。因此,本实验推测,运动可以抑制高脂膳食诱导的海马炎症反应,拟通过8周高脂膳食建立肥胖模型,随后进行急性游泳训练,训练后6~12 h内采用流式细胞仪检测海马内小胶质细胞激活情况,并通过RT-PCR检测海马内炎症因子(TNF-α、 IL-1-β、IL-6、IL-10)mRNA表达,同时检测海马内NO水平及氧化应激水平,探讨急性游泳运动对高脂膳食诱导肥胖模型海马内小胶质细胞激活、炎症反应及氧化应激的影响。
1 材料和方法
1.1 动物和分组
5周龄健康雄性C57BL/6小鼠80只,购于华东师范大学实验动物中心,许可证号:SCXK(沪)2008-0016。适应性饲养1周,分笼饲养,温度25±2℃,光照时间12 h左右,自由饮食饮水。随机选取40只喂普通饲料,40只喂高脂饲料,8周膳食干预后,从普通膳食小鼠中选取12只体重正常小鼠(对照组,C),从高脂膳食小鼠中选取12只体重增量较大小鼠(肥胖组,O,约占总数的1/3),禁食12 h后进行糖耐量实验。随后将C组分为安静对照组(SC,n=6)和运动对照组(EC,n=6);将O组分为安静肥胖组(SO,n=6)和运动肥胖组(EO,n=6)[14]。实验所用普通饲料和高脂饲料均由上海市斯莱克动物实验中心提供,其中,普通饲料含水9.2%、粗蛋白21.1%、粗脂肪5.28%、粗灰粉5.2%、粗纤维4.12%及其他无机盐及必须氨基酸等;高脂饲料含54.6%普通饲料,另添加猪油16.9%、蔗糖14%、预混料2.1%、酪蛋白10.2%及麦芽糊精2.2%。
1.2 糖耐量实验
在运动前,将C组和O组禁食12 h后,腹腔注射20%葡萄糖(10 ml/10 g体重),在注射后即刻、30 min、60 min、90 min、120 min,通过尾静脉取血,用血糖试纸测定血糖浓度。
1.3 运动方案
运动对照组和运动肥胖组小鼠分别进行急性游泳训练[16],具体方案:将两组小鼠置于直径约为45 cm的玻璃容器内,水温约为32℃~33℃,首先适应性游泳10 min,为期2天,以适应水环境应激。第3天开始正式游泳运动,两组小鼠以游泳30 min-休息5 min-游泳30 min-休息5 min……进行游泳运动,进行4个循环,共计游泳2 h。运动结束后2 h内自由饮食、饮水,随后禁食禁水,运动后8 h开始取材。
1.4 取材
腹腔注射1%戊巴比妥钠(50 mg/kg)麻醉小鼠,将其固定于手术台上,打开胸腔,暴露心脏,从心脏左心室尖处灌注0.9%的生理盐水,取全脑,分离左、右侧海马组织。左侧海马用于RT-PCR、NO及氧化应激实验,右侧海马用于流式细胞实验。
1.5 RT-PCR
取适量海马组织,Trizol法提取细胞总RNA,测其OD260/OD280在1.80~2.00之间。以20 μl体系,以37℃,15 min,98 ℃,5 min进行PCR,逆转录得到稳定的cDNA,-20℃长期保存。根据RT-PCR试剂盒说明:加入10 μL SYBR green PCR MasterMix,ROX 0.4 μL,2 μL cDNA,上、下游引物各0.04 μL,补充dH2O至20 μL。TNF-α:上游引物:5′-CTG AAC TTC GGG GTG ATC GGT-3′,下游引物:5′-TCC TCC ACT TGG TGG TTT GCT AC-3′;IL-1β:上游引物:5′-TCC AGG ATG AGG ACA TGA GCAC-3′,下游引物:5′-GAA CGT CAC ACA CCA GCA GGT TA-3′;IL-6:上游引物:5′-GCT GAC CTC TGG ACG CTT AG-3′,下游引物:5′-GGG AGA TGC TTT TGT TCC AA-3′;IL-10:上游引物:5′-CCA GGG AGA TCC TTT GAT GA-3′,下游引物:5′-CAT TCC CAG AGG AAT TGC AT-3′; GAPDH上游引物:5′-ATG GTG AAG GTC GGT GTG-3′,下游引物:5′-AAC TTG CCG TGG GTA GAG-3′。按照RT-PCR扩增循环参数:预变性95 ℃,60 s;以95 ℃,15 s;60 ℃,30 s;72 ℃,45 s为一循环,进行40个循环,72℃末段延伸5 min。溶解曲线,从60℃~95℃,每升高1 ℃收集一次荧光。记录Ct值,根据2-△△Ct法计算相对表达量。
1.6 NO含量、MDA含量和SOD活力检测
将海马在PBS中漂洗,滤纸拭干后称重,取适量海马,放入研磨管中,按重量体积比1∶9加入PBS制成10%的组织匀浆液,4℃,1 600 g离心10 min,取上清,用BCA蛋白浓度测定试剂盒测定蛋白浓度(碧云天,P0009)。
取适量脑组织匀浆液,根据一氧化氮检测试剂盒(碧云天,S0021)检测NO含量。
取适量脑组织匀浆液,根据脂质氧化(MDA)检测试剂盒(碧云天,SO131)检测MDA含量。
取适量脑组织匀浆液,根据CuZn/Mn-SOD活性检测试剂盒(碧云天,SO103)检测总SOD、Mn-SOD活力。
1.7 流式细胞仪分析小胶质细胞
将右侧海马组织置于buffer A(1×DPBS+0.5%BSA)中剪碎,转移至50 ml离心管,加入papain(Worthington公司)(PIPES+L-cystein-HCL+EDTA+8U/ml papain+80U/ml DNaseⅠ)消化液,37℃恒温水浴锅孵育消化50 min,加入buffer A反复吹打,使用70 μm滤膜过滤细胞悬液,1 000 g,4℃,离心15 min,弃上清。加入FACS buffer(1×DPBS +2 mM EDTA+1%胎牛血清),4℃,1 000 g,离心10 min。使用30%Percoll重悬细胞,700 g离心10 min,去除髄磷脂,FACS buffer冲洗,离心,用FACS buffer重悬,即为单细胞悬液[22]。20 μg/ml Fc-Block抗体4℃孵育细胞20 min,小鼠CD11b-PE、CD45-APC荧光标记流式抗体暗室孵育细胞20 min。美国BD FACS CantoII型流式细胞仪分离CD11b+/CD45+细胞(小胶质细胞)。
1.8 数据处理
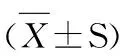
2 结果
2.1 高脂膳食对小鼠体重及葡萄糖耐量的影响
80只C57BL/6小鼠在适应性饲养后随机分为两组,分别进行普通膳食和高脂膳食干预,8周膳食干预后,随机从两组选出体重正常者(对照组)和体重增量较大者(肥胖组),两组小鼠体重出现极显著性差异(P<0.01,图1 A)。随后,分别对两组小鼠禁食12 h后,通过糖耐量实验发现,对照组小鼠血糖浓度在注射葡萄糖后即刻(P<0.01)、30 min(P<0.01)、60 min(P<0.05)、90 min(P<0.05)、120 min(P<0.05)均显著低于肥胖组小鼠血糖浓度,提示,肥胖组葡萄糖耐量受损(图1 B)。
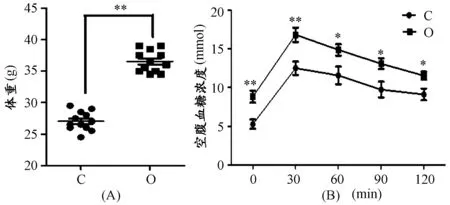
图1 本研究高脂膳食对小鼠体重及葡萄糖耐量的影响示意图
注:A.两组小鼠体重比较.B 空腹注射葡萄糖后两组小鼠血糖水平比较.与C组比较,*P<0.05,**P<0.01。
2.2 急性游泳运动对肥胖小鼠海马内炎性因子mRNA表达的影响
本实验通过RT-PCR检测小鼠海马内炎性因子TNF-α、IL-1β、IL-6及IL-10的mRNA表达,发现与SC组比较,SO组TNF-α、IL-6 mRNA表达极显著提高(P<0.01),EC组IL-10极显著性降低(P<0.01);与SO组比较,EO组TNF-α、IL-1β极显著性降低,IL-6显著性降低(P<0.05,图 2)。
2.3 急性游泳运动对高脂膳食诱导肥胖小鼠海马内NO及氧化应激的影响
本实验发现,高脂膳食增加了海马NO含量,诱导了海马氧化应激,而运动可以逆转这种现象。如图3 A所示,高脂膳食增加了海马区NO含量(P<0.01),而运动可以抑制高脂膳食诱导的海马NO水平上调(P<0.05)。图3 B显示,高脂膳食可以显著增加海马内MDA水平(P<0.05),运动也会减少肥胖小鼠海马内MDA含量的增加,但是并没有显著性差异(P>0.05)。图3 C证实,高脂膳食降低了海马内总SOD和Mn-SOD的活力(P<0.05),急性游泳运动可以增加肥胖小鼠海马内总SOD和Mn-SOD的活力(P<0.01)。

图2 本研究运动对肥胖小鼠海马内炎症因子mRNA表达的影响柱状图
注:本实验通过RT-PCR检测了小鼠海马内TNF-α、IL-1β、IL-6及IL-10等炎症因子的mRNA表达。与SC组比较,*P<0.05,**P<0.01;与SO组比较,#P<0.05,##P<0.01。

图3 本研究运动对肥胖小鼠海马内NO含量和氧化应激水平的影响柱状图
注:本实验通过NO、MDA、SOD检测试剂盒(碧云天)检测了海马内NO含量、MDA含量和SOD活力。A.各组小鼠NO含量比较,B.各组小鼠MDA含量比较,C.各组小鼠SOD、Mn-SOD活力比较.与SC组比较,*P<0.05,**P<0.01;与SO组比较,#P<0.05,##P<0.01。
2.4 急性游泳运动对高脂膳食诱导肥胖小鼠海马内小胶质细胞激活的影响
本实验采用流式细胞仪检测了海马内的CD11b和CD45阳性细胞数量。实验发现两簇细胞群,分别为CD11b+/CD45lo和CD11b+/CD45hi细胞。CD11b+在脑内可以用于标记小胶质细胞,而CD45在小胶质细胞内的表达依赖于小胶质细胞的激活情况,如静息态小胶质细胞低表达CD45(CD45lo),而活化态小胶质细胞高表达CD45(CD45hi)[38]。因此,CD11b+/CD45lo和CD11b+/CD45hi细胞分别代表了静息态的小胶质细胞和活化态小胶质细胞。结果显示,与SC组比较,SO组海马内CD11b+/CD45hi细胞与CD11b+/CD45lo细胞比值显著上调,而与SO组比较,EO组海马内CD11b+/CD45hi细胞与CD11b+/CD45lo细胞比值显著性下调。提示,高脂膳食可以显著性激活海马内小胶质细胞,而急性游泳运动可以逆转高脂膳食诱导的小胶质细胞激活(图4)。
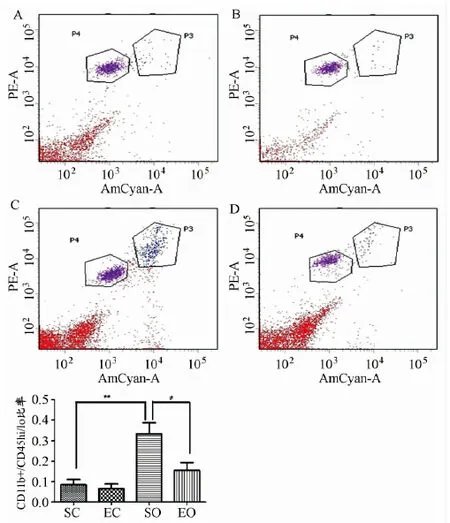
图4 本研究运动对肥胖小鼠海马内CD11b+/CD45lo和CD11b+/CD45hi细胞数量的影响示意图
注:PE-A代表CD11b,AmCyan-A代表CD45,P3代表CD11b+/CD45hi,P4代表CD11b+/CD45lo。A:SC组,B:EC组,C:SO组,D:EO组,E:各组CD11b+/CD45hi细胞与CD11b+/CD45lo细胞比值,与SC组比较,**P<0.01;与SO组比较,#P<0.05。
3 讨论
本实验证实,长期高脂膳食激活了海马内小胶质细胞,诱导了海马炎症反应,而急性游泳运动可以逆转高脂膳食诱导的海马炎症反应。先前有研究发现,运动可以逆转长期高脂膳食诱导的脑认知功能下降[23],并发现其与海马内BDNF表达及其信号通路密切相关[20,35]。近来有研究证实,高脂膳食可以激活海马小胶质细胞,诱导炎症反应[7],但是,目前并无运动对高脂膳食诱导肥胖小鼠海马内小胶质细胞激活的研究。本实验发现,急性游泳运动对高脂膳食诱导肥胖小鼠海马内炎症反应的逆转效应可能与小胶质细胞激活有关。
3.1 高脂膳食诱导小鼠肥胖模型
肥胖不仅可以诱导高血压、心脏病等慢性疾病,也可以诱导脑炎症反应,降低脑功能,然而,诱发机体肥胖的因素错综复杂,包括遗传、饮食、生活方式等,其中,高脂膳食诱导的肥胖模型与人类自然肥胖最为接近,是一种常见的肥胖模型。由于动物对高脂膳食反应并不一致,高脂膳食造肥胖模型存在“肥胖型”和“肥胖抵抗型”。因此,本研究将小鼠随机分别喂养普通膳食和高脂膳食8周后,分别从两组中选取体重正常和体重增量较多者作为研究对象(C和O)。通过统计分析发现,两组小鼠体重具有极显著性差异。同时通过糖耐量实验发现,O组小鼠血糖在注射葡萄糖后2 h内血糖浓度均显著高于对照组。提示,8周高脂膳食增加了小鼠体重,损害其糖耐量,8周高脂膳食造肥胖模型成功[14]。
3.2 急性游泳运动对高脂膳食诱导肥胖小鼠海马内炎症反应的影响
肥胖不仅可以引起外周组织慢性炎症反应,也可以诱导中枢神经系统(尤其是海马)神经炎性反应[8]。Thirumangalakudi等[3]发现,8周高脂/高胆固醇膳食增加了C57BL/6小鼠和LDLR敲除鼠海马内炎症因子TNF-α,IL-1-β,IL-6和一氧化氮合酶(nitric oxide synthase 2,NOS2)表达,诱导了海马神经炎性反应。本实验发现,8周的高脂膳食增加了海马内TNF-α、IL-6 mRNA表达,提示8周高脂膳食诱导了海马内神经炎性反应,与上述研究一致。但也有研究发现,高脂膳食并没有引起海马内的神经炎性反应[18]。研究结果出现矛盾原因可能为实验所用动物不同、高脂膳食开始干预时间不同或膳食中脂肪、胆固醇等的比例不同所致。如Boitard等[4]发现,青少年期(3周龄)进行高脂膳食可以诱导大鼠海马内神经炎性反应,而成年期(12周龄)进行高脂膳食并不能诱导其神经炎性反应。Pistell等[28]证实,60%脂肪含量的高脂膳食增加了脑内炎症反应,而40%脂肪含量的高脂膳食并没有导致炎症反应。而本实验采用5周龄C57BL/6小鼠,发现添加猪油和蔗糖的高糖高脂饲料可以诱导小鼠海马内炎症反应。
另外,本实验首次发现,急性游泳运动可以抑制肥胖小鼠海马内TNF-α、IL-1β、IL-6 mRNA表达的增加,提示,急性游泳运动可以抑制高脂膳食诱导的海马神经炎症反应。目前研究已经证实,运动可以抑制高脂膳食诱导肥胖模型认知功能的下降,其机制主要涉及到NGF、BDNF等营养因子、Akt、MAPK、CREB等信号通路及突触可塑性等[20,21,23,35],但并无运动对高脂膳食诱导海马炎症反应影响的研究。因此,本实验通过RT-PCR检测了小鼠海马内的TNF-α、IL-1β、IL-6、IL-10的mRNA表达,发现急性运动降低了高脂膳食诱导海马内的TNF-α、IL-1β、IL-6表达,提示,运动可以抑制高脂膳食诱导的海马炎症反应,推测其也可能是运动提高肥胖小鼠认知能力的原因,但是,本研究并没有检测其空间记忆能力。
此外,Pervaiz等[27]研究发现,急性跑台运动可降低野生型小鼠海马内TNF-α、IL-6等蛋白表达水平,减少炎症反应。而本实验中急性游泳运动并没有改变对照组小鼠海马内TNF-α、IL-1β、IL-6 mRNA表达,其原因可能与运动方式、运动强度不同,或实验选取动物年龄不同,或者所用检测方法不同有关。令人意外的是,本实验还发现,急性游泳训练显著性降低了对照组小鼠海马内IL-10的mRNA表达,IL-10是一种抗炎因子,可通过抑制Kupffer细胞(库普弗细胞)的激活和其他炎症介质、自由基、NF-κB等起到抗炎效应。本实验发现,急性游泳运动抑制了肥胖小鼠海马内炎症反应,却降低了正常小鼠的抗炎能力。推测其原因可能为IL-1β、IL-6、IL-10等炎症因子之间可以相互作用[25],IL-10的降低可能是由其他炎症因子的相互作用造成的。
3.3 急性游泳运动对高脂膳食诱导肥胖小鼠海马内氧化应激及NO水平的影响
另外,长期高脂膳食也可导致脑内氧化应激水平提高[10]。本研究中,8周高脂膳食减少了海马超氧化物歧化酶(superoxide dismutase,SOD)及Mn-SOD活力,增加了海马MDA含量。机体抗氧化能力由酶促和非酶促两类抗氧化体系组成,抗氧化酶系包括SOD、CAT等,其中,SOD活力最强,作用最为广泛。在生物体内,由于脂质过氧化反应的增强及机体抗氧化能力的减弱,导致机体大量自由基生成,反应终产物MDA含量增多,诱发细胞内蛋白质、核酸等交联聚合,破坏细胞结构和功能。Alzoubi等[1]发现,高脂膳食可以抑制海马内SOD活力,损害脑抗氧化能力。White等[34]发现,8周高脂膳食后SD大鼠脑内MDA含量显著性增加,氧化应激反应加剧。本实验不但检测了总SOD活力,也检测了Mn-SOD活力,同时检测了MDA含量,结合先前研究得出,长期高脂膳食可加剧海马内氧化应激反应。
本实验也检测了游泳运动对高脂膳食肥胖小鼠海马内总SOD、Mn-SOD和MDA水平的影响,发现急性游泳运动抑制了高脂膳食诱导的海马内SOD、Mn-SOD活力下降。在一项阿尔茨海默病(Alzheimer’s disease, AD)动物模型的研究中发现,跑台运动上调了AD小鼠海马内SOD1和SOD2活力,抑制其氧化应激水平[33]。结合本实验结果,提示,运动可通过提高海马抗氧化能力,减轻高脂膳食诱导的氧化应激水平。
此外,本实验发现,高脂膳食增加了海马内NO水平,而急性游泳运动可以抑制高脂膳食诱导的海马内NO水平增多。NO可以与O2—反应产生过氧亚硝酸盐等活性氮,损伤DNA、脂质、蛋白质等,引起脑功能紊乱[36]。有研究发现,急性运动可通过IR/IRS1/Akt信号通路降低高脂膳食诱导的肌肉内iNOS表达增加[26]。但目前并无运动对高脂膳食诱导肥胖小鼠海马内NO含量的研究,本实验结果表明,急性游泳运动可通过减少NO含量来抵制高脂膳食对脑结构和功能的损害。
3.4 急性游泳运动对高脂膳食诱导肥胖小鼠海马内小胶质细胞激活的影响
高脂膳食可诱导海马炎症反应、氧化应激,但其具体机制不甚清楚。近来一些证据显示,高脂膳食激活了海马内小胶质细胞,促使其产生大量炎症因子、NO等,诱导炎症反应。Hwang等[15]通过免疫组织化学实验发现,高脂膳食增加了C57BL/6小鼠脑内的Iba-1+细胞,上调了促炎因子表达,提示,高脂膳食可以激活脑内小胶质细胞,诱导脑内炎症反应。Buckman等[7]采用GFP转基因小鼠作为研究对象,通过流式细胞仪分析发现,高脂膳食小鼠脑内GFP+细胞增多,而80%的GFP+细胞同时标记有CD11b、CD45蛋白。提示,高脂膳食促进外周免疫细胞进入中枢神经系统转变为活化态小胶质细胞。本实验采用流式细胞仪分析CD11b+/CD45+细胞发现,CD11b+/CD45lo和CD11b+/CD45hi两簇细胞团,由于CD45在小胶质细胞的表达情况依赖于小胶质细胞的活化状况[38]。因此,CD11b+/CD45hi与CD11b+/CD45lo比值可以代表小胶质细胞的活化情况。本实验发现,高脂膳食显著性上调了CD11b+/CD45hi与CD11b+/CD45lo比值。提示,高脂膳食增加了活化态小胶质细胞数量,促使其分泌更多的炎性因子及NO,诱导炎症反应。本研究还发现,急性游泳运动可以显著性抑制高脂膳食诱导的CD11b+/CD45hi/CD11b+/CD45lo比值上调,减少海马内活化的小胶质细胞数量,但并没有进行相关机制研究。有研究发现,高脂膳食可扰乱血脑屏障,外周相关因子通过血液循环穿过受损的血脑屏障,激活小胶质细胞[32],诱导炎症反应、氧化应激。而运动可能通过改善血脑屏障,阻止外周刺激因子进入脑内激活小胶质细胞。另外, Buckman等[7]发现,高脂膳食诱导的活化态小胶质细胞数量的增多源自于外周免疫细胞,因此,推测运动也可能通过抑制进入脑内的外周免疫细胞数量减少活化态小胶质细胞数量,抑制炎症反应。
小胶质细胞是正常生理状态下脑内的巨噬细胞,即发挥免疫调节功能、也参与脑内慢性炎症反应。小胶质细胞的过度激活及大量促炎因子的释放可导致脑内环境失调,诱导认知障碍等。研究发现,小胶质细胞存在多种激活表型,其与激活后释放的促炎和抗炎因子密切相关[24]。主要分为两种:M1型为经典激活型,主要产生氧化应激产物和促炎细胞因子,引起炎症损伤,标记物包括IL-6、CCL3等;M2型为选择激活型,其功能与抑制免疫炎症反应和促进组织修复有关,标记物包括IL-10、CCL1、CCL22等[5]。本实验通过RT-PCR检测了海马内的IL-6和IL-10的基因表达情况,发现高脂膳食增加了IL-6表达,而急性游泳运动可以抑制IL-6表达的增加。提示,高脂膳食诱导了M1型小胶质细胞数量增加,而运动可以抑制高脂膳食诱导的M1型小胶质细胞增加。但是,本实验仅用RT-PCR检测了海马内的M1型标记物(IL-6)和M2型标记物(IL-10)的表达情况,并不能够完全代表M1型和M2型小胶质细胞。今后应该通过免疫荧光双染色同时标记IL-6+/Iba+细胞和IL-10+/Iba+细胞,或通过流式细胞仪分选IL-6+/CD11b+细胞和IL-10+/CD11b+细胞,或者通过免疫磁珠分离小胶质细胞,检测小胶质细胞内的IL-6和IL-10的mRNA表达及蛋白表达等方法,以确定运动对高脂膳食诱导肥胖小鼠小胶质细胞不同表型的影响。
4 结论
本研究证实,高脂膳食增加了活化态小胶质细胞数量,上调了炎症因子表达,诱导了氧化应激,而急性游泳运动可以抑制高脂膳食诱导的海马小胶质细胞激活,但其具体机制不甚清楚,有待进一步研究。
[1]ALZOUBI K H,KHABOUR O F,SALAH H A,etal.Vitamin E prevents high-fat high-carbohydrates diet-induced memory impairment:the role of oxidative stress[J].Physiol Behav,2013,119:72-78.
[2]AUSTIN M W,PLOUGHMAN M,GLYNN L,etal.Aerobic exercise effects on neuroprotection and brain repair following stroke:a systematic review and perspective[J].Neurosci Res,2014,87:8-15.
[3]BEYDOUN M A,BEYDOUN H A,WANG Y.Obesity and central obesity as risk factors for incident dementia and its subtypes:a systematic review and meta-analysis [J].Obes Rev,2008,9(3):204-218.
[4]BOITARD C,CAVAROC A,SAUVANT J,etal.Impairment of hippocampal-dependent memory induced by juvenile high-fat diet intake is associated with enhanced hippocampal inflammation in rats[J].Brain Behav Immun,2014,40:9-17.
[5]BRAMBILLA P,BELLNI M,ISOLA M,etal.Increased M1/decreased M2 signature and signs of Th1/Th2 shift in chronic patients with bipolar disorder,but not in those with schizophrenia[J].Transl Psychiatry,2014,4:e406.
[6]BRASKIE M N,BOYLE C P,RAJAGOPALAN P,etal.Physical activity,inflammation,and volume of the aging brain[J].Neuroscience,2014,273:199-209.
[7]BUCKMAN L B,HASTY A H,FLAHERTY D K,etal.Obesity induced by a high-fat diet is associated with increased immune cell entry into the central nervous system[J].Brain Behav Immun,2014,35:33-42.
[8]DINEL A L,ANDRE C,AUBERT A,etal.Cognitive and emotional alterations are related to hippocampal inflammation in a mouse model of metabolic syndrome[J].PLoS One,2011,6(9):e24325.
[9]FREEMAN L R,HALEY-ZITLIN V,STEVENS C,etal.Diet-induced effects on neuronal and glial elements in the middle-aged rat hippocampus[J].Nutr Neurosci,2011,14(1):32-44.
[10]FREEMAN L R,ZHANG L,NAIR A,etal.Obesity increases cerebrocortical reactive oxygen species and impairs brain function[J].Free Radic Biol Med,2013,56:226-233.
[11]GRANHOLM A C,BIMONTE-NELSON H A,MOORE A B,etal.Effects of a saturated fat and high cholesterol diet on memory and hippocampal morphology in the middle-aged rat[J].J Alzheimers Dis,2008,14(2):133-145.
[12]GREENWOOD C E,WINOCUR G.High-fat diets,insulin resistance and declining cognitive function [J].Neurobiol Aging,2005,26 Suppll:42-45.
[13]HOTAMISLIGIL G S.Endoplasmic reticulum stress and the inflammatory basis of metabolic disease[J].Cell,2010,140(6):900-917.
[14]HU C C,QING K,CHEN Y.Diet-induced changes in stearoyl-CoA desaturase 1 expression in obesity-prone and -resistant mice[J].Obes Res,2004,12(8):1264-1270.
[15]HWANG I K,KIM I Y,KIM Y N,etal.Comparative study on high fat diet-induced 4-hydroxy-2E-nonenal adducts in the hippocampal CA1 region of C57BL/6N and C3H/HeN mice[J].Neurochem Res,2009,34(5):964-972.
[16]LIMA A F,ROPELLE E R,PAULI J R,etal.Acute exercise reduces insulin resistance-induced TRB3 expression and amelioration of the hepatic production of glucose in the liver of diabetic mice[J].J Cell Physiol,2009,221(1):92-97.
[17]LUCHSINGER J A,TANG M X,SHEA S,etal.Caloric intake and the risk of Alzheimer disease[J].Arch Neurol,2002,59(8):1258-1263.
[18]MARIC T,WOODSIDE B,LUHESHI G N.The effects of dietary saturated fat on basal hypothalamic neuroinflammation in rats[J].Brain Behav Immun,2014,36:35-45.
[19]MASSON G S,COSTA T S,YSHII L,etal.Time-dependent effects of training on cardiovascular control in spontaneously hypertensive rats:role for brain oxidative stress and inflammation and baroreflex sensitivity[J].PLoS One,2014,9(5):e94927.
[20]MOLTENI R,WU A,VAYNMAN S,etal.Exercise reverses the harmful effects of consumption of a high-fat diet on synaptic and behavioral plasticity associated to the action of brain-derived neurotrophic factor[J].Neuroscience,2004,123(2):429-440.
[21]MULLER A P,CAMMAROTA M,DIETRICH M O,etal.Different effect of high fat diet and physical exercise in the hippocampal signaling[J].Neurochem Res,2008,33(5):880-885.
[22]NIKODEMOVA M,WATTERS J J.Efficient isolation of live microglia with preserved phenotypes from adult mouse brain[J].J Neuroinflammation,2012,9:147.
[23]NOBLE E E,MAVANJI V,LITTLE M R,etal.Exercise reduces diet-induced cognitive decline and increases hippocampal brain-derived neurotrophic factor in CA3 neurons[J].Neurobiol Learn Mem,2014,114:40-50.
[24]OLAH M,BIBER K,VINET J,etal.Microglia phenotype diversity[J].CNS Neurol Disord Drug Targets,2011,10(1):108-118.
[25]OSTRAND-ROSENBERG S,SINHA P,BEURY D W,etal.Cross-talk between myeloid-derived suppressor cells (MDSC),macrophages,and dendritic cells enhances tumor-induced immune suppression[J].Semin Cancer Biol,2012,22(4):275-281.
[26]PAULI J R,ROPELLE E R,CINTRA D E,etal.Acute physical exercise reverses S-nitrosation of the insulin receptor,insulin receptor substrate 1 and protein kinase B/Akt in diet-induced obese Wistar rats[J].J Physiol,2008,586(2):659-671.
[27]PERVAIZ N,HOFFMAN-GOETZ L.Immune cell inflammatory cytokine responses differ between central and systemic compartments in response to acute exercise in mice[J].Exerc Immunol Rev,2012,18:142-157.
[28]PISTELL P J,MORRISON C D,GUPTA S,etal.Cognitive impairment following high fat diet consumption is associated with brain inflammation[J].J Neuroimmunol,2010,219(1-2):25-32.
[29]RUNGE C F.Economic consequences of the obese [J].Diabetes,2007,56(11):2668-2672.
[30]SOLFRIZZI V,PANZA F,CAPURSO A.The role of diet in cognitive decline[J].J Neural Transm,2003,110(1):95-110.
[31]THIRUMANGALAKUDI L,PRAKASAM A,ZHANG R,etal.High cholesterol-induced neuroinflammation and amyloid precursor protein processing correlate with loss of working memory in mice[J].J Neurochem,2008,106(1):475-485.
[32]TUCSEK Z,TOTH P,SOSNOWSKA D,etal.Obesity in aging exacerbates blood-brain barrier disruption,neuroinflammation,and oxidative stress in the mouse hippocampus:effects on expression of genes involved in beta-amyloid generation and Alzheimer's disease[J].J Gerontol A Biol Sci Med Sci,2014,69(10):1212-1226.
[33]UM H S,KANG E B,KOO J H,etal.Treadmill exercise represses neuronal cell death in an aged transgenic mouse model of Alzheimer's disease[J].Neurosci Res,2011,69(2):161-173.
[34]WHITE C L,PISTELL P J,PURPERA M N,etal.Effects of high fat diet on Morris maze performance,oxidative stress,and inflammation in rats:contributions of maternal diet[J].Neurobiol Dis,2009,35(1):3-13.
[35]WOO J,SHIN K O,PARK S Y,etal.Effects of exercise and diet change on cognition function and synaptic plasticity in high fat diet induced obese rats[J].Lipids Health Dis,2013,12:144.
[36]YAMAKURA F,MATSUMOTO T,IKEDA K,etal.Nitrated and oxidized products of a single tryptophan residue in human Cu,Zn-superoxide dismutase treated with either peroxynitrite-carbon dioxide or myeloperoxidase-hydrogen peroxide- nitrite[J].J Biochem,2005,138(1):57-69.
[37]YI C X,AL-MASSADI O,DONELAN Eetal.Exercise protects against high-fat diet-induced hypothalamic inflammation[J].Physiol Behav,2012,106(4):485-490.
[38]ZHANG G X,LI J,VENTURA E,etal.Parenchymal microglia of naive adult C57BL/6J mice express high levels of B7.1,B7.2,and MHC class II[J].Exp Mol Pathol,2002,73(1):35-45.
Effects of Acute Swimming Exercise on Microglia Activation,Inflammation and Oxidative Stress in the Hippocampus of High-Fat Diet-induced Obese Mice
ZHANG Xian-liang1,2,XU Bo1,2,PENG Hai-xia2,HE Qiang1,HE Biao2,JI Liu1,2
objective:To determine the effect of acute swimming exercise on hippocampal microglia activation,inflammation and oxidative stress of high-fat diet-induced obese mice.Methods:High-fat diet-induced obese mice were randomly divided into sedentary control group (SC),exercise control group (EC),sedentary obese group (SO),and exercise obese group (EO).EC and EO were underwent acute swimming exercise.After 8 hours,the hippocampus were token.We examined inflammatory factors (TNF-α、 IL-1-β、IL-6、IL-10) mRNA expression using RT-PCR.Using kits to test NO,MDA,SOD levels in the hippocampus.The number of hippocampal activated microglia were analyzed by flow cytometry.Results:1)8 weeks high-fat diet increased the body weight significantly,while glucose tolerance were decreased significantly.2)Comparing with SC,the mRNA expression of TNF-α,IL-6 were upregulated in group SO,while IL-10 mRNA expression were downregulated in group EC.Comparing with group SO,the level of TNF-α,IL-1β,IL-6 were reduced significantly in group EO.3)The contents of NO and MDA were higher while the activity of SOD and Mn-SOD in group SO were lower than those in group SC.And the content of NO lower while the activity of SOD and Mn-SOD in group EO were higher than those in group SO.4)Compared to SC,the rate of CD11b+/CD45hito CD11b+/CD45lowas increased in gourp SO.Whereas it was decreased in group EO compared to group SO.Conclusion:acute swimming exercise inhibited activation of microglia,reduced inflammation and decreased oxidative stress in the hippocampus of high-fat diet-induced obese mice.
acuteswimmingexercise;microglia;inflammation;oxidativestress;nitricoxide
2015-02-10;
2015-08-10
国家自然科学基金面上项目(31371204)。
张宪亮(1987-),男,山东德州人, 在读博士研究生,主要研究方向为体育学习与身心健康, E-mail:zhangheng224@126.com; 徐波(1963-),男,山东莱阳人,教授,博士研究生导师,主要研究方向为体育学习与身心健康,E-mail:bxu@tyxx.ecnu.edu.cn;彭海霞(1985-),女,山东菏泽人,在读硕士研究生,主要研究方向为运动与骨健康,E-mail:haixiap@163.com。
1.华东师范大学 “青少年健康评价与运动干预”教育部重点实验室,上海 200241;2.华东师范大学 体育与健康学院,上海 200241 1.Key Laboratory of Adolescent Health Assessment and Exercise Intervention,Ministry of Education,East China Normal University,Shanghai 200241,China;2.East China Normal University,Shanghai 200241,China.
1000-677X(2015)09-0058-07
10.16469/j.css.201508000
G804.5
A
