地黄中梓醇的变化条件研究
2014-12-20刘峰张恒李静温学森刘彦飞
刘峰,张恒,李静,温学森,刘彦飞
(1.青岛市海慈医疗集团,山东 青岛 266033;2.山东大学药学院生药学研究所,山东 济南 250012)
地黄为玄参科植物地黄(Rehmannia glutinosa)的块根,是重要的补益类中药之一。梓醇(catalpol)是一种环烯醚萜葡萄糖苷,是地黄的主要有效成分之一,近年来活性研究主要集中在神经保护[1-3]、抗癌[4]、降血糖[5]、抗肝炎病毒[6]及抗银屑病[7]等方面,特别是在抗老年性痴呆方面显示出了巨大的开发潜力[8]。梓醇在地黄的加工炮制过程中含量明显下降,与地黄经加工炮制药效发生改变可能有某种联系。为探讨其加工过程中的含量下降情况,本文进行了研究。
1 仪器、试剂及试药
岛津LC-10AT输液泵(配合SPD-10A紫外-可见检测器);浙大智达N2000色谱工作站;梓醇对照品(自制,含量>99.2%);鲜地黄(山东鼎立中药材科技有限公司);磷酸、乙腈为色谱纯;高纯水(自制);其他试剂为分析纯。
2 色谱条件
Phenomenex Luna C18色谱柱(250mm×4.60mm,5μm),流动相乙腈-1‰磷酸(1∶99);流速 1.0mL/min;进样体积15μL,检测波长210nm,柱温室温。理论塔板数按梓醇峰计不低于9000。
3 实验方法及结果
3.1 地黄加工过程中pH值的变化及梓醇的含量变化
3.1.1 地黄加工过程中pH值的变化
取鲜地黄约1.5kg,分别置于电热鼓风箱中,设置温度分别为60℃、70℃、80℃、90℃4组,在不同时间点各切取每块鲜地黄上的一部分,榨汁,降温至室温,pH计测定其pH值,同时设对照组,计算失重。
结果显示,温度越高,pH值下降越快,见图1。
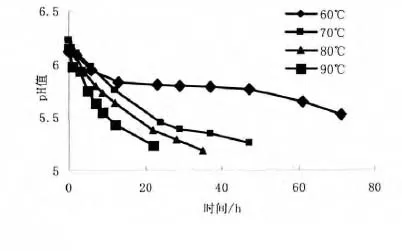
图1 地黄加工过程中pH值的变化
3.1.2 地黄加工过程中梓醇的含量变化
将电热鼓风箱中干燥的各组样品,研成粗粉,取约0.4g,精密称定,置具塞锥形瓶中,精密加入甲醇25mL,称定重量,加热回流1.5h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过。精密量取续滤液10mL,浓缩至近干,残渣用流动相溶解,转移至10mL量瓶中,并用流动相稀释至刻度,摇匀,过0.22μm滤膜,取续滤液15μL进样,HPLC测定。
结果显示,不同温度下加工的地黄中梓醇的含量差别显著,60℃、70℃、80℃、90℃各组温度加工条件下地黄中梓醇的质量分数分别为3.3%、2.8%、2.6%、1.5%,和未加工前的鲜地黄中梓醇的质量分数相比,分别下降了 14.9%、27.9%、33.9%、61.4%,可见加工温度越高,梓醇含量越低。
3.2 模拟地黄加工过程中pH值的变化及梓醇的含量变化
3.2.1 模拟地黄加工过程中pH值的变化
取5℃预冷鲜地黄约1.5kg榨汁,分装到5个300mL的锥形瓶中,分别设置温度5℃、60℃、70℃、80℃、90℃5组,20min后均达到各自设定温度,在0h、0.5h、1.5h、3.5h、7.5h、15.5h、25.5h、37.5h、49.5h、61.5h等10个时间点各组均取出约20mL悬浮液,降温至室温,pH计测定其pH值。
结果显示,5℃条件下,pH值下降缓慢,而其他组均有明显下降,特别是60℃和90℃下降更为明显,见图2。
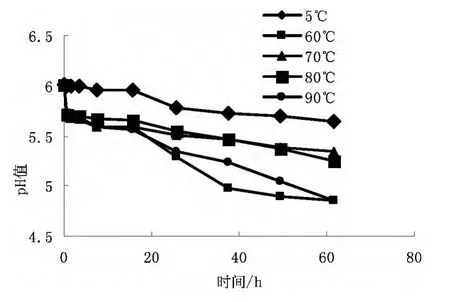
图2 模拟地黄加工过程中pH值的变化
3.2.2 模拟地黄加工过程中梓醇的含量变化
3.2.2.1 供试品的制备 样品榨汁后,在上述各时间点均取各组供测 pH值的样品约2g,精密称定,置25mL量瓶中,精密加入25mL甲醇,称定重量,超声提取20min,再称定重量,甲醇补重,摇匀,滤过。精密量取续滤液10mL,浓缩至近干,残渣用流动相溶解,转移至10mL量瓶中,并用流动相稀释至刻度,摇匀,过0.22μm滤膜,取续滤液进样15μL进样,HPLC测定梓醇含量。
3.2.2.2 对照品溶液的制备 精密称定梓醇对照品25.00mg,置25mL量瓶中,加流动相溶解并稀释至刻度,避光冷藏,作为贮备液备用。
3.2.2.3 线性关系考察 将梓醇质量浓度分别为0.0625、0.125、0.25、0.375、0.5、0.75、1mg/mL 的对照品溶液分别精密注入15μL进行测定。以峰面积值(X)对质量分数(Y)作回归计算,r=0.9999,回归方程Y=6×10-7X-0.0061。表明梓醇在进样量0.9375~15μg之间与峰面积呈良好的线性关系。
3.2.2.4 精密度实验 取同一对照品溶液,连续进样5次,每次15μL,测定峰面积,梓醇峰面积平均值为1629740,RSD=0.36%,表明精密度良好。
3.2.2.5 重现性实验 精密称取同一样品5份,按上述方法测定,RSD=0.74%,说明本法具有良好的重现性。
3.2.2.6 稳定性实验 取新配制的供试品溶液,于0、2、4、6、8h 进样测定,其峰面积平均值为 788042.8,RSD=0.17%,表明供试品溶液中梓醇在8h内稳定。
3.2.2.7 加样回收率实验 取样品约1g,精密称定,置三角瓶中,精密加入梓醇对照品一定量,其余操作同供试品液制备项下的方法,测定5份,计算平均回收率为97.5%,RSD 为2.06%。
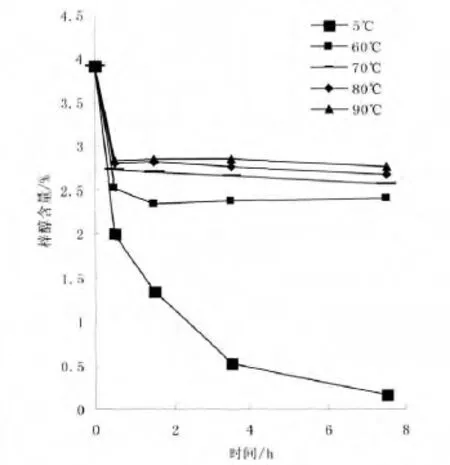
图3 模拟地黄加工过程中梓醇的含量变化(7.5h)

图4 模拟地黄加工过程中梓醇的含量变化(61.5h)
结果显示,样品在升温到各组设定温度过程中含量下降显著,且温度越低,含量下降越显著,0.5h时测定5℃、60℃、70℃、80℃、90℃5 组的梓醇质量分数分别为 2%、2.53%、2.74%、2.81%、2.84%,与最初含量相比分别下降了 44.9%、30.3%、24.5%、22.6%、21.8%;到7.5h时,5℃组的梓醇质量分数已经下降了95.3%,60℃、70℃、80℃三组样品中梓醇含量基本与0.5h持平,见图3;61.5h时,5℃组梓醇质量分数为0,60℃、70℃、80℃三组样品中梓醇含量基本与前持平,90℃组出现了较明显下降,梓醇含量比最初下降了43.8%,见图4。
4 讨论
4.1 地黄加工及模拟加工过程中pH值的变化
在地黄加工过程中,可能是温度的升高导致了地黄中所含的蛋白质分解为偏酸性的多肽类物质或者游离的氨基酸,从而使地黄内部呈酸性,温度越高,越有利于蛋白质的分解。而在模拟加工过程中,60℃条件下的pH值偏低可能是由于此温度下某些可以分解地黄中苯乙酰苷类及地黄脑苷的酶比较活泼,酶解苷键断裂释放出芳香酸类、脂肪酸类及多酚类物质所致。
4.2 酶对于梓醇在地黄加工过程中的含量下降的影响
已有研究证明,鲜地黄中含有β-葡萄糖苷酶[9],在加工过程中温度的升高可能导致了地黄中细胞核核膜和液泡膜的破裂从而使β-葡萄糖苷酶和梓醇相遇引起梓醇降解,温度越高梓醇降解程度越高,说明可能是存在着这样一个平衡,即细胞破裂的时间和酶灭活的时间有一个先后问题,温度越高酶灭活越快,同时细胞破裂也越快,事实上可能是温度越高,细胞破裂所需的时间越短,从而使β-葡萄糖苷酶和梓醇相遇,在更大程度上引起了梓醇的降解。而在模拟地黄加工条件下,榨汁使酶和梓醇已充分接触,因而温度越高,酶灭活的越快,梓醇的降解在更大程度上受到了抑制。
4.3 pH值对于梓醇在地黄加工过程中的含量下降的影响
一方面,酶可以酶解糖苷键,另一方面,氢离子也可以酸解糖苷键,地黄加工过程中不断下降的酸性环境可能在后期影响了梓醇的降解,值得注意的是,在鲜地黄内部呈弱酸性,加工是在高温的条件下进行的,而作者测定的pH值是在室温下进行的,考虑到氢离子的浓度受温度的影响(对于弱酸性的物质,温度越高,氢离子浓度越大),所以事实上地黄内部的真实pH值应该比作者测定的更低,这样,当氢离子达到一定浓度后,就可能酸解梓醇的糖苷键,致使梓醇含量下降。
4.4 梓醇的量与地黄质量的关系
目前对道地药材的研究中发现,对于一些公认质量较好的道地药材,其道地性,即优质性,在化学成分上往往表现为一个量的范围,所以尽管文献报道地黄中梓醇的含量相差幅度较大,但从某种程度上来讲,只要梓醇含量在一定幅度范围,就应该可以起到发挥其药效的作用。例如在研究梓醇的对神经保护和衰老细胞的作用时,梓醇起作用的量大大低于《中国药典》规定的量,尽管如此,我们应该尽量减少鲜地黄加工过程中梓醇的降解,从而更多的保留其有效成分,更好的发挥其药效。
那么,地黄中的β-葡萄糖苷酶的最适温度的确定、地黄的细胞破裂条件以及梓醇降解成何新物质,将是下一步研究的重要内容。
[1] Li DQ,Duan YL,Bao YM,et al.Neuroprotection of catalpol in transient global ischemia in gerbils[J].Neuroscience Reaearch,2004,50(2):169.
[2] Li DQ,B YM,Li Y,et al.Catalpol modulates the expressions of Bcl-2 and Bax and attenuates apoptosis in gerbils after ischemic injury[J].Brain Research,2006,1115(1):179.
[3] Liu J,He QJ,Zou W,et al.Catalpol increases hippocampal neuroplasticity and up-regulates PKC and BDNF in the aged rats[J].Brain Res,2006,1123(1):68.
[4] Pungitore CR,Ayub MJ,Borkowski EJ,et al.Inhibition of Taq DNA polymerase by catalpol[J].Cell Mol Biol(Noisy-le-grand),2004,50(6):767.
[5] Ya-Fang Ke.Antihyperglycemic Action of Catalpol[D].Taiwan(Province):National Cheng Kung University,2003.
[6] Fu SH.The effect catalpol on 2-aminofluore N-acetylation from human tumor cells in vitro and 2-aminofluore metabolites in Spregure-Dawley rats in vivo[D].Taiwan(Province):China Medical University,2000.
[7] 匡岩巍.鲜地黄叶中梓醇的积累动态及其抗银屑病作用的研究[D].北京:中国人民解放军军事医学科学院,2009.
[8] 王金红,孙启祥,夏宗勤,等.地黄活性成分梓醇对转基因CHO细胞 M2受体的调节作用[J].中国药理学通报,2006,22(12):1462.
[9] 赵宇,温学森,崔晶,等.鲜地黄中α-半乳糖苷酶和β-葡萄糖苷酶的提取与初步纯化[J].中药材,2006,29(2):137.
