快速溶剂萃取联合高效液相色谱法测定不同产地酸枣仁中皂苷A、B的含量
2014-12-16张彤楠
丁 轲,张彤楠,韩 涛,*
(1.北京农学院食品科学与工程学院,北京102206;2.食品质量与安全北京实验室,北京102206;3.农产品有害微生物及农残安全检测与控制北京市重点实验室,北京102206)
酸枣仁,鼠李科植物酸枣[Zizyphus jujuba Mill.Var.spinosa(Bunge)Hu ex H.F.Chou(Rhamnaceae)]的种子。酸枣仁主要用于治疗虚烦不眠,惊悸多梦,体虚多汗、津伤口渴等症,具有宁心、安神、养肝、敛汗的功效,临床用于治疗多种类型的失眠症[1]。酸枣仁药材药用历史悠久,最早以“酸枣”之名收入《神农本草经》,以“酸枣仁”立项首见于《本草乘雅班偈》。酸枣仁主产于河北、陕西、辽宁、河南等地,内蒙古、甘肃、山西、山东、安徽等地亦产[2]。
大量研究结果表明酸枣仁皂苷是酸枣仁发挥镇静、安神作用的有效部位[3-7],酸枣仁中含有11种不同的皂苷化合物,其中酸枣仁皂苷A(jujuboside A,C58H94O26)[8-9]和 B(jujuboside B,C52H84O21)是最主要的两种皂苷组分,其结构式见图1。酸枣仁皂苷的分析方法有报道的主要有:比色法[10]、反相高效液相色谱-紫外检测法(RP-HPLC-UV)[11-12]、反相高效液相色谱-蒸发光检测法(RP-HPLC-ELSD)法[13-14]、薄层色谱法(TLCS)[15-16]和胶束电动毛细管色谱法[17],其中比色法的灵敏度及准确率均相对较差,由于其不能分别测定皂苷A、B的浓度,因此限制了其应用范围;RP-HPLC-UV法由于受到皂苷紫外吸收弱、吸收波长处干扰大等问题,因此该方法的灵敏度较低,对样品中皂苷浓度的要求较高;TLCS法定量的准确度和精度都较差,只适合定性或者不用精确定量的测定;胶束电动毛细管色谱法对测定仪器的要求高,成本昂贵,不适合常规的测定;RP-HPLC-ELSD法避免了前4种方法的缺陷,操作简便,准确率好,灵敏度也高,非常适合皂苷类物质的含量测定,再结合快速溶剂萃取法进行样品中皂苷的提取,可以取得非常好的测定效果。
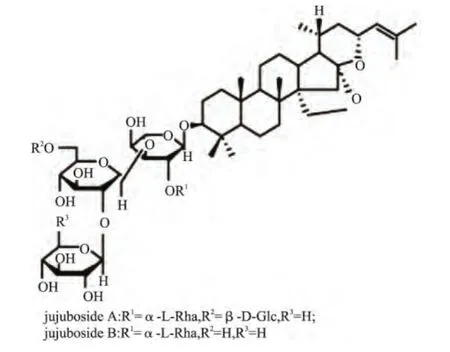
图1 酸枣仁皂苷A、B的化学结构Fig.1 Structures of jujubosides A and B in ZSS
作为中药材使用的酸枣仁其质量优劣主要取决于其皂苷含量的多少,本研究选择了国内外7种不同产地的酸枣仁,建立了酸枣仁皂苷的快速提取方法和HPLC-ELSD分析方法,为建立酸枣仁药材的质量标准提供了研究基础和技术支持。
1 材料与方法
1.1 材料与仪器
酸枣仁 购自河北安国药材市场,产地分别为河北省白平县、赞皇县、富平县、山东、辽宁、老挝和缅甸,经北京农学院食品科学与工程学院韩涛教授鉴定产于老挝和缅甸的酸枣仁为伪品,其余均为真品;酸枣仁皂苷A、B标品(≥98%) 上海顺勃生物工程技术有限公司;甲醇(色谱纯) 美国ThermoFisher公司;其余常规试剂均为分析纯级。
高效液相色谱仪(LC-20AD二元泵2台,DGU-20A5在线脱气机1台,CTO-20A柱温箱1台,SCL-10A VP控制器 1 台,CLASS-VP version 6.14 SP1 色谱工作站软件) 日本SHIMADZU公司;蒸发光检测器(3300,ELSD) 美国ALLTECH科技有限公司;无油空气泵(XWK-Ⅲ) 天津市华生分析仪器厂;PSEone快速溶剂萃取仪 美国Applied Separation公司;超纯水纯化系统(Direct-Q UV) 法国MILLIPORE公司;其余为实验室常用仪器。
1.2 实验方法
1.2.1 酸枣仁样品的预处理 a.脱脂:采用索氏提取法,将不同产地的酸枣仁粉碎成直径2~4mm大小的颗粒后各自称取100g用索氏提取器进行脱脂,用石油醚(30~60℃)作为脱脂溶剂,脱脂后将酸枣仁晾干即可进行皂苷的提取。b.酸枣仁皂苷的快速提取:采用快速溶剂萃取法,以河北白平产的酸枣仁为例,提取步骤如下:精确称取4g脱脂酸枣仁粉末,6g石英砂,混合均匀后,倒入快速溶剂萃取仪不锈钢萃取釜内(釜底出口事先盖好筛板,拧好螺纹旋盖),保持物料与釜口1cm的距离,在上面覆盖一层仪器配带的分散剂,再盖上一层滤纸后将萃取釜放入提取槽旋紧提取槽上的盖子准备开始提取;打开萃取仪电源,按说明书设定参数,然后将萃取仪的输液口放入装有提取剂的容器中,在萃取仪出液口放好采样瓶,开始提取。由于快速溶剂萃取仪提取的效果受很多因素影响,因此有必要对主要的影响因素进行优化,参阅快速溶剂萃取仪的使用手册可知,釜温的设定范围在150℃以下,釜压的设定范围在150bar以下(厂家建议在120bar下使用较为安全),每次提取的最大循环次数为9次,一次提取时间最多99min。提取时间经预实验优化后发现超过5min皂苷A、B的提取率均不再提高,在本人之前对皂苷提取条件的研究[18]中已证实乙醇浓度对皂苷提取效果的影响很大,综上,对快速溶剂萃取法的以下四个因素进行优化:釜温、釜压、每次提取的循环次数和乙醇浓度,其他条件都采用固定值,分别是:B模式(循环模式),11mL萃取釜,暂停次数为0,冲洗程序:溶剂/空气/重复冲洗=25sec/2min/0,Refill值为10/2,提取时间5min。待优化的四因素中,釜温、釜压和每次提取的循环次数都在仪器使用手册规定的设定值范围内选择了三个水平值,乙醇浓度参照本人之前对皂苷提取条件的研究[18]结论,在乙醇最佳浓度50%附近选择了三个水平,因素水平安排如表1所示,选择L9(34)正交表安排正交实验。

表1 快速溶剂萃取法提取酸枣仁皂苷因素水平表Table 1 Factors and levels of the exrtration of jujubosides in ZSS
1.2.2 提取液的浓缩和干燥 将采样瓶中的提取液倒入梨形蒸馏瓶用旋转蒸发仪蒸干,将蒸干后的提取物连同蒸馏瓶一起进行真空干燥,干燥恒重后,称量带有提取物的蒸馏瓶总质量,将干燥后的提取物用不锈钢药匙从蒸馏瓶上刮下后冷藏保存待测,将蒸馏瓶洗干净再干燥至恒重后测瓶重,前后两次质量差即为提取物总质量。
1.2.3 酸枣仁皂苷的测定 酸枣仁皂苷A、B的含量采用高效液相色谱法(HPLC)测定。a.色谱条件:色谱柱:YMC-Pack ODS-AQ C18(250L × 4.6mm I.D.,5μm,12nm);流动相:甲醇-水-冰醋酸(体积比 =70∶30∶1);流速:1mL/min;柱温:25℃。b.蒸发光检测器(ELSD)检测参数的优化:ELSD的雾化器载气流量及漂移管温度是两个重要的可调参数。无油空气泵为ELSD提供压缩空气作为雾化载气,压力为0.45MPa。载气流量太小,会产生较大的液滴而导致基线噪音增大;载气流量太大产生的液滴过小会导致信号降低。漂移管温度过高,溶剂过度气化会导致检测器响应值下降;温度过低溶剂气化不完全会导致基线不稳,因此采用单因素实验对两个参数进行了优化,固定飘移管温度,在四个不同的载气流量(1.5、2.0、2.5、3L·min-1)下分析酸枣仁皂苷 A、B;固定载气流量,在四个不同的漂移管温度(40、50、60、70℃)下分析酸枣仁皂苷A、B,考察不同载气流量和不同温度分别对检测器信噪比(S/N)的影响。c.对照品溶液的制备:分别精密称取酸枣仁皂甙A、B对照品 5.0921,4.9923mg,用甲醇溶解并定容至 5mL,摇匀,即得浓度分别为 1.0184mg/mL 和 0.9985mg/mL的酸枣仁皂甙A、B初始浓度标准溶液,将此标准溶液依次稀释2、4、8、16、32 倍得到6 个浓度分别为1.0184,0.5092,0.2546,0.1273,0.0637,0.0318mg/mL 的酸枣仁皂苷 A 标准溶液和 6 个浓度分别为 0.9985,0.4993,0.2496,0.1248,0.0624,0.0312mg/mL 的酸枣仁皂苷 B标准溶液。d.供试品溶液的制备:精密称取酸枣仁皂甙提取物约1g,用甲醇超声溶解并定容至25mL,临用前用一次性针筒注射器和一次性微滤膜(0.45μm)过滤后进样。e.酸枣仁皂苷标准曲线的测定:分别吸取15μL酸枣仁皂苷A、B六种不同浓度的标准溶液进样,根据进样后色谱图中皂苷A、B的峰面积和标准溶液浓度做出两种物质的标准曲线。f.精密度、稳定性和重复性实验:取同一酸枣仁皂苷A、B对照品混合溶液,连续进样6次测定分析方法的精密度;再分别于 0、2、4、7、10 和12h时测定该对照品混合溶液的稳定性;按d方法平行制备6份样液,分别进样测定样液的重复性。g.加样回收率实验:称取已知皂苷A、B含量的脱脂酸枣仁粉末6份,每份4g,精密称定,分别精密加入酸枣仁皂苷 A、B 固体各 2mg,按“1.2.1酸枣仁样品预处理”方法优化后的最佳条件制备酸枣仁皂苷 A、B提取物,再按 1.3.1制备样液后进行测定。
1.2.4 测定不同产地酸枣仁中皂苷A、B的含量 按照“1.2.1酸枣仁样品的预处理”方法在最优条件下分别提取7种不同产地的酸枣仁皂苷提取液,再按照“1.2.2提取液的浓缩和干燥”方法得到各产地酸枣仁皂苷提取物,采用“1.2.3酸枣仁皂苷的测定”方法测定7种不同产地的酸枣仁皂苷A、B含量。
2 结果与分析
2.1 酸枣仁皂苷快速溶剂萃取条件正交实验优化结果与分析
2.1.1 直观分析 快速溶剂萃取法条件优化的直观分析结果如表2所示。由表2的极差(R)大小可知,4个因素对酸枣仁皂苷A提取率的影响大小依次为:提取频率>乙醇浓度>提取压力>提取温度,各因素的最优水平组合为乙醇浓度65%、提取频率1次/min、提取压力100bar、提取温度100℃;4个因素对酸枣仁皂苷B提取率的影响大小依次为:乙醇浓度>提取频率>提取压力>提取温度,各因素的最优水平组合为乙醇浓度55%、提取频率 5次/min、提取压力120bar、提取温度100℃;4个因素对酸枣仁皂苷A+B提取率的影响大小依次为:乙醇浓度>提取温度>提取压力>提取频率,各因素的最优水平组合为乙醇浓度65%、提取频率3次/min、提取压力80bar、提取温度100℃。
在本实验考察的四个因素中,乙醇浓度可以看作是外部因素,而提取温度、提取压力和提取频率都可以看作是快速溶剂萃取仪的工作参数,也即内部因素,综合以上各因素的影响大小关系,可以看出,外部因素乙醇浓度对提取率的影响最大,这说明选择一种适于目标物从原料溶出的溶剂十分重要,这是使用ASE法有效提取目标物的前提,在此基础上优化温度、压力以及提取频率才有意义。
2.1.2 方差分析 由于实验使用的正交表L9(34)中的每一列都被安排了一个因素,因此没有空列作为误差列进行方差分析,在这种情况下只好以直观分析中极差最小的列为误差列,进行方差分析,从结果可以看出,对酸枣仁皂苷A而言,乙醇浓度、提取频率和提取压力都对其提取率有影响,提取温度影响不显著(p<0.10);对酸枣仁皂苷B而言,乙醇浓度对其提取率有影响,而提取频率,提取压力和提取温度的影响不显著(p<0.10);对酸枣仁皂苷A+B而言,乙醇浓度对其提取率的影响差异显著,提取温度和提取压力的影响次之,而提取频率的影响不显著(p<0.10)。从方差分析的结果可以看出,各因素对酸枣仁皂苷提取率的影响与直观分析的结果基本一致,无论是单一皂苷的提取还是皂苷A+B的提取,乙醇浓度都是最重要的影响因素,其余三个因素对不同酸枣仁皂苷的提取影响大小不一致。
综合皂苷A、B的最佳提取条件,选择乙醇浓度为60%,提取压力和提取次数由于最佳值相差较大,采用两步提取法:第一步按照提取频率1次/min、提取压力100bar提取皂苷A,之后按照提取频率5次/min、提取压力120bar提取皂苷B,提取温度对提取结果的影响较小,属于次要因素,因此提取温度就定为100℃,经过验证,在该条件下提取皂苷 A提取率为0.9736mg/g、皂苷 B 提取率为 0.5642mg/g,A+B 的提取率达到1.5378mg/g,取得了最好的提取效果。
2.2 酸枣仁皂苷测定结果与分析
2.2.1 ELSD检测参数优化 不同的载气流量及漂移管温度对ELSD的S/N的影响见图2。理论上S/N的值越大越好,结果如图2(a)、2(b)所示,无论是皂苷A还是皂苷B,载气流量和漂移管温度对其的影响都是一致的,S/N随载气流量的增大先增大后减小,有一个最大值,也即载气流量为2.5L/min,S/N随漂移管温度增大逐渐增大,漂移管温度为70℃时S/N有最大值,最终确定ELSD的检测参数为:载气流量为2.5L/min,漂移管温度为70℃。

表2 快速溶剂萃取法提取条件正交优化实验结果与直观分析Table 2 The orthogonal test results of the ASE conditions and visual analysis
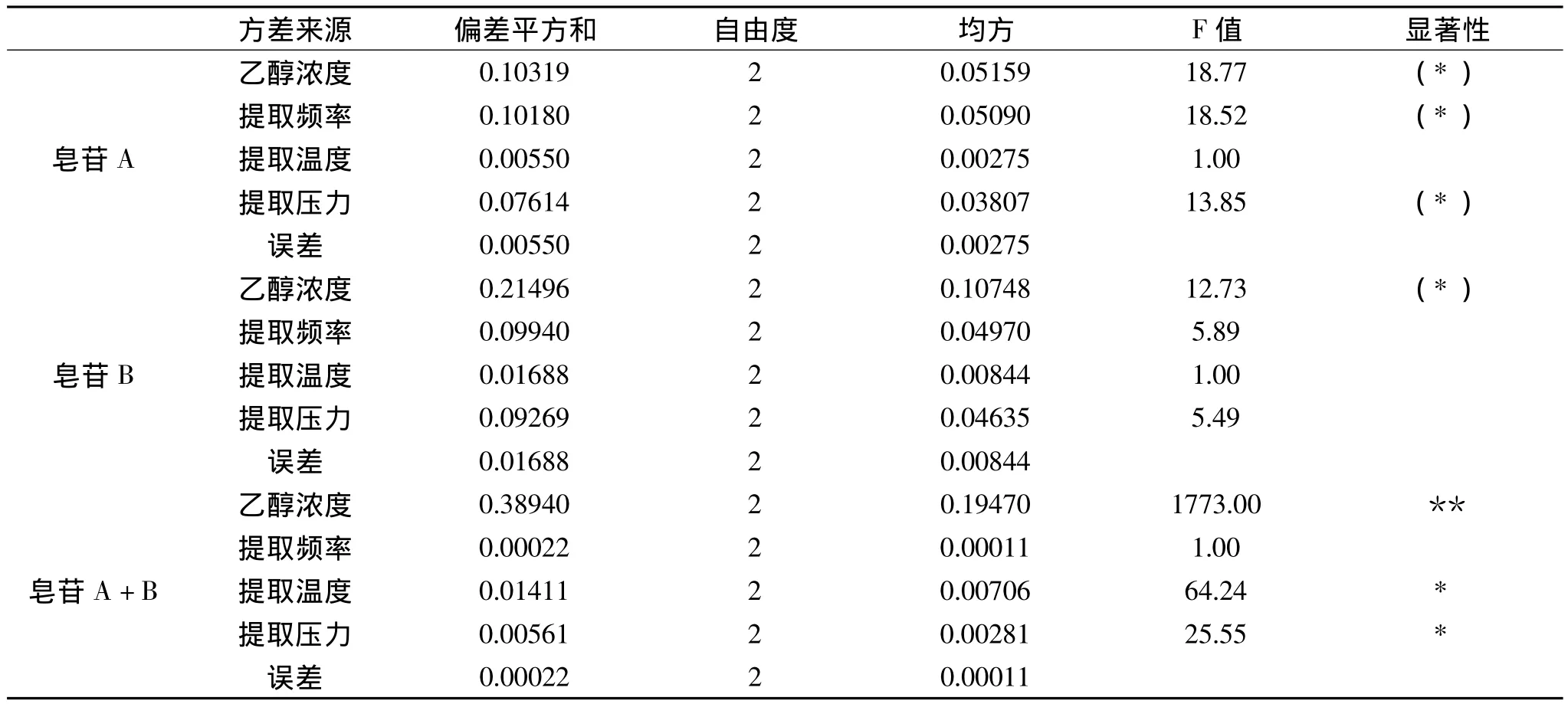
表3 快速溶剂萃取法提取条件正交优化实验结果方差分析Table 3 Analysis of variance for the orthogonal test results of the ASE conditions
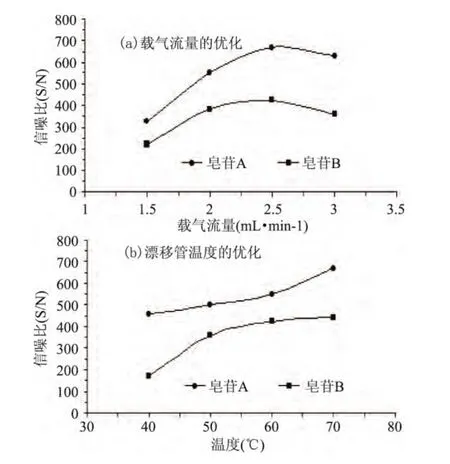
图2 ELSD参数优化结果Fig.2 Optimized operating parameters of ELSD
2.2.2 对照品与样品分析结果 测定结果如图3所示。A图为酸枣仁皂苷A、B对照品的色谱图,B图为酸枣仁皂苷提取物的色谱图,图中峰1为皂苷A的色谱峰,峰2为皂苷B的色谱峰,从B图中可以看出提取色谱图中皂苷A、B与其余的杂质峰实现了基线分离,而且出峰时间也控制的比较好,该流动相条件可以用来定量检测皂苷A、B的含量。
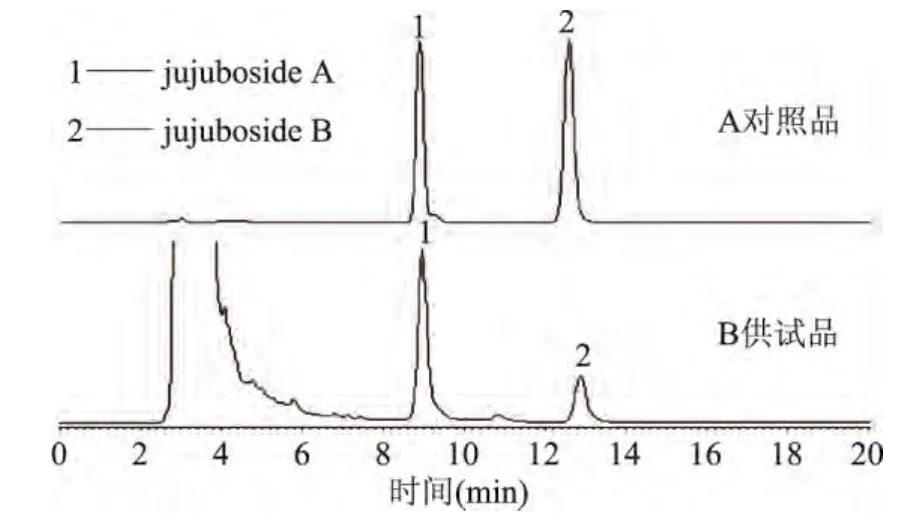
图3 酸枣仁皂甙A、B高效液相色谱图Fig.3 HPLC chromatograms of jujuboside A and B
2.2.3 标准曲线测定结果 根据ELSD的检测原理,散射光强度与样品微粒质量的关系为:I=kmb⑴(式中m为微粒质量,k、b为实验条件如:温度、流动相性质决定的常数)[19],方程(1)两边取对数可以得到式(2):lgI=lgk+blgm,从(2)式可以看出,使用ELSD测定目标物的标准曲线,需要分别以待测物的质量对数和待测物的响应值,也即峰面积对数为横、纵坐标作图。如图4所示,分别以色谱图中皂苷A、B峰面积的对数Y为纵坐标,进样15μL对照品溶液中标准品的质量对数X为横坐标,绘制标准曲线,标准曲线方程如下:Y=1.49X+5.534,r=0.998,Y=1.520 X+5.568,R2=0.998,线性范围分别为:0.40~12.00μg 和 0.55~16.50μg。

图4 酸枣仁皂甙A、B标准曲线Fig.4 Regression curve of jujuboside A and B
2.2.4 精密度、稳定性、重复性以及加样回收率测定结果 连续进样6次测定同一酸枣仁皂苷A、B对照品混合溶液,皂苷A、B峰面积的RSD分别为0.5%和0.6%,结果表明色谱检测精密度良好;在一天内的不同时段测定同一酸枣仁皂苷A、B对照品混合溶液,酸枣仁皂苷 A、B的RSD分别为0.7% 和1.4%,结果表明对照品溶液在12h内能够保持良好的稳定性;平行测定6份样液,酸枣仁皂苷A、B峰面积的RSD分别为1.9%和1.26%,结果表明样液制备方法重复性良好;平行处理6份样品得到6份酸枣仁皂苷提取物,制备样液后依次进行测定,结果表明,酸枣仁皂苷A、B的平均回收率分别是102.4%和99.2%,皂苷A、B峰面积的RSD分别为2.3%和2.7%。
2.3 不同产地酸枣仁中两种皂苷的含量测定结果与分析
不同产地的酸枣仁中皂苷A、B含量的测定结果如表4所示。从表中的数据可以看出,各地酸枣仁皂苷A含量的大小依次为:河北白平>河北赞皇>山东>河北富平>老挝>辽宁>缅甸;酸枣仁皂苷B含量的大小依次为:河北白平>河北赞皇>河北富平>山东>辽宁>老挝>缅甸;各地两种皂苷总含量的大小依次为:河北白平>河北赞皇>山东>河北富平>辽宁>老挝>缅甸。综上,山东、河北的酸枣仁中皂苷含量远高于其他地方的酸枣仁,特别是缅甸和老挝的酸枣仁中皂苷含量很低,根据文献可知[20],主产于缅甸和我国云南的酸枣仁叫滇枣仁,也叫进口枣仁、缅枣仁或黄枣仁,它是酸枣仁同属植物滇刺枣(Ziziphus mauritiana Lam.)的种子,滇枣仁通常都作为酸枣仁的伪品处理。而本实验结果从数据上给出了滇枣仁的药效不如酸枣仁的原因。
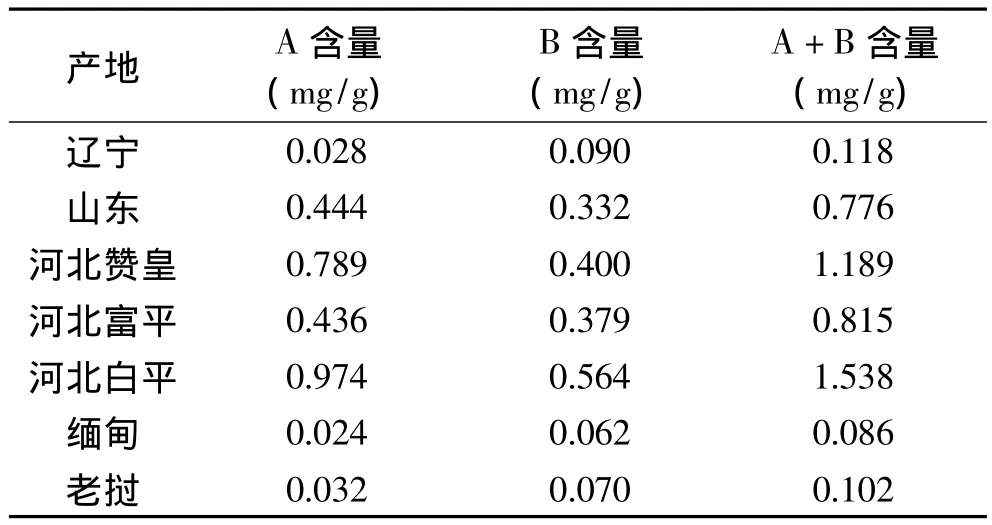
表4 不同产地的酸枣仁中皂苷含量Table 4 Contents of jujubosides in ZSS from different place of production
3 结论
酸枣仁皂苷在酸枣仁中的天然含量很低,因此皂苷的含量测定需要一种有效的提取方法才能使皂苷最大量的从酸枣仁中快速溶出,本研究所采用的快速溶剂萃取法比传统的溶剂回流法和浸提法回收率提高了很多,接近100%,而且完成一次提取只需要10min,因此该方法非常适合天然产物中皂苷类活性成分含量测定的样品前处理过程,本研究得到的最佳提取条件是:采用两步提取,第一步:乙醇浓度60%、提取频率1次/min、提取压力100bar、提取温度100℃;第二步:乙醇浓度60%、提取频率5次/min、提取压力120bar、提取温度100℃。
酸枣仁皂苷除了在紫外检测器210nm的低波长紫外区域有吸收以外,在其余的紫外波长范围内几乎没有吸收,而且在210nm附近检测受杂质干扰严重,对样品中皂苷的含量限值也有要求,而酸枣仁皂苷在酸枣仁中的含量极低,所以采用ELSD具有良好的定量检测效果,ELSD最佳检测参数:载气流量为2.5L/min,漂移管温度为 70℃。
经测定,酸枣仁中的皂苷A含量最高,皂苷B次之,河北、山东的酸枣仁中皂苷含量远高于其他地方的酸枣仁,可以作为开发酸枣仁保健品的优质原料资源使用,该研究为进一步研究和开发酸枣仁皂苷这一有效部位奠定了研究基础。
[1]国家药典委员会主编.中华人民共和国药典[M].2005年版.北京:化学工业出版社,2005:254-255.
[2]史琪荣,周耘,周萍,等.中药酸枣仁的研究概况[J].天然药物化学,2004,22(2):94-98.
[3]郭胜民,范晓雯,宋少刚,等.酸枣仁总皂苷中枢抑制作用研究[J].西北药学杂志,1996,11(4):166-168.
[4]陈百泉,杜钢军,许启泰.酸枣仁皂苷的镇静催眠作用[J].中药材,2002,25(6):429-430.
[5]黄胜英,谢世荣,黄彩云,等.酸枣仁皂苷的镇静作用研究[J].大连大学学报,2002,23(4):90-92.
[6]Peng WH,Hsieh MT,Lee YS,et al.Anxiolytic effects of seed of Zizyphus ujube in mouse models of anxiety[J].Journal of ethnopharmacology,2000,72:435-441.
[7]Park JH,Lee HJ,Koh SB,et al.Protection of NMDA-induced neuronal cell damage by methanol extract of Zizyphi Spinosi Semen in cultured rat cerebellar granule cells[J].Journal of ethnopharmacology,2004,95:39-45.
[8]Kawai KI,Akiyama T,Ogihara Y,et al.A new sapogenin in the saponins of Zizyphus ujube,hovenia dulcis and bacopa monnieri[J].Phytochemistry,1974,13:2829-2832.
[9]Ostuka H,Akiyama T,Kawai K,et al.The structure of jujubosides A and B,the saponins isolated from the seeds of the Zizyphus ujube[J].Pytochemistry,1978,17:1349-1352.
[10]高声传,郭涛,夏维杰.比色法测定酸枣仁提取物中总皂苷的含量[J].实用药物与临床,2005,8(1):15-16.
[11]李会军,李萍.高效液相色谱法蒸发光散射检测器测定酸枣仁中酸枣仁皂苷A及B的含量[J].药物分析杂志,2000,20(2):82-84.
[12]王锋,刘雪松,陈勇,等.酸枣仁皂苷大孔树脂纯化工艺及HPLC-ELSD 测定方法研究[J].中药材,2010,33(8):1343-1346.
[13]钟东会,雷根虎,郭五保,等.RP-HPLC测定酸枣仁中的酸枣仁皂苷-A 的含量[J].中成药,2004,26(11):963-964.
[14]李玉娟,车镇涛,毕开顺,等.反相高效液相法测定酸枣仁中酸枣仁皂苷A的含量[J].中国中药杂志,2001,26(5):309-310.
[15]韩光,孙茂峰.TLCS法测定静安胶囊中酸枣仁皂苷A的含量[J].中国药学杂志,2003,38(11):889.
[16]王健,林晓.酸枣仁中酸枣仁皂苷A和B含量的测定[J].中草药,1996,27(3):154-155.
[17]Dong M,Chen GH,Wu X,et al.Determination of Jujubosides A and B by micellar electrokinetic capillary chromatography[J].China journal of natural medicines,2010,8(3):208-211.
[18]丁轲,茅琪婧,卢文静,等.酸枣仁皂苷A、B提取纯化工艺的研究[J].中国食品学报,2010,10(3):40-46.
[19]张玉奎,张维冰,邹汉法主编.液相色谱分析——分析化学手册第六分册[M].第二版.北京:化学工业出版社,2000:82-83.
[20]卢振江,孙冬梅.酸枣仁与滇枣仁的研究[J].中国中医药杂志,2007,5(11):89-90.
