磁共振脂肪定量技术在骨骼疾病中的应用与展望
2014-12-13陈慧莹袁慧书
陈慧莹,袁慧书
北京大学医学部第三附属医院放射科,北京 100191
长期以来,骨髓脂肪组织被认为仅仅用于“填充”骨量减少后多出的髓腔空间[1-2],并未受到应有的重视。近期则发现,髓腔脂肪细胞与成骨细胞具有同源性,均来自髓腔间充质细胞(mesenchymal stromal cells,MSCs),而MSCs向两者的分化是一个微调过程,受体内外多种因素影响[3-5]。同时,脂肪组织作为有分泌功能的器官,在维持正常成骨活动所需的骨髓微环境中有重要作用,其分泌的不同脂肪因子可对MSCs甚至造血功能细胞产生正性或负性的影响[6-9]。有基于动物实验的研究认为髓腔脂肪成分对骨髓代谢环境可能具有双向作用,即青春期具有“棕色脂肪”特征的脂肪组织可以创造利于成骨活动的骨髓微环境,而年龄增长和糖尿病可削弱这种作用[10-11]。但目前为止,骨髓脂肪组织的作用尚未完全明确,脂肪含量的变化在疾病中代表的意义也多在探索之中。基于此,磁共振脂肪定量技术被引入骨髓脂肪含量的测量,为临床和科研提供了一项有效、无创的评价工具。
1 磁共振脂肪定量技术
目前文献报道的应用在骨髓脂肪定量测量的磁共振技术包括T1加权磁共振成像(T1 weighted magnetic resonance imaging,T1WI-MRI)技术、磁共振波谱(magnetic resonance spectroscopy,MRS)技术,以及基于化学移位的水脂分离(Dixon &IDEAL)技术。
1.1 T1WI-MRI技术
在获得测量部位的原始轴位T1WI图像后,应用图像分析软件在灰度图上将骨髓脂肪的划分阈值设为与皮下脂肪同一水平,人工划分出骨髓脂肪组织的区域,再通过下式获得髓腔脂肪的容积:

式中,V代表脂肪容积(volume),Ai代表扫描的横截面积,t为层厚,h为层间隔,N为总层数[12-14]。T1WI技术比较稳定,扫描时间短,但后处理过程比较繁琐,且计算方法比较粗糙,实际应用较少。
1.2 MRS技术
MRS技术被认为是非入侵性组织脂肪定量的金标准,应用最为广泛[15-18]。MRS测定的并非骨髓的绝对脂肪含量,而是脂肪比(fat fraction,FF),即感兴趣区内脂肪信号幅度占总信号幅度(脂肪信号及水信号,Sfat &Swater)的百分比,通过以下公式算得:
Fat fraction =Sfat/(Sfat + Swater)
由于测得的是脂肪信号与水信号的相对比值,任何直接或间接影响组织内脂肪含量或水含量的变化都会导致测量值的变动,故目前尚未看到准确的关于MRS技术所得脂肪比的组织学验证,MRS作为“金标准”的依据主要体现在理论和计算方法上。
MRS的缺点在于扫描条件要求高,时间长,尤其在骨骼系统不甚稳定,且后处理过程十分繁琐,限制该技术的发展应用[16]。
1.3 基于化学位移的水脂分离(Dixon & IDEAL)技术
Dixon法利用水和脂肪的化学位移不同,分别采集到两者的同相位(in phase)和反相位(out of phase)图像,进一步通过图像加减获得纯水像和纯脂像。在此基础上对水像和脂像进行量化,通过公式:脂像/(水像+脂像)即可获得脂肪比(FF)[15,19]。IDEAL(iterative decomposition of water and fat with echo asymmetry and least-squares)技术由Dixon技术发展而来[20-21],结合了非对称采集技术与迭代最小二乘水脂分离算法,在其基础上对T2*衰减、脂肪的多谱峰分布等进行校正[22-23],理论上可以得到更精确的数值。IDEAL技术在脂肪肝的定量测量上与MRS方法取得了较高的一致性[23],在骨髓脂肪含量的测量上也有初步应用[24],且在操作过程、扫描时间及数据后处理上优于MRS技术,有望替代MRS成为新的参考技术。
2 磁共振脂肪定量技术在骨骼病变的应用
尽管现有的磁共振脂肪定量技术没有得到确切的组织学方法验证,但在骨骼病变中,脂肪含量的变化似乎比脂肪绝对含量更有意义,至少并未影响现阶段人们将其应用到临床和科研中的热情。目前主要的研究方向是在骨质疏松中的应用,但对其他原发或累及骨骼系统的疾病也有零星报道。
2.1 骨质疏松症
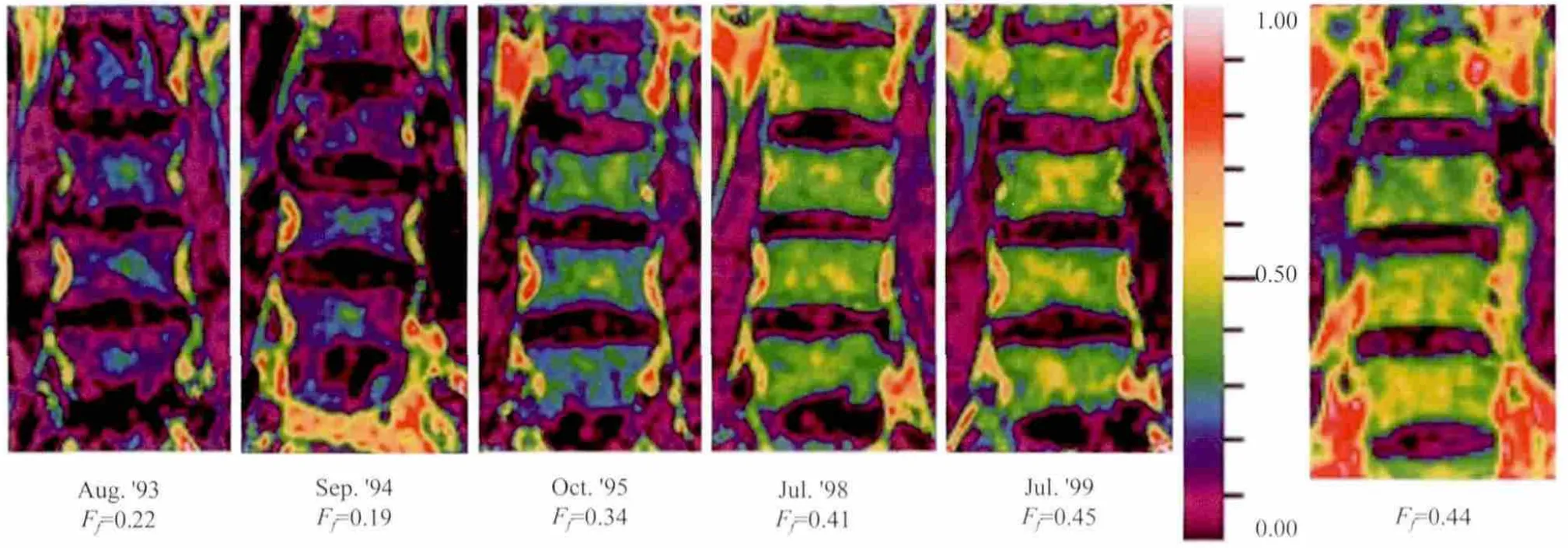
图1 腰椎骨髓脂肪比在酶学治疗期间升高。A:治疗前,女,47岁;B~E治疗中,获得数据的时间和L3~5平均脂肪比在下方给出;F:脂肪比比色刻度尺,由黑色(F=0.00)经黄色(0.50)至白色(1.00);G:48岁女性健康志愿者的脂肪比图。图片引自参考文献[19]Fig.1 Increase in bone marrow fat fraction in the lumbar spine during enzyme therapy in patient 2(female).A: Just before therapy, at the age of 47 years.B—E: During therapy, acquisition dates and averaged F values of L3—5 are given.F: Color fat fraction scale from black (F= 0.00) through yellow (0.50) to white (1.00).G: fat fraction image of a healthy female volunteer, aged 48.Photograph from reference [19].
骨质疏松症是以骨强度下降、骨折风险性增加为特征的骨骼系统的疾病[25-26]。骨强度包含骨密度和骨质量两个方面:骨密度是个体峰值骨量和骨丢失量两者的综合,骨质量则是包括骨骼构筑、骨代谢转换、骨骼的积累性破坏(显微骨折)和骨的矿化程度在内的总称。目前诊断骨质疏松的“金标准”是应用双能X线骨密度仪(dual-energy X-ray absorptiometry,DXA)测量股骨及腰椎部位的骨密度(bone mineral density,BMD)[27-28]。尽管BMD是反映骨强度最重要的指标,单独应用DXA BMD评价骨质疏松、预测骨折风险的敏感度却不高[29],且在越来越重视早期干预的现在,DXA BMD对骨质疏松病程进展的监测和对各种预防措施、治疗手段效果的评估也不能满足临床的需求。新发展的定量断层扫描测量法(quantitative computed tomography,QCT)相比DXA能够测得更准确的BMD,但同样无法提供骨质量的信息[30-32],而能反应骨小梁结构的高分辨QCT技术(high resolution-QCT,HR-QCT)、显微CT技术(micro CT,μCT)和高分辨核磁共振技术(HRMRI)或因辐射剂量大,或因设备昂贵、扫描时间长等问题,在临床上的推广应用也存在较大阻力[33-35]。在此背景下,应用磁共振脂肪定量技术测量骨髓脂肪含量,为评价骨质疏松提供了一项新的诊断思路。
2.1.1 骨质疏松的诊断及骨折风险的评估
早期已有大量证据表明随年龄增长存在骨量下降和髓腔内脂肪增多现象[1-2,36],近期发现髓腔脂肪细胞与成骨细胞具有同源性,并能够影响骨髓成骨微环境,被认为可以反映部分骨质量的情况。现有的研究大部分支持骨髓脂肪含量(bone marrow fat,BMF)与低骨量相关,并证实存在椎体骨折的患者有较高的BMF(48.8%~57.3%、33.6%~52.8%)[12-13,16-18]。而Schellinger等[37]一项关于MRS BMF与DXA BMD间的对比研究则认为,椎体高BMF并不总伴有低BMD,BMF在反映骨强度下降的能力方面不亚于DXA BMD,但综合参考两者(BMF/BMD ratio)更具诊断方面的优势。鉴于DXA对BMD的测量精度易受腰椎退变及主动脉钙化的影响[32],Schellinger等[37]的这一结果并不具备充分的说服力。所幸Bredella等[38]应用QCT技术测得更准确的BMD,同样证实BMF独立于BMD,而与内脏脂肪含量及IGF-1相关,这可能部分解释了代谢综合征患者中即使骨量正常也存在较高的骨折风险[39]。理论上BMF不仅可以间接反映BMD下降,还能提供部分骨质量的信息,但不同文献报道的骨折组BMF存在一定交叉,BMF能否作为预测骨质疏松性骨折的独立风险因素,目前的证据仍显单薄。
2.1.2 骨质疏松药物疗效监测及作用机制探究
固醇类药物可以导致骨质疏松,但其机制尚不完全明确。研究发现固醇类药物诱导的骨质疏松早期即存在骨髓脂肪细胞体积增大和血流灌注减低的现象[40-42],而理论上这一变化可以十分敏感地被MRS或水脂分离脂肪定量技术检测到。Li等[43]的一项动物实验证实,使用甲泼尼龙的新西兰白兔在第4周开始出现显著的骨量下降和骨髓脂肪比增高(+36.1%)现象,并一直持续到第12周(+75.2%),而经过唑来膦酸盐治疗的白兔其脂肪比则降回至基线水平。这一结果不仅提示(至少部分提示)了唑来膦酸盐治疗糖皮质激素诱导的骨质疏松的作用机制,还提示磁共振脂肪定量技术可用于临床患者,监测唑来膦酸盐治疗骨质疏松的反应。
雌激素是骨质疏松的一线用药,可直接影响MSCs向成骨细胞和脂肪细胞的分化[44]。Liu等[45]研究表明绝经期女性骨量下降同时伴随骨髓脂肪含量增高现象,Syed等[46]证实经过雌激素治疗一年的绝经期骨质疏松症患者,其骨髓脂肪含量未再上升,甚至出现下降。尽管未见到磁共振脂肪定量技术直接应用于监测雌激素治疗骨质疏松的报道,但Syed等[46]的结果强烈提示,磁共振脂肪定量技术可以用于该项目的检测。
2.2 在血液系统疾病的应用
2.2.1 再生障碍性贫血的诊断及评估
再生障碍性贫血(aplastic anemia, AA)是由于各种因素导致骨髓造血功能衰竭,外周血全血细胞减少的一组异质性疾病,骨髓穿刺显示有核细胞增生减低,脂肪滴增多为其特征[47]。Xu等[48]应用MRS技术测量6例再生障碍性贫血患者的腰椎及髂骨的骨髓脂肪比,发现高达74.69%~91.51%,强烈提示磁共振脂肪定量测量技术可作为诊断再生障碍性贫血的辅助检查。尤其在行骨髓穿刺较为麻烦的儿童患者,理论上结合外周血细胞全血细胞减低和骨髓脂肪比增高,可对AA进行诊断。即使骨髓脂肪比不能完全取代骨髓穿刺在诊断中的价值,在诊断后的治疗过程中,也可结合外周血检查,用于评估骨髓造血功能的恢复情况。
2.2.2 血液系统恶性肿瘤的评估
血液系统恶性肿瘤包括白血病、淋巴瘤及多发性骨髓瘤等,白血病及多发性骨髓瘤主要侵犯骨髓,而淋巴瘤累及骨髓患者,也可出现相应的髓内改变[47]。理论上,髓内肿瘤细胞的大量浸润会侵占正常脂肪组织占据的空间,而Xu等[48]的研究也证实,26例急性白血病患者中,MRS测得的椎体及髂骨的脂肪比均为0%。在同一研究中,非肿瘤性疾病如珠蛋白生成障碍性贫血的脂肪比也显著降低(5.02%),提示骨髓脂肪比降低在区分血液系统肿瘤及某些非肿瘤性病变,以及不同类型的肿瘤病变间并无特异性,在诊断方面的价值不大。但其可用于评估疾病在诊断及治疗后的转归,同样在儿童患者中有较大的应用潜力。
2.3 I型戈谢病(typeiGaucher disease)的药物疗效评估
戈谢病是由于溶酶体内的酸性β-葡萄糖苷酶缺乏,葡萄糖脑苷脂贮积在各器官的单核巨噬细胞系统而致病[49]。其中,I型戈谢病可出现戈谢细胞(Gaucher cells)向骨髓的浸润,出现骨痛、骨质疏松等骨骼系统症状[49-50]。I型戈谢病可通过酶学替代疗法得到有效的治疗[51],但在磁共振脂肪定量技术应用之前,并没有敏感可靠的方法评价I型戈谢病患者中骨髓病变对酶学治疗的反应。由于戈谢细胞的浸润,I型戈谢病患者存在骨髓脂肪含量下降情况(FF,0.08%~0.40%和27%~43%)[19],而这一改变理论上可被有效的酶学治疗纠正。Hollak等[19]应用Dixon化学移位成像技术监测骨髓脂肪比变化,发现12位应用酶学替代治疗4~5年的患者中,有11例骨髓脂肪比恢复到正常水平,而未经治疗的患者仍维持在一个较低的水平。研究同时指出,11位取得良好结果的患者中有6位提高了治疗剂量,但并未明确影响骨髓脂肪比的变化。这一结果充分表明,磁共振脂肪定量技术可较为敏感地评估I型戈谢病对酶学替代疗法的治疗反应。
3 存在的问题及展望
磁共振脂肪定量技术的一大缺点是设备昂贵,即使在理论和研究较为成熟的骨质疏松领域,指望该项技术取代传统的DXA测量方法,大范围用于骨质疏松的筛查与诊断显然也是不实际的。尽管如此,基于现有的理论和研究,磁共振脂肪定量技术作为一项无创的检查手段,至少在以下方面中具有一定优势:(1)预测骨质疏松骨折风险,尤其在代谢综合征患者;(2)因各种原因需要长期或大量使用固醇类药物的患者,需要监测骨骼状态;(3)再生障碍性贫血的无创诊断,尤其在儿童患者或有骨髓穿刺相对禁忌证的患者;(4)药物疗效的监测,如需要进行药物治疗的骨质疏松、血液系统恶性肿瘤等;(5)基础研究,如某些药物作用机制的探究、新药研发等。
磁共振脂肪定量技术作为一种可定量的检查方法,一改以往磁共振影像中依靠肉眼定性信号强度的诊断思路,在某些疾病的诊断与鉴别诊断、治疗与转归过程的评估上具有一定的独到之处。经过校正的IDEAL技术免去了MRS繁琐的扫描操作及数据后处理过程,大大缩短了扫描时间,更为该项检查在未来临床上的常规化提供了可能。尽管骨髓脂肪组织的作用尚未完全清楚,脂肪含量受疾病进程及体内外因素影响而发生变化的规律和意义尚在探索之中,现有的关于骨髓脂肪含量随年龄增长的生理性变化规律的资料也不甚完善,尤其缺乏较为重要的低年龄部分;但正因如此,骨髓脂肪含量变化在骨骼疾病中的应用具有非常广阔的探索空间,磁共振脂肪定量技术无论作为现阶段科学研究的手段还是未来独立的临床检测项目,都有十分乐观的应用前景。
[References]
[1]Gimble JM.The function of adipocytes in the bone marrow stroma.New Biologist, 1990, 2(4): 304-312.
[2]Gimble JM, Robinson CE, Wu X, et al.The function of adipocytes in the bone marrow stroma: an update.Bone, 1996, 19(5): 421-428.
[3]Beresford JN, Bennett JH, Devlin C, et al.Evidence for an inverse relationship between the differentiation of adipocytic and osteogenic cells in rat marrow stromal cell cultures.J Cell Science, 1992, 102(2):341-351.
[4]Bianco P, Riminucci M, Gronthos S, et al.Bone marrow stromal stem cells: nature, biology, and potential applications.Stem Cells, 2001,19(3): 180-192.
[5]Oreffo RO, Cooper C, Mason C, et al.Mesenchymal stem cells.Stem Cell Rev, 2005, 1(2): 169-178.
[6]Rosen CJ, Ackert-Bicknell C, Rodriguez J P, et al.Marrow fat and the bone microenvironment: developmental, functional, and pathological implications.Crit Rev Eukaryot Gene Expr, 2009, 19(2): 109-124.
[7]Cornish J, MacGibbon A, Lin JM, et al.Modulation of osteoclastogenesis by fatty acids.Endocrinology, 2008, 149(11): 5688-5695.
[8]Naveiras O, Nardi V, Wenzel PL, et al.Bone-marrow adipocytes as negative regulators of the haematopoietic microenvironment.Nature,2009, 460(7252): 259-263.
[9]Dazzi F, Ramasamy R, Glennie S, et al.The role of mesenchymal stem cells in haemopoiesis.Blood Rev, 2006, 20(3): 161-171.
[10]Kawai M, de Paula FJ, Rosen CJ.New insights into osteoporosis: the bone–fat connection.J Int Med, 2012, 272(4): 317-329.
[11]Krings A, Rahman S, Huang S, et al.Bone marrow fat has brown adipose tissue characteristics, which are attenuated with aging and diabetes.Bone, 2012, 50(2): 546-552.
[12]Shen W, Chen J, Punyanitya M, et al.MRI-measured bone marrow adipose tissue is inversely related to DXA-measured bone mineral in Caucasian women.Osteoporos Int, 2007, 18(5): 641-647.
[13]Shen W, Chen J, Gantz M, et al.MRI-measured pelvic bone marrow adipose tissue is inversely related to DXA-measured bone mineral in younger and older adults.European J Clin Nutrit, 2012, 66(9):983-988.
[14]Shen W, Gong XQ, Weiss J, et al.Comparison among T1-Weighted magnetic resonance imaging,modified dixon method, and magnetic resonance spectroscopy in measuring bone marrow fat.J Obesity,2013: 298675.
[15]Layer G, Traber F, Block W, et al.1H MR spectroscopy of the lumbar spine in diffuse osteopenia due to plasmacytoma or osteoporosis.Rofo Fortschr Geb Rontgenstr Neuen Bildgeb Verfahr, 1998, 169(6):596–600.
[16]Schwartz AV, Sigurdsson S, Hue TF, et al.Vertebral bone marrow fat associated with lower trabecular BMD and prevalent vertebral fracture in older adults.J Clin Endocrinol Metab, 2013, 98(6): 2294-300.
[17]Schellinger D, Lin CS, Hatipoglu HG, et al.Potential value of vertebral proton MR spectroscopy in determining bone weakness.Am J Neuroradiol, 2001, 22(8): 1620-1627.
[18]Li GW, Chang SX, Bao H, et al.Primary application of marrow fat contents in determining the risk of osteoporotic vertebral fracture.J Pract Radiol, 2012, 28(1): 74-77.李冠武, 常时新, 鲍红, 等.骨髓脂肪含量对预测骨质疏松性椎体骨折风险的初步应用.实用放射学杂志, 2012, 28(1): 74-77.
[19]Hollak C, Maas M, Akkerman E, et al.Dixon quantitative chemical shift imaging is a sensitive tool for the evaluation of bone marrow responses to individualized doses of enzyme supplementation therapy in type 1 Gaucher disease.Blood Cells Mol Dis, 2001, 27(6):1005-1012.
[20]Reeder SB, Pineda AR, Wen Z, et al.Iterative decomposition of water and fat with echo asymmetry and least- squares estimation (IDEAL):application with fast spin- echo imaging.Magn Reson Med, 2005,54(3): 636-644.
[21]Reeder SB, Wen Z, Yu H, et al.Multicoil Dixon chemical species separation with an iterative least- squares estimation method.Magn Reson Med, 2004, 51(1): 35-45.
[22]Yu H, Shimakawa A, Hines CD, et al.Combination of complex- based and magnitude- based multiecho water- fat separation for accurate quantification of fat-fraction.Magn Reson Med, 2011, 66(1): 199-206.
[23]Meisamy S, Hines CD, Hamilton G, et al.Quantification of hepatic steatosis with T1-independent, T2*-corrected MR imaging with spectral modeling of fat: blinded comparison with MR spectroscopy.Radiology, 2011, 258(3): 767-775.
[24]Pichardo JC, Milner RJ, Bolch WE.MRI measurement of bone marrow cellularity for radiation dosimetry.J Nuclear Med, 2011,52(9): 1482-1489.
[25]Peck WA, Burckhardt P, Christiansen C, et al.Consensus development conference: diagnosis, prophylaxis, and treatment of osteoporosis.Am J Med, 1993, 94(6): 646-650.
[26]Qin L, Zhang G.NIH consensus development panel on osteoporosis prevention diagnosis and therapy (translated text).Chin J Osteopor,2002, 8(1): 90-93.秦岭, 张戈.美国国家卫生院有关骨质疏松症的预防、诊断和治疗的共识文件(译文).中国骨质疏松杂志, 2002, 8(1): 90-93.
[27]WHO Study Group on Assessment of Fracture Risk, its Application to Screening for Postmenopausal Osteoporosis.Assessment of fracture risk and its application to screening for postmenopausal osteoporosis.World Health Organization, 1994.
[28]Cheng XG, Liu ZH.Official positions of the International Society for Clinical Densitometry and Executive Summary of the 2005 Position Development Conference (translated text).Chin J Osteopor, 2006,12(2): 205-9.程晓光,刘忠厚.国际临床骨密度学会共识文件(2005年版).中国骨质疏松杂志, 2006, 12(2): 205-209.
[29]Schuit SC, Van der Klift M, Weel A, et al.Fracture incidence and association with bone mineral density in elderly men and women: the Rotterdam Study.Bone, 2004, 34(1): 195-202.
[30]Adams JE.Quantitative computed tomography.Eur J Radiol, 2009,71(3): 415-424.
[31]Lochmüller EM, Bürklein D, Kuhn V, et al.Mechanical strength of the thoracolumbar spine in the elderly: prediction from in situ dual-energy X-ray absorptiometry, quantitative computed tomography (QCT),upper and lower limb peripheral QCT, and quantitative ultrasound.Bone, 2002, 31(1): 77-84.
[32]Yu AH, Chen XS, Sun WJ, et a1.Effects of Height, Weight and body mass index on bone mineral density measurements using DXA and QCT.Chin J Med Imag, 2011, 12(9): 909-911.于爱红, 陈祥述, 孙伟杰, 等.体重、身高及体重指数与双能X线骨密度仪和定量CT测量腰椎骨密度的关系.中国医学影像学杂志,2011, 12(9): 909-911.
[33]Boutrey S, Bouxsein ML, Munoz F.et a1.In vivo assessment of trabeeular bone microarehitecture by high-resolution peripheral quantitative computed tomography.J Clin Endocrinol Metsb, 2005,90(12): 6508-6515.
[34]Mittra E, Rubin C, Gruber B, et al.Evaluation of trabecular mechanical and microstructural properties in human calcaneal bone of advanced age using mechanical testing, μCT, and DXA.J Biomechanics, 2008,41(2): 368-375.
[35]Shi Y.The research on assessment of the osteoporosis and its response to the therapy using HRMRI.Suzhou: Soochow University, 2005.史勇.HRMRI评价骨质疏松症及其治疗结果的研究.苏州: 苏州大学, 2005.
[36]Justesen J, Stenderup K, Ebbesen EN, et al.Adipocyte tissue volume in bone marrow is increased with aging and in patients with osteoporosis.Biogerontology, 2001, 2(3): 165-171.
[37]Schellinger D, Lin CS, Lim J, et al.Bone marrow fat and bone mineral density on proton MR spectroscopy and dual-energy X-ray absorptiometry: their ratio as a new indicator of bone weakening.AJR Am J Roentgenol, 2004, 183(6): 1761-1765.
[38]Bredella MA, Torriani M, Ghomi RH, et al.Vertebral bone marrow fat is positively associated with visceral fat and inversely associated with IGF‐1 in obese women.Obesity, 2011, 19(1): 49-53.
[39]Von Muhlen D, Safii S, Jassal SK, et al.Associations between the metabolic syndrome and bone health in older men and women: the Rancho Bernardo Study.Osteopor Int, 2007, 18(10): 1337-1344.
[40]Miyanishi K, Yamamoto T, Irisa T, et al.Bone marrow fat cell enlargement and a rise in intraosseous pressure in steroid-treated rabbits with osteonecrosis.Bone, 2002, 30(1): 185-190.
[41]Motomura G, Yamamoto T, Miyanishi K, et al.Bone marrow fat-cell enlargement in early steroid-induced osteonecrosis: a histomorphometric study of autopsy cases.Pathol Res Pract, 2005,200(11): 807-811.
[42]Li GW, Xu Z, Chen QW, et al.The temporal characterization of marrow lipids and adipocytes in a rabbit model of glucocorticoidinduced osteoporosis.Skeletal Radiol, 2013, 42(9): 1235-1244.
[43]Li GW, Chang SX, Fan JZ, et al.Marrow adiposity recovery after early zoledronic acid treatment of glucocorticoid-induced bone loss in rabbits assessed by magnetic resonance spectroscopy.Bone, 2013,52(2): 668-675.
[44]Heim M, Frank O, Kampmann G, et al.The phytoestrogen genistein enhances osteogenesis and represses adipogenic differentiation of human primary bone marrow stromal cells.Endocrinology, 2004,145(2): 848-859.
[45]Liu Y, Tang G, Tang R, et al.Assessment of bone marrow changes in postmenopausal women with varying bone densities: magnetic resonance spectroscopy and diffusion magnetic resonance imaging.Chin Med J (English Edition), 2010, 123(12): 1524.
[46]Syed FA, Oursler MJ, Hefferanm TE, et al.Effects of estrogen therapy on bone marrow adipocytes in postmenopausal osteoporotic women.Osteopor Int, 2008, 19(9): 1323-1330.
[47]Wang HY.Internal Medicine.Beijing: Peking University Medical Press, 2005: 832-835, 884-939.王海燕.内科学.北京: 北京大学医学出版社, 2005: 832-835,884-939.
[48]Xu L, Chen Y, He GW, et al.Magnetic resonance imaging and spectroscopy of the bone marrow in children with common hematological diseases.Zhonghua Yi Xue Za Zhi, 2012, 92(9):587-591.
[49]Beutler E.Gaucher disease.Adv Genet, 1995, 32: 17-49.
[50]Stowens DW, Teitelbaum SL, Kahn AJ, et al.Skeletal complications of Gaucher disease.Medicine, 1985, 64(5): 310-322.
[51]Barton NW, Brady RO, Dambrosia JM, et al.Replacement therapy for inherited enzyme deficiency: macrophage-targeted glucocerebrosidase for Gaucher’s disease.N Engl J Med, 1991, 324(21): 1464-1470.
