纳米AlOOH(Al2O3)的合成及表面性质研究
2014-11-24季洪海沈智奇凌凤香
季洪海,苗 升,沈智奇,凌凤香
(1.中国石化抚顺石油化工研究院,辽宁 抚顺113001;2.中国石化胜利油建工程有限公司)
自从碳纳米管[1]被发现后,纳米材料的研究受到人们的重视。纳米氧化铝可被用作结构陶瓷[2]、催化剂载体[3]、阻燃剂[4]、吸附剂[5]等,因此纳米氧化铝的制备倍受关注。自1961年Bugosh[6]利用水热法制备γ-AlOOH纳米纤维后,水热法作为一种简单而易于工业化的方法,常被用来合成一维纳米γ-AlOOH。He等[7]以AlCl3和NH3为原料得到Al(OH)3胶体,然后将胶体置于一定浓度的H2SO4水溶液中水热处理,制得长度为50~2 000nm、直径为6~20nm 的 γ-AlOOH。Chen等[8]以 Al(NO3)3·9H2O和N2H4为原料,通过控制pH,采用水热法制备了γ-AlOOH纳米棒和纳米片。Ma等[9]将AlCl3·6H2O溶解到水与二甲苯的混合溶液中,然后向混合溶液中加入十二烷基苯磺酸钠和NaOH溶液,将得到的沉淀经水热处理、干燥、焙烧后制得Al2O3纳米棒。Liu等[10]将一定浓度的AlCl3溶液滴加到NaOH溶液中,将得到的沉淀加入一定量十六烷基三甲基溴化铵后转入高压釜中水热处理,经冷却、洗涤、干燥、焙烧后制得树叶状纳米Al2O3。然而,现有水热法制备纳米γ-AlOOH的过程较复杂,往往需要添加形貌控制剂,或者需要选择较复杂的合成体系及原料,成本较高,不利于工业放大生产。另外,对不同形貌纳米氧化铝的表面性质研究不够深入。本课题以廉价的AlCl3·6H2O和NaOH为原料,通过调节n(OH-)与n(Al3+)的比值合成γ-AlOOH纳米棒和纳米片,焙烧后得到相应的γ-Al2O3纳米棒和纳米片,并通过X射线衍射(XRD)、透射电子显微镜(TEM)、傅里叶变换红外光谱(FTIR)对样品进行表征。
1 实 验
1.1 原料及试剂
AlCl3·6H2O,分析纯,天津市福晨化学试剂厂生产;NaOH,分析纯,天津市永大化学试剂有限公司生产;去离子水。
1.2 样品合成
根据需要配制一定浓度的NaOH和AlCl3·6H2O溶液。量取一定体积的AlCl3·6H2O溶液,加入 NaOH 溶液调节n(OH-)/n(Al3+)的大小,密封下充分搅拌约30min。取70mL悬浮液转移至100mL聚四氟乙烯静态反应釜中,将反应釜放入烘箱中加热并保温一段时间。加热完毕后,取出反应釜置于冷水中冷却。除去上层清液,将沉淀用去离子水洗涤、离心过滤4~5次,然后在70℃下干燥24h,即制得AlOOH。将AlOOH置于马福炉中于550℃下焙烧4h后得到γ-Al2O3。AlOOH制备条件见表1。

表1 AlOOH制备条件
1.3 样品表征
XRD表征:采用荷兰帕纳科公司生产的X’Pert PRO MPD X光粉末衍射仪,Kα辐射源,石墨单色器,管电压40kV,管电流80mA,扫描范围10°~70°,步长0.01°,扫描速率1(o)/min。TEM表征:采用日本JEOL公司生产的JEM-2100(HR)六硼化镧透射电子显微镜测定样品的微观结构,加速电压200kV。FTIR表征:采用美国Nicolet-6700型傅里叶变换红外光谱仪测定Al2O3的羟基结构。
2 结果与讨论
2.1 TEM表征

图1 n(OH-)/n(Al3+)对纳米AlOOH形貌的影响
不同n(OH-)/n(Al3+)条件下合成的AlOOH的形貌如图1所示。从图1可以看出:当n(OH-)/n(Al3+)为2.0时(图1a),AlOOH 为条状颗粒,条长约400nm,宽度不一,从两头到中间直径逐渐增大,有聚集现象;当n(OH-)/n(Al3+)为2.3时(图1b),AlOOH的形貌为一维纳米棒,平均直径为14nm,平均长度为300nm,长径比为21;当n(OH-)/n(Al3+)为2.5时(图1c),AlOOH的形貌仍然为一维纳米棒,平均直径为15nm,平均长度为230nm,长径比为15.3;当n(OH-)/n(Al3+)为2.7时(图1d),平均直径为14nm,平均长度为120nm,长径比为8.6;当n(OH-)/n(Al3+)为2.9时(图1e),纳米棒开始向二维方向生长,AlOOH的形貌类似椭圆状,表面尺寸约为100 nm×50nm,厚度为10~20nm,此时晶粒形貌已经开始向片状结构转变,长径比为2;当n(OH-)/n(Al3+)为3时(图1f),AlOOH 已经全部变为厚度10~20nm、边长50nm的均匀纳米片。随着n(OH-)/n(Al3+)的增大,AlOOH 的长径比逐渐减小。图1f中的条状结构为侧立的纳米片的投影,其宽度恰是纳米片的厚度。
将棒状(样品3)和片状(样品6)纳米AlOOH置于马福炉中于550℃下焙烧4h,得到相应的棒状及片状γ-Al2O3,其TEM照片如图2所示。从图2可以看出:Al2O3纳米棒为平均长度约200nm、平均直径约10nm的均匀棒状结构,边缘光滑;Al2O3纳米片为边长约50nm、厚度约10nm的片状结构。图2b中的条状结构并不是纳米棒,而是侧立的纳米片的投影,其宽度恰是纳米片的厚度。

图2 Al2O3的TEM照片
为了研究以上2种不同形貌Al2O3的晶面特性,分别对2种Al2O3进行高分辨率及电子衍射研究。图3为Al2O3纳米棒不同取向的高分辨电镜照片。选区电子衍射图显示制备的Al2O3纳米棒为单晶。图3a为[0,1,-1]取向,高分辨放大图中,晶格间距为0.2nm,平行于纳米棒轴向,与γ-Al2O3的(400)晶面一致,所以纳米棒侧面为(100)晶面族。图3b为[1,-1,1]取向,高分辨放大图中,晶格间距为0.28nm,垂直于纳米棒的轴向,与γ-Al2O3的(220)晶面间距一致,所以纳米棒的端面为(110)晶面族。

图3 Al2O3纳米棒的高分辨及选区电子衍射图
图4为Al2O3纳米片的高分辨电镜图以及对应的选区电子衍射图。图4a为Al2O3纳米片平放时的正面高分辨图,取向为[0,1,-1]。高分辨图像中两个方向的晶格间距都为0.45nm,分别平行于相邻的两个侧面,经测量,其夹角为71°,而实际(111)面夹角为70°32′。纳米片两个表面为对称的平行四边形,所以得出侧面为(111)晶面族。图4b为纳米片侧面高分辨图以及对应的选区电子衍射图,取向为[1,-1,1],推测纳米片的上下表面为(110)晶面族。

图4 Al2O3纳米片的高分辨及选区电子衍射图
2.2 XRD表征
不同形貌AlOOH及Al2O3的XRD图谱如图5所示。从图5a可以看出:AlOOH的衍射峰主要在14.49°,28.21°,38.36°,48.94°,49.30°,55.26°,64.14°附近,与标准谱图对比,确定为正交晶系的勃母石,晶胞参数a=0.369 4nm,b=1.221 4nm,c=0.286 8nm;(020)晶面峰强度最大;所有的衍射峰均尖锐,说明AlOOH的结晶较好;没有杂峰出现,说明样品纯净,全为勃母石γ-AlOOH。由图5b可知:Al2O3纳米棒及Al2O3纳米片的XRD图谱 中,衍 射 峰 主 要 在 31.94°,37.60°,45.86°,60.90°,67.03°附近,与标准谱图对比,确定为立方相的γ-Al2O3,晶胞参数a=b=c=0.790 0nm,空间群为Fd-3m;没有杂峰出现,说明样品纯净,为γ-Al2O3;样品的衍射峰窄而尖锐,说明样品的结晶度好,晶粒尺寸大。
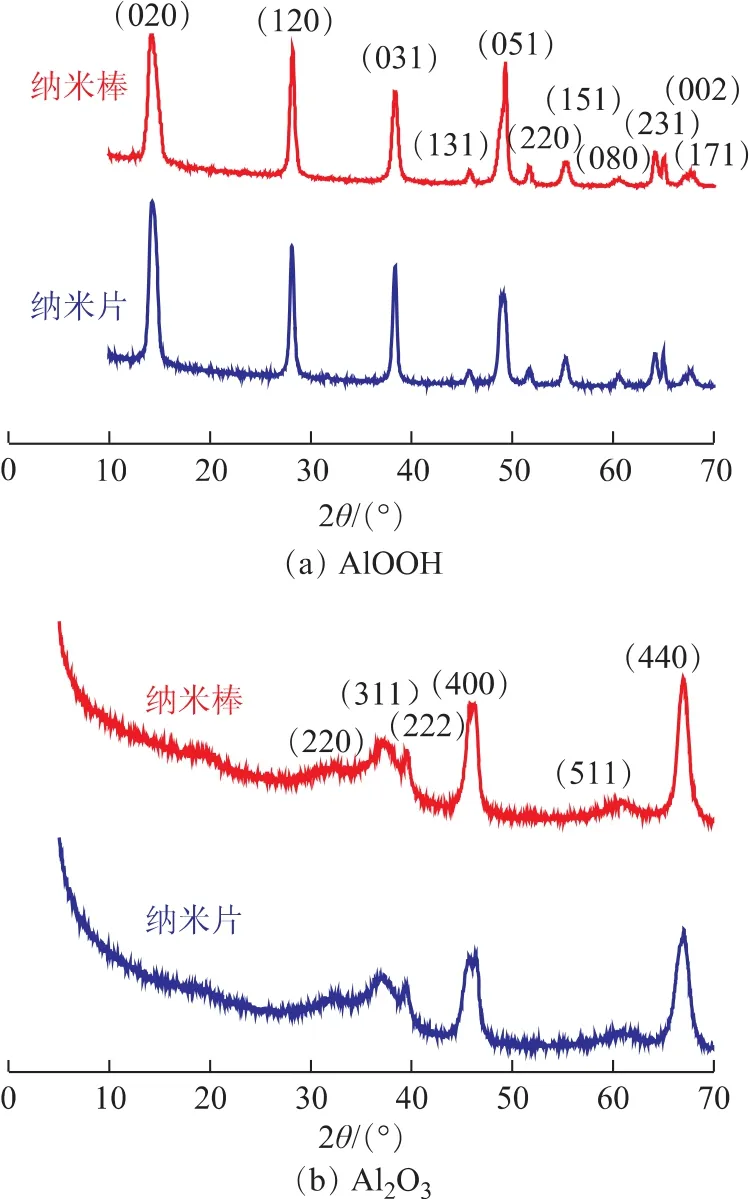
图5 AlOOH及Al2O3的XRD图谱
2.3 FTIR表征
图6为Al2O3纳米棒和Al2O3纳米片的红外光谱。从图6可以看出:Al2O3纳米棒的红外光谱有3个吸收峰,分别位于3707,3679,3550cm-1处,其中3707cm-1处的吸收峰为氧化铝(110)晶面HO-μ2-AlⅥ吸收峰[11],3679cm-1处的吸收峰为HO-μ3-AlⅥ吸收峰,该羟基主要存在于氧化铝(111)晶面及(100)晶面[12-13],另外,3550cm-1处存在一个较宽的吸收峰,该吸收峰归属于氧化铝(100)晶面HO-μ3-AlⅥ氢键的吸收峰,结合该处氢键的吸收峰可以确认3679cm-1处的吸收峰为(100)晶面HO-μ3-AlⅥ吸收峰;Al2O3纳米片的红外光谱有4个吸收峰,分别位于 3752,3733,3707,3679 cm-1处,其中3752cm-1和3733cm-1处的吸收峰分别归属于氧化铝(111)晶面HO-μ3-AlⅥ和HO-μ2-AlⅥ吸收峰[10],3707cm-1和3679cm-1处的吸收峰分别归属于氧化铝(110)晶面HO-μ2-AlⅥ和HO-μ3-AlⅥ吸收峰。
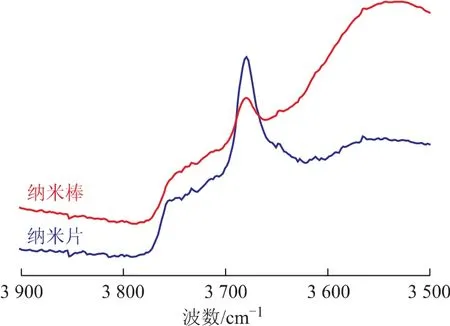
图6 Al2O3的红外光谱
3 结 论
在水热条件下,不加任何添加剂,调控n(OH-)/n(Al3+),合成出γ-AlOOH纳米棒和纳米片,经过焙烧得到γ-Al2O3纳米棒和纳米片。n(OH-)/n(Al3+)影响纳米粒子晶体的生长方向,随着n(OH-)/n(Al3+)的增大,Al2O3长径比逐渐减小,由最初的纳米棒生长成最终的纳米片。Al2O3纳米棒表面有2种类型的羟基,分别属于(110)晶面HO-μ2-AlⅥ和(100)晶面HO-μ3-AlⅥ;Al2O3纳米片表面有4种类型的羟基,分别归属于(111)晶面HO-μ3-AlⅥ、HO-μ2-AlⅥ和(110)晶面HO-μ2-AlⅥ和HO-μ3-AlⅥ。
[1]Iijima S.Helical microtubules of graphitic carbon[J].Nature,1991,354:56-58
[2]Arami H,Mazloumi M,Khalifehzadeh R,et al.Bundles of self-assembled boehmite nanostrips from a surfactant free hydrothermal route[J].Journal of Alloys and Compounds,2008,461(1/2):551-554
[3]Park I S,Kwon M S,Kim N,et al.Rhodium nanoparticles entrapped in boehmite nanofibers:Recyclable catalyst for arene hydrogenation under mild conditions[J].Chemical Communications,2005:5667-5669
[4]Camino G,Maffezzoli A,Braglia M,et al.Effect of hydroxides and hydroxycarbonate structure on fire retardant effectiveness and mechanical properties in ethylene-vinyl acetate copolymer[J].Polymer Degradation and Stability,2001,74(3):457-464
[5]Tanada S,Kabayama M,Kawasaki N,et al.Removal of phosphate by aluminum oxide hydroxide[J].Colloid Interface Science,2003,257(1):135-140
[6]Bugosh J.Colloidal alumina—The chemistry and morphology of colloidal boehmite[J].Phys Chem,1961,65(10):1789-1793
[7]He Taobo,Xiang Lan,Zhu Shenlin.Hydrothermal preparation of boehmite nanorods by selective adsorption of sulfate[J].Langmuir,2008,24(15):8284-8289
[8]Chen Xiangying,Zhang Zhongjie,Li Xueliang,et al.Controlled hydrothermal synthesis of colloidal boehmite(γ-AlOOH)nanorods and nanoflakes and their conversion intoγ-Al2O3nanocrystals[J].Solid State Communications,2008,145(7/8):368-373
[9]Ma Mingguo,Zhu Yingjie,Xu Zili.A new route to synthesis ofγ-alumina nanorods[J].Materials Letters,2007,61(8/9):1812-1815
[10]Liu Ye,Ma Ding,Han Xiuwen,et al.Hydrothermal synthesis of microscale boehmite and gamma nanoleaves alumina[J].Materials Letters,2008,62(8/9):1297-1301
[11]Digne M,Sautet P,Raybaud P,et al.Use of DFT to achieve a rational understanding of acid-basic properties ofγ-alumina surfaces[J].Journal of Catalysis,2004,226(1):54-68
[12]Ballinger T H,Jr Yates J T.IR spectroscopic detection of lewis acid sites on A12O3using adsorbed CO.Correlation with Al-OH group removal[J].Langmuir,1991,7(12):3041-3045
[13]Lavalley J C,Benaissa M.FT-IR study of the effect of pretreatment on the surface properties of alumina produced by flame hydrolysis of aluminium trichlo ride[J].Applied Catalysis,1986,24(1/2):249-255
