热疗、介入联合索拉非尼治疗原发性肝癌的研究
2014-09-17魏明琴徐细明
魏明琴,徐细明
(武汉大学人民医院,湖北 武汉 441000)
肝癌是我国临床最为常见的恶性肿瘤之一,具有极高的发病率,尤其现代人们生活、饮食习惯发生改变,肝炎、肝硬化等肝脏疾病增多,导致肝癌的发病率呈逐渐上升的趋势[1]。该病恶性程度较高,临床治疗方式包括外科手术、放化疗及生物免疫治疗等,单一治疗效果多不理想,预后较差,多需要进行综合治疗。热疗是近年来新型的重要辅助治疗方法,通过物理方法对相应组织升温,在不影响正常组织前提下对肿瘤细胞形成干扰,能够降低肿瘤耐药性,促进肿瘤细胞的化疗敏感性,与放化疗等其他治疗措施联合应用可协同提高疗效,且通常不会引起较严重的毒副作用,具有良好临床应用前景[2-3]。本研究旨在探讨局部热疗、介入联合索拉非尼治疗原发性肝癌的临床疗效,现报道如下。
1 临床资料
1.1一般资料 选取2010年5月—2013年2月本院收治的原发性肝癌患者49例,经临床检查及B超、CT、MRI等影像学检查均符合肝癌诊断标准,并经病理学检查均已证实确诊为原发性肝癌[4];年龄18~75岁,有介入治疗适应证;预计生存期不低于3个月,卡氏评分(KPS评分)不低于70分,临床分期Ⅲ~Ⅳ期;患者入组前充分了解相关内容,自愿参与并签署知情同意书,符合医学伦理学要求。排除标准[5]:非原发性或出现转移病灶肝癌患者,经检查发现门静脉主干癌栓或门脉高压患者,近期接受过放化疗等相关抗肿瘤治疗患者,肝功能分级Child C级合并严重黄疸者、肝硬化者,肿瘤巨大、体积超过全肝体积70%以上者,门静脉主干完全阻塞、无明显门脉侧支形成者,严重门脉高压、胃底食管静脉重度曲张、有破裂出血危险者,下腔静脉癌栓者,肝内外广泛转移者,胆管癌栓、伴明显黄疸者,严重糖尿病未予控制或合并全身严重感染者,肝肾功能障碍或衰竭者,血液性疾病或凝血异常者,伴有严重的心脏病或其他相关热疗禁忌证者,相关药物过敏者,对药物不良反应严重不耐受无法完成治疗方案者,不具备手术指证或不接受热疗等治疗方式者等。其中男30例,女19例;年龄27~71岁。将患者随机分为2组:观察组15例,男9例,女6例;年龄27~69(39.7±6.8)岁;临床分期Ⅲ期11例,Ⅳ期4例;单发病灶10例,多发5例。对照组34例,男21例,女13例;年龄29~71(41.2±7.1)岁;临床分期Ⅲ期24例,Ⅳ期10例;单发病灶22例,多发12例。2组基线资料均衡(P均>0.05),具有可比性。
1.2方法 对照组行微波消融术联合血管介入治疗。观察组在对照组治疗的基础上加用索拉非尼治疗。
1.2.1血管介入治疗 采用Sdingger技术插管成功后,行腹腔动脉和肠系膜上动脉插管。常规行腹腔动脉、肝总动脉和肠系膜上动脉血管造影,仔细分析造影表现,供血动脉超选择。超选到位后,在电视透视下行栓塞化疗。前30 min经导管注入止呕吐药及2%利多卡因5~10 mL、地塞米松5~10 mL以缓解疼痛。栓塞结束后用生理盐水将滞留于导管内的碘油冲洗干净,再次行血管造影,了解肿瘤血管阻断情况、栓塞效果,必要时给予再次栓塞。本研究选用化疗方案为FAM方案,即ADM 50 mg/m2+MMC 10 mg/m2+Lipiodol 10~30 mL+5-Fu 750 mg/m2+CF 100 mg/m2。
1.2.2经皮微波消融术 采用微波治疗仪,微波频率为915 MHz,输出功率为20~50 W,发射方式为脉冲。治疗前患者进行血常规、肝功能和凝血酶原时间测定。治疗当日禁食水,治疗前建立静脉通道,一般在静脉麻醉下进行。给予超声定位后,在超声引导下将电极送入穿刺预订的肝肿瘤部位,瘤周旁开5 mm常规放置测温针,根据肿瘤大小设定功率和时间组合,以瘤周温度达到60 ℃即刻或54 ℃持续3 min为停止消融的指标。作用时间一般需要5~10 min[6]。
1.2.3索拉非尼治疗 观察组患者在上述基础上联合索拉非尼进行治疗,给予索拉非尼(多吉美Nexavar,北京拜耳医药保健有限公司生产,国药准字H20060296)400 mg/次,2次/d,于饭后2 h口服,连续治疗1个月为1个疗程。
1.3观察指标 观察2组临床治疗效果及治疗期间不良反应(包括胃肠道反应、血小板减少、白细胞减少、肝功损伤等)发生情况,并使用肿瘤患者KPS评分对其治疗前后的生活质量实施评估。
1.4临床疗效评估标准[7]完全缓解(CR):肿瘤完全或基本消退,并维持4周以上无复发,亦无新病灶发生;部分缓解(PR):肿瘤最大病灶的最大垂直径乘积减少超过50%,并维持4周以上不扩大、亦无新病灶发生;维持无变化(NC):肿瘤最大病灶的最大垂直径乘积减少不足50%或增加不足25%,临床症状、体征无明显改变;进展(PD):肿瘤最大病灶的最大垂直径乘积增加超过25%,或出现新病灶。CR+PR为有效,CR+PR+NC为临床获益。
1.5统计学方法 采用SPSS17.0软件进行统计学处理。计数资料以率表示,行2检验;计量资料以表示,行t检验。检验水准为α=0.05。
2 结 果
2.12组临床疗效比较 观察组有效率及临床获益率均明显高于对照组(P均<0.05),见表1。
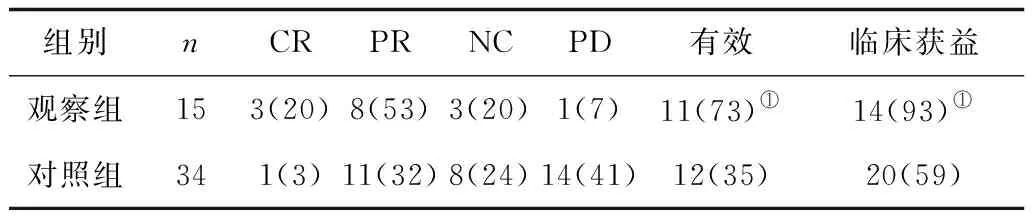
表1 2组临床疗效比较 例(%)
注:①与对照组比较,P<0.05。
2.22组治疗前后KPS评分比较 治疗后观察组KPS评分明显升高(P<0.05),且明显高于对照组(P<0.05),见表2。

表2 2组治疗前后KPS评分比较分)
2.32组治疗期间不良反应情况比较 2组患者治疗期间胃肠道反应、血小板减少、白细胞减少、肝功损伤等不良反应发生率比较差异未见统计学意义(P均>0.05)。见表3。
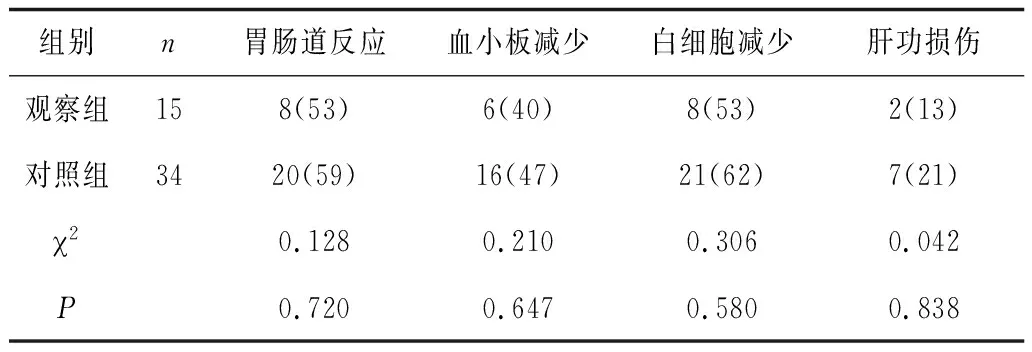
表3 2组治疗期间不良反应情况比较 例(%)
3 讨 论
原发性肝癌是最为常见的肝脏恶性肿瘤,在我国发病率、病死率较高。早期肝癌通常会采取外科手术切除肿瘤组织治疗,但由于该病在临床上发现时多已到达中晚期,不再具有手术指征与适应证,而放化疗等常规抗肿瘤措施治疗效果不甚理想,通常预后较差,患者生存率与存活时间较少[8]。同时该病术后复发率亦较高,术后5 a复发率累计可达到近90%,而再次复发后手术风险大幅升高,放化疗等治疗效果明显下降,这也是该病成为临床上关注度较高的恶性肿瘤的原因之一[9]。
随着上个世纪70年代现代影像技术的问世和近年来微创技术的不断发展,微创原位灭活技术得到长足进步,并在临床得到迅速推广和应用。初始主要采用化学消融技术,如对肿瘤病灶注入无水乙醇、醋酸、高渗盐水等,以达到小肝癌能完全坏死的效果,但其可控性较差,且须反复多次治疗,尤其对于较大肿瘤难以达到预期效果[10]。直至上个世纪90年代,随着微波、射频、激光及高强聚焦超声等现代热疗技术的迅速发展,才为局部适形热消融在临床的应用提供了必要的技术方法,这是肿瘤非开放性手术治疗的重大进步。当前应用于肝癌的热疗方法较多,主要包括经动脉导管热凝固、热化疗及热消融治疗等。其中以热消融治疗在临床应用最为广泛和有效,特别是射频和微波热消融治疗肿瘤已经取得了较好的普及和应用,其对直径小于3 cm的肝癌和肝转移癌的治疗效果相当于甚至优于手术治疗[11]。蔡树华等[12]使用超声引导下经皮微波消融治疗原发性肝癌患者872例,随访6个月~12 a,其1,2,3,4,5 a的累积生存率分别为93.5%,82.6%,72.2%,63.2%和51.3%,术后严重并发症发生率很低。多因素分析结果显示,肿瘤的大小、数目、Child分级对生存质量有显著性影响,而肿瘤有无复发对生存率的影响无显著意义。本研究所采用微波热消融技术通过富含水分的组织对微波辐射的吸收,加大能量输出,将局部温度提高到超过60 ℃,而微波所形成的热场接近球形,可在空间上完全覆盖肿瘤,从而达到消灭肿瘤细胞的目的。研究表明,局部热疗中温度的变化与病理组织学的改变有较好的对应性,54 ℃持续1 min或60 ℃即刻为正常肝细胞不可逆坏死的温度[13],癌细胞比正常细胞对热效应更加敏感,治疗中温度的监测可作为预测肿瘤坏死的重要指标。一般可将测温针放置于预设凝固区边缘,即肿瘤外缘5~10 mm,这是当前在热消融中对整个治疗区温度场进行估计的较有价值的方法。
局部热疗在多种肿瘤的临床治疗中发挥着重要的辅助作用,临床上已经将热疗视为疗效在外科手术、放化疗、生物免疫治疗之后的第5种治疗方法。相关研究表明,热疗能够有效提高化疗药物在患者体内浓度,甚至可以达到正常浓度的3倍以上,且可以促进肿瘤血管通透性以提高化疗药物向肿瘤的渗透、增强肿瘤对化疗药物敏感性,有效提高临床治疗效果[14]。肿瘤组织中央核心区域内细胞多属于乏氧细胞,对化学药物敏感性较差,但对高热温度有较高敏感性,而组织周边细胞则恰好相反,对温度不敏感而容易受到化学药物抑制,因此临床上常将热疗作为辅助治疗措施配合化学药物进行联合治疗,进而充分发挥其协同作用。热疗与化疗的协同作用可能与以下机制有关[15-16]:①加速血液流动,使化学药物更快达到肿瘤内部,以维持肿瘤组织中较高的药物浓度,并促进其与肿瘤细胞的加速结合,有效增强相关药物对于肿瘤的抑制效果;②对肿瘤细胞损伤后DNA修复进行抑制,以降低肿瘤细胞耐药性,甚至能够形成逆转而保障药物有效发挥作用;③对肿瘤细胞内蛋白质及核糖核酸等物质合成进行有效抑制,以控制肿瘤细胞的繁殖,诱导其死亡;④提高机体免疫能力并对骨髓形成保护;⑤抑制肿瘤组织中血管形成并控制其转移[17]。
热疗对于肿瘤细胞的直接杀伤途径包括以下几方面:①通过热量改变肿瘤细胞膜通透性并导致其细胞骨架散乱;②破坏肿瘤细胞内环境,并抑制其中细胞器的生理功能;③抑制肿瘤细胞内蛋白质、核酸合成并对其结构进行破坏;④抑制肿瘤细胞分裂、使其停滞在某一细胞周期中,并诱导细胞凋亡。由于肿瘤组织中血液流速较为缓慢,通过加热可以进一步减缓血液流动而引起血管内淤滞,有效减少肿瘤中心区域血液流动,抑制对肿瘤组织的供氧及营养支持,并引起其温度明显增高。相关研究显示热疗中肿瘤组织的温度相比周围正常组织温差能够达到近10 ℃,可以有效使肿瘤细胞被杀灭的同时不对其周围正常组织产生影响[18]。虽然热疗对于肿瘤组织具有灭活作用并有其自身作用机制,但临床上通常并不单独应用热疗进行治疗。
血管介入治疗同样是当前临床用于治疗肝癌的有效方法,其为不能耐受手术治疗的肝癌患者提供了一条新的治疗途径,在临床已广泛应用并取得公认的疗效,使众多中晚期不能手术的肝癌患者受益,生存期得以延长,也成为小肝癌患者根治性治疗手段之一。肝动脉插管灌注化疗一般与化疗栓塞同时进行,在患者不适合栓塞时可单纯给予动脉灌注化疗。目前国内多采用一次性冲击疗法,造影证实后,将化疗药物用生理盐水稀释后经导管缓慢注入,一般用时20~30 min。部分化疗药物经门脉循环回流入肝,对门静脉参与供血者可起到门静脉化疗作用,此方法可因高浓度化疗药物流入胃肠道及胰腺的供血动脉,不良反应会相应增加[19]。我院常用的动脉灌注化疗药物主要包括5-Fu、ADM、DDP、PTX等,需根据患者肝功及全身情况、既往化疗栓塞效果及下一步综合治疗计划来考虑化疗方案及用药剂量,对于肝功较差或年龄较大的患者,可考虑使用二联和1/3~1/2量的化疗药物进行。
本研究观察组患者除了应用上述热疗及血管介入2种治疗手段外,还联合索拉菲尼持续口服治疗,其治疗有效率及临床获益率均明显高于对照组;治疗后观察组KPS评分明显升高,且显著高于对照组;2组患者治疗期间胃肠道反应、白细胞计数降低、肝功损伤等不良反应发生率差异无统计学意义,尽管上述2种治疗手段联合应用可提高肝癌患者的生存率及生活质量水平,但在此基础上加用索拉菲尼更有利于提高临床疗效及获益率,KPS评分的提高也表明索拉菲尼还具有改善患者生存质量水平的作用,这可能与其杀灭肿瘤细胞、缓解临床症状体征、阻断患者病情进一步恶化等有关。
索拉非尼作为临床新型抗肿瘤药物,属于多靶点的多激酶抑制剂,可作用于肿瘤细胞及肿瘤血管上的丝氨酸/苏氨酸激酶及受体酪氨酸激酶,包括RAF激酶、VEGFR-2、VEGFR-3、血小板源性生长因子受体β(PDGFR-β)、干细胞因子受体(KIT)、Fms样酪氨酸激酶3(FLT-3)和神经胶质细胞系来源的亲神经因子受体(RET)。其一方面可抑制受体酪氨酸激酶KIT和FLT-3以及Raf/MEK/ERK途径中丝氨酸/苏氨酸激酶,抑制肿瘤细胞增生;另一方面,可通过上游抑制受体酪氨酸激酶VEGFR和PDGFR及下游抑制Raf/MEK/ERK途径中丝氨酸/苏氨酸激酶,抑制肿瘤细胞血管的生成,因此,该药具有抑制肿瘤细胞繁殖与血管形成的双重抗肿瘤效果[20]。相关研究证实,Raf激酶在大多数肝癌患者的肿瘤细胞组织中均存在过度表达的现象,HBV和HCV及有丝分裂生长因子均可对Raf/MEK/ERK途径进行激活,从而诱发肿瘤病变[21];由于肝癌为一种富血管性肿瘤,VEGF可促进肿瘤细胞的发展和转移,因此,该药阻断Raf-1的信号传导途径及VEGF的作用可能会对肝癌的治疗起到重要价值。秦凤婷等[22]进行了索拉菲尼与安慰剂对照治疗晚期肝癌的多中心、随机临床研究,患者随机接受索拉菲尼或安慰剂400 mg 2次/d口服治疗,终点时观察2组患者的生存期和症状进展时间,结果发现索拉菲尼组和安慰剂组患者总生存率的风险比(HR)为0.69(95%CI(0.5,0.87),P=0.000 6),同时证实索拉非尼对不同PS分级、有无肝外转移及肉眼可见的血管浸润患者均显示出不同程度的获益。康静波等[23]显示,索拉非尼组与安慰剂组严重不良事件(SAE)发生率相似,分别为52%与54%。其主要不良反应包括腹泻、出血及肢体皮肤反应等,通常较轻微且容易控制,安全性较高。另一项研究显示,索拉非尼可以阻断或缓解肝癌患者的病情进一步恶化,形成治疗效果,而明显延长了患者生存时间,是一种高效的抗肿瘤药物[24],这与本研究结果表现一致。索拉非尼与同期热疗、介入治疗具有良好的协同作用,可有效改善患者临床症状体征,提高短期治疗有效率及获益率,有助于提高KPS评分、改善患者生存质量。且加用索拉非尼治疗并未明显增加相关不良反应发生率,2组不良反应发生情况类似。
综上所述,热疗、介入治疗联合索拉非尼治疗原发性肝癌能有效改善患者临床症状,控制病情恶化,提高其生活质量,且不会增加不良反应,安全性较好,具有良好的临床应用效果及推广价值。
[参考文献]
[1] 陈俊伟,庞鹏飞,孟晓春,等. TACE联合索拉非尼治疗原发性肝癌合并不同分型门静脉癌栓的临床观察[J]. 中华医学杂志,2013,93(9):663-667
[2] 王丽,张新国,霍忠超,等. 肝动脉化疗栓塞术联合热疗及三维适形放疗对原发性肝癌的临床疗效分析[J]. 实用临床医药杂志,2013,17(1):24-26
[3] 喻刘杨,徐细明,戈伟,等. 伽玛刀放疗联合局部热疗治疗肝癌与单纯放疗对比的临床回顾性分析[J]. 实用肿瘤学杂志,2013,27(4):313-317
[4] Nozaki Y,Yamamoto M,Ikai I. Reconsideration of the lymph node metastasis pattern (N factor) from intrahepatic cholangiocarcinoma using the International Union Against Cancer TNM staging system for primary liver carcinoma[J]. Cancer,1998,83(7):1923-1929
[5] 蒋国樑. 索拉非尼与放射治疗联合应用治疗原发性肝癌:实验和临床研究[C]. 第十五届全国临床肿瘤学大会暨2012年CSCO学术年会论文集,2012:309-310
[6] 孙景娟,赵恒军,李薇,等. 射频消融联合索拉非尼治疗进展期肝细胞癌的临床观察[C]. 2011肝脏疾病转化医学论坛论文集,2011:145-149
[7] Kwon JH,Bae SH,Kim JY. Long-term effect of stereotactic body radiation therapy for primary hepatocellular carcinoma ineligible for local ablation therapy or surgical resection.Stereotactic radiotherapy for liver cancer[J]. BMC Cancer,2010,10(4):475
[8] 阮新建,王飞,李小梅,等. 肝动脉化疗栓塞联合射频热疗治疗原发性肝癌的疗效观察[C]. 第14届世界冷冻治疗大会暨第一届国际冷冻免疫学大会、第三届中国肿瘤靶向治疗大会论文集,2007:201-203
[9] Ueno S,Tanabe G,Nuruki K. Prognostic performance of the new classification of primary liver cancer of Japan (4th edition) for patients with hepatocellular carcinoma:a validation analysis[J]. Hepatol Res,2002,24(4):395-403
[10] 彭大为,黄仕思. 索拉非尼治疗前后原发性肝癌患者外周血T淋巴细胞和NK细胞的变化及临床意义[J]. 广东医学,2010,31(6):783-784
[11] 杜云翔,张建宇,曹海英,等. 经导管肝动脉化疗栓塞术联合伽玛刀和射频热疗治疗原发性肝癌56例分析[J]. 东南大学学报:医学版,2009,28(6):519-521
[12] 蔡树华,张东成,李化龙,等. 全身热疗联合奥沙利铂治疗中晚期原发性肝癌近期疗效观察[J]. 实用肝脏病杂志,2012,15(5):451-452
[13] 王威,齐雪梅. 体外高频热疗联合肝动脉化疗栓塞术治疗原发性肝癌患者的护理[J]. 中国实用护理杂志,2009,25(25):47-48
[14] 狄纪君,郭卫东,张惠洁,等. 原发性肝癌介入栓塞后动脉化疗联合热疗的疗效观察[C]. 第十届全国消化道恶性病变介入诊疗研讨会暨2010消化介入/内镜新技术国际论坛暨2010成都消化年会论文集,2010:202-208
[15] 张保祯,郁志龙. 热疗结合介入(TACE)及放疗(IMRT)治疗肝癌的临床研究[J]. 现代肿瘤医学,2013,21(12):2750-2753
[16] 蔡晓军,邓守恒. 替吉奥联合奥沙利铂化疗及热疗治疗晚期胃癌的临床研究[J]. 现代中西医结合杂志,2012,21(29):3237-3239
[17] 郭燕,刘文超,马骥,等. NDRG2在热疗抗肝癌细胞作用中的影响[J]. 现代肿瘤医学,2014,22(2):259-264
[18] 钟艳,刘俊骥,刘欣,等. 深部组织肿瘤热疗在肿瘤内科的临床应用[J]. 中国卫生产业,2014,11(2):128-130
[19] 戴晓萍. 盐酸替罗非班氯化钠注射液与心血管介入治疗急性心肌梗死患者临床效果[J]. 安徽医学,2013,34(8):1145-1147
[20] 刘代忠,刘爱祥. 索拉非尼靶向治疗肝细胞肝癌的现状与进展[J]. 广西医科大学学报,2013,30(6):977-980
[21] Dy GK,Hillman SL,Rowland KM Jr,et al. A front-line window of opportunity phase 2 study of sorafenib in patients with advanced nonsmall cell lung cancer:north central cancer treatment group study n0326[J]. Cancer,2010,16(24):5686-5693
[22] 秦凤婷,阎吕军. 索拉非尼治疗肝细胞肝癌疗效观察[J]. 现代中西医结合杂志,2013,22(15):1640-1642
[23] 康静波,赵向飞,聂青,等. 立体定向放疗联合热疗及索拉非尼治疗复发及转移性肝癌的疗效分析[J]. 中国肿瘤临床,2013,40(20):1236-1238
[24] 杨君,孟庆华,于红卫. 索拉非尼联合经皮肝动脉化疗栓塞术治疗肝细胞癌的Meta分析[J]. 临床肝胆病杂志,2013,29(10):764-765
