AMPK/PPARα/SCAD信号途径对心肌肥大的调控研究*
2014-08-08黄金贤罗佳妮刘培庆陈少锐黄秋菊潘雪刁臧林泉周四桂
黄金贤, 罗佳妮, 刘培庆, 陈少锐, 黄秋菊, 潘雪刁, 臧林泉, 周四桂△
(1广东药学院临床药学系,广东 广州 510006; 2中山大学药学院药理与毒理学实验室,广东 广州 510006)
我们采用定量蛋白质组学技术比较了16周龄自发性高血压大鼠和血压正常大鼠的心肌蛋白质组,首次发现短链酰基辅酶A脱氢酶(short-chain acyl-coenzyme A dehydrogenase,SCAD)在自发性高血压大鼠肥大心肌中的表达显著降低[1]。SCAD是脂肪酸β氧化的限速酶,对脂肪酸β氧化起着关键作用。我们的研究进一步证实,SCAD的蛋白表达及酶活性的显著下调,可能是导致自发性高血压大鼠肥厚心肌能量代谢“胚胎型再演”的分子基础[2];体外苯肾上腺素(phenylephrine,PE)刺激诱导的心肌细胞肥大模型中,SCAD在蛋白及mRNA水平均显著下调;采用siRNA干扰SCAD后,心肌细胞肥大指标明显上升,表明SCAD参与了心肌肥大的调控[3]。然而,SCAD调控心肌肥大的分子机制尚不清楚。
过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)是核受体超家族成员,也是脂肪酸氧化酶基因的主要转录调控子。研究证实,与野生型小鼠相比,PPARα-/-小鼠心肌中SCAD蛋白表达显著下调,且心肌对脂肪酸摄取、氧化能力下降,表明SCAD基因的表达受PPARα调控。已有大量的研究证明,心肌肥大过程伴随着PPARα的表达下调[4-6]。我们的研究发现,PPARα受体激动剂非诺贝特可能通过上调SCAD的表达抑制大鼠心肌肥大,改善心肌能量代谢障碍[7-8]。
腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)是一种丝/苏氨酸蛋白激酶,参与不同的生理及病理过程中细胞能量代谢的调控。研究表明,AMPK可通过激活PPARα信号通路,从而抑制心肌肥大[9]。因此,探讨AMPK/PPARα/SCAD信号途径是否对心肌肥大具有一定的调控作用,对于进一步阐明心肌肥大的分子机制具有重要的意义。
材 料 和 方 法
1 材料
单克隆兔抗p-AMPKα和AMPKα购于Cell Signaling Technology;单克隆鼠抗PPARα、单克隆兔抗SCAD、单克隆鼠抗α-tubulin、非诺贝特、5-bromo-2’-deoxyuridine(BrdU)、PE和5-氨基咪唑-4-甲酰胺核糖核苷酸(5-aminoimidazole-4-carboxamide ribonu-cleotide,AICAR)购于Sigma;BCA蛋白定量试剂盒和Western blotting发光液购于Thermo;游离脂肪酸含量测定试剂盒购于南京建成;RT-PCR测定试剂盒和TRIzol购于TaKaRa。
2 方法
2.1乳鼠心肌细胞培养 采用乳鼠心肌细胞改良法分离并培养心肌细胞,取2~3 d SD乳鼠(广州中医药大学实验动物中心)心脏用0.8%胰蛋白酶(Sigma)冰上消化20 min后,37 ℃水浴4 min,1次消化将乳鼠心脏消化成为单细胞悬液,在差速贴壁分离1 h后,调节细胞密度接种于培养皿中,置于37 ℃、5% CO2培养箱中培养,并加入BrdU (0.1 mmol/L)抑制成纤维细胞生长48 h。无血清培养24 h后,心肌细胞预先给予非诺贝特(10 μmol/L)或AICAR (0.5 mmol/L)30 min,再加入PE(20 μmol/L)刺激心肌细胞24 h,建立心肌细胞肥大模型。
2.2SCADRNA干扰SCADsiRNA购于上海吉玛生物制药技术有限公司,序列见表1。采用35 mm皿,siRNA∶Lipofectamine 2000 为 20 pmol∶1 μL。实验分组如下: (1) 空白对照组(control,Con): 不加任何转染试剂,不加siRNA;(2) 阴性对照组(negative control,NC): 加转染试剂和阴性对照siRNA;(3) siRNA-1186转染组:加转染试剂和siRNA-1186;(4) siRNA-744转染组:加转染试剂和siRNA-744;(5) siRNA-207转染组:加转染试剂和siRNA-207。转染方法按照公司提供的转染试剂说明书进行。

表1 siRNA 序列
2.3SCAD活性测定 按上海杰美基因医药科技有限公司提供的说明书进行实验,心肌细胞以(1~5)×106细胞密度接种于60 mm皿中,细胞生长密度达到70%~80%时以无血清培养基培养16~24 h 后,更换新的无血清培养基并且加入处理因素。
古树名木是一种自然资源,也是一种文化遗产,具有重要的经济、生态、科研、历史、纪念等价值。古树名木作为森林资源,可涵养水源、保持水土、除尘抑菌,具有稳固的生态功能[4];是珍贵的活文物,与城镇和宗教文化发展息息相关,具有深刻的历史文化价值[5];是自然科学研究的活标本,具有重要的科学价值[6];具有独特的观赏价值,是自然景观和文化景观的结合,是绝佳的旅游资源[7]。对古树名木的现状进行调查分析,并探讨相应的保护策略具有重大理论和现实意义。
2.4心肌细胞表面积测定 PE刺激24 h后,用Zeiss(AX10)倒置荧光显微镜(×200)进行拍照,各处理组随机选取10个视野,测量100个细胞的表面积,重复3次以上实验,用ImageJ图像分析系统进行数据分析。
2.5心肌细胞游离脂肪酸的含量测定 PE刺激24 h后,提取心肌细胞的总蛋白,采用BCA试剂盒进行蛋白定量,按照试剂盒说明书进行游离脂肪酸浓度的测定,根据吸光率计算心肌细胞中游离脂肪酸的含量。
2.6Real-time PCR检测PPARα、SCAD、心房利钠因子(atrial natriuretic factor,ANF)和脑利钠肽(brain natriuretic peptide,BNP) mRNA的表达 按照TRIzol说明书步骤提取细胞总RNA,采用紫外分光光度计检测RNA样品的A260/A280比值在1.8~2.0之间,以确定RNA纯度,并计算出RNA的浓度。参照RT-PCR试剂盒说明书进行逆转录反应,将反应管放置于PCR仪中进行逆转录反应,逆转录反应参数:95 ℃ 30 s (1个循环), 95 ℃ 5 s,60 ℃ 30 s(40个循环)。
RT-PCR扩增的引物序列见表2。两步法进行PCR扩增反应,按照说明书加入SYBR荧光染料、引物序列(上海生工生物工程股份有限公司)和RT产物后在real-time PCR仪中进行反应。反应参数如下:95 ℃ 10 s,90 ℃ 5 s,循环50次;95 ℃ 15 s,60 ℃ 1 h,65 ℃ 30 s,循环61次。每组样品设置3个复孔,以保证实验结果的有效性和重复性。

表2 RT-PCR扩增的引物序列
2.7Western blotting检测p-AMPKα、PPARα和SCAD蛋白的表达 提取各组心肌细胞总蛋白,BCA试剂盒检测细胞蛋白含量后调整上样量,分装、变性,配置10% SDS分离胶和5%浓缩胶进行电泳,电泳结束后转移至PVDF膜,室温封闭2 h后加入Ⅰ抗(SCAD为1∶1 000; PPARα为1∶500; p-AMPKα为1∶1 000; AMPKα为1∶1 000;α-tubulin为1∶5 000),过夜。漂洗后加入Ⅱ抗,室温孵育1 h,化学发光试剂增强反应,X光压片曝光、显影、定影,结果采用ImageJ图像分析系统对条带进行分析。
3 统计学处理
数据均以数±标准差(mean±SD)表示,采用SPSS 13.0 统计软件处理,组间比较应用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 siRNA的筛选结果
采用Western blotting、RT-PCR和SCAD活性测定比较3条干扰序列对SCAD的干扰效果,从图1可见,与空白对照和阴性对照组相比较,siRNA-1186、siRNA-744和siRNA-207均可以不同的程度降低SCAD蛋白、mRNA表达和酶活性,其中以siRNA-1186在蛋白、mRNA和酶活性水平上的降低程度最明显。因此选择siRNA-1186进行后续实验。

Figure 1. Selection of the siRNA sequences in cardiomyocytes.A: Western blotting results;B: RT-PCR results;C: SCAD activity.Mean±SD.n=5.*P<0.05,**P<0.01 vs Con.
2 siRNA-1186敲低SCAD基因对心肌细胞表面积及脂质代谢的影响
由图2可见,siRNA-1186通过瞬时转染对SCAD基因表达进行干扰后,心肌细胞表面积明显增加,心肌细胞出现了明显肥大,其程度与刺激因素PE诱导的心肌肥大趋势一致。此外,心肌细胞对脂肪酸的氧化能力明显降低,心肌细胞内游离脂肪酸含量显著增多,SCAD下调对心肌细胞脂质代谢的影响与PE诱导心肌细胞肥大导致的脂质变化一致。这表明SCAD的表达下调可能导致了心肌细胞脂肪酸β氧化能力下降,从而引起心肌细胞的游离脂肪酸含量增加,导致心肌细胞肥大发生。
3 siRNA-1186敲低SCAD基因对心肌细胞目的基因表达与SCAD酶活性的影响
由图3可见,siRNA-1186敲低SCAD基因和PE刺激均引起SCAD mRNA、蛋白表达及酶活性水平显著下降。此外,心肌肥厚标志因子ANF和BNP mRNA表达均有明显的上升,表明二者均引起心肌细胞出现了明显肥大,SCAD在心肌肥大过程中具有重要作用,其表达量的降低可能是造成心肌肥大的一个重要因素。
4 非诺贝特对1186敲低SCAD基因的心肌细胞保护作用
从图4可以看出,siRNA-1186通过瞬时转染对SCAD基因表达进行干扰后,SCAD mRNA、蛋白及酶活性均明显降低,心肌细胞表面积明显增加,心肌肥厚标志因子ANF和BNP mRNA表达明显上升,心肌细胞内游离脂肪酸含量明显增加。与siRNA-1186干扰SCAD后的心肌细胞相比,非诺贝特预处理作用于敲低SCAD的心肌细胞后,心肌细胞表面积明显变小,细胞内游离脂肪酸含量显著减少,肥厚标志因子ANF和BNP mRNA表达有明显的下降,SCAD mRNA水平明显升高,相对应的蛋白表达量及SCAD酶活性也显著增高,见图4、5。这表明心肌肥大过程中PPARα对SCAD有直接的调控作用。

Figure 2. The changes of surface area (A,B) and content of free fatty acids (C) in the cardiomyocytes treated with phenylephrine (PE, 20 μmol/L) or siRNA-1186.Mean±SD.n=5. **P<0.01 vs Con.

Figure 3. The expression and activity of SCAD in cardiomyocytes treated with phenylephrine (PE, 20 μmol/L) or siRNA-1186. A: Western blotting results; B: RT-PCR results; C: SCAD activity.Mean±SD.n=5.##P<0.01 vs NC;**P<0.01 vs Con.

Figure 4. The effect of fenofibrate (Feno) on the surface area (A) and content of free fatty acids (B) in the cardiomyocytes treated with siRNA-1186.Mean±SD.n=5. **P<0.01 vs Con; #P<0.05, ##P<0.01 vs siRNA-1186.

Figure 5. The effect of fenofibrate (Feno) on the expression and the activity of SCAD in cardiomyocytes treated with siRNA-1186. A: Western blotting results; B: RT-PCR results; C: SCAD activity.Mean±SD.n=5.**P<0.01 vs Con; #P<0.05, ##P<0.01 vs riRNA-1186.
5 非诺贝特对PE处理的心肌细胞表面积及游离脂肪酸含量的影响
图6显示,PE刺激24 h后,心肌细胞表面积明显增大,出现了心肌细胞肥大,而用非诺贝特能明显预防心肌细胞肥大,心肌细胞表面积明显减少。心肌细胞内的游离脂肪酸含量明显增多,而非诺贝特能显著降低心肌细胞的游离脂肪酸含量。

Figure 6. The effect of fenofibrate (Feno) on the surface area (A) and content of free fatty acids (B) in cardiomyocyte treated with phenylephrine (PE). Mean±SD.n=5.**P<0.01 vs Con; #P<0.05 vs PE.
6 非诺贝特对PE处理的心肌细胞PPARα和SCAD蛋白及mRNA表达的影响
由图7可见,PE刺激24 h后,心肌细胞内肥大标志物ANF和BNP mRNA表达量均显著上升,说明心肌细胞肥大模型建立成功。而SCAD和PPARα蛋白及mRNA表达水平均显著下调,表明心肌细胞肥大模型中,SCAD的表达下调,可能导致了心肌细胞的脂肪酸β氧化能力下降,从而引起心肌细胞的游离脂肪酸含量增加。非诺贝特能使PPARα和SCAD蛋白及mRNA水平显著上调,表明非诺贝特可能通过增加SCAD的表达,从而导致心肌细胞脂肪酸β氧化能力增强,引起心肌细胞的游离脂肪酸含量下降,预防心肌细胞肥大。
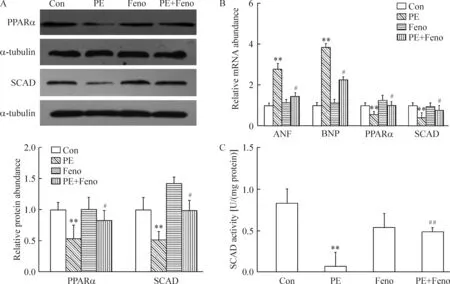
Figure 7. The effect of fenofibrate (Feno) on the expression of PPARα and SCAD at mRNA and protein levels in the cardiomyocytes treated with phenylephrine (PE).A: Western blotting results; B: RT-PCR results; C: SCAD activity.Mean±SD.n=5. **P<0.01 vs Con; #P<0.05,##P<0.01 vs PE.
7 AICAR对PE处理的心肌细胞表面积及游离脂肪酸含量的影响
由图8可见,PE刺激24 h后,心肌细胞表面积明显增大,而AICAR能显著逆转心肌细胞肥大;心肌细胞内的游离脂肪酸含量明显增多,而AICAR能显著降低心肌细胞的游离脂肪酸含量,这一变化趋势与非诺贝特预处理相一致。
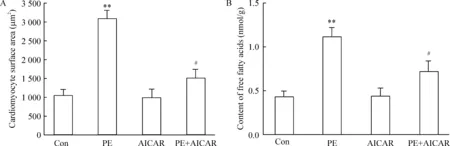
Figure 8. The effect of 5-aminoimidazole-4-carboxamide ribonucleotide (AICAR) on the surface area (A) and content of free fatty acids (B) in the cardiomyocytes treated with phenylephrine (PE).Mean±SD.n=5. **P<0.01 vs Con; #P<0.05 vs PE.
8 AICAR对PE处理的心肌细胞p-AMPKα、PPARα及SCAD表达的影响
由图9可见,PE刺激24 h后,心肌细胞ANF和BNP mRNA表达量均显著上升,而SCAD和PPARα mRNA表达则有所下调。与mRNA的变化趋势一致的是,PE刺激24 h后,SCAD、PPARα和p-AMPKα蛋白水平亦显著下调。AICAR能显著激活AMPK,使p-AMPKα表达下调。同时, PPARα和SCAD蛋白和mRNA水平均显著上调,表明AICAR可能通过激活AMPK增加PPARα的表达,从而上调下游基因SCAD,导致心肌细胞的脂肪酸β氧化能力增强,引起心肌细胞的游离脂肪酸含量下降,预防心肌细胞肥大。

Figure 9. The effect of 5-aminoimidazole-4-carboxamide ribonucleotide (AICAR) on the protein and mRNA expression of p-AMPKα, PPARα and SCAD in the cardiomyocytes treated with phenylephrine (PE).A: Western blotting results; B: RT-PCR results; C: SCAD activity. Mean±SD.n=5.**P<0.01 vs Con; #P<0.05,##P<0.01 vs PE.
讨 论
心肌肥大是心肌细胞对高血压、瓣膜病、急性心肌梗死及先天性心脏病等常见临床疾病的一种基本应答。心肌肥大的病理转变过程可分为肥大进展、肥大代偿和肥大失代偿期3个阶段。引起心肌肥大的发生机制极其复杂,至今仍未完全明了[10]。
心肌肥大是肥大刺激诱导核内基因异常表达的结果,细胞内信号转导通路是肥大刺激与核内基因转录活化的偶联环节。然而,不同刺激诱导的心肌肥大可能具有不同的“分子表型”,这主要取决于它们启动的信号转导通路。对心肌肥大信号转导通路的深入认识,不仅有助于阐明心肌肥大的分子机制,而且可为药物干预防治心肌肥大提供新思路[11]。
研究证实,胚胎时期哺乳动物心肌处于相对缺氧的环境,以葡萄糖及丙酮酸作为主要的能源物质,出生后则转为依赖脂肪酸氧化[12]。大量证据表明:当病理因素导致心肌肥大时,心肌能源供给由脂肪酸β氧化转变为以葡萄糖的酵解为主,即心肌能量代谢的“胚胎型再演”[13]。而与脂肪酸β氧化密切相关的SCAD是高度保守的酰基辅酶A脱氢酶家族成员之一,是脂肪酸β氧化第一步反应的限速酶。SCAD蛋白表达随年龄变化逐渐增加,且血清和心肌游离脂肪酸含量逐渐减少,可能与大鼠心肌对能量代谢底物的利用转变有关[2]。因此,SCAD作为脂肪酸β氧化的关键酶,其表达变化与心脏生长发育密切相关的同时,对心脏的能量代谢也起到重要的作用,进一步研究SCAD在心肌肥大能量代谢中的机制有着重要的意义。
本研究进一步采用RNA干扰技术敲低SCAD的表达,观察SCAD与心肌细胞肥大的关系,并与PE诱导的心肌细胞肥大模型相比较。我们观察到,敲低SCAD的表达后,心肌细胞表面积明显增大,心肌肥大标志因子ANF和BNP mRNA水平均显著上升,与PE诱导的心肌肥大趋势一致,SCAD的表达下调直接导致了心肌细胞的肥大发生,表明SCAD在心肌肥大的发生中具有重要作用。
敲低SCAD的表达后,心肌细胞内SCAD的蛋白表达和酶活性明显降低,心肌细胞内游离脂肪酸含量显著升高,提示心肌细胞的能量代谢出现了明显改变。SCAD下调对心肌细胞脂质代谢的影响与PE诱导心肌细胞肥大导致的脂质变化一致。此外,PE诱导的心肌肥大模型中,SCAD mRNA、蛋白表达及酶活性均显著下降。因此,我们推测,SCAD的脂肪酸氧化作用显著下降,可能导致了心肌细胞对脂肪酸的摄取和氧化能力明显降低,从而引起心肌细胞游离脂肪酸含量不断增多。
PPARα是核受体超家族成员,主要分布在脂肪酸氧化效率高的组织,是生理条件下心肌脂质和能量代谢的重要调控因子。然而,包括SCAD在内,依赖PPARα的脂肪酸代谢酶至少有7个。因此,心肌中高分布的PPARα与心肌能量代谢密切相关。本研究发现PE刺激24 h后,心肌细胞明显肥大,心肌细胞的游离脂肪酸含量明显增加,并伴有PPARα和SCAD的表达下调,呈现脂肪酸的利用减少和SCAD的表达下调相一致的趋势,表明肥大心肌存在脂肪酸氧化酶基因表达水平的降低,从而引起脂肪酸利用受阻,最终导致心肌能量代谢障碍,可能与肥大心肌细胞中PPARα的表达水平降低,引起的SCAD表达减少有关。本研究采用PPARα受体激动剂,观察到非诺贝特在激活PPARα和SCAD表达的同时,可明显逆转心肌细胞肥大,增强肥大心肌细胞对脂肪酸的代谢,降低心肌细胞中游离脂肪酸的含量。并在证实SCAD下调与心肌肥大脂质代谢密切相关的基础上,观察到非诺贝特预处理可以上调SCAD mRNA、蛋白表达及增高酶的活性,减少心肌细胞表面积,降低肥厚标志因子ANF和BNP mRNA表达,减低心肌细胞内游离脂肪酸的含量,直接预防敲低SCAD引起的心肌细胞肥大,表明心肌肥大中PPARα对SCAD具有直接的调控作用。综上所述,非诺贝特可能通过激活心肌细胞PPARα,进而上调依赖PPARα的下游基因SCAD,使SCAD酶活性增强,从而增强心肌细胞脂肪酸的β氧化,改善心肌细胞的能量代谢,预防心肌细胞肥大。这表明PPARα/SCAD信号途径对心肌肥大具有直接的调控作用。
AMPK是一个表达在心血管系统的异源三聚体蛋白,能调节体内能量代谢,在压力超负荷的作用下,会增加细胞AMP/ATP的比率,导致ATP减少。AMPK失活与心肌功能障碍及其它代谢性疾病相关[14], AICAR为AMPK的激活剂,可通过激活AMPKα磷酸化位点Thr172,对PE诱导的心肌肥大有一定的保护作用[15]。本研究显示,PE刺激24 h后,p-AMPK的表达显著下调,AICAR在激活AMPK的同时,可明显逆转心肌细胞肥大,显著增强肥大心肌细胞的脂肪酸氧化,并伴随着PPARα及SCAD的表达上调,表明AICAR可能通过激活AMPK进而活化PPARα,上调脂肪酸氧化限速酶SCAD的表达,从而增强心肌细胞脂肪酸的β氧化,改善能量代谢,预防心肌细胞肥大。可见,AMPK/PPARα/SCAD信号途径可能介导了心肌细胞肥大的发生。
研究表明,体外激活AMPK抑制心肌肥大是通过FOXO1/MuRF1信号通路介导的[16]。而AICAR可通过激活ERK1/2信号途径,从而提高PPARα活性,抑制心肌肥大[9]。可见,激活AMPK/PPARα信号通路可能与AMPK/FOXO1/MuRF1信号通路有关,ERK1/2信号途径是否参与了AMPK/PPARα/SCAD信号通路对心肌肥大的调控,有待进一步研究。
[参 考 文 献]
[1] Zhou SG, Zhou SF, Huang HQ, et al. Proteomic analysis of hypertrophied myocardial protein patterns in renovascularly hypertensive and spontaneously hypertensive rats[J]. J Proteome Res, 2006, 5(11): 2901-2908.
[2] 周四桂, 王 平, 路 遥, 等. 短链酰基辅酶A脱氢酶在大鼠心脏发育中的表达及其与心肌肥厚的关系[J]. 中国病理生理杂志, 2013, 29(1):9-14.
[3] 罗佳妮, 周四桂, 陈少锐, 等. 短链脂酰辅酶A脱氢酶与心肌肥大关系的初步探索[J]. 中国药理学通报, 2013, 29(5):637-642.
[4] Ichihara S, Obata K, Yamada Y, et al. Attenuation of cardiac dysfunction by a PPAR-α agonist is associated with down-regulation of redox-regulated transcription factors[J]. J Mol Cell Cardiol, 2006, 41(2):318-329.
[5] Zou J, Le K, Xu S, et al. Fenofibrate ameliorates cardiac hypertrophy by activation of peroxisome proliferator-activated receptor-α partly via preventing p65-NFκB binging to NFATc4[J]. Mol Cell Endocrinol, 2013, 370(1-2):103-112.
[6] Purushothaman S, Sathik MM, Nair RR. Reactivation of peroxisome proliferator-activated receptor alpha in spontaneously hypertensive rat: age-associated paradoxical effect on the heart[J]. J Cardiovasc Phamacol, 2011, 58(3):254-262.
[7] 周四桂, 王 平, 路 遥, 等. 短链酰基辅酶A脱氢酶在大鼠生理性和病理性心肌肥大中的作用[J]. 中国病理生理杂志, 2012, 28(11):1921-1927。
[8] 周四桂, 徐立朋, 路 遥, 等. 非诺贝特通过上调短链酰基辅酶A脱氢酶抑制大鼠心肌肥厚[J]. 中国临床药理学与治疗学, 2013, 18(8):868-873.
[9] Meng R, Pei Z, Zhang A, et al. AMPK activation enhances PPARα activity to inhibit cardiac hypertrophy via ERK1/2 MAPK signaling pathway[J]. Arch Biochem Biophy, 2011, 511(1-2):1-7.
[10] 李 潞. 心脏肥大发生机制研究进展[J]. 沈阳医学院学报, 2009, 11(1):1-5.
[11] 符民桂, 唐朝枢. 心肌细胞肥大的信号转导通路[J]. 生理科学进展, 2000, 31(1):19-24.
[12] Khan RS, Lin Y, Hu Y, et al. Rescue of heart lipoprotein lipase knockout mice confirms a role for triglyceride in optimal heart metabolism and function[J]. Am J Physiol Endocrinol Metab, 2013, 305(11): E1339-E1347.
[13] Breckenridge RA, Piotrowska I, Ng KE, et al. Hypoxic regulation ofHand1 controls the fetal-neonatal switch in cardiac metabolism[J]. PLoS Biol, 2013, 11(9): e1001666.
[14] Wong AK, Howie J, Petrie JR, et al. AMP-activated protein kinase pathway a potential therapeutic target in cardiometabolic disease[J]. Clin Sci, 2009, 116(8): 607-620.
[15] Pang T, Raiapurohitam V, Cook M, et al. Differential AMPK phosphorylation sites associated with phenylephrinevsantihypertrophic effects of adenosine agonists in neonatal rat ventricular myocytes[J]. Am J Physiol Heart Circ Physiol, 2010, 298(5):H1382-H1390.
[16] Chen BL, Ma YD, Meng RS, et al. Activation of AMPK inhibits cardiomyocyte hypertrophy by modulating of the FOXO1/MuRF1 signaling pathyinvitro[J]. Acta Pharmacol Sin, 2010, 31(7):798-804.
