气相色谱/质谱测定皮革及其制品中乙二醇醚类有机溶剂的残留量
2014-08-03王成云张伟亚李丽霞沈雅蕾林君峰谢堂堂褚乃清
王成云, 张伟亚, 李丽霞, 沈雅蕾, 林君峰, 谢堂堂, 褚乃清
(深圳出入境检验检疫局工业品检测技术中心,广东深圳518067)
乙二醇醚类有机溶剂是环氧乙烷的重要衍生物,其分子内同时含有醚键和羟基,具有十分优异的性能,因此获得了广泛的应用。在皮革工业中,乙二醇醚类有机溶剂大量用于着色剂、匀染剂等助剂中。20世纪80年代以来,对乙二醇醚类有机溶剂的毒性进行了大量研究[1],发现乙二醇醚类有机溶剂在体内代谢后会形成剧毒物质,对人体造成永久性伤害,甚至会致癌。因此各国及组织纷纷立法限制使用乙二醇醚类有机溶剂[2-4],欧盟法规《化学品的注册、评估、授权和限制》(REACH法规)规定,乙二醇醚类有机溶剂使用量不得超过0.1%。目前限制使用的乙二醇醚有机溶剂已达7种,欧盟更将乙二醇单甲醚(ethylene glycol methyl ether,EGME)、乙二醇单乙醚(ethyleneglycol ethyl ether,EGEE)、乙二醇二甲醚(ethylene glycol dimethyl ether,EGDME)、乙二醇二乙醚(ethylene glycol diethyl ether,EGDEE)、二乙二醇二甲醚(diethylene glycol dimethyl ether,DEGDME)列入高关注物质(substance of very high concern,SVHC)清单中。我国乙二醇醚类有机溶剂的消费量占全球总消费量的21%,国外对乙二醇醚类有机溶剂的严厉限制给我国皮革制品的出口设立了一道技术贸易壁垒,必须建立一个快速简便的检测方法,以应对国外技术贸易壁垒。目前对乙二醇醚类有机溶剂的检测主要集中在环境样品、化妆品、食品、防冻剂、涂料、纺织品、玩具等方面[5-14],采用的检测方法有气相色谱法、气相色谱/质谱法、毛细管柱气相色谱法、液相色谱/质谱法等,但这些文献中均只涉及部分被限用的乙二醇醚类有机溶剂,尚未有文献报道对全部7种限用乙二醇醚类有机溶剂进行测定,而皮革及其制品中乙二醇醚类有机溶剂残留量的测定则尚未见文献报道。
皮革样品基质复杂,大量共存杂质与待测物质往往同时被萃取出来,影响待测组分检测的灵敏度,因此通常需要先进行净化处理,而固相萃取柱净化则是最常用的净化手段[15-17]。本文采用超声萃取技术提取皮革及其制品中的乙二醇醚类有机溶剂,萃取物经固相萃取柱净化后进行气相色谱/质谱-选择离子监测法(GC/MS-SIM)测定,建立了一个同时测定12种乙二醇醚类有机溶剂残留量的气相色谱-质谱联用方法。
1 实验部分
1.1 仪器与试剂
Agilent 7890A-7000B三重四极杆气相色谱-质谱联用仪(美国Agilent公司);AS 20500AT超声波清洗器(Auto Science公司);Retch SM 2000织物研磨仪(德国Retch公司);SmarVapor RE501旋转蒸发仪(德国Dechem-Tech公司);氮吹仪(青岛海科仪器有限公司);0.22 μm滤膜(德国Membrane公司);硅胶固相萃取柱(美国Waters公司,规格为1 g/6 mL)。
色谱纯甲醇(美国Media公司),分析纯试剂二氯甲烷、丙酮、四氢呋喃、甲醇、乙酸乙酯、乙醇、乙腈(广州化学试剂厂)。
标准品乙二醇单甲醚(纯度99.8%)、乙二醇单乙醚(纯度99.5%)、乙二醇单丁醚(ethylene glycol butyl ether,EGBE,纯度99.8%)、二乙二醇单甲醚(diethylene glycol methyl ether,DEGME,纯度99.5%)、二乙二醇单乙醚(diethylene glycol ethyl ether,DEGEE,纯度 99.0%)、二乙二醇单丁醚(diethylene glycol butyl ether,DEGBE,纯 度98.5%)、乙二醇二甲醚(纯度99.9%)、乙二醇二乙醚(纯度99.5%)、乙二醇二丁醚(EGDBE,纯度99.5%)、二乙二醇二甲醚(纯度99.9%)、二乙二醇二乙醚(diethylene glycol diethyl ether,DEGDEE,纯度99.5%)、二乙二醇二丁醚(diethylene glycol dibutyl ether,DEGDBE,纯度 99.8%)均由德国Dr.Ehrenstorfer公司提供。
1.2 标准溶液的配制
分别称取适量的标准品,用甲醇溶解,配制成质量浓度约为2 000 mg/L的标准储备液。分别移取适量的各标准溶液储备液,配制成混合标准溶液储备液,其中各组分的质量浓度分别为40.00(EGME)、80.16(EGEE)、41.00(EGBE)、41.20(EGDME)、40.32(EGDEE)、28.98(EGDBE)、29.26(DEGME)、20.20(DEGEE)、31.14(DEGBE)、42.04(DEGDME)、42.60(DEGDEE)、28.20 mg/L(DEGDBE)。使用时,用甲醇逐级稀释至所需浓度。
1.3 样品前处理
选取有代表性的样品,用织物研磨仪磨碎成粉末,混匀。称取1.0 g样品,置于150 mL磨口锥形瓶中,加入25 mL乙酸乙酯,在45℃下超声萃取30 min,收集上清液,残渣用25 mL乙酸乙酯进行第二次萃取,合并萃取液,旋转蒸发至近干,再用氮气缓慢吹干。用5 mL甲醇溶解残留物,转移至用5 mL甲醇预活化的Waters Sep-Pak Vac Silica(1 g/6 mL)固相萃取柱中,控制流速为2滴/s,收集流出液,用5 mL甲醇淋洗固相萃取柱并收集流出液。流出液旋转蒸发至近干,用氮气缓慢吹干后,用2 mL甲醇溶解并定容,经0.22 μm滤膜过滤后进行气相色谱/质谱-选择离子监测法分析。必要时,先进行适当稀释。
1.4 GC/MS 条件
DB-Wax色谱柱(60 m×0.25 mm×0.25 μm),起始温度60℃,保持2 min,以20℃/min的速度升至220℃,保持3 min。后处理温度为245℃,时间为5 min。进样口温度230℃,传输线温度280℃。载气为氦气,纯度 >99.999%,流速0.8 mL/min,进样量1.0 μL,脉冲分流进样,分流比20∶1,溶剂延迟5.2 min。
离子源温度220℃,电子轰击(EI)电离方式,电离能量70 eV。监测方式:全扫描模式定性,选择离子扫描模式定量,监测离子见表1。μm)分离不够完全,而极性柱DB-Wax(60 m ×0.25 mm×0.25 μm)可达到良好的分离效果。
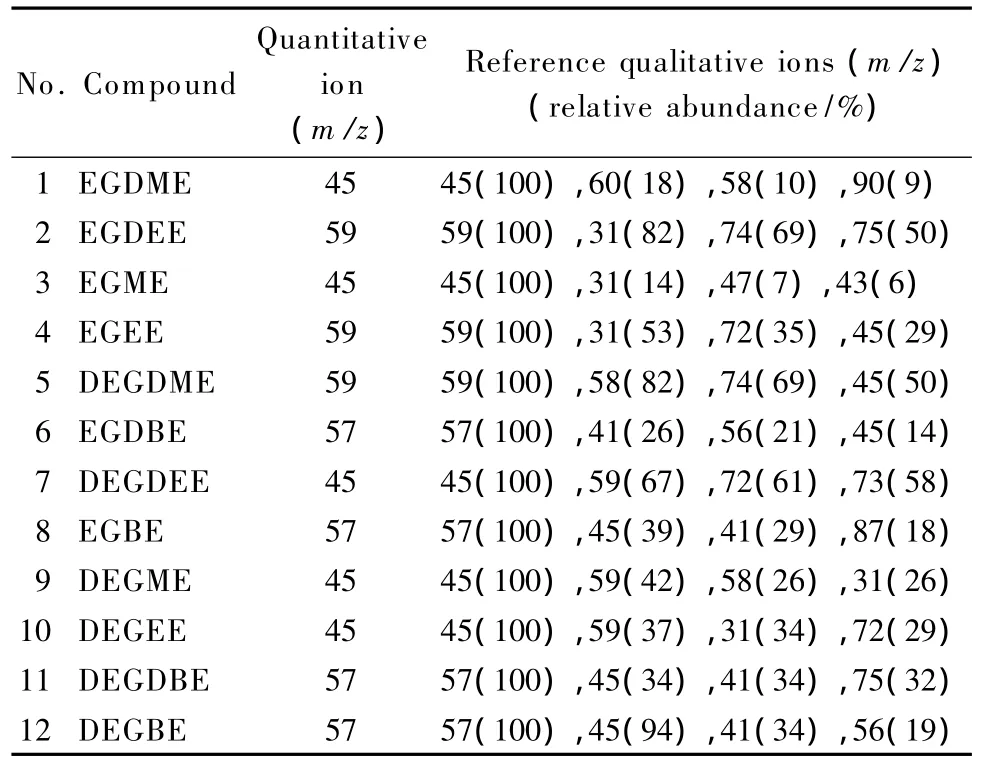
表1 目标化合物的特征离子和定量离子Table 1 Characteristic ions and quantitative ions of the target compounds
通常可采用分流进样和不分流进样两种进样方式,经对比研究,发现采用分流进样方式时,所得的谱图质量较高,因此选择采用分流进样方式。
为更全面地考察各因素的综合影响,针对进样口温度、离子源温度、载气流速、分流比等影响色谱峰面积的4个因素,设计了表2所示的四因素三水平正交实验,对实验数据进行归一化处理以便于进行比较[18],实验结果表明,No.9条件下总峰面积最大。因此,分析条件最终确定如下:进样口温度230℃,离子源温度220℃,载气流速0.8 mL/min,分流比为20∶1。图1给出了12种乙二醇醚类混合标准液的选择离子监测色谱图,图1中各组分之间完全分离,各谱峰峰形尖锐,对称性好。

表2 气相色谱/质谱条件正交实验Table 2 Orthogonal experiments of gas chromatography/mass spectroscopy conditions
2 结果与讨论
2.1 分析条件的优化
色谱分离时,固定液种类的不同极大地影响目标化合物在色谱柱上的保留时间和分离度,乙二醇醚类有机溶剂分子中含有烷基、醚键,有的还含有羟基,在实验过程中,分别使用不同极性的色谱柱,如弱极性柱 DB-5MS(30 m ×0.25 mm ×0.25 μm)、DB-5MS(60 m × 0.25 mm ×0.25 μm)、DB-5HT(15 m×0.25 mm ×0.10 μm)、DB-35MS(30 m ×0.25 mm×0.25 μm)、中等极性柱 DB-624(30 m ×0.25 mm×4.10 μm)、极性柱 DB-Wax(30 m × 0.25 mm ×0.25 μm)、DB-Wax(60 m ×0.25 mm ×0.25 μm)等7种不同的色谱柱进行分离,改变色谱条件,观察分离效果。结果发现,弱极性柱和中等极性柱分离效果均不好,极性柱DB-Wax(30 m×0.25 mm×0.25
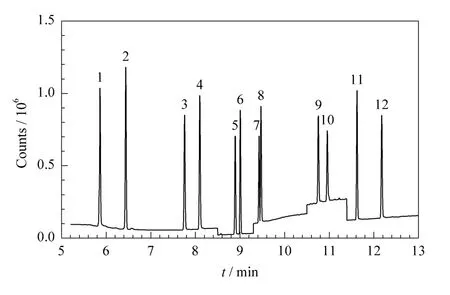
图1 优化条件下12种目标物混合标准溶液的选择离子色谱图Fig.1 SIM chromatogram of a mixed solution of the 12 standards by GC/MS under optimized conditions
2.2 净化条件的优化
皮革样品基质复杂,待测物提取后,往往需要进行净化处理。固相萃取(SPE)是集富集、分离、净化于一体的一种样品预处理技术,填料是其技术核心。本文选择了极性、吸附原理、吸附容量及填料种类各异的15种SPE柱:Waters Sep-Pak Vac Silica(1 g/6 mL)、Supelclean LC-C18SPE(1 g/6 mL)、Supelclean LC-Ph SPE(0.5 g/3 mL)、Supelclean LC-Si SPE(1 g/6 mL)、Waters Sep-Pak Vac C18(0.5 g/3 mL)、AccuBond Florisil PR(0.5 g/3 mL)、Anpelclean PA SPE(1 g/6 mL)、CNWBond LC-C18(1 g/6 mL)、Supelclean LC-Florisil SPE(1 g/6 mL)、Agilent Bond Elut Si(1 g/6 mL)、Agilent Bond Elut C18(1 g/6 mL)、Varian HF Bond Elut C18(2 g/12 mL)、Varian Bond Elut SCX(0.5 g/3 mL)、Supelclean ENVI-18 SPE(0.5 g/3 mL)、Agilent Bond Elut Al-N(0.5 g/3 mL),考察它们对混合标准液和实际样品溶液的预处理效果,并将净化前后的溶液进行对照。实验结果表明,C18柱可有效去除提取物中的油脂,但不能有效去除色素,Florisil柱对油脂和色素的去除效果均不佳,硅胶柱可有效去除色素;过柱时的流速和淋洗液体积也是影响SPE净化效果的重要因素,分析目标物的回收率与流速和淋洗液体积成反比,这些实验结果与文献报道一致[19,20]。另外,萃取效果对柱容量也有要求,容量过小将导致回收率偏低。Waters Sep-Pak Vac Silica柱的填料为极性的二氧化硅,填料与乙二醇醚类之间的作用机理为正相萃取,乙二醇醚中的极性基团与填料中的极性二氧化硅之间的作用力在萃取过程中起到了主导作用。用强极性溶剂洗脱时,目标分析物被洗脱下来,而杂质则被留在硅胶上。
在1.3节的条件下,使用Waters Sep-Pak Vac Silica柱(1 g/6 mL)可获得最好的回收率和净化效果。对于混合标准液,各组分的回收率均在97%以上,远高于其他萃取柱,而且净化后的样品谱图中杂质峰最少,而使用其他SPE柱净化后样品溶液尚存有少量杂质,甚至引入新的杂质。对于实际样品,各组分回收率均大于87%,且谱图中杂质峰极少,回收率和净化效果远远好于其他萃取柱。表3给出了牛皮、猪皮、羊皮等3种不同基质的皮革制品的过柱净化回收率数据。这3种皮革制品中均不含目标分析物,分别添加质量浓度约为5 mg/L的混合标准液2 mL,用 Waters Sep-Pak Vac Silica柱净化,收集洗脱液,定容至10 mL,测定回收率。从表3可知,对于3种不同基质的皮革,各组分的回收率均大于87.0%。因此,本文最终选择采用Waters Sep-Pak Vac Silica柱(1 g/6 mL)进行净化处理。
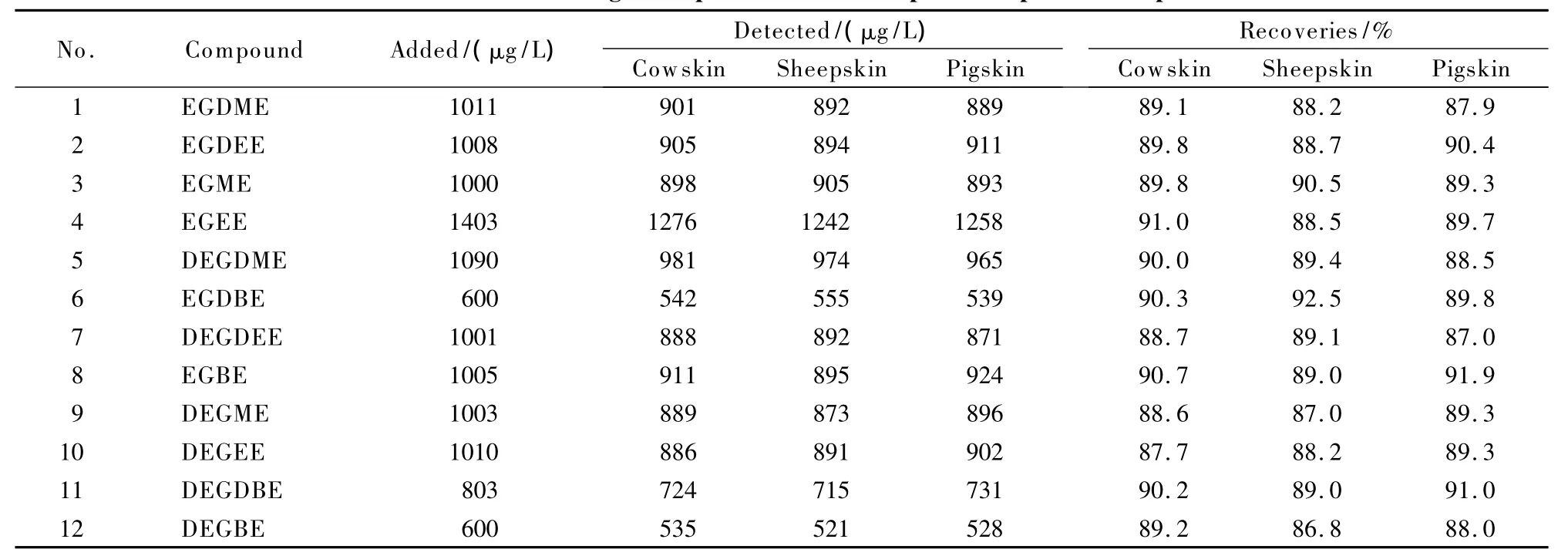
表3 目标化合物在实际样品中的净化回收率Table 3 Recoveries of target compounds in real samples after purification procedure
2.3 超声萃取条件的优化
影响超声萃取效率的主要因素是萃取溶剂种类,超声萃取方式、温度、时间以及溶剂用量也对萃取效率有影响。
以乙酸乙酯为萃取溶剂,对一个阳性样品进行超声萃取,该样品中含有DEGEE和DEGBE。在保持其他因素不变的前提下,分别改变超声萃取时间、温度以及溶剂用量,考察其总萃取量的变化。结果发现,最佳萃取时间为30 min、最佳萃取温度为40℃、最佳萃取体积为25 mL。为更好地反映萃取温度、萃取时间以及萃取溶剂体积对总萃取量的影响,设计了表4所示的三因素三水平正交实验,测定各条件下各组分的萃取量以及总萃取量,以总萃取量的大小作为萃取效果高低的判断依据。结果表明,最佳超声萃取条件为:萃取时间为30 min,萃取温度为45℃,萃取溶剂体积为25 mL。
取3份样品,第1份样品超声萃取1次,第2份样品连续超声萃取2次,第3份样品连续超声萃取3次,测定其总萃取量,其总萃取量分别为123.6、1 27.2、127.5mg/kg,可见连续超声萃取2次已经基本萃取完全。
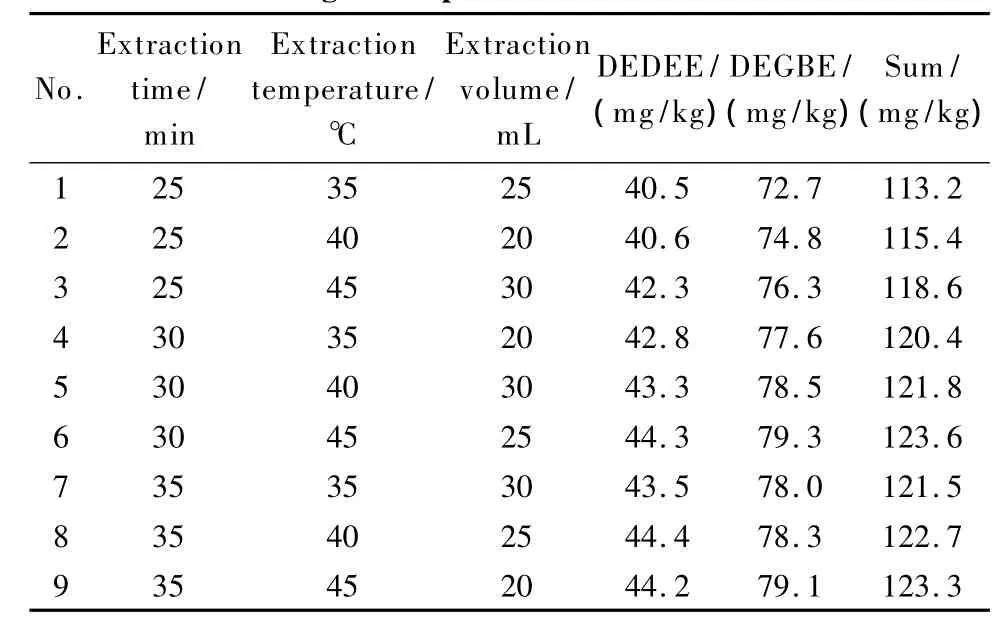
表4 萃取条件正交实验Table 4 Orthogonal experiments of extraction conditions
分别选取乙醚、二氯甲烷、叔丁基甲醚、丙酮、四氢呋喃、甲醇、正己烷/丙酮(1∶1,v/v)、乙酸乙酯、乙酸乙酯/二氯甲烷(1∶1,v/v)、乙醇、石油醚、乙腈等12种常见溶剂作为萃取溶剂,对2个阳性样品进行超声萃取,其中1#样品中含有DEGEE和DEGBE,2#样品中含有 EGDME、EGDEE、DEGDME、EGDBE和DEGDEE,观察萃取量的变化,结果见表5。从表5数据可以看出,对于不同样品中的不同组分,萃取量最大的溶剂各不相同。以各组分的总萃取量大小来判断溶剂的萃取能力大小,结果发现,对于2个阳性样品,乙酸乙酯的萃取效果均最好。同时,此时所得谱图中杂质峰很少。分别以乙醚和二氯甲烷作为萃取溶剂时,所得谱图中杂质峰较多;特别是乙醚作为萃取溶剂时,杂质峰对EGDME的测定有较大干扰。因此最终选择乙酸乙酯作为超声萃取溶剂。
2.4 方法的线性关系和检出限
以不含目标分析物的牛皮革作为空白基质,在空白基质中添加不同浓度的混合标准液,按上述方法进行测定,结果发现,在各自的质量浓度(ρ)范围内,峰面积(A)与质量浓度(ρ)之间存在良好的线性关系,表6给出了各组分的线性关系。
在信噪比(S/N)=3的条件下,确定各组分的检出限,也列于表6中。
2.5 方法的回收率和精密度
以不含目标分析物的牛皮革为空白基质,分别添加高、中、低3个不同浓度水平的混合标准溶液,每个浓度水平制备9个平行样,按上述方法进行测试,计算方法的平均回收率和精密度,结果见表7。12种乙二醇醚类有机溶剂的加标平均回收率为81.2%~95.5%,精密度(以相对标准偏差(RSD)计)为1.4%~6.6%。
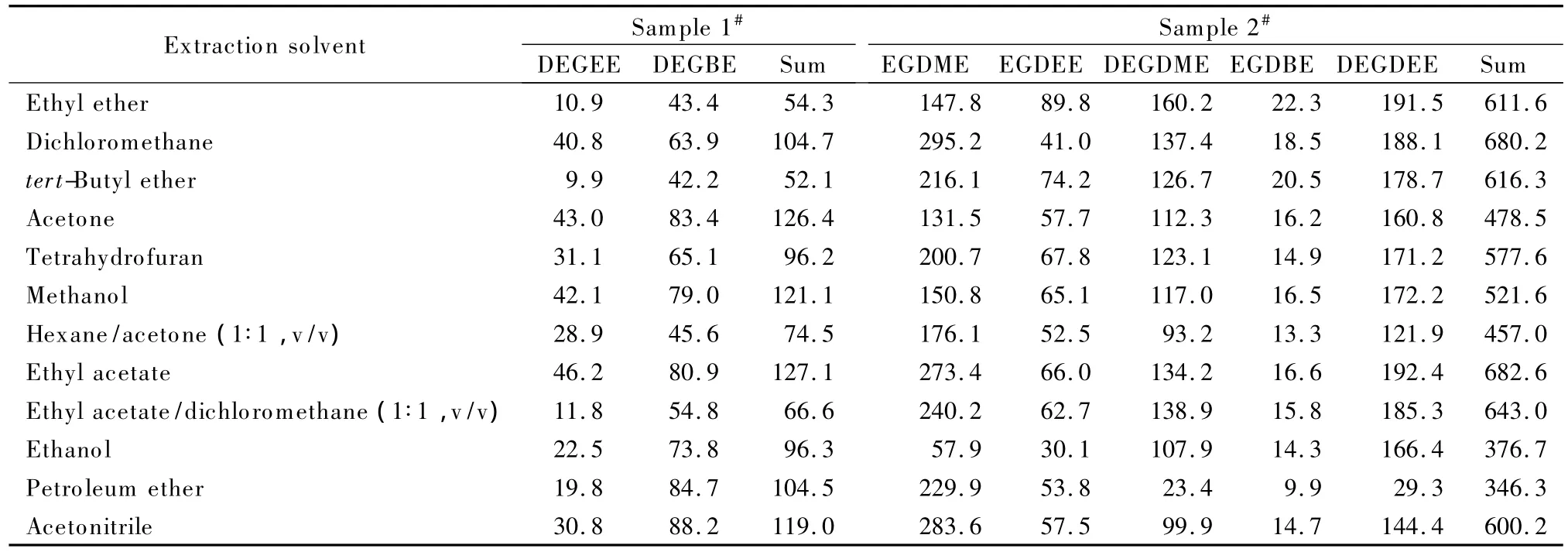
表5 不同溶剂的超声萃取效果Table 5 Extraction effects of different solvents mg/kg
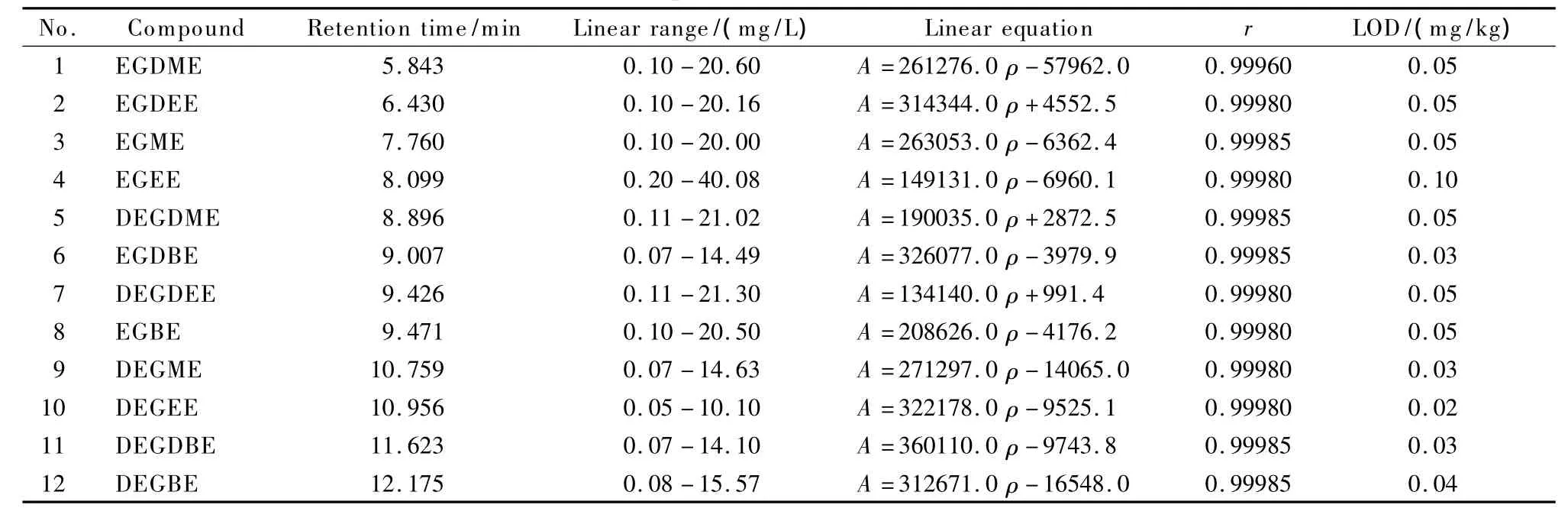
表6 方法的线性关系和检出限Table 6 Linear relationships and limits of detection(LOD)of the method
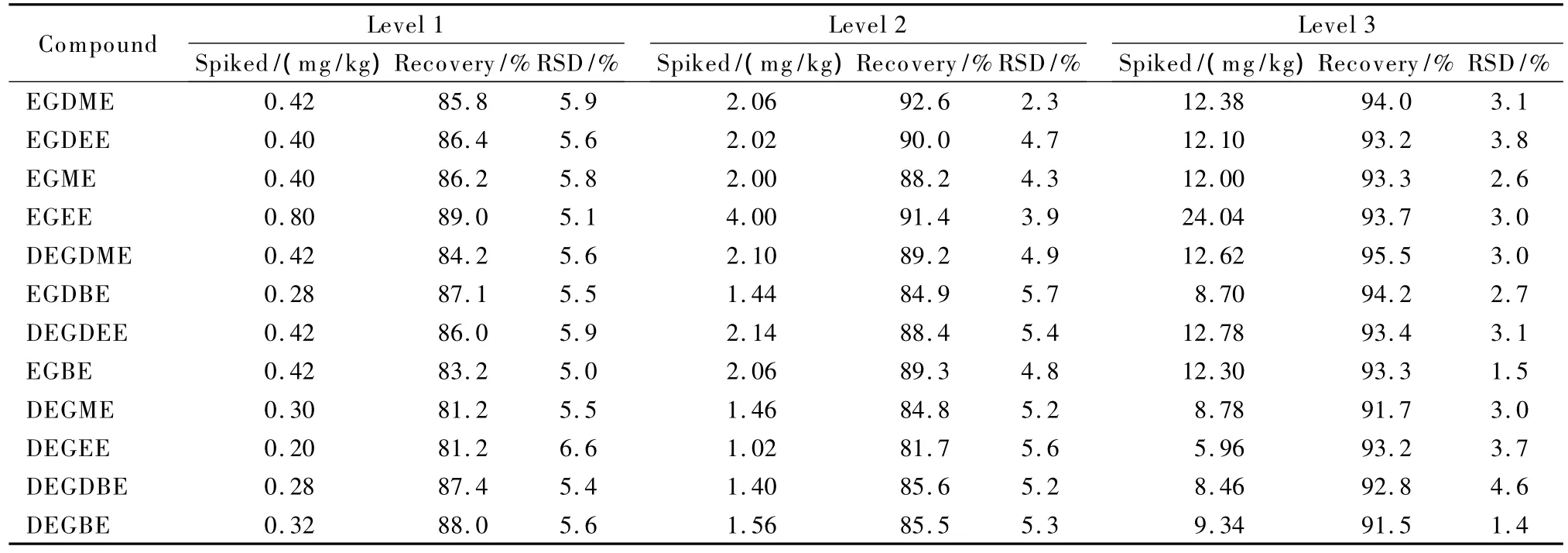
表7 方法的回收率和精密度(n=9)Table 7 Recoveries and precisions(RSDs)of the method(n=9)
2.6 实际样品的测试
应用本文建立的方法对42个皮革和皮革制品(包括牛皮革7个、羊皮革4个、猪皮革3个、牛皮革制品19个、羊皮革制品7个、猪皮革制品2个)中乙二醇醚类有机溶剂残留量进行了测定。结果在1个黑色牛皮革中检出DEGEE和DEGBE,其含量分别为35.57 mg/kg和62.23 mg/kg;在1个赭色羊皮革中检出DEGBE,其含量为23.49 mg/kg;在1个蓝色牛皮革中检出DEGEE和DEGBE,其含量分别为46.24 mg/kg和80.92 mg/kg,图2是该蓝色牛皮革样品的GC/MS-SIM图。
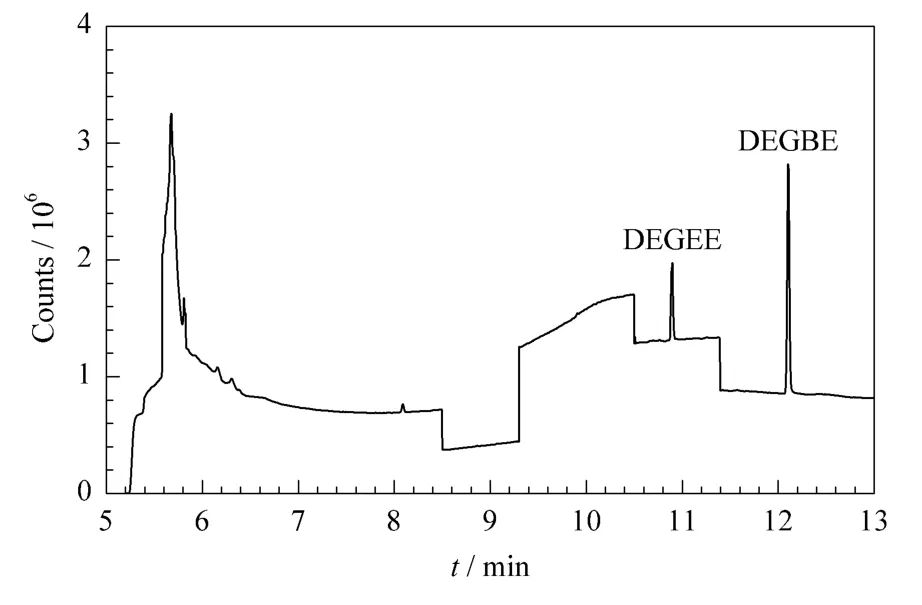
图2 实际样品的选择离子色谱图Fig.2 GC/MS-SIM chromatogram of a real sample
3 结语
为了同时测定皮革及皮革制品中12种乙二醇醚类有机溶剂的残留量,建立了气相色谱/质谱-选择离子监测方法。该方法以乙酸乙酯为萃取溶剂,超声提取样品中的待测组分,提取液经固相萃取柱净化后再进行气相色谱/质谱-选择离子监测法测定。该方法简便快速、灵敏度高,定性可靠,定量准确,成功地应用于市售皮革和皮革制品中乙二醇醚类有机溶剂残留量的测定。该方法为制定相关检测标准提供了参考。
[1] Takei M,Ando Y,Saitoh W,et al.Toxic Sci,2010,118(2):643
[2] Decision No.1348/2008/EC of the European Parliament and of the Council.Official Journal of the European Union,2008:L348/108
[3] Commission Decision of 17 December 2008 Amending Decisions 2005/692/EC,2005/731/EC,2005/734/EC and 2007/25/EC Concerning Avian Influenza as Regards Their Period of Application.Official Journal of the European Union,2009:L4/15
[4] Commission Regulation(EC)No.552/2009 of 22 June 2009 Amending Regulation(EC)No.1907/2006 of the European Parliament and of the Council on the Registration,Evaluation,Authorisation and Restriction of Chemicals(REACH)as Regards Annex XVII.Official Journal of the European Union,2009:L164/8
[5] Wang Z,Han C,You F M,et al.Flavour Fragrance Cosmetics(王征,韩超,游飞明,等.香精香料化妆品),2013(5):24
[6] Cappiello A,Famiglini G,Palma P,et al.Talanta,2009,80(1):257
[7] Tran B N,Okoniewski R,Bucciferro A,et al.J AOAC Inter,2014,97(1):232
[8] Chen J B,Shen R F,Chen H H.Chinese Journal of Health Laboratory(陈金斌,沈仁富,陈海红.中国卫生检验杂志),2011,21(9):2177
[9] Rahim A A,Saad B,Osman H,et al.Food Chem,2011,126:1412
[10] Tokarczyk R,Jiang Y,Poole G,et al.J Chromatogr A,2010,1217:6964
[11] Lian Q Y, Liu G.Qualityand Technical Supervision Research(连秋燕,刘贵.质量技术监督研究),2012(6):12
[12] Yu B,Tang Y,Zhou X L,et al.Modern Paint&Finishing(于滨,唐瑛,周湘玲,等.现代涂料与涂装),2007,10(3):47
[13] Lü Q,Zhang Q,Kang S Y,et al.Journal of Instrumental Analysis(吕庆,张庆,康苏媛,等.分析测试学报),2011,30(7):776
[14] Hua J L,Zhang J Y,Xie H Y.Dyeing and Finishing(花金龙,张建扬,谢鸿义.印染),2012(8):42
[15] Chen T,Wen Y Y,Ou Y,et al.Chinese Journal of Chromatography(陈婷,温裕云,欧延,等.色谱),2014,32(1):89
[16] Li T B,Liu W,Wang C L,et al.West Leather(李天宝,刘炜,王春利,等.西部皮革),2010,32(23):32
[17] Zhao Y,Qi X X.Chinese Journal of Chromatography(赵洋,戚晓霞.色谱),2010,28(1):54
[18] Li Z P,Li L W,Tao M X,et al.Rock and Mineral Analysis(李中平,李立武,陶明信,等.岩矿测试),2010,29(3):221
[19] Su J F,Hu C Y,Chen J X,et al.Chinese Journal of Analysis Laboratory(苏建峰,胡朝阳,陈劲星,等.分析试验室),2009,28(6):84
[20] Pan X X,Sun S Q,Du Z X,et al.Chinese Journal of Analysis Laboratory(潘晓新,孙姝琦,杜振霞,等.分析试验室),2013,32(7):52