响应面分析法优化茵陈中总黄酮的提取工艺
2014-07-26宋海吴冬青安红钢林敏任雪峰
宋海,吴冬青,安红钢,林敏,任雪峰,*
(1.河西学院化学化工学院,甘肃张掖734000;2.甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃张掖734000)
茵陈(Artemisia Capillaris Herba)为菊科植物滨蒿(Artemisia scoparia Waldst.et Kit.)或茵陈蒿(Artemisia capillaris Thunb.)的干燥地上部分[1],又名白蒿、绒蒿、松毛艾、猪毛蒿等。其化学成分主要包括有机酸类、香豆素类、色原酮类[2]及挥发油[3]等。茵陈是一种常用的中药,其味辛、苦,性微寒,归脾、胃、肝、胆经,具有清湿热、退黄疸、改善肝功能,提高谷草转氨酶(GOT)、谷-丙转氨酶(GPT)等水平作用的功效,临床上主要用于黄疸尿少,湿疮瘙痒和传染性黄疸型肝炎的治疗[1]。试验以茵陈总黄酮的提取率为考察指标,以分光光度法对其进行测定,优选茵陈总黄酮的最佳提取工艺,以其为茵陈总黄酮提取的生产工艺提供参考。
1 原料、试剂与方法
1.1 原料及处理方法
茵陈:2011年3月采自张掖市甘州区大满镇马均村东部沙漠边缘。
原料处理方法:将茵陈经自来水、蒸馏水洗净后晾干,放入烘箱(50℃)烘干至恒重,粉碎后过60目筛,备用。
1.2 主要试剂
芦丁:(Rutin)国药集团化学制剂有限责任公司(上海),批号:F20040304。95%乙醇,硝酸铝,亚硝酸钠,氢氧化钠等试剂均为分析纯,试验用水为蒸馏水。
1.3 主要仪器
WFJ2100型可见分光光度计:尤尼柯(上海)仪器有限公司;KH-300DE型数控超声波清洗器:昆山禾创超声仪器有限公司;RE-52型旋转蒸发仪:上海青浦沪西仪器厂;HH-6数显恒温水浴锅:常州国华电器有限公司;SHB-III循环水式多用真空泵:郑州长城科工贸有限公司;GB204电子天平、Pipet-One移液器(100 μL~1 000 μL):梅特勒-托利多仪器(上海)有限公司。
1.4 试验方法
1.4.1 茵陈总黄酮提取液的制备
精确称取0.500 0 g茵陈干粉于100 mL的圆底烧瓶中,以一定浓度和一定体积的乙醇作溶剂,在一定的提取温度和时间下回流提取,过滤。提取3次后,收集滤液,定容至100 mL的容量瓶中,待测。
1.4.2 单因素试验
分别以提取温度、乙醇浓度、提取时间和料液比为影响因素,设置各因素的不同水平,以确定相关因素对茵陈提取液中总黄酮提取率的影响。
1.4.3 响应面试验
为了获得最佳的工艺条件,根据中心组合设计原理,结合响应面分析法,综合单因素试验结果以料液比、乙醇浓度、提取温度和提取时间4个因素为自变量,茵陈总黄酮提取率为响应值,设计四因素三水平的响应面试验,利用响应面的试验结果,确定茵陈中总黄酮的最佳提取工艺条件。试验因素与水平设计见表1。

表1 响应面试验因素与水平表Table 1 Factors and levels code of response surface
1.4.4 芦丁标准曲线的绘制
1.4.4.1 芦丁标准溶液的配制
准确称取120℃干燥至恒重的芦丁对照品0.0500g,用75%乙醇溶解,定容至100 mL容量瓶中,摇匀。得浓度为0.500 0(mg/mL)芦丁标准溶液。
1.4.4.2 标准曲线的绘制
准确移取浓度为0.500 0 mg/mL芦丁标准溶液0.00、0.50、1.00、1.50、2.00、2.50、3.00 mL,分别置于 10mL具塞试管中,加入5%NaNO2溶液0.50 mL,摇匀,放置6 min后;加入10%Al(NO3)3溶液0.50 mL,摇匀,再放置6 min;然后加4%NaOH溶液5.00 mL,用75%乙醇定容,摇匀,放置10 min后,在510 nm处测定吸光度(以试剂空白为参比),以芦丁体积(V)为横坐标,吸光度值(A)为纵坐标,绘制芦丁标准曲线。
1.4.5 茵陈总黄酮提取率的测定
以芦丁试剂空白为参比,依1.4.4.2方法测定吸光度值,总黄酮提取率按下式计算:

2 结果与分析
2.1 标准曲线
按照1.4.4.2的实验方法,以样品体积V(mL)为横坐标,吸光度值A为纵坐标绘制标准曲线,结果见图1。
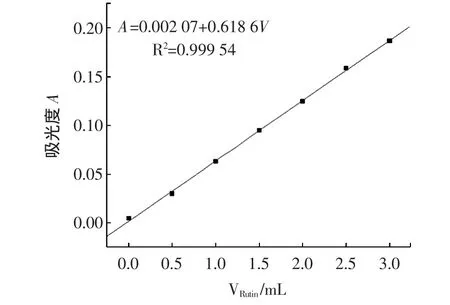
图1 芦丁标准曲线Fig.1 Standard curve of rutin
由图1可知,芦丁体积在0.00~3.00 mL范围内芦丁标准溶液浓度与吸光度之间有较好的线性相关性,回归直线方程:A=0.002 07+0.618 6V,R2=0.999 54。
2.2 单因素试验
2.2.1 提取温度对黄酮提取率的影响
精确称取0.500 0 g茵陈干粉,固定乙醇浓度为50%,提取时间为 2 h,料液比为 1 ∶50(g/mL),考察提取温度在 30、40、50、60、70、80、90 ℃范围内对茵陈总黄酮提取率的影响,见图2。

图2 提取温度对总黄酮提取率的影响Fig.2 Effect of extract temperature on extraction yield of total flavonoids
从图2可以看出,随着温度的升高,吸光度不断增加,但当温度达到70℃后,吸光度开始减小,一直呈下降趋势,这是因为温度升高,分子运动速度加快,渗透、扩散、溶解速度加快,黄酮类化合物更易从细胞中转移到溶剂中,使黄酮类化合物的得率随提取温度的升高而提高,当温度升高到一定程度时,黄酮类化合物被氧化破坏而导致其得率下降[4-5]。因此,选择提取温度为70℃。
2.2.2 乙醇浓度对黄酮提取率的影响
精确称取0.500 0 g茵陈干粉,固定提取温度为70 ℃,提取时间为 2 h,料液比为 1∶50(g/mL),考察乙醇浓度在 50%、55%、60%、65%、70%、75%、80%、85%的范围内对茵陈总黄酮提取率的影响,见图3。

图3 乙醇浓度对总黄酮提取率的影响Fig.3 Effect of ethanol concentration on extraction yield of total flavonoids
从图3可以看出,随着乙醇浓度的增加,吸光度不断增加,乙醇浓度在70%时的吸光度最大,随后逐渐减小。这可能由于茵陈中黄酮类化合物多为水溶性和醇溶性物质,具有较强的极性,根据相似相溶原理,在乙醇浓度为70%时,醇溶性和水溶性的黄酮类物质都能最大程度的溶出,而乙醇浓度超过70%时,水溶性黄酮溶出量大幅度减少故黄酮提取率下降。所以在乙醇浓度为70%时其吸光度达到最大,故选择乙醇浓度为70%。
2.2.3 料液比对黄酮提取率的影响
精确称取0.500 0 g茵陈干粉,固定提取温度为70℃,提取时间为2h,乙醇浓度为70%,考察料液比在 1∶20、1∶30、1∶40、1∶50、1∶60、1∶70和 1∶80的范围内对茵陈总黄酮提取率的影响,见图4。
由图4可知,在料液比为1∶60时,总黄酮的提取率达到最大,可能原因是在1∶60之前随着溶剂和溶质的接触面积慢慢增大,茵陈总黄酮的提取量也增大,在1∶60之后,由于溶剂过多,溶剂和溶质的接触面积慢慢减小,随之提取量也减小,因此,选择料液比为 1∶60。
2.2.4 提取时间对黄酮提取率的影响

图4 料液比对总黄酮提取率的影响Fig.4 Effect of material-liquid ratio on extraction yield of total flavonoids
精确称取0.500 0 g茵陈干粉,固定提取温度为70℃,乙醇浓度为70%,料液比为1∶60,考察提取时间在 0.25、0.5、1.0、1.25、1.5、2.0、2.5 h 的范围内对茵陈总黄酮提取率的影响,结果如图5所示。
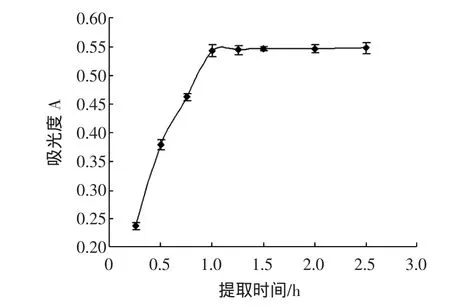
图5 提取时间对总黄酮提取率的影响Fig.5 Effect of extract time on extraction yield of total flavonoids
由图5可知,随着提取时间增加,总黄酮的提取率不断增加,在1 h时达到最大值,之后增幅逐渐较小。从提取效果和时间效益考虑,选择最佳提取时间为1 h。
2.3 响应面试验
以料液比、乙醇浓度、提取时间和提取温度为自变量,茵陈总黄酮提取率为响应值(Y),进行响应面分析试验。试验方案及结果见表2。

表2 响应面试验设计及结果Table 2 Response surface experimental design and results

续表2 响应面试验设计及结果Table 2 Response surface experimental design and results
采用Design-expert 7.1.6软件对表2中数据进行多项拟合回归,建立多元二次响应面回归模型:

2.3.1 方差分析
各因素的方差分析结果见表3。
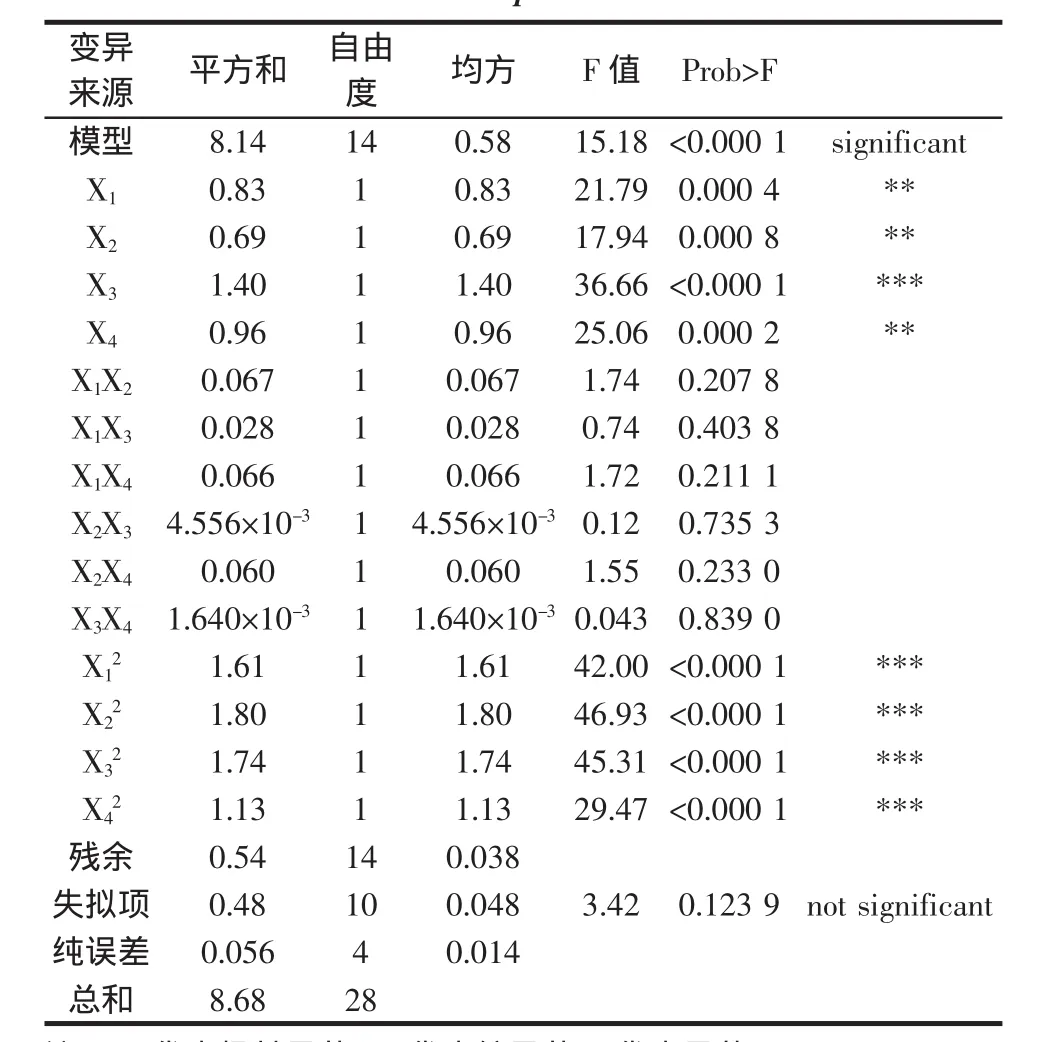
表3 方差分析结果Table 3 Variance analysis of extraction rate of total flavonoids of Artemisia Capillaris Herba
由表3知,模型的“Prob>F”值小于 0.000 1,表明二次方程拟合极其显著,失拟项F值为3.42,表明失拟项相对于绝对误差是不显著的,而不显著的失拟项才可用。提取时间(X3)的“Prob>F”值小于 0.000 1,表明其对茵陈总黄酮提取率影响及其显著,料液比(X1)、乙醇浓度(X2)和提取温度(X4)的“Prob>F”值小于0.01,表明其对茵陈总黄酮提取率影响较为显著。决定系数R2=0.938 2,CV值为2.81%,说明模型拟合好,实验误差小,实验操作可信,可用此模型对茵陈总黄酮提取率进行分析和预测[6-7],且影响茵陈总黄酮提取率的各因素按影响大小排序依次为提取时间、提取温度、料液比、乙醇浓度。二次项 X12、X22、X32和 X42影响极显著,其它不太显著,表明各因素对总黄酮提取率不是简单线性关系。各交互因素响应曲面图如图6,可以看出同样的结果。
2.3.2 验证试验


图6 各因素对茵陈中总黄酮提取率影响的三维响应曲面图Fig.6 Response surface for the effects of variables on the rate of the total flavonoids from Artemisia Capillaris Herba
通过回归模型预测的茵陈总黄酮提取最佳工艺条件为料液比1∶72.9,乙醇浓度为76.6%,提取时间为1.685 h,提取温度为73.5℃,在此条件下,茵陈总黄酮提取率理论上可达7.962%。考虑到实际操作的可行性,将茵陈总黄酮的最佳提取条件在理论值基础上修正为料液比为1∶73,乙醇浓度为77%,提取时间为1.68 h(100 min),提取温度为 71℃,采用此工艺条件进行验证实验,平行3组。测得的茵陈总黄酮提取率分别为7.893%、7.935%和7.932%,茵陈总黄酮提取率的平均值为7.920%,相对误差为0.53%,说明采用响应面法得到的工艺参数可靠,具有一定的实际价值。
3 结论
响应面分析法是研究几种因素间交互作用的回归分析方法,它克服了正交设计只能处理离散的水平值,而无法找出整个区域上因素的最佳组合和相应值的最优值的缺陷[8]。采用响应曲面分析中的Box-Behnken模式,对茵陈总黄酮提取工艺条件进行了优化,并得出最佳工艺参数。试验结果表明,模型拟合程度高,试验误差小,可用于实际预测。优化的工艺条件为:料液比1∶73,乙醇浓度为77%,提取时间为1.68 h,提取温度为71℃,在此条件下,茵陈总黄酮理论提取率为7.962%,实际得率为7.962%,优化得到的预测结果与实际结果吻合较好。说明采用响应面法优化得到的茵陈总黄酮提取工艺准确。
[1]国家药典委员会.中国药典 (一部)[M].北京:化学工业出版社,2005:166
[2]王春梅,胡坪,刘清飞,等.指纹图谱技术在茵陈提取工艺优化中的应用[J].中成药,2007,29(6):785-787
[3]郭方遒,梁逸曾,黄兰芳,等.茵陈挥发油GC-MS指纹图谱分析[J].高等学校化学学报,2005,26(11):2027-2030
[4]范媛媛,李新华.绿豆黄酮提取工艺研究[J].沈阳农业大学学报,2005,36(5):619-622
[5]张延杰,田金河.绿豆壳中提取黄酮的工艺研究[J].粮油食品科学,2005,13(5):39-40
[6]张国华,乔建卫,张如松.响应面法优化超声提取行白菊黄酮工艺条件的研究[J].亚太传统医药,2009,5(2):20-22
[7]李晓军,潘宏利,陈花,等.响应曲面法优化超声辅助提取金银花总黄酮[J].山西师范大学学报:自然科学版,2009,37(2):81-90
[8]闫克玉,高远翔,响应面分析法优化槐米总黄酮的提取工艺[J].食品研究与开发,2009,30(7):21-24
