啤酒酵母对嘌呤类化合物吸收特征的研究
2014-07-25刘常姝崔云前王吉龙
刘常姝,李 红,崔云前,* ,王吉龙
(1.齐鲁工业大学食品与生物工程学院,山东济南 250353;2.中国食品发酵工业研究院,北京 100015;3.山东农业大学食品科学与工程学院,山东泰安 271018)
饮用啤酒能够引起血液中尿酸含量上升,从而引发高尿酸血症及痛风,通过降低啤酒中的嘌呤含量有效避免这一现象[1-2]。目前有关低嘌呤啤酒的研究,常见方法有高比例辅料法、高浓发酵法和吸附法[3-7]。这些方法在低嘌呤啤酒的实际生产中仍面临诸多问题,如高比例辅料法降低啤酒嘌呤物质含量的程度有限,而吸附法会引起啤酒风味损失[8]。因此,开辟新的嘌呤减少途径对低嘌呤啤酒的生产有重要意义。
啤酒中的嘌呤主要来自麦芽,麦芽中的嘌呤溶于麦汁中[9-10]。研究表明,酵母能够吸收培养液中嘌呤物质,用于维持自身的生长代谢与繁殖[11-12]。经酵母发酵后,发酵液残留嘌呤,尤其是鸟嘌呤和腺嘌呤的含量明显降低[13],证明酵母吸收确实是可以降低啤酒嘌呤含量的有效途径。因此,研究酵母对嘌呤物质的吸收规律,能够更科学、更高效地利用酵母吸收嘌呤物质,从而降低啤酒嘌呤含量。
培养液中嘌呤有游离嘌呤和非游离嘌呤两种存在形式,非游离嘌呤几乎全部是以嘌呤核苷的形式存在[14-15]。水解核苷能够显著增加游离嘌呤的含量。嘌呤核苷酶能够使核苷中非游离态嘌呤转化成游离态[16]。麦芽自身含有的嘌呤核苷酶酶活非常低[17-19],市面常见的嘌呤核苷磷酸化酶(PNP)产品酶活相对较高,更适用于增加游离嘌呤含量。目前国内外对核酸水解酶的研究较多,但研究所得的目的产物均为核苷酸[20-21],对水解核苷的嘌呤核苷酶的研究较少[22-24],国内尚未有该方面研究。Shibano Y 等人从人苍白杆菌(Ochrobactrum anthropi)中提取了嘌呤核苷酶并用于生产低嘌呤啤酒,取得了一定成果[15]。
1 材料与方法
1.1 材料与仪器
YPD液体培养基 北京奥博星生物技术有限责任公司;鸟嘌呤、腺嘌呤、次黄嘌呤、黄嘌呤标准品HPLC 99%,美国Sigma公司;鸟苷、腺苷、肌苷、黄苷标准品 99%,北京索莱宝科技有限公司;嘌呤核苷磷酸化酶8.78U/mg,500U 北京世纪山水科技有限公司。
高效液相色谱仪 配有紫外检测器和CLASS-VP工作站,日本岛津;pH计PHS-3C 上海精密科学仪器有限公司;分析天平Tecator-6002 Switzerland公司;恒温水浴锅HX105 长流科学仪器厂。
1.2 实验方法
1.2.1 酵母吸收嘌呤实验 向YPD液体培养基中分别添加不同含量的嘌呤及嘌呤核苷标准品,制得多组嘌呤含量不同的酵母培养液。其中,5组游离嘌呤与总嘌呤(游离与非游离嘌呤总和)含量均不相同的培养液用于研究酵母对不同形式嘌呤化合物吸收规律,记为培养液1、2、3、4、5;10 组游离嘌呤含量依次升高,总嘌呤含量相同的培养液用于研究麦汁嘌呤游离率对酵母的嘌呤吸收率的影响,记为W1~W10。取300mL培养液分装至500mL三角瓶。无菌环境下接种适量酵母,发酵温度控制在12±0.2℃,24h内每4h摇动一次,24h后加发酵栓,发酵7d,检测发酵液的游离嘌呤及总嘌呤含量。每组实验做三个平行。
1.2.2 PNP反应体系与反应条件实验 酶液配制:分别称取 0.0200、0.0400、0.0800g PNP 酶,用 pH7.0磷酸钾缓冲液定容至10mL,配制成2、4、8mg/mL的酶液A、酶液B、酶液C,4℃保存待用。PNP反应实验:取4 支试管,各加 5mL 麦汁,编号 0、1、2、3,分别加入100μL磷酸钾缓冲液、酶液A、酶液B、酶液C,30℃反应10min。煮沸2min终止反应,冷却后,检测反应液的游离嘌呤及总嘌呤;另取3支试管,反应体系与反应温度同上,反应时间分别为10、30、60min。上述实验均做三次平行。
1.2.3 样品处理方法 参考文献[25],游离嘌呤检测样品:取1mL样品,经0.45μm膜过滤,直接进样检测;总嘌呤检测样品:样品超声5min除气,取2mL于10mL比色管,加入 2mL 3mol/L硫酸溶液,100℃水解5min,冰浴冷却,加入4mL 3mol/L NaOH中和,用超纯水定容至10mL,经0.45μm膜过滤后进样。
1.2.4 液相色谱条件 参考文献[26-27],色谱柱:Thermo Hypersil GOLD AQ(4.6mm × 250,5μm);柱温:25℃;流 动 相:0.02mol/LKH2PO4缓 冲 液(pH4.00);流速1mL/min;进样量:10μL;紫外检测波长:254nm。
1.2.5 数据处理 为了研究方便,本文中提出了两个概念。一是嘌呤游离率,其定义为培养液游离嘌呤含量与总嘌呤含量的百分比,表示嘌呤的游离程度;二是酵母的嘌呤吸收率,其定义为被酵母吸收的嘌呤量与培养液游离嘌呤含量的比值,用来表示酵母对嘌呤的吸收能力。二者的计算公式分别为:

2 结果与分析
2.1 酵母对嘌呤类化合物吸收规律的研究
2.1.1 酵母对不同形式嘌呤化合物吸收规律的研究5组嘌呤含量各不相同的培养液发酵前(BF)与发酵后(AF)游离鸟嘌呤(FG)、游离次黄嘌呤(FH)、游离黄嘌呤(FX)、游离腺嘌呤(FA)以及总游离嘌呤(TFG)含量见表1,麦汁发酵前后非游离鸟嘌呤(NFG)、非游离次黄嘌呤(NFH)、非游离黄嘌呤(NFX)、非游离腺嘌呤(NFA)以及总非游离嘌呤(TNFP)含量见表2。
由表1可以看出,5种嘌呤含量的培养液经过发酵后,各种游离嘌呤含量明显低于发酵前。对表中数据分析可知,发酵前后非游离的鸟嘌呤、次黄嘌呤、腺嘌呤以及总嘌呤含量均呈显著正相关关系,相关系数分别为 0.985、0.985、0.989、0.935、0.985(p<0.05);发酵前后游离态的鸟嘌呤、次黄嘌呤、黄嘌呤、腺嘌呤以及总嘌呤的均值差值分别为13.58、1.88、1.44、16.86和33.86mg/L(p<0.05),说明发酵前游离嘌呤的含量高于发酵后,差异显著。由此可以证明,酵母能够吸收利用游离嘌呤。
另外,由表1还可看出发酵后仍有少量游离嘌呤存在,可见酵母无法完全利用培养液中的游离嘌呤。
由表2可以看出,5种嘌呤含量的培养液经过发酵后,各种非游离嘌呤含量与发酵前相比基本无变化。
经过数据分析可知,发酵前后非游离的鸟嘌呤、次黄嘌呤、腺嘌呤以及总嘌呤含量均呈显著正相关关系,相关系数分别为0.999(p<0.01)、0.993(p<0.01)、0.983(p<0.01)、0.998(p<0.01)、0.999(p<0.01);上述非游离嘌呤对应的均值差值分别为0.66、-0.12、-0.10、0.04 和 0.52mg/L(p>0.05),说明发酵前后非游离嘌呤的含量均无显著差异。由此可以证明,发酵过程中非游离嘌呤含量不发生变化,即酵母不能吸收利用非游离嘌呤。个别检测值为负是由液相检测方法的准确性导致的误差。
综上可知,酵母能且只能吸收游离形态的嘌呤,但不能将游离嘌呤完全吸收。因此,研究酵母对培养液嘌呤的吸收规律,即研究酵母对培养液中游离嘌呤的吸收规律。
2.1.2 培养液嘌呤游离率对酵母的嘌呤吸收率的影响 W1~W10十种不同培养液的鸟嘌呤(G)、次黄嘌呤(H)、黄嘌呤(X)、腺嘌呤(A)和总嘌呤(TP)的游离率见图1,酵母对各嘌呤的吸收量以及吸收率分别见图2和图3。

表1 培养液发酵前后游离态嘌呤含量Table 1 The content of free purines of 5 worts before and after fermentation
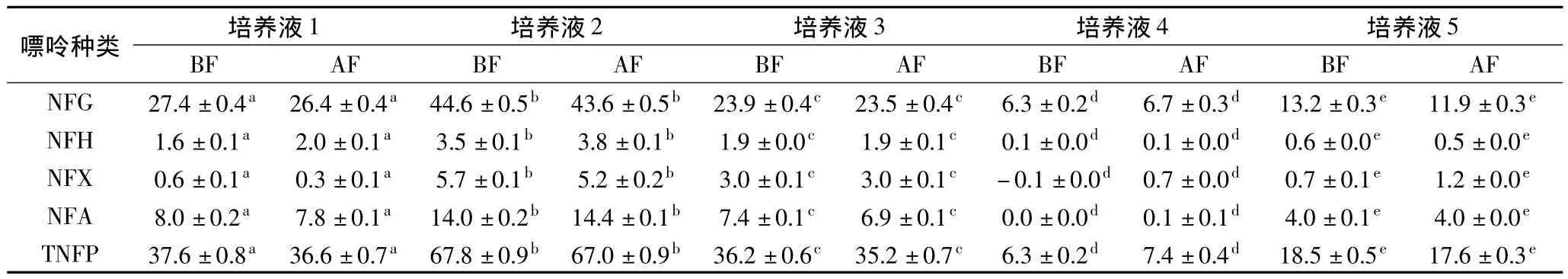
表2 培养液发酵前后非游离态嘌呤含量Table 2 The content of non-free purines of 5 worts before and after fermentation

图1 10组不同培养液的嘌呤游离率Fig.1 The purine dissociation rate of 10 different worts

图2 酵母对10组不同培养液的嘌呤吸收量Fig.2 The purine absorption of 10 different worts
由图1和图2可以看出,随着培养液中嘌呤游离程度的增加,酵母对各种嘌呤的吸收量升高。酵母的嘌呤吸收量与培养液的嘌呤游离率之间相关性显著(鸟嘌呤R2>0.990,p<0.01;次黄嘌呤R2>0.991,p<0.01;黄嘌呤R2>0.998,p<0.01;腺嘌呤R2>0.996,p<0.01;总嘌呤R2>0.995,p<0.01)。由于酵母从胞外吸收游离嘌呤的主要途径是主动运输,当培养液中总嘌呤含量一定时,嘌呤游离率越高,游离嘌呤含量越高,与酵母细胞膜上载体结合概率越大,酵母越容易从外部获得嘌呤,因此导致酵母对各种嘌呤的吸收量升高。

图3 酵母对10组不同培养液的嘌呤吸收率Fig.3 The purine absorption rate of 10 different worts
另外,酵母吸收 G、H、X、A、TP增加量与培养液中对应嘌呤增加量的均值差值分别为-1.12(p>0.05)、-0.04(p>0.05)、-0.15(p>0.05)、-0.16(p>0.05)、-1.14(p>0.05),即酵母吸收嘌呤的增加量均低于相应嘌呤在培养液中的增加量。说明培养液中增加的游离嘌呤无法被酵母完全吸收。
由图1和图3可以看出,随着培养液中嘌呤游离程度的增加,酵母对各种嘌呤的吸收率变化并不一致。总的来说,当嘌呤游离率小于90%时,随着培养液中嘌呤程度的增加,酵母对游离嘌呤的整体吸收率基本不变;当嘌呤游离率大于90%时,酵母对嘌呤的吸收率略有降低。
其中,对于培养液中的次黄嘌呤、黄嘌呤,随着培养液中嘌呤游离程度的增加,其吸收率均呈升高趋势。说明酵母吸收嘌呤的增加速度大于培养液游离嘌呤的增加速度。在游离次黄嘌呤、游离黄嘌呤含量较低的条件下,其含量变化对酵母吸收这两种嘌呤的影响极大,酵母吸收嘌呤的能力呈非线性增长,从而引起吸收率增高的现象。
对于G、A,当嘌呤游离率小于90%时,随着培养液中嘌呤程度的增加,酵母对这两种嘌呤的吸收率基本不变;当嘌呤游离率大于90%时,吸收率明显降低。这是因为培养液中这两种嘌呤整体含量水平较高,而酵母对游离嘌呤的吸收能力有一定限度,当培养液中G、A含量过高时(G>19.8±0.5mg/L,A>20.1±0.4mg/L),酵母不能充分利用多出来的游离嘌呤,因此,酵母对这两种游离嘌呤的吸收率反而降低,这与酵母在该条件下嘌呤吸收量升高并不矛盾。
综上可知,当嘌呤含量极低时,酵母对嘌呤的吸收率随嘌呤游离率的增加而增加;当嘌呤含量适中时,酵母对嘌呤的吸收率维持在一定水平,不随嘌呤游离率的增加而改变;当嘌呤含量过高时,随着嘌呤游离率的增加,酵母的嘌呤吸收率逐渐下降。
另外,由图3还可看出,其中腺嘌呤的吸收率始终是四种嘌呤中最高的,基本维持在100%。其次是次黄嘌呤、鸟嘌呤和黄嘌呤。
上述结论表明,增加培养液中游离嘌呤比例,能够有效增加酵母对游离嘌呤的吸收量,从而减少啤酒中的嘌呤含量。
2.2 PNP对麦汁嘌呤的影响
为了研究PNP对麦汁嘌呤含量的影响,本文以麦汁为底物,添加适量PNP酶制剂进行反应。
2.2.1 PNP添加量对麦汁中游离嘌呤的影响 向一定量麦汁中添加不同含量的PNP酶,检测添加后麦汁嘌呤变化。不同PNP酶添加量麦汁中嘌呤游离率见图4。
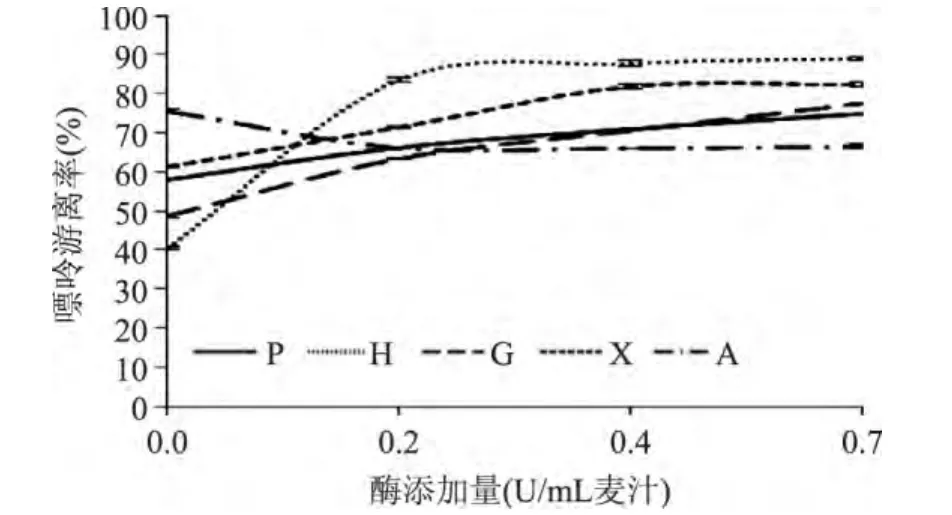
图4 PNP添加量对4种嘌呤游离率的影响Fig.4 The effect of PNP addition on 4 kinds purine dissociation rate
由图4可以看出,随着PNP添加量的增加,麦汁中整体游离嘌呤含量呈明显的增加趋势。其中,当酶添加量由0U增加至0.7U时,总游离嘌呤含量增加了28.5±0.6%。其中,麦汁中FG、FH、FX含量分别增加了59.8±0.1%、117.9±2.6%和增加了33.7±0.2%,但FA含量降低了12.0±0.2%。说明PNP在本实验条件下,水解腺苷糖苷键的反应为逆向反应,即反应向着游离嘌呤和核糖生成腺苷的方向进行。
麦汁中的嘌呤未能完全游离出来。这是由于PNP催化反应是可逆反应,本实验条件下已达到平衡状态。另外,由于PNP是以核苷为底物,不能分解麦汁中核苷酸等含嘌呤的化合物,因此结束后仍存有少量的聚合态嘌呤。
上述结论表明,PNP酶能够水解麦汁中核苷的糖苷键,使麦汁中游离嘌呤含量明显增高。只是由于PNP反应底物以及反应自身特点的限制,若要提高PNP对麦汁核苷的水解效果,还需进一步的研究。
2.2.2 嘌呤核苷磷酸化酶(PNP)催化反应的反应时间对麦汁中游离嘌呤含量的影响 不同反应时间,麦汁中游离嘌呤含量及总嘌呤含量见图5。

图5 PNP反应时间对4种嘌呤游离率的影响Fig.5 The effect of PNP reaction time on 4 kinds of purine dissociation rate
由图5可以看出,反应10min后麦汁中游离嘌呤含量基本不变。说明PNP催化反应十分迅速,反应10min基本达到平衡。相对于麦汁制备过程所需时间(2~4h),PNP反应快速,具有对工艺时间影响较小的优势。
3 结论
研究结果表明,酵母只能够吸收麦汁中游离形式的嘌呤,且随着麦汁中嘌呤游离率的增加,酵母吸收的嘌呤含量也随之增高。因此,通过酵母吸收的形式降低啤酒嘌呤,关键在于增加麦汁的嘌呤游离率。同时证实,PNP对麦汁中的核苷确实有明显的水解效果,能够增加麦汁的嘌呤游离率;且PNP催化反应时间较快,对麦汁的生产工艺影响较小。上述结论对于低嘌呤啤酒的生产具有一定指导意义及参考价值。同时,PNP酶在本实验条件下对核苷的水解能力有限,还需进一步提高PNP的水解能力。
[1]Moriwaki Y,Yamamoto T.Beer in health and disease[M].Elsevier Inc,2009:541-547.
[2]Yamamoto T,Moriwaki Y,Takahashi S,et al.Effect of beer on the plasma concentrations of uridine and purine bases[J].Metabolism,2002,51(10):1317-1323.
[3]杨子龙.一种低嘌呤啤酒及其制备方法:中国,CN 101475888[P].2009-07-08.
[4]江南大学.一种含低嘌呤类物质的啤酒的制造方法:中国,CN 1743444A[P].2006-03-08.
[5]江苏大富豪啤酒有限公司.一种低嘌呤啤酒的生产方法:中国,CN 1563321A[P].2005-01-12.
[6]Shibata J,Murayama N,Takeyama M.Adsorption of purine compounds in beer with activated carbon prepared from beer lees[J].环境资源工学,2009,56(3):120-126.
[7]吴斌.不同吸附剂对啤酒中嘌呤类物质吸附作用的研究[J].商品与质量:理论研究,2012(3):7-8.
[8]李志良,张五九.高效液相色谱法测定麦汁,发酵液和啤酒中的嘌呤含量[J].食品与发酵工业,2006,32(3):73-75.
[9]Prentice N.Comparision of malts for nuclease and nucleobase potentials[J].J Am Soc Brew Chem,1981,41(4):130-140.
[10]贾凤超.啤酒生产中的嘌呤类物质与低嘌呤啤酒的研究进展[J].啤酒科技,2013,(1):24-27.
[11]Lee W J,Prentice N.Utilization of nucleosides and nucleobases by the lager yeast Saccharomyces carlsbergensis[J].J Am Soc Brew Chem,1987,45(4):128-131.
[12]Bradee L H.Some practical aspects of malting and mashing related to yeast nutrition and fermentation[J].Technical Quarterly Master Brewers Association of Americas,1970,7:37-42.
[13]商曰玲.啤酒酿造过程中嘌呤含量的变化研究[D].泰安:山东农业大学,2009.
[14]G Harris,R Pasons.Nitrogenous constituents of brewing matieral IX.The purine of wort and their fate in brewing[J].Journal of the Institute of Brewing,1957,63(4).227-236.
[15]Shibano Y,Yomo H,Matsumoto T,et al.Process for producing beer:European Patent,EP 0753572[P].2002-9-4.
[16]Prasher D C,Carr M C,Ives D H,et al.Nucleoside phosphotransferase from barley.Characterization and evidence for ping pong kinetics involving phosphoryl enzyme[J].Journal of Biological Chemistry,1982,257(9):4931-4939.
[17]Lee W J,Pyler R E.Nucleic acid degrading enzymes of barley malt.II.Nucleosidases and nucleoside deaminases[J].J Am Soc Brew Chem,1985,43(1):6-10.
[18]Lee W J,Pyler R E,Oleson A E.Nucleic acid degrading enzymes of barley malt.III.Adenosine nucleosidase from malted barley[J].J Am Soc Brew Chem,1986,44(2):86-90.
[19]Hyun M H,Jung R Y,Hee S N,et al.5′-Phosphodiesterase activity from malt rootlets[J].Food Science and Biotechnology,2000,9(3):183-187.
[20]Prentice N.Characterization of a nuclease from malted barley roots[J].Journal of cereal science,1987,5(2):175-187.
[21]何义进,华洵璐,匡群,等.核酸水解酶及酶解法生产核苷酸研究进展[J].辽宁大学学报:自然科学版,2012,39(2):110-117.
[22] OgawaJ,TakedaS,XieS X,etal.Purification,characterization,and gene cloning of purine nucleosidase from Ochrobactrum anthropic[J].Applied and environmental microbiology,2001,67(4):1783-1787.
[23]Campos A,Rijo- Johansen M J,Carneiro M F,et al.Purification and characterisation of adenosine nucleosidase from Coffea Arabica young leaves[J].Phytochemistry,2005,66(2):147-151.
[24]Szuwart M,Starzyńska E,Pietrowska-Borek M,et al.Calcium-stimulated guanosine-inosine nucleosidase from yellow lupin(Lupinusluteus)[J].Phytochemistry,2006,67(14):1476-1485.
[25]钟晓盈,陆幼兰.利用 HPLC测定啤酒嘌呤含量方法的研究[J].啤酒科技,2007,3:23-26.
[26]Kaneko K,Yamanobe T,Fujimori S.Determination of purine contents of alcoholic beverages using high performance liquid chromatography[J].Biomedical Chromatography,2009,23(8):858-864.
[27]王海容,付大友.啤酒中嘌呤类物质测定方法的研究进展[J].酿酒科技,2009(6):95-98.
