真性红细胞增多症基因组学与疾病进展的关系*
2014-06-15赵迎旭盛梦瑶杨逢春艾丽梅
赵迎旭 白 洁 张 磊 盛梦瑶 石 慧 邢 文 杨逢春 艾丽梅 周 圆
真性红细胞增多症基因组学与疾病进展的关系*
赵迎旭1,2白 洁2张 磊2盛梦瑶2石 慧2邢 文2杨逢春2艾丽梅1△周 圆2
目的 研究135例真性红细胞增多症(PV)患者ASXL1、TET2、IDH1、IDH2、SETBP1、MPL515、JAK2V617F及JAK2 exon12基因突变情况,综合评判PV后骨髓纤维化(PPMF)疾病进展与基因组学特征。方法用Sanger方法对ASXL1、TET2、IDH1、IDH2、SETBP1、MPL515和JAK2 exon12基因进行测序;用巢式等位基因特异性PCR方法检测JAK2V617F突变,对突变患者用Taqman-MGB探针检测突变负荷。分析基因突变与PPMF疾病进展的关系。应用Logistic多因素分析分析PV后继发PPMF的危险因素。结果PV患者ASXL1、TET2、IDH1、IDH2的突变率分别为7.69%(8/104)、5.26%(1/19)、0.08%(1/120)、和0.08%(1/121)。未发现SETBP1、MPL515突变者。PV患者JAK2总突变率为82.22%(111/135)。其中JAK2 exon12突变率为2.96%(4/135)。PPMF患者中,ASXL1突变率高达31.82%(7/22)。ASXL1与JAK2V617F负荷(V617F%)呈正相关(rs=0.298,P=0.002),ASXL1突变组的血红蛋白低于未突变组,白细胞、V617F%≥50%比例、血栓栓塞比例及继发PPMF比例高于未突变组(P<0.05);ASXL1突变、V617F%≥50%和脾大是PPMF的危险因素。结论ASXL1突变可能通过某种机制促进V617F%增高,参与PPMF的发生和发展。
真性红细胞增多症;基因组学;ASXL1;TET2;IDH1;IDH2;SETBP1;MPL515;JAK2V617F;JAK2 exon12
真性红细胞增多症(PV)是骨髓增殖性肿瘤(MPN)的典型代表,PV后继发骨髓纤维化(PPMF)和急性白血病(AML)转化是PV疾病进展的主要表现。研究表明超过90%的PV患者存在非受体型酪氨酸激酶JAK2V617F突变[1-2]。近年来,包括表观遗传学和剪切子相关的基因组学异常在MPN发生和疾病进展中的作用得到了学者的重视[3]。本研究通过检测并分析135例PV患者的ASXL1(黑腹果蝇附加性梳样结构-1,外显子12)、TET2(10-11易位癌基因家族成员2,12个外显子)、IDH1、IDH2(异柠檬酸脱氢酶1和2,外显子4)、SETBP1(SET结合蛋白1)以及经典的JAK2V617F、JAK2外显子12(JAK2 exon12)、MPL515(骨髓增殖性白血病病毒,外显子10)等基因突变情况,并对有意义的基因突变与PPMF等疾病进展进行相关研究,以期探讨表观遗传学相关基因异常在PV疾病进展中的作用。
1 资料与方法
1.1 一般资料 选择2012年11月—2013年6月中国医学科学院血液病医院收治的PV患者135例。诊断依据2008年WHO标准[4]。所有患者均签署知情同意书,本研究获得中国医学科学院血液病医院伦理委员会批准。
1.2 定义及分组 PV骨髓纤维化时间定义为PV疾病诊断至患者发生PPMF之间的时间。高白细胞(WBC)定义为WBC≥25×109/L;高血小板(Plt)为Plt≥600×109/L。
JAK2V617F按照 V617F%值分为 V617F%≥50%组和V617F%<50%组。治疗情况分无治疗、放血治疗或干扰素治疗组(第1组);羟基脲治疗组(第2组)。
1.3 方法
1.3.1 Sanger测序 采集患者外周血,-80℃保存,应用血液基因组柱式小量提取试剂盒(北京康为世纪生物科技有限公司)提取DNA。采用Sanger测序检测ASXL1、TET2、IDH1、IDH2、SETBP1、MPL515以及JAK2 exon12编码序列突变情况。PCR扩增体系为40 μL:含200 ng模板DNA、上下游引物各20 pmol,余体积用Platinum PCR Super Mix(Invitrogen)补足。PCR扩增条件:95℃5 min;95℃30 s,54℃25 s,72℃30 s,40个循环;72℃10 min。产物由北京天一辉远公司进行纯化测序,测序结果应用DNASIS MAX软件进行分析,所有突变样品用另外1个独立PCR产物进行证实。所参考GenBank信息分别是 ASXL1:NM_015338.5;TET2:NT_ 016354.18;IDH1:NG_023319.2;IDH2:NG_023302;SETBP1:NG_027527;JAK2exon12:NG_009904.1;MPL515:NG_ 007525.1。
1.3.2 等位基因特异性PCR 应用巢式等位基因特异性PCR检测JAK2V617F突变情况。引物如下:P25′-CCTCAGAACGTTGATGGCA-3′,P2r 5′-ATTGCTTTCCTTTTTCACAAGA-3′,Pnf 5′-AGCATTTGGTTTTAAATTATGGAGTATATG-3′,Pmr 5′-GTTTTACTTACTCTCGTCTCCACAAAA-3′。PCR条件同1.3.1。PCR产物用2.5%琼脂糖凝胶电泳后于紫外线下分析,产物为453 bp、279 bp和229 bp3种类型。279 bp为JAK2V617F突变型,229 bp为野生型。当DNA样本含量较低时,先用引物P1 5′-GATCTCCATATTCCAGGCTTACACA-3′和P1r 5′-TATTGTTTGGGCATTGTAACCTTCT-3′预扩增,再取1 μL预扩增产物用上述巢式PCR进行二次扩增。
1.3.3 Taqman-MGB探针实时定量PCR 将上述方法测定的JAK2V617F阳性标本应用StepOne实时定量PCR仪进行检测。引物为:上游5′-AAGCTTTCTCACAAGCATTTGGTTT-3′,下游5′-AGAAAGGCATTAGAAAGCCTGTAGTT-3′;JAK2野生型Taqman探针VIC-5′-TCTCCACAGACACATAC-3′;JAK2突变型Taqman探针FAM-5′-TCCACAGAAACATAC-3′。PCR条件同1.3.1。应用JAK2V617F突变纯合子与表达野生型JAK2的PV标本以不同比例混合后绘制标准曲线;突变负荷计算公式为:JAK2V617F/(JAK2V617F+JAK2WT);检测敏感度为1%。
1.4 统计学方法 应用SPSS 21.0软件进行分析,定性资料比较用χ2检验;连续变量比较用独立样本t检验。变量的相关性分析用Spearman相关。采用Logistic回归分析影响PPMF发生的危险因素;P<0.05为差异有统计学意义。
2 结果
2.1 PV患者的临床特征及基因突变情况 135例PV患者中男75例,女60例;年龄23~82岁,平均59岁;其中脾大64例(47.4%),白细胞(4.12~39.92)×109/L;血小板351(107~1 107)×109/L;23例合并PPMF,占17.04%。ASXL1、TET2、IDH1、IDH2、JAK2、JAK2V617F、JAK2exon12突变情况见表1。未发现SETBP1、MPL515突变。
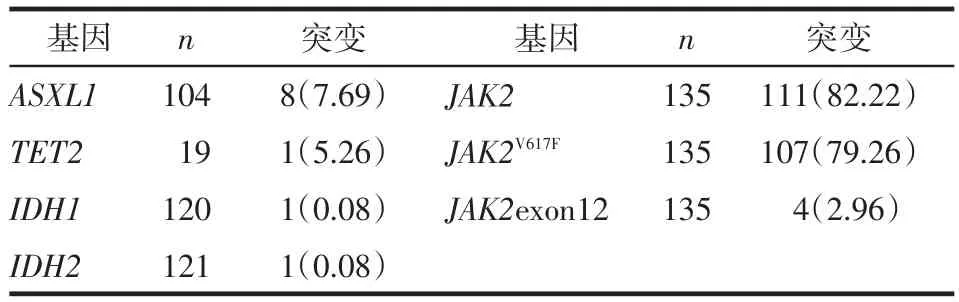
Table 1 Genetic mutations in PV patients表1 PV患者基因组学特征 例(%)
2.2 ASXL1突变和PV患者临床特征、疾病进展的关系 ASXL1突变组的血红蛋白低于未突变组,白细胞、V617F%水平、V617F%≥50%比例、有血栓栓塞比例及合并PPMF比例高于未突变组(P<0.05),见表2。ASXL1与V617F%呈正相关(rs=0.298,P= 0.002)。
在可检测的22例PPMF患者中(1例未做检测),ASXL1突变7例(31.82%)。但是无PPMF的PV患者中仅1例ASXL1突变(1/112,0.89%)。将ASXL1突变PV患者的其他基因情况做组合分析,结果显示所有ASXL1突变患者均为JAK2V617F突变,且V617F%较高。未发现其与TET2/IDH1/IDH2突变同时发生,见表3。
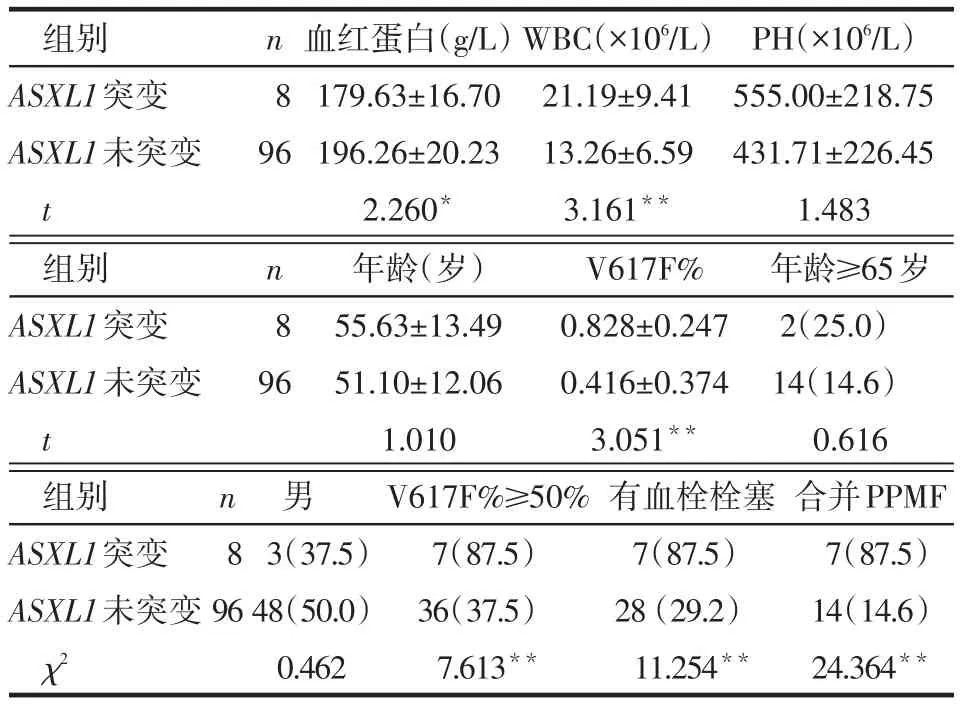
Table 2 Correlation of ASXL1 mutation with clinical features表2 ASXL1突变与临床特征的关系
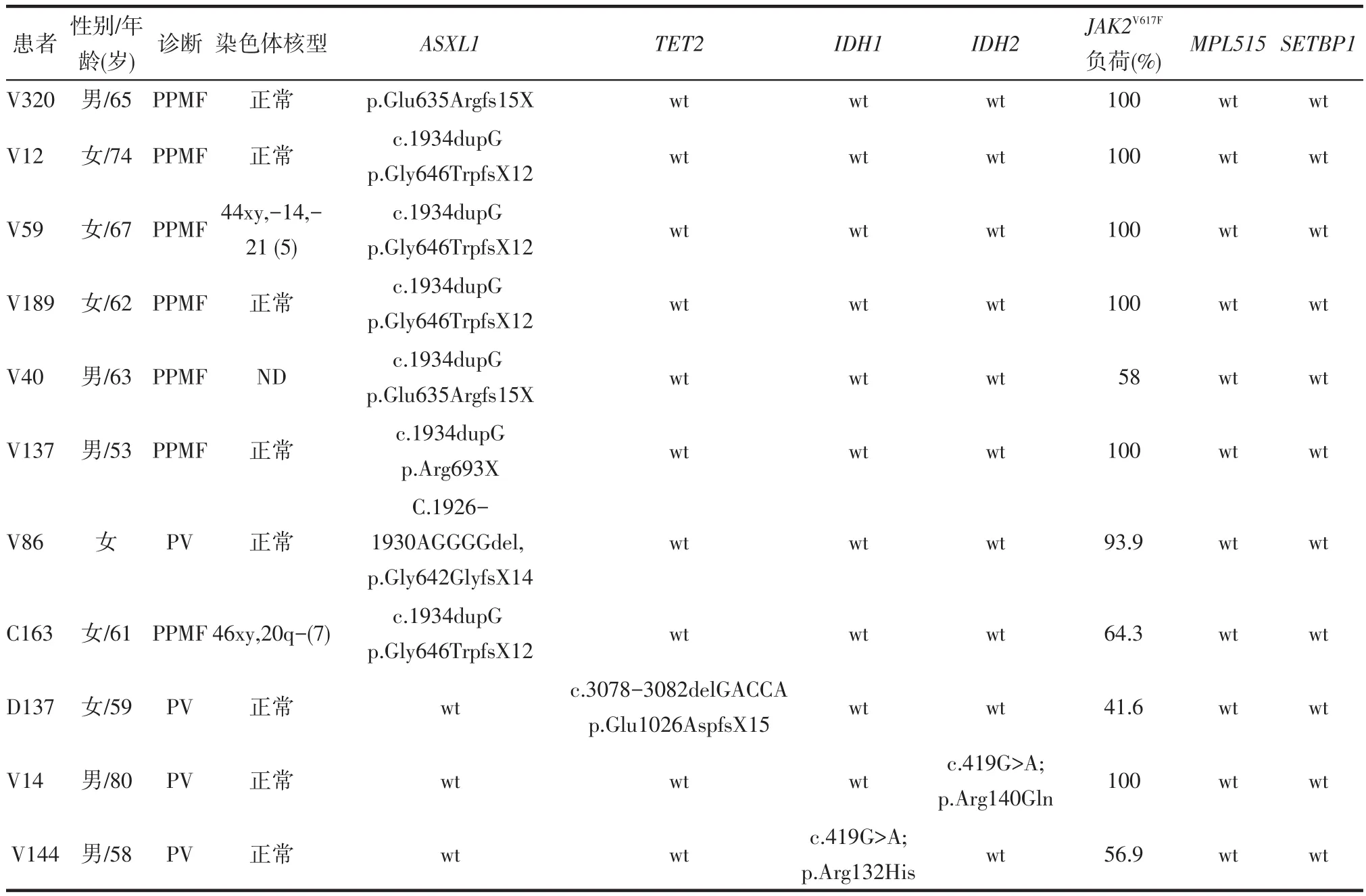
Table 3 Abnormal genetic characteristic in 11 PV patients表3 11例PV患者基因组学异常情况
2.3 JAK2V617F突变负荷与PV患者临床特征的关系 V617F%≥50%组的女性比例、高血小板比例、高白细胞比例、血栓栓塞比例和合并PPMF比例高于V617F%<50%组(P<0.05),见表4。

Table 4 The correlation of JAK2V617Fmutation load with clinical features表4 JAK2V617F突变与临床特征的关系 例(%)
2.4 PPMF危险因素的Logistic分析 以是否合并PPMF为应变量(是=1,否=0),以性别(女=0,男=1)、治疗分组(第1组=0,第2组=1)、脾大(是=1,否=0)、白细胞数、血小板数、ASXL1突变(是=1,否=0)和V617F%(≥50%=1,<50%=0)为自变量,进行Logistic多因素回归分析,结果显示ASXL1突变、V617F%≥50%和脾大是PPMF的危险因素,见表5。

Table 5 Logistic regression analysis for post-PV myelofibrosis risk factors表5 PPMF危险因素的Logistic分析结果
3 讨论
ASXL1通过与梳样结构抑制物复合体2(PRC2)发生反应,影响组蛋白的翻译、修饰,起到抑制癌症的作用[5]。文献报道ASXL1在特发性骨髓纤维化(PMF)中的发生率为13%~36%[6],而关于ASXL1在PPMF中突变情况的报道较少见。仅Abdel-Wahab等[7]提出ASXL1在原发性血小板增多症(ET)/PV后MF中的突变率为23%,且其没有对EPMF和PPMF进一步精确分析。本研究发现ASXL1在PPMF患者中有更高的突变率(31.82%),而在无PPMF的PV患者中发生比较低,仅为0.89%。且本组患者中ASXL1突变患者具有较高的V617F%。这可能由于ASXL1突变后对于BAP1等的募集减少,影响到JAK2基因的表达及造血微环境的变化,利于PPMF的发生[5]。本研究还发现ASXL1突变患者的血栓栓塞发生率高,可能是由于ASXL1突变后,其抑癌基因的作用消失,白细胞增多更为明显所致[8]。本研究结果表明ASXL1突变组血红蛋白水平相对较低,可能与ASXL1突变PV患者的高骨髓纤维化倾向有关。和Brecqueville等[9]的研究结果不同,本研究没有发现ASXL1突变与高年龄及性别有关。但发现患者年龄<65岁、女性发生ASXL1突变比率偏高。TET2、IDH1/IDH2突变均可通过DNA高甲基化,引起髓系细胞功能改变,参与MDS/MPN和AML的发生发展[9]。文献报道TET2、IDH1/IDN2突变在MPN的发生率分别为16%~26%和2%~4%[10-13]。本研究中TET2、IDH1、IDH2突变各1例,比例较低,且此3例均为高龄患者,V617F%较高。
SETBP1是多功能SET蛋白的结合伴侣[14],参与细胞的凋亡、转录和核小体组装。MPL515是血小板生成素受体基因,参与巨核细胞增殖[15]。文献报道SETBP1发生在2.5%PMF和4.5%的慢性粒单核细胞白血病(CMML)患者[16-17],MPL515突变发生3%ET、10%PMF和5%MPN转化为AML的患者[15,18]。本研究未发现SETBP1和MPL515突变存在于PV和PPMF患者。
[1]Baxter EJ,Scott LM,Campbell PJ,et al.Acquired mutation of the tyrosine kinase JAK2 in human myeloproliferative disorders[J].Lancet,2005,365(9464):1054-1061.
[2]Nagao T,Kurosu T,Umezawa Y,et al.Proliferation and survival signaling from both Jak2-V617F and Lyn involving GSK3 and mTOR/ p70S6K/4EBP1 in PVTL-1 cell line newly established from acute myeloid leukemia transformed from polycythemia vera[J].PLoS One,2014,9(1):e84746.
[3]Vannucchi AM,Biamonte F.Epigenetics and mutations in chronic myeloproliferative neoplasms [J]. Haematologica,2011,96(10): 1398-1402.
[4]Tefferi A.Polycythemia vera and essential thrombocythemia:2013 update on diagnosis,risk-stratification,and management[J].Am J Hematol,2013,88(6):507-516.
[5]Abdel-Wahab O,Dey A.The ASXL-BAP1 axis:new factors in myelopoiesis,cancer and epigenetics[J].Leukemia,2013,27(1):10-15.
[6]Carbuccia N,Murati A,Trouplin V,et al.Mutations of ASXL1 gene in myeloproliferativeneoplasms[J].Leukemia,2009,23(11):2183-2186.
[7]Abdel-Wahab O,Pardanani A,Patel J,et al.Concomitant analysis of EZH2 and ASXL1 mutations in myelofibrosis,chronic myelomonocytic leukemia and blast-phase myeloproliferative neoplasms [J].Leukemia,2011,25(7):1200-1202.
[8]Durmus A,Mentese A,Yilmaz M,et al.The Thrombotic Events in Polycythemia Vera Patients May Be Related to Increased Oxidative Stress[J].Med Princ Pract,2014,15(Epub ahead of print)
[9]Brecqueville M,Rey J,Bertucci F,et al.Mutation analysis of ASXL1,CBL,DNMT3A,IDH1,IDH2,JAK2,MPL,NF1,SF3B1, SUZ12,and TET2 in myeloproliferative neoplasms[J].Genes Chromosomes Cancer,2012,51(8):743-755.
[10]Tefferi A,Jimma T,Sulai NH,et al.IDH mutations in primary myelofibrosis predict leukemic transformation and shortened survival: clinical evidence for leukemogenic collaboration with JAK2V617F [J].Leukemia,2012,26(3):475-480.
[11]Pardanani A,Lasho TL,Finke CM,et al.IDH1 and IDH2 mutation analysis in chronic-and blast-phase myeloproliferative neoplasms [J].Leukemia,2010,24(6):1146-1151.
[12]Verger E,Andreoli A,Chomienne C,et al.TET2 gene sequencing may be helpful for myeloproliferative neoplasm diagnosis[J].Br J Haematol,2014,165(3):416-419
[13]Tefferi A,Pardanani A,Lim KH,et al.TET2 mutations and their clinical correlates in polycythemia vera,essential thrombocythemia and myelofibrosis[J].Leukemia,2009,23(5):905-911.
[14]Laborde RR,Patnaik MM,Lasho TL,et al.SETBP1 mutations in 415 patients with primary myelofibrosis or chronic myelomonocytic leukemia:independent prognostic impact in CMML[J].Leukemia, 2013,27(10):2100-2102.
[15]Pikman Y,Lee BH,Mercher T,et al.MPLW515L is a novel somaticactivating mutation in myelofibrosis with myeloid metaplasia[J]. PLoS Med,2006,3(7):e270.
[16]Damm F,Itzykson R,Kosmider O,et al.SETBP1 mutations in 658 patients with myelodysplastic syndromes,chronic myelomonocytic leukemia and secondary acute myeloid leukemias[J].Leukemia, 2013,27(6):1401-1403.
[17]Meggendorfer M,Bacher U,Alpermann T,et al.SETBP1 mutations occur in 9%of MDS/MPN and in 4%of MPN cases and are strongly associated with atypical CML,monosomy 7,isochromosome i(17) (q10),ASXL1 and CBL mutations[J].Leukemia,2013,27(9):1852-1860.
[18]Tefferi A.Novel mutations and their functional and clinical relevance in myeloproliferative neoplasms:JAK2,MPL,TET2,ASXL1, CBL,IDH and IKZF1[J].Leukemia,2010,24(6):1128-1138.
(2014-02-14收稿 2014-04-20修回)
(本文编辑 闫娟,陈丽洁)
读者·作者·编者
《天津医药》第七届编辑委员会委员名单
Correlation of Genomic Characteristic with Disease Progression in Polycythemia Vera
ZHAO Yingxu1,2,BAI Jie2,ZHANG Lei2,SHENG Mengyao2,SHI Hui2,XING Wen2,YANG Fengchun2,AI Limei1,ZHOU Yuan2
1 Department of Hematology,The First Affiliated Hospital of Liaoning Medical University,Jinzhou 121001,China;2 State Key Laboratory of Experimental Hematology,Institute of Hematology and Blood Diseases Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College
ObjectiveTo screen mutations in genes including ASXL1,TET2,IDH1,IDH2,SETBP1,MPL515, JAK2 exon 12 and JAK2V617in 135 polycythemia vera(PV)patients.To assess progreasson and genomics characteristics post polycythemic myelofibrosis.MethodsDNA sequencing of ASXL1(Exon12),TET2(Exons 3-11),IDH1(Exon4),IDH2(Exon4),SEPBP1(Exon4),JAK2 exon 12 and MPL515(Exon 10)genes were carried out using Sanger method.JAK2V617mutation was detected by allele-specific PCR in patients with PV.In the mean time,the mutation load of JAK2V617Fallele (V617F%)was evaluated by real-time PCR using Tagman MGB probe.Then,the significant of gene mutations and clinical outcomes of post-PV Myelofibrosis(PPMF)was analyzed.To study risk factors of PPMF,logistic regression were employed.ResultsASXL1,TET2,IDH1,IDH2 were mutated in 7.69%(8/104),5.26%(1/19),0.08%(1/120)and 0.08%(1/121)of all PV patient respectively.JAK2 was mutated in 82.22%(111/135)of PV patients with mutation rate of exon12 of 2.96%(4/ 135)and there were no mutation of MPL515 and SETBP1 in PV patients.ASXL1 mutation was found in 31.82%(7/22)PPMF patients.Spearman analysis showed that ASXL1 is correlated with JAK2V617F(V617F%)(rs=0.298,P=0.002).The hemoglobin was lower in patients with ASXL1 mutation than patient without mutation(wild type).Leukocyte count,V617F%>50% rate,thrombosis and PPMF were higher in patients with ASXL1 mutation than that of ASXL1 wild type(P<0.05).ASXL1 mutation,V617F%>50%rate and splenomegaly were all risk factors of PPMF.ConclusionASXL1 mutation is the risk-factor of PPMF and may promote V617F%by some mechanism.
polycythemia vera;genomics;ASXL1;TET2;IDH1;IDH2;SETBP1;MPL515;JAK2V617F;JAK2 exon12
R555.1
A
10.3969/j.issn.0253-9896.2014.06.002
*国家高技术研究发展计划(863计划,项目编号:2012AA02A211);国家自然科学基金面上项目(项目编号:81370610);天津市自然科学基金基础重点项目(项目编号:13JCZDJC31200);辽宁省科技厅项目(项目编号:2011225015)
1辽宁医学院附属一院血液科(邮编121001);2中国医学科学院北京协和医学院血液病医院(血液学研究所)实验血液学国家重点实验室
△通讯作者 E-mail:janebai86@126.com
