不同时程电针预处理对脑缺血大鼠血脑屏障功能的保护效应
2014-06-14刘建勋林咸明
刘建勋,林咸明
不同时程电针预处理对脑缺血大鼠血脑屏障功能的保护效应
刘建勋1,林咸明2
(1.宁波市第二医院,宁波 315010;2.浙江中医药大学第三临床医学院,杭州 310053)
通过观察不同时程电针预处理对脑缺血大鼠脑含水量及血脑屏障通透性的影响,评价电针预处理对脑缺血大鼠血脑屏障功能的保护效应。将清洁级健康雄性SD大鼠随机分为5组(=48),模型对照组、电针预处理1 d组、电针预处理3 d组、电针预处理7 d组及电针预处理15 d组,电针预处理各组电针预处理结束后建立大鼠单侧大脑中动脉阻塞(MCAO)模型,分别于脑缺血12 h、24 h和48 h,检测脑含水量、血脑屏障EB透过量。模型对照组脑缺血12 h和48 h时间点大鼠脑含水量及血脑屏障EB透过量均低于脑缺血24 h时间点(<0.05);电针预处理15 d组在脑缺血各时间点对脑含水量及EB透过量的减少作用显著(<0.05,<0.01<0.001)。脑缺血12 h、24 h、48 h3个时间点中以脑缺血24 h时间点血脑屏障损伤程度显著;电针预处理可通过明显降低脑缺血大鼠脑水肿及血脑屏障通透性发挥其对脑缺血大鼠血脑屏障功能的保护效应。
电针;预处理;脑缺血;血脑屏障;大鼠
由于缺血性脑血管病的高发病率、高致死率、高致残率,目前尚缺乏高效的治疗手段,近年来,针对脑缺血损伤的脑保护研究层出不穷,其中预处理是非常重要的预防措施之一。由预处理产生的脑保护现象称为“脑缺血耐受”。预处理的方式多种多样,短暂脑缺血、远程缺血、低氧、高压氧、麻醉剂及促炎性细胞因子等,但是其中很多预处理方式在临床中有着不可操作性。国内已有研究者发现电针预处理可诱导脑缺血耐受[1-4]。利用电针可诱导脑缺血耐受这一效应及该疗法的优势,开展对缺血性脑血管高危人群的预防性治疗具有积极意义。血脑屏障(blood brain barrier, BBB)是脑组织与血管之间的维持各种物质稳定的重要结构,脑缺血损伤后血脑屏障破坏以及并发的脑水肿是缺血性脑血管病的主要病理损害。血脑屏障结构与功能的完整性与脑水肿的形成密切相关,要研究电针预处理对缺血性脑血管病的脑保护作用,解决血脑屏障受损的问题是防治缺血性脑血管疾病所致损伤的关键[5]。不同时程电针预处理对血脑屏障功能保护作用的研究未见报道,本研究的目的之一,就是寻求电针预处理对脑缺血大鼠血脑屏障功能保护作用的最佳电针预处理时程。
本实验对SD大鼠进行不同时程电针预处理(预处理1 d、3 d、7 d、15 d),再参照Longa线栓法[6]建立大鼠单侧MCAO模型,动态观察不同时程电针预处理对血脑屏障功能(脑含水量、EB透过量)的影响,以揭示电针预处理对实验性脑缺血大鼠血脑屏障通透性的保护作用,并比较不同时程的电针预处理保护效应。
1 材料与方法
1.1 实验动物
选用清洁级健康雄性SD大鼠240只,体重(250±20)g,购自中科院上海实验动物中心,饲养于浙江中医药大学实验动物中心。采用随机数字表分配法将大鼠分为5组(=48),即模型对照组、电针预处理1 d组、电针预处理3 d组、电针预处理7 d组以及电针预处理15 d组。各电针预处理组进行相应时程的电针预处理后,各组大鼠建立单侧MCAO模型,再将各组分成单侧脑缺血12 h、24 h和48 h3个亚组,其中8只进行脑含水量测定,另8只检测伊文思蓝透过量。
1.2 电针预处理方法
取百会、水沟(取穴点位置参照华兴邦等制定的《实验动物穴位图谱》),采用华佗牌0.20 mm×25 mm针灸针刺入穴位,连接HANS-100电针仪,频率2/15 Hz,电流1 mA,每次30 min,每日1次。
1.3 单侧MCAO模型建立方法
参照Longa线栓法[6]建立SD大鼠单侧MCAO模型。术前24 h禁食、不禁水。用10%水合氯醛(0.35mL/100g体重)对大鼠进行腹腔注射,完全麻醉后,固定,备皮,碘伏消毒,生理盐水脱碘,垂直于目外眦与耳屏之间连线切口约1 cm,钝性分离肌肉,暴露颞骨,置于激光多普勒血流监测仪下监测脑部即时基础血流,再将大鼠取仰卧位固定,于颈前皮肤正中切口1.5 cm,暴露右侧颈三角,分离右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),在颈总动脉下端打一死结。游离颈外动脉主干,在其与颈内动脉交接的根部用1号线打一死结。用缝合线阻断左侧颈总动脉并用止血钳暂时阻断颈内动脉血流,在右侧颈总动脉位于其与颈外动脉交接位置下端约2 mm处剪一约相当于颈总动脉直径1/4大小的切口,松开夹紧颈内动脉的止血钳,将制备好的栓线插入颈内动脉(线栓为4号鱼线,长约25 mm,预先蘸有肝素钠),进入颈内动脉颅内段,当遇有轻微阻力时停止,同时用激光多普勒血流仪监测缺血程度,以脑血流下降至基础值的(45±10)%为MCAO大鼠模型缺血程度,栓子插入19~22 mm,栓线经颈内动脉与颈外动脉分叉轻插入颅内至大脑前动脉(ACA),该深度恰好堵塞MCA开口,栓线外端留出约5 mm,90 min后进行再灌注,将线栓抽至颈内动脉起始部,即恢复MCA血供,用缝合线扎紧线栓后消毒、缝合皮肤,同时予青霉素钠肌注。同步喂养,取材。
1.4 脑含水量测定
脑含水量的测定参照Meng等[7]的方法。取造模后12 h、24 h、48 h共3个时间点,麻醉大鼠,断头取脑,弃去小脑及双侧嗅球,称取右侧湿重(Wet weight,WW),恒温烤箱110 ℃/24 h烘干后称取干重(Dry Weight,DW)。干-湿比重法测定脑组织含水量,计算各组右侧的脑组织含水量,计算公式为(WW-DW)/WW×100%。
1.5 脑缺血大鼠血脑屏障EB透过量的测定
血脑屏障通透性是按照Uyama O等的方法[8],通过渗出血管外的伊文思蓝(EB)(Fluka进口分装)来评价的。在造模后12 h、24 h和48 h用10%水合氯醛麻醉大鼠(35 mg/100 g体重),经股静脉注入2% EB生理盐水溶液(4 mL/kg),大鼠眼球结膜、四肢迅速蓝染,表明EB注入成功。1 h后开胸通过左心室灌注生理盐水),直到右心房流出的液体无色为止,断头取脑,取损伤侧背外侧新皮层,样品称重并置入50%三氯乙酸溶液中。匀浆和离心(10000 rpm,20 min),取上清液按1:3的比例用乙醇稀释。荧光值通过多功能酶标分析仪测得(激发波长620 nm,发射波长680 nm)。根据EB溶液(0~50 ng/mL)的外在标准绘出的EB与荧光值之间的线形标准曲线,可以得出脑组织中EB的含量,并用每克组织含量来表示(ng/g)。
1.6 统计学方法
所有数据采用SPSS16.0统计软件进行分析,计量资料用均数±标准差表示,多组间计量资料比较采用单因素方差分析();组间两两比较,方差齐性时用检验,方差不齐时用检验。以<0.05作为差异有统计学意义的标准。
2 结果
2.1 不同时程电针预处理对大鼠脑缺血不同时间点脑含水量的影响
从表1中可以看出,不同时程电针预处理大鼠在脑缺血12 h时间点,各电针预处理组脑含水量明显低于模型对照组(<0.05),其中电针预处理15 d组与模型对照组比较,脑含水量降低最为明显(<0.001)。电针预处理1 d组、电针预处理3 d组和电针预处理7 d组之间无明显差异(>0.05),电针预处理15 d组大鼠脑含水量明显低于电针预处理1 d、电针预处理3 d组(<0.01),与电针预处理7 d组相比,电针预处理15 d组大鼠脑含水量亦有明显降低(<0.05);在脑缺血24 h时间点,模型对照组、电针预处理1 d组、电针预处理3 d组和电针预处理7 d组大鼠脑含水量之间无明显差异(>0.05),电针预处理15 d组与模型对照组比较,大鼠脑含水量显著下降(<0.001),与电针预处理1 d组和电针预处理3 d组比较,大鼠脑含水量明显下降(<0.01),与电针预处理7 d组比较亦有明显下降(<0.05);在脑缺血48 h时间点,各电针预处理组与模型对照组相比差异有统计学意义,其中电针预处理1 d组和电针预处理7 d组大鼠脑含水量明显低于模型对照组(<0.01),电针预处理3 d组大鼠脑含水量明显低于模型对照组(<0.05),电针预处理15 d组与模型对照组比较,大鼠脑含水量显著下降(<0.001)。电针预处理1 d组、电针预处理3 d组和电针预处理7 d组大鼠脑含水量之间无明显差异(>0.05),电针预处理15 d组大鼠脑含水量明显低于电针预处理1 d组与电针预处理7 d组(<0.01),且明显低于电针预处理3 d组(<0.001)。
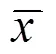
表1 不同时程电针预处理对脑缺血大鼠脑含水量的影响 (±s,100%)
注:与模型对照组比较1)<0.05,2)<0.01,3)<0.001;与电针预处理1 d组比较4)<0.01;与电针预处理3 d组比较5)<0.01,6)<0.001;与电针预处理7 d组比较7)<0.05,8)<0.01
2.2 不同时程电针预处理对脑缺血大鼠血脑屏障EB透过量的影响
如表2所示,在脑缺血12 h时间点,各电针预处理组EB透过量明显低于模型对照组,电针预处理1 d组和电针预处理3 d组与模型对照组比较差异明显(<0.01),电针预处理7 d组和电针预处理15 d组与模型对照组比较差异显著(<0.001)。电针预处理15 d组大鼠EB透过量明显低于电针预处理1 d组与电针预处理3 d组,电针预处理1 d组、电针预处理3 d组、电针预处理7 d组之间EB透过量差异不明显(>0.05),电针预处理15 d组与电针预处理7 d组相比也无统计学意义(>0.05);在脑缺血24 h时间点,各电针预处理组大鼠EB透过量明显低于模型对照组,电针预处理1 d组与模型对照组相比差异明显(<0.01),电针预处理3 d组、电针预处理7 d组和电针预处理15 d组与模型对照组相比差异显著(<0.001)。电针预处理1 d组、电针预处理3 d组和电针预处理7 d组之间EB透过量无统计学差异(>0.05)。电针预处理15 d组大鼠EB透过量明显低于电针预处理1 d组,相比差异显著(<0.01),也明显低于电针预处理3 d组、电针预处理7 d组(<0.05);在脑缺血48 h时间点,各电针预处理组EB透过量明显低于模型对照组,电针预处理1 d组和电针预处理3 d组与模型对照组比较差异明显(<0.05),电针预处理7 d组与模型对照组比较差异显著(<0.01),电针预处理15 d组与模型对照组相比差异显著(<0.001)。电针预处理1 d组、电针预处理3 d组和电针预处理7 d组之间相比差异不明显(>0.05),电针预处理15 d组与电针预处理7 d组相比差异不明显(>0.05)。电针预处理15 d组大鼠EB透过量明显低于电针预处理1 d组、电针预处理3 d组(<0.05)。
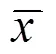
表2 不同时程预处理对大鼠脑缺血不同时间点血脑屏障EB透过量的影响 (±s,ng/g)
注:与模型对照组比较1)<0.05,2)<0.01,3)<0.001;与电针预处理1 d组比较4)<0.01;与电针预处理3 d组比较5)<0.05,6)<0.01;与电针预处理7 d组比较7)<0.05
3 讨论
血脑屏障是存在于脑组织和血液之间,它通过控制血液循环中的某些物质向中枢神经组织转运,从而保证中枢神经系统内环境的稳定,其通透能力与中枢神经的变性、损伤和炎症等密切相关[9-10]。在生理状态下,血脑屏障相对不通透,主要起屏障功能,严格控制水溶性物质如小分子的电解质进入脑组织,只允许气体分子和脂溶性的物质通过血脑屏障弥散入脑组织。同时,为了维持脑部的营养供给,血脑屏障的转运系统也使极性物质进出脑组织[11]。血脑屏障的通透性变化受脑细胞相关因素影响。许多调节因子可通过对内皮细胞的转运系统和酶系统进行影响,改变血脑屏障的通透性[12]。血脑屏障的功能遵循Starlin原理,即任何在单纯静水压下进入脑组织的水分,都将由被阻留在血管内的电解质和血浆蛋白形成的渗透压所建立起的一种反向力量将其重新“抽”回血液,从而有效地控制水分子及其溶质进入脑组织[13]。在病理情况下,由于血脑屏障受到破坏,这种调控作用消失,血液的成分,包括电解质和血浆蛋白因血液压力而经开放的血脑屏障释入脑组织,即血脑屏障通透性增加。
缺血、缺氧是诱发脑水肿的主要原因,而血脑屏障通透性增加又是脑水肿加重的主要因素。缺血量的多少以及缺血时间的长短与脑损伤的程度有着极大的关系。本实验结果显示,脑缺血后脑损伤呈抛物线状发展趋势,即在实验所选取的3个时间点中以脑缺血后24 h时间点损伤最为严重,在12 h和48 h时间点损伤呈发展到缓解的状态。可能与缺血后血脑屏障的自我修复有关。电针预处理可降低脑含水量及减少血脑屏障EB透过量,以电针预处理15 d组效果最为显著,短时程的电针预处理对降低脑水肿及减少EB透过量有反复性和不稳定性且与脑损伤程度呈负相关,长时程的电针预处理效果明显优于短时程电针预处理。总而言之,不同时程的电针预处理对血脑屏障功能的保护效应存在差异,以电针预处理15 d的保护效应最为明显。
[1] 孙忠人,唐伟,单丽莉,等.针刺诱导脑缺血耐受的实验研究[J].中国临床康复,2005,9(1):122-123.
[2] 唐伟,王威,孙忠人,等.针刺预处理全脑缺血大鼠海马CA1区Bcl-2 mRNA的表达[J].中国中医基础医学杂志.2007,13(2):156-158.
[3] 唐伟,孙忠人,张力,等.针刺预处理全脑缺血大鼠海马CA1区细胞凋亡和热休克蛋白70 mRNA的表达[J].中国临床康复,2005,9(37): 90-92.
[4] 王淑兰,倪光夏.针刺督脉经穴对局灶性脑缺血再灌注大鼠缺血半暗带MAP-2、NF-L的mRNA表达的影响[J].上海针灸杂志,2013, 32(3):221-223.
[5] Warach S,Latour LL. Evidence of reperfusion injury, exacerbated by thrombolytic therapy, in human focal brain ischemia using a novel imaging marker of early blood-brain barrier disruption[J]. Stroke, 2004,35(11 Suppl 1):2659-2661.
[6] Longa EZ, Weinstein PR, Carlson S,. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1): 84-87.
[7] Meng F, Liu R, Gao M,. Pinocembrin attenuates blood-brain barrier injury induced by global cerebral ischemia-reperfusion in rats[J]. Brain Res, 2011,1391:93-101.
[8] Uyama O, Okamura N, Yanase M,. Quantitative evaluation of vascular permeability in the gerbil brain after transient ischemia using Evans blue fluorescence[J].J Cereb Blood Flow Metab,1988,8(2): 282-284..
[9] Cucullo L, McAllister MS, Kight K,. A new dynamic in vitromodel for the multidimensional study of astrocyte-endothelial cell interactions at the blood-brain barrier[J]. Brain Res, 2002,951(2): 243-254.
[10] Marchi N, Fazio V, Cucullo L,. Serum transthyretin monomer as a possible marker of blood-to-CSF barrier disruption[J]. J Neurosci, 2003,23(5):1949-1955.
[11] McAllister MS, Krizanac-Bengez L, Macchia F,. Mechanisms of glucose transport at the blood-brain barrier: an in vitro study[J]. Brain Res, 2001,904(1):20-30.
[12] Abbott NJ. Astrocyte-endothelial interactions and blood-brain barrier permeability[J]. J Anat, 2002,200(6):629-638.
[13] Kimelberg HK. Current concepts of brain edama. Review of laboratory investigations[J]. J Neurosurg,1995,83(6):1051-1059.
Protecting Effects of Different Time-course Electroacupuncture Pretreatments on Blood-brain Barrier Function in Cerebral Ischemia Rats
1,2.
1.315010,; 2.310053,
To investigate the impactsof different time-course electroacupuncture pretreatments on brain water content and blood-brain barrier permeability and assess their protecting effects on blood-brain barrier function in cerebral ischemia rats.Clean-grade healthy male SD rats were randomly allocated to five groups (=48): model control group, and one-day, three-day, seven-day and fifteen-day electroacupuncture pretreatment groups. A rat model of unilateral middle cerebral artery occlusion (MCAO) was made after electroacupuncture pretreatment was finished in various electroacupuncture groups. The water content of the brain and the amount of EB through blood brain barrier were measured at 12, 24 and 48 hrs after cerebral ischemia.Both brain water content and EB permeation amount were lower at 12 and 48 hrs than at 24 hrs after cerebral ischemia (<0.05). There was a significant reducing effect on brain water content and EB permeation amount in the fifteen-day electroacupuncture pretreatment group at various time points after cerebral ischemia (<0.05,<0.01,<0.001).The blood-brain barrier is impaired most severely at 24 hrs of the three time points 12, 24 and 48 hrs after cerebral ischemia. Electroacupuncture pretreatment can produce a protecting effect on blood-brain barrier function in cerebral ischemia rats by markedly reducing cerebral edema and blood-brain barrier permeability.
Electroacupuncture; Pretreatment; Cerebral ischemia; Blood-brain barrier; Rats
1005-0957(2014)12-1169-04
R2-03
A
10.13460/j.issn.1005-0957.2014.12.1169
2014-03-20
浙江省自然科学基金项目(Y2111260)
刘建勋(1983 - ),男,医师,硕士
林咸明(1966 - ),男,教授,研究方向为针灸治疗脑源性疾病的基础与临床研究,Email:Linxianming66@126.com
