慢性噪声暴露对大鼠听皮层及海马脑区胰岛素样生长因子-1表达的影响△
2014-06-12杨希林廖华陈抗松解为全杨琨朱占永
杨希林 廖华 陈抗松 解为全 杨琨 朱占永
长期噪声暴露不仅对听觉通路造成不良影响,也会增加机体其他系统尤其是中枢神经系统受到损伤的风险[1]。噪声对人体的危害已经成为社会普遍关注的公共卫生问题,迫切需要在其病理生理机制及防治方面进行深入研究。胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)是一种结构和功能都类似胰岛素的多肽类神经营养因子,在中枢神经系统的生长发育过程中和维持神经系统的完整性及动态平衡方面具有重要而复杂的生物学作用[2]。中枢神经系统内的IGF-1可发挥非选择性神经保护作用,抑制细胞凋亡,有助于神经细胞受损后的功能修复[3]。目前IGF-1在脑缺血缺氧损伤、阿尔茨海默症等中枢神经系统变性疾病中的临床应用价值越来越受到关注[4],但其在噪声暴露影响中枢神经系统中作用尚无系统性研究。因此,本研究拟通过检测慢性噪声暴露后大鼠听皮层及海马脑区IGF-1表达的变化,探讨IGF-1在噪声性中枢神经系统损伤中的作用。
1 材料与方法
1.1实验动物分组及处理 选取ABR反应阈正常且相近的Wistar成年雄性大鼠16只(由武汉大学人民医院实验动物中心提供),随机分为噪声组和对照组,每组8只,对照组正常喂养,不予任何处理;噪声组:将动物置于隔音混响室内,参照Wibke等[5]的方法,给予中心频率为4 kHz、声强为100 dB SPL的宽带白噪声暴露,每天暴露4 h,持续28 d;噪声由美国TDT(Tucker-Davis technology)公司 Rvpds软件包编译,连接扬声器播放,并用声级计校准。
1.2实验试剂及设备 兔抗大鼠IGF-1抗体、羊抗兔IgG(武汉博士德公司);TDT系统(Tucker-Davis technology TDT公司,美国)。
1.3实验方法
1.3.1ABR测试 于噪声暴露前1 d、暴露第28 d,分别在隔声屏蔽室内对各组大鼠进行ABR测试。按45 mg/kg的剂量腹腔注射2%戊巴比妥钠麻醉大鼠后置于固定架上,记录电极插于大鼠左右耳连线中点颅顶皮下,参考电极插于给声耳乳突皮下,接地线插于鼻尖,采用TDT系统SigGenRP软件单耳给声并采集信号,刺激声为click,强度范围为10~110 dB SPL,衰减间隔5 dB,滤波带宽300~3 000 Hz,持续时间 10 ms,叠加1 024 次,以引出波Ⅲ的最小刺激强度为大鼠的反应阈,波形分化较差时可以波Ⅲ幅值接近特定的电压为判断标准,记录ABR的反应阈值。
1.3.2大鼠听皮层及海马脑区组织标本采集及免疫组织化学染色 噪声暴露第28天,ABR检测完毕后,将噪声组和对照组大鼠经1%戊巴比妥腹腔麻醉,开胸暴露心脏,灌注固定,依据大鼠立体定位图谱定位大鼠海马脑区及听皮层,冰台上断头取脑,迅速置于多聚甲醛溶液固定4 h以上,常规脱水、透明、石蜡包埋。连续冠状切片,厚度6 μm。每只大鼠海马脑区及听皮层脑区分别取4张切片行IGF-1免疫组织化学法染色。将切片置于3%H2O2室温孵育10 min,柠檬酸缓冲液修复抗原,山羊血清封闭30 min后,用兔抗大鼠IGF-1抗体(1:50)4 ℃孵育过夜。充分洗涤后用生物素标记的羊抗兔二抗37 ℃孵育,滴加辣根酶标记链霉卵白素工作液,孵育20 min,冲洗后DAB显色,最后贴片、脱水、透明、封片。染色设PBS代替一抗作为阴性对照,光镜下观察,胞浆出现棕黄色颗粒为阳性着色。
1.4统计学方法 运用Image Pro Plus 6.0(zpp60)图像分析软件分别计量分析两组动物海马及听皮层标本免疫组织化学染色信号反应产物的含量。每张脑片在400倍光镜下随机选取3个视野,计算每个视野中阳性细胞数及累积光密度值(integrated optical density, IOD)。采用SPSS19.0统计软件,两独立样本的计量资料采用t检验对两组数据进行统计学分析,以P<0.05为差异有统计学意义。
2 结果
2.1两组大鼠实验前后ABR反应阈比较 噪声暴露前,实验组与对照组大鼠ABR阈值无明显差异(P>0.05)。噪声暴露第28天,与对照组比较,实验组大鼠ABR反应阈明显升高,差异有显著统计学意义(P<0.01)(表1)。

表1 两组大鼠实验前后ABR反应阈比较
注:*与对照组同期比较,P<0.01
2.2噪声组和对照组大鼠海马脑区与听皮层神经元IGF-1表达比较(图1、2) 噪声暴露28天后噪声组大鼠海马及听皮层脑区均可见IGF-1免疫反应阳性神经元,其棕黄色染色颗粒位于胞浆中,与对照组比较,噪声组大鼠海马及听皮层脑区IGF-1阳性神经元数目明显增多,差异有统计学意义(P<0.01);且噪声组大鼠海马及听皮层脑区IOD值均较对照组显著升高,差异有统计学意义(P<0.01)(表2)。
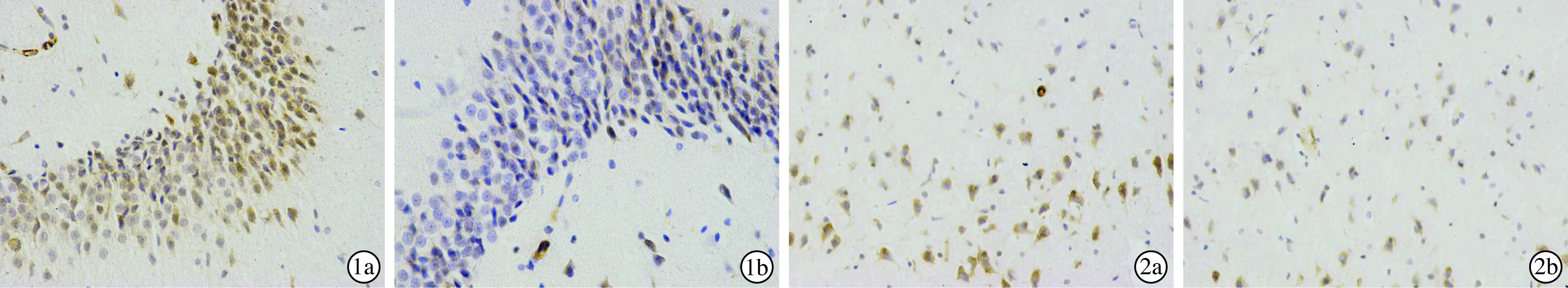
图1 噪声暴露28天后IGF-1在两组大鼠海马脑区的表达(SP×400) a 噪声组;b 对照组

组别只数(只)阳性神经元数目(个/视野) 听皮层 海马 IOD值 听皮层 海马 噪声组8856.52±6.89*144.28±19.19*4 192.03±246.44*13 613.39±1 959.51*对照组840.08±4.63108.44±9.822 344.48±554.856 890.58±1 344.99
注: *与对照组比较,P<0.01
3 讨论
噪声暴露所致听觉系统损害主要包括暂时性或永久性阈移,以及伴随的耳鸣等听觉功能紊乱。听觉传导通路始于内耳毛细胞,耳蜗螺旋神经节的双极细胞将外周听觉信号向上依次经过耳蜗核、外侧丘系、下丘、内侧膝状体至听皮层,经过复杂的分析综合产生听觉意识。既往关于噪声对听觉系统影响的研究重点主要集中于耳蜗毛细胞、螺旋神经节及血管纹等外周听觉系统,随着研究的深入,噪声环境下听觉中枢结构和功能的变化越来越受到关注。已有动物实验发现噪声暴露后,小鼠耳蜗核及下丘中央核凋亡细胞数显著增多[6],内侧膝状体和听皮层各区域细胞密度明显下降[7],包括听皮层在内的中枢听觉通路各脑区谷氨酸、γ-氨基丁酸(GABA)、天门冬氨酸等氨基酸类递质表达较对照组显著升高, 证明噪声对听觉中枢神经信号传递有影响[8]。
由于听觉通路与边缘系统之间存在着广泛联系,长时间噪声暴露后,边缘系统也出现结构和功能的变化。众多流行病学调查显示除了听觉系统损害的表现之外,噪声接触者记忆力及学习能力减退、操作能力下降、厌烦反应和消极社会行为等认知功能改变发生率明显增高,造成工作和学习效率及生活质量的下降,这已经成为备受关注的公共卫生问题。相对于流行病学研究而言,目前噪声对认知功能影响的深入实验研究尚处于起步阶段。海马是与认知功能关系最为密切的重要脑区,在陈述性学习记忆、整合认知及情感信息中起着重要作用,也是相关研究的关键靶点。 Uran等[9]给予幼年大鼠中等强度噪声暴露后(95~97 dB SPL,2 h),发现其海马区域结构和功能改变,同时大鼠记忆、认知等行为学表现异常;Cui等[10]给予大鼠持续14天的100 dB SPL白噪声暴露后,发现大鼠海马和前额叶均出现神经退行性病变的细胞内标志tau蛋白磷酸化表达增高。因此,慢性噪声暴露后,中枢神经系统相关重要功能脑区损伤的相关机制及修复是未来研究的热点。
胰岛素样生长因子(IGF-1)是由70个氨基酸、3个二硫键交叉连接而成的单链碱性多肽分子,广泛分布于中枢神经系统,其通过激活促分裂原活化蛋白激酶(mitoen-activatedprotein kinase,MAPK)和磷脂酰肌醇3-激酶/丝氨酸-苏氨酸蛋白激酶(PI3K-Akt)等多条信号通路抑制神经元凋亡,发挥非选择性神经保护作用,能够在病理状态下减轻中枢神经系统的损伤,有助于神经细胞功能恢复。Cheng[11]给予蛋白酶抑制剂预处理的神经元SH-SY5Y细胞系IGF-1后,发现凋亡标志蛋白表达下降。Gleichmann等[12]观察了IGF-1对小脑颗粒神经元的抗凋亡作用,发现其与PI3K-Akt通路上促凋亡蛋白Bad的磷酸化有关。
本研究在给予大鼠100 dB SPL慢性噪声暴露4周后,实验组大鼠ABR反应阈较对照组显著升高,说明慢性噪声暴露导致大鼠外周听觉神经至脑干通路的神经电活动异常,听功能出现损害,证明该慢性噪声性听损伤动物模型造模成功。文中结果显示噪声组听觉通路高级中枢听皮层及边缘系统关键脑区海马神经元IGF-1表达均较对照组均显著增加。可见,由于长期噪声暴露可以导致听觉通路高级中枢及其与情绪密切相关的边缘系统神经元出现结构和功能的变化,甚至出现凋亡,因此推测,慢性噪声暴露后,IGF-1系统被激活,其在相应脑区的表达显著增加,进而发挥相应的神经保护作用。目前,关于IGF-1在神经系统损伤修复中的应用价值越来越受到关注。Maya-Vetencourt等[13]给予成年视觉剥夺动物模型皮层内微泵灌注IGF-1共2周,发现外源性给予IGF-1可以增加成年动物神经系统的可塑性,并促进视觉功能的恢复。 Dupraz等[14]分别给予离体培养大鼠视网膜螺旋神经节细胞(retinal ganglion cells,RGCs)IGF-1受体(IGF-1R)拮抗剂、IGF1R序列小干扰RNA后,发现RGCs轴突再生显著下降,说明成年动物中枢神经系统神经元轴突再生需要IGF-1R的激活。
本研究着眼于慢性噪声暴露后大脑皮层听觉中枢与情绪调节中枢边缘系统IGF-1表达的变化,发现长期噪声暴露可导致听觉中枢与边缘系统IGF-1表达增加,可能与机体激活IGF-1系统发挥对中枢神经系统损伤的保护作用有关,但其具体分子通路尚不明确。因此在下一步研究中,将着重探讨内源性IGF-1在噪声性听觉通路及边缘系统损伤保护中的机制,并尝试通过给予外源性IGF-1,对中枢神经系统噪声性损伤起到修复作用,为减轻噪声对人体的危害开辟新的治疗途径。
4 参考文献
1 Ising H, Kruppa B. Health effects caused by noise: evidence in the literature from the past 25 years[J]. Noise Health, 2004, 6:5.
2 Bibollet-Bahena O, Cui QL, Almazan G. The insulin-like growth factor-1 axis and its potential as a therapeutic target in central nervous system (CNS) disorders[J]. Cent Nerv Syst Agents Med Chem, 2009, 9:95.
3 Fernandez AM, Torres-Aleman I. The many faces of insuin-like peptide signalling in the brain[J]. Nat Rev Neurosci, 2012,13:225.
4 Guan J, Mathai S, Liang H, et al. Insulin-like growth factor-1 and its derivatives: potential pharmaceutical application for treating neurological conditions[J]. Recent Pat CNS Drug Discov, 2013, 8:142.
5 Wibke S, Annalisa Z, Mirko J,et al.Noise-induced inner hair cell ribbon loss disturbs central arc mobilization: a novel molecular paradigm for understanding tinnitus[J]. Mol Neurobiol, 2013, 47:261.
6 Coordes A, Gröschel M, Ernst A, et al. Apoptotic cascades in the central auditory pathway after noise exposure[J]. J Neurotrauma, 2012, 29:1 249.
7 Basta D, Tzschentke B, Ernst A.Noise-induced cell death in the mouse medial geniculate body and primary auditory cortex[J]. Neurosci Lett, 2005, 381: 199.
8 Godfrey DA, Kaltenbach JA, Chen K, et al. Amino acid concentrations in the hamster central auditory system and long-term effects of intense tone exposure[J]. J Neurosci Res, 2012, 90:2 214.
9 Uran SL, Aon-Bertolino ML, Caceres LG, et al. Rat hippocampal alterations could underlie behavioral abnormalities induced by exposure to moderate noise levels[J]. Brain Res, 2012, 1 471:1.
10 Cui B, Zhu L, She X, et al. Chronic noise exposure causes persistence of tau hyperphosphorylation and formation of NFT tau in the rat hippocampus and prefrontal cortex[J]. Exp Neurol, 2012, 238:122.
11 Cheng B, Maffi SK, Martinez AA, et al.Insulin-like growth factor-I mediates neuroprotection in proteasome inhibition-induced cytotoxicity in SH-SY5Y cells[J]. Mol Cell Neurosci, 2011, 47:181.
12 Gleichmann M, Weller M, Schulz JB.Insulin-like growth factor-1-mediated protection from neuronal apoptosis is linked tophosphorylation of the pro-apoptotic protein BAD but not to inhibition of cytochrome c translocation in rat cerebellar neurons[J]. Neurosci Lett, 2000, 282:69.
13 Maya-Vetencourt JF, Baroncelli L, Viegi A, et al. IGF-1 restores visual cortex plasticity in adult life by reducing local GABA levels[J]. Neural Plast, 2012. doi:10.1155/2012/250421.
14 Dupraz S, Grassi D, Karnas D, et al.The insulin-like growth factor 1 receptor is essential for axonal regeneration in adult central nervous system neurons[J]. PLoS One, 2013, 8:e54 462.
