饲料蛋白质水平对大黄鱼体内蛋白质的沉积和代谢反应的影响*
2014-04-17林淑琴张文兵麦康森申屠基康
林淑琴,成 琳,张文兵**,徐 玮,麦康森,申屠基康
(1.中国海洋大学水产动物营养与饲料农业部重点实验室,海水养殖教育部重点实验室,山东 青岛266003;2.宁波市海洋与渔业研究院,浙江 宁波315010)
蛋白质是鱼类必需的营养物质,在其生长过程中发挥着重要的生理功能。鱼体摄入的蛋白质通过一系列代谢过程合成新的蛋白质,在组织器官中沉积[1]。鱼体的生长实质上是体内蛋白质沉积的过程,饲料中蛋白质缺乏或不足会导致鱼体生长受阻,体质下降。一般来说,随着个体发育日趋成熟,鱼体的生长速度下降,对蛋白质的需要量也下降[2]。提高饲料中蛋白质的含量通常会提高鱼体的生长速率,但饲料蛋白质含量超过其适宜值,会引起蛋白质效率下降,作为能量消耗的蛋白质增加,体内蛋白质沉积也会受到影响[3-5]。与此同时,体内多余的蛋白质代谢产生的氨和尿素排出体外,对养殖环境造成不良影响。
研究表明,东海银鲳(Pampusargenteus)和丝尾鱼(Mystusnemurus)的鱼体蛋白质含量会随着饲料中蛋白质水平的升高而显著升高[6-7],而美洲黑石斑(Centropristisstriata)的鱼体蛋白质含量则受饲料蛋白质水平的影响不显著[8]。Deng等研究丝尾鳠(Hemibagruswyckioides)后认为,鱼体蛋白质的沉积主要由所处的生长阶段所决定[9]。
大黄鱼(Pseudosciaenacrocea)是我国特有的名贵海水养殖鱼类。Duan等在研究饲料中不同蛋白质/脂肪比对大黄鱼幼鱼生长的影响时发现,鱼体蛋白质含量受饲料蛋白质水平的影响不显著[10]。但大黄鱼体内蛋白质代谢相关反应、蛋白质沉积与代谢反应是否受到饲料蛋白质水平和生长阶段的双重影响等问题并不清楚。本研究以大黄鱼为实验对象,比较分析饲料中不同蛋白质水平对3个不同生长阶段的大黄鱼体内蛋白质沉积和氨基酸代谢反应相关指标的影响,为完善不同生长阶段大黄鱼的饲料配方提供基础数据。
1 材料和方法
1.1 实验用鱼
实验用大黄鱼购自浙江象山苗种培育有限公司。其中,小规格实验鱼初始体重为(12.80±0.08)g,简写为SF;中规格实验鱼初始体重为(137.90±0.81)g,简写为 MF;大规格实验鱼初始体重为(194.10±2.37)g,简写为LF。
1.2 实验饲料
以鱼粉、酪蛋白和明胶为蛋白源,鱼油、卵磷脂为脂肪源,糊精为糖源,配制7种不同蛋白质梯度的等脂(粗脂肪:11.8%)、等能(可利用能:16.7kJ/g)实验饲料。饲料中蛋白质含量的实测值分别为:30.4%,34.2%,38.5%,42.2%,46.0%,50.3%和54.3%(见表1)。其中,蛋白质含量为30.4%~50.3%的6组饲料用于LF大黄鱼,蛋白质含量为34.2%~54.3%的6组饲料用于SF和MF大黄鱼。饲料制作前,所有原料经粉碎后过80目筛网,各原料混合均匀后加入鱼油和卵磷脂手工搓匀,随后加适量的水揉匀,经F(II)-26型双螺杆挤条机(华南理工大学,广州)加工制成颗粒饲料,然后置于50℃鼓风烘箱烘干至水分含量10%以下,并用塑料袋包装后保存于-20℃冰箱中备用。SF实验鱼用饲料直径为4mm,MF实验鱼用饲料直径为8mm,LF实验鱼饲料直径为10mm。
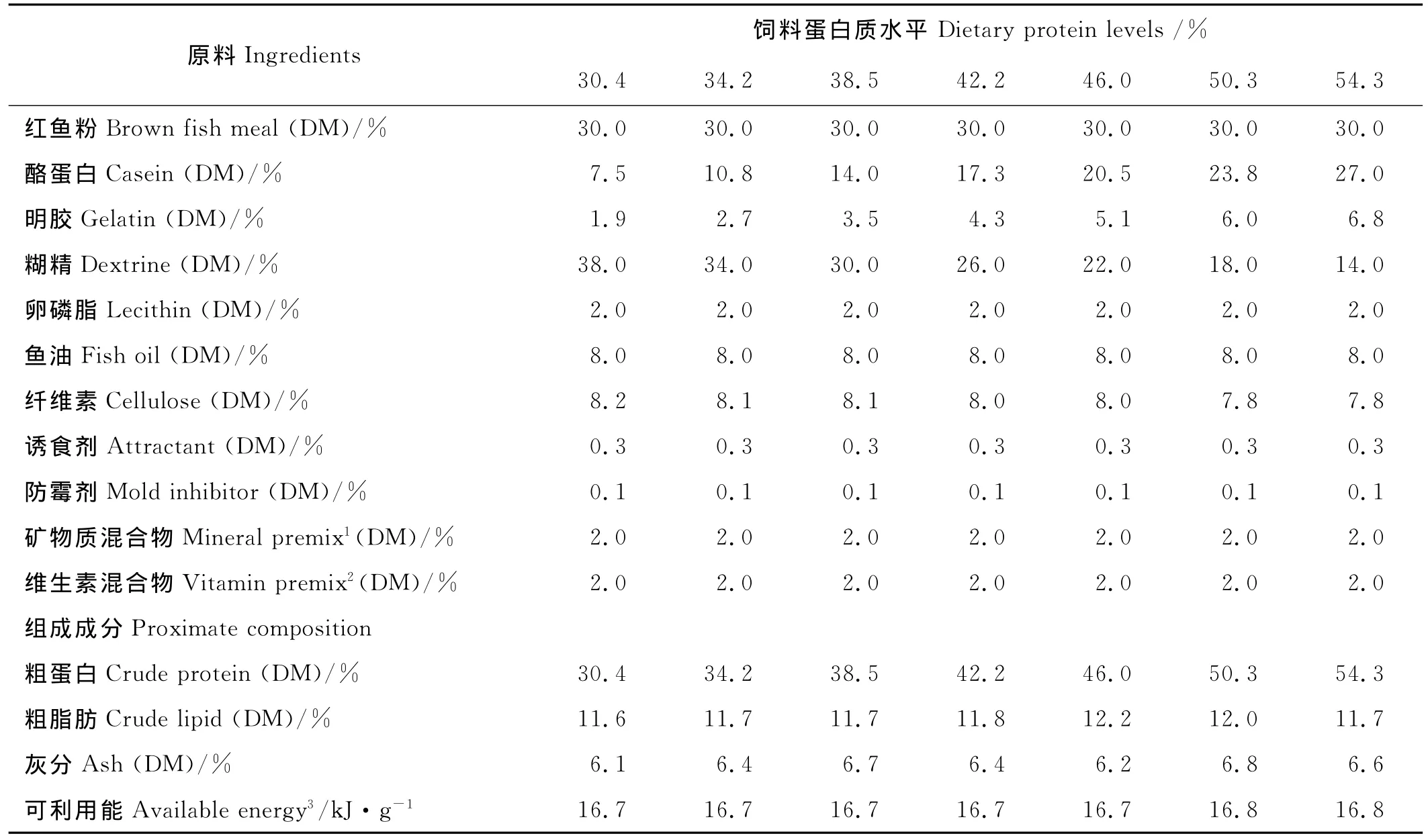
表1 实验饲料配方和化学成分(干重)Table 1 Formulation and proximate composition of the experimental diets(dry matter)
1.3 养殖管理与样品采集分析
养殖实验在浙江省象山县外高泥村西沪港海湾的近海浮式网箱中进行。正式实验前,3种规格的大黄鱼分别放于网箱(3.0m×6.0m×3.0m)中进行暂养,并以商业饲料(青岛七好生物科技有限公司,粗蛋白40%)饱食投喂2周,使之逐渐适应人工配合饲料和养殖环境。
2周的暂养期结束以后,3种规格大黄鱼采用相同方式进行分组。分别从暂养网箱中挑选出规格一致、体格健壮的大黄鱼随机分配到18个小网箱(1.5m×1.5m×2.0m)中,SF每网箱放养60尾,MF和LF每网箱放养45尾。SF和MF投喂实验饲料8周,LF投喂实验饲料9周。每个规格大黄鱼养殖实验均有6个处理,每个处理3个重复,每个重复1个网箱。采用饱食投喂,每天2次(05:00和17:30)。养殖期间,水温27~30℃,盐度25~28,溶解氧在7mg·L-1左右。
养殖实验开始前对实验鱼进行饥饿处理24h后,分别随机抽取10尾SF、MF和LF,置于-20℃冰箱中备用。养殖实验结束后,实验鱼进行24h饥饿处理,每个网箱随机取11尾大黄鱼,其中5尾置于-20℃冰箱中备用,另外6尾用无菌注射器自尾静脉取血,在4℃、3 500r/min的条件下离心10min,取上清,于-80℃冰箱保存。实验鱼取血后,立即进行解剖,取肝脏迅速放入液氮中保存。
饲料原料、饲料成分和鱼体蛋白质含量测定参照AOAC的方法[12]。肝脏谷草转氨酶(AST)和谷丙转氨酶(ALT)活性以及血清中血氨、尿素氮和总氨基酸含量采用南京建成生物工程研究所相应试剂盒测定。
1.4 计算和统计分析
氮保留率(NR,g·kg-1·d-1)=(Nt-N0)/((Wt+W0)/2×t)。
其中:Nt和N0分别为大黄鱼体终末氮含量(g)和初始氮含量(g);Wt和W0分别为大黄鱼终末体重(g)和初始体重(g);t为实验天数(d)。
实验数据(平均值±标准误)用SPSS 17.0统计软件进行单因素方差分析(ANOVA),当差异显著时(P<0.05),进行Tukey多重比较。
2 结果
2.1 饲料蛋白质水平对大黄鱼体蛋白质含量和氮保留率的影响
本实验条件下,大黄鱼存活率均在85%以上,各处理组间没有显著差异(P>0.05)。
SF全鱼体蛋白质含量随着饲料蛋白质水平的上升逐渐上升(P<0.05),当饲料蛋白质水平为54.3%时,鱼体蛋白质含量取得最大值16.56%,显著高于饲料蛋白质含量为34.2%时鱼体蛋白质含量(14.78%,见图1)。饲料蛋白质水平对MF和LF全鱼体蛋白质含量没有显著影响(P>0.05,见图2和3)。
饲料中蛋白质水平的升高显著提高SF的氮保留率(P<0.05),当饲料蛋白质水平为54.3%时,氮保留率取得最大值0.65g·kg-1·d-1,显著高于饲料蛋白质含量为34.2%时的氮保留率(0.48g·kg-1·d-1,见图1)。饲料中蛋白质水平对MF和LF的氮保留率没有显著影响(P>0.05),其中 MF的氮保留率为0.19~0.24g·kg-1·d-1,LF 的氮保留率为0.49~0.55 g·kg-1·d-1(见图2和3)。
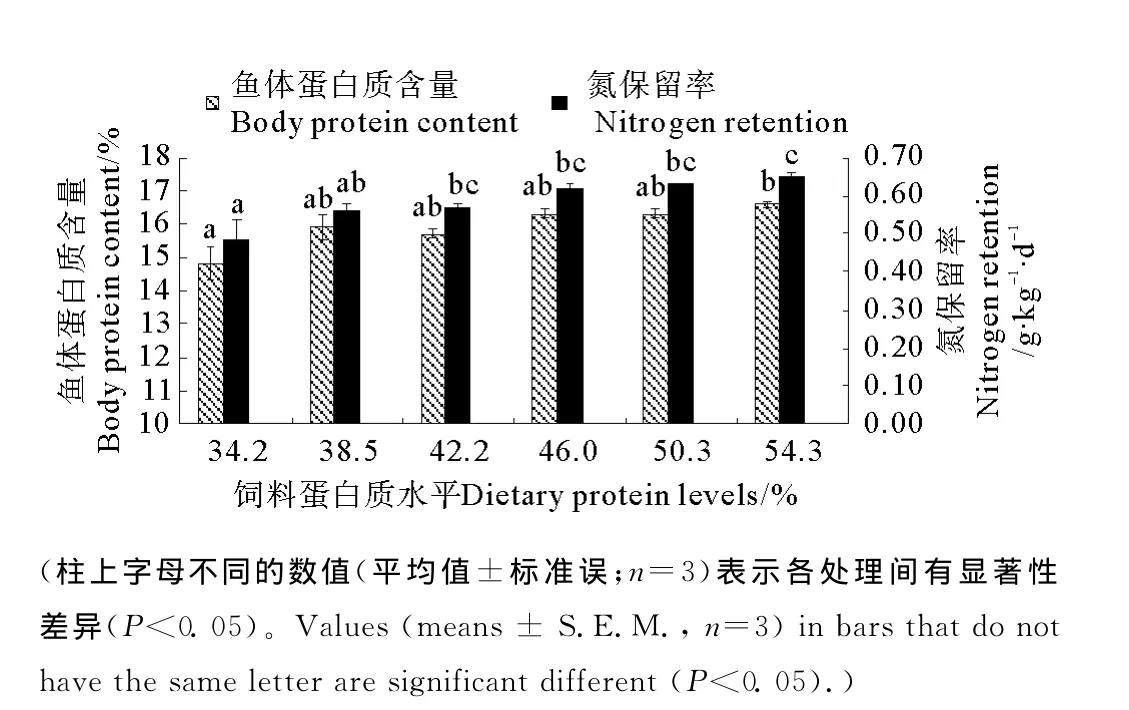
图1 饲料蛋白质水平对大黄鱼小规格鱼(SF)全鱼体蛋白质含量和氮保留率的影响(平均值±标准误,n=3)Fig.1 Effects of dietary protein levels on the whole body protein content and the nitrogen retention of large yellow croaker(SF)(means±S.E.M.,n=3)
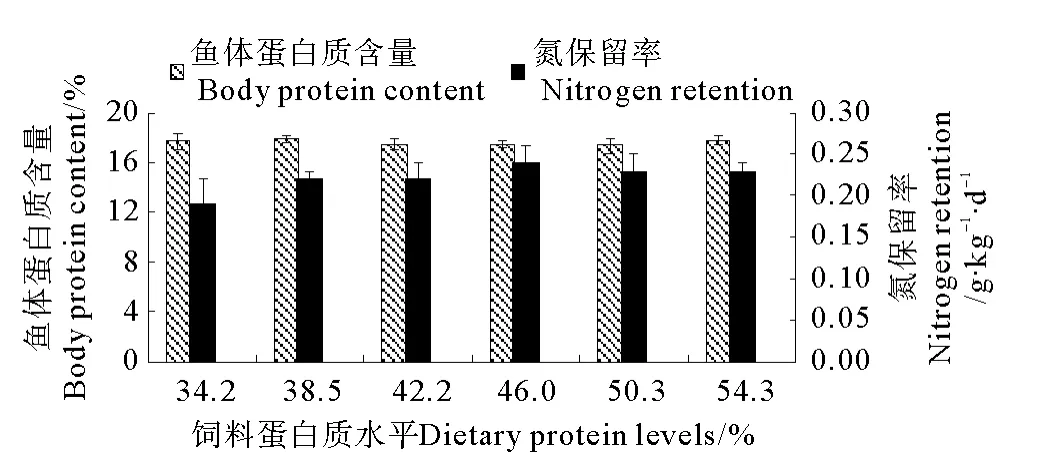
图2 饲料蛋白质水平对大黄鱼中规格鱼(MF)全鱼体蛋白质含量和氮保留率的影响(平均值±标准误,n=3)Fig.2 Effects of dietary protein levels on the whole body protein content and the nitrogen retention of large yellow croaker(MF)(means±S.E.M.,n=3)
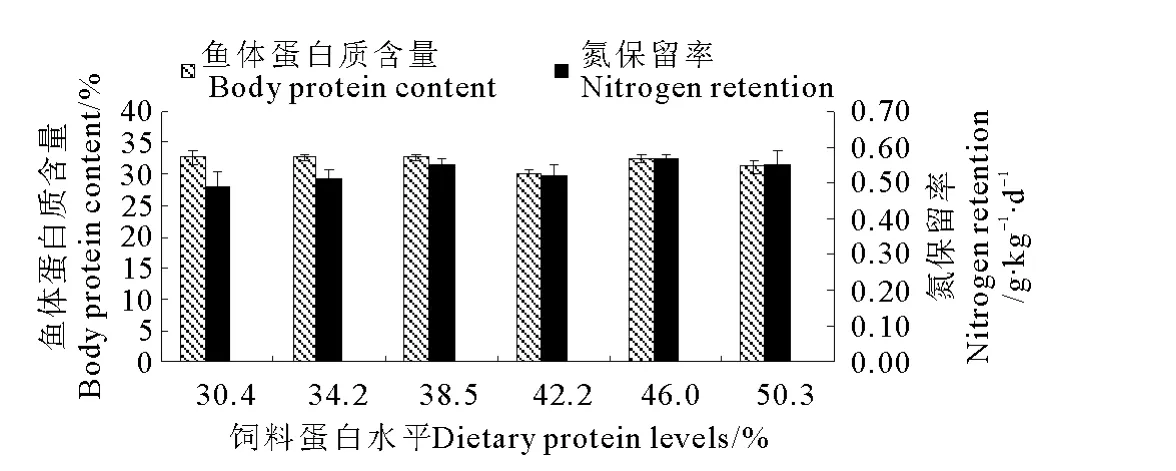
图3 饲料蛋白质水平对大黄鱼大规格鱼(LF)全鱼体蛋白质含量和氮保留率的影响(平均值±标准误,n=3)Fig.3 Effects of dietary protein levels on the whole body protein content and the nitrogen retention of large yellow croaker(LF)(means±S.E.M.,n=3)
大黄鱼氮保留率在3个不同生长阶段存在显著差异(P<0.0 5,见图4)。MF的氮保留率最低(0.2 2 g·kg-1·d-1),显著低于SF和LF。SF和LF之间氮保留率没有显著差异(P>0.05),其中SF的氮保留率为0.59g·kg-1·d-1,LF的氮保留率为0.53g·kg-1·d-1。
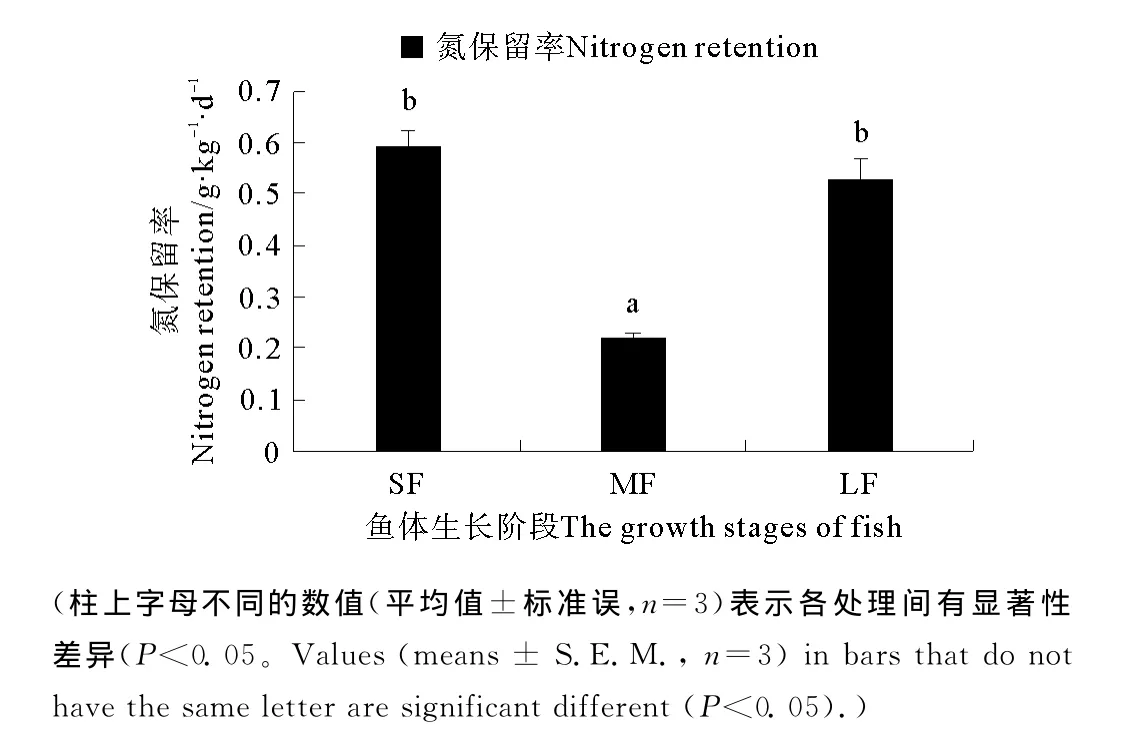
图4 不同生长阶段对大黄鱼氮保留率的影响(平均值±标准误,n=3)Fig.4 Effects of growth stages on the nitrogen retention of large yellow croaker(means±S.E.M.,n=3)
2.2 饲料蛋白质水平对大黄鱼肝脏指标的影响
饲料蛋白质水平对SF、MF和LF肝脏中AST和ALT的活性均有显著性影响(P<0.05)。
随着饲料蛋白质水平的升高,SF的肝脏AST活性显著上升(P<0.05)(见表2)。当饲料蛋白质含量为54.3%时,AST活性取得最大值44.8U/mg prot.,显著 高 于 34.2%、38.5%、42.2% 和 46.0% 处 理 组(P<0.05),但与50.3%处理组之间没有显著差异。随着饲料蛋白质水平的升高,SF的肝脏ALT活性显著上升(P<0.05)(见表2)。当饲料蛋白质含量为54.3%时,ALT活性取得最大值76.1U/mg prot.,显著高于34.2%、38.5%、42.2%和46.0%处理组(P<0.05),但与50.3%处理组之间没有显著差异。
MF的肝脏AST活性随着饲料蛋白质水平的升高显著上升(P<0.05)(见表3)。当饲料蛋白质含量为54.3%时,AST活性取得最大值91.9U/mg prot.,显著高于34.2%、38.5%和42.2%处理组(P<0.05),但与46.0%和50.3%处理组之间没有显著差异。随着饲料蛋白质水平的升高,MF的肝脏ALT活性显著上升(P<0.05)(见表3)。当饲料蛋白质含量为54.3%时,ALT活性取得最大值 55.9U/mg prot.,显著高于34.2%、38.5%、42.2%和46.0%处理组(P<0.05),但与50.3%处理组之间没有显著差异。
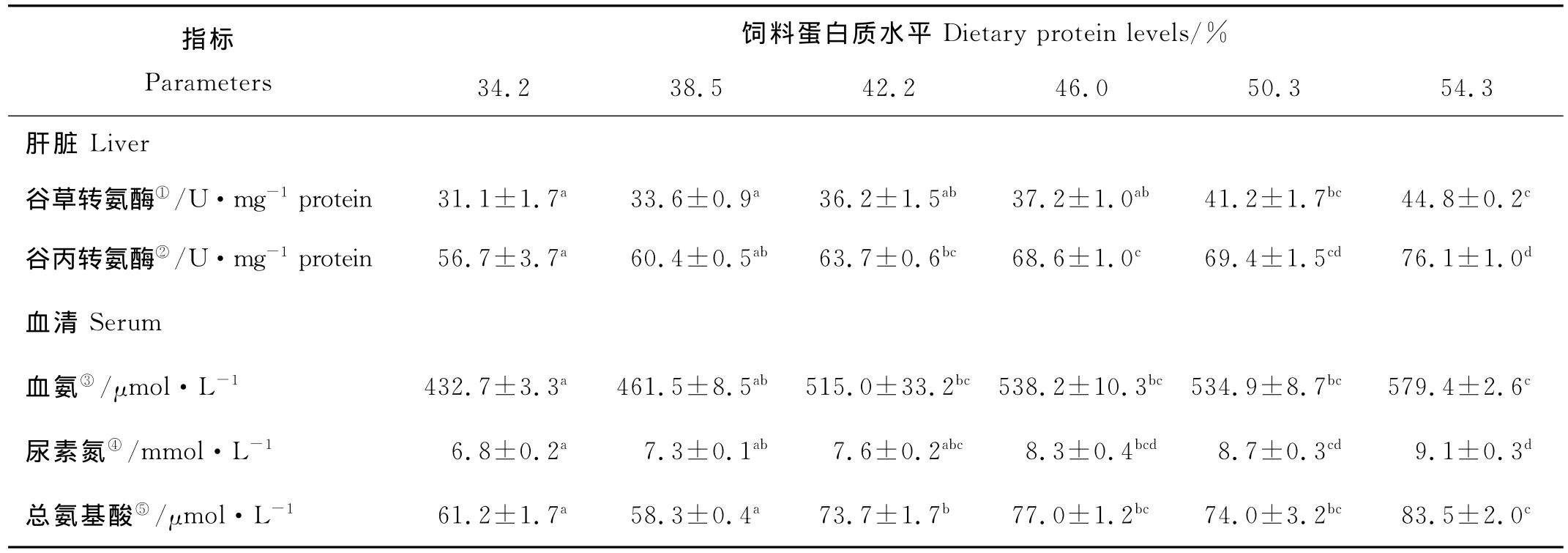
表2 饲料蛋白质水平对大黄鱼小规格鱼代谢反应的影响(平均值±标准误,n=3)1Table 2 Effects of dietary protein levels on protein metabolic responses in serum and in liver of large yellow croaker(SF)(means± S.E.M.,n=3)1
随着饲料蛋白质水平的升高,LF的肝脏AST活性显著上升(P<0.05)(见表4)。当饲料蛋白质含量为50.3%时,AST活性取得最大值24.0U/mg prot.,显著高于30.4%,34.2%、38.5%处理组(P<0.05),但与42.2%和46.0%处理组之间没有显著差异。随着饲料蛋白质水平的升高,LF的肝脏ALT活性显著上升(P<0.05)(见表4)。当饲料蛋白质含量为50.3%时,ALT活性取得最大值63.1U/mg prot.,显著高于30.4%,34.2%、38.5%、42.2%和46.0%处理组(P<0.05)。
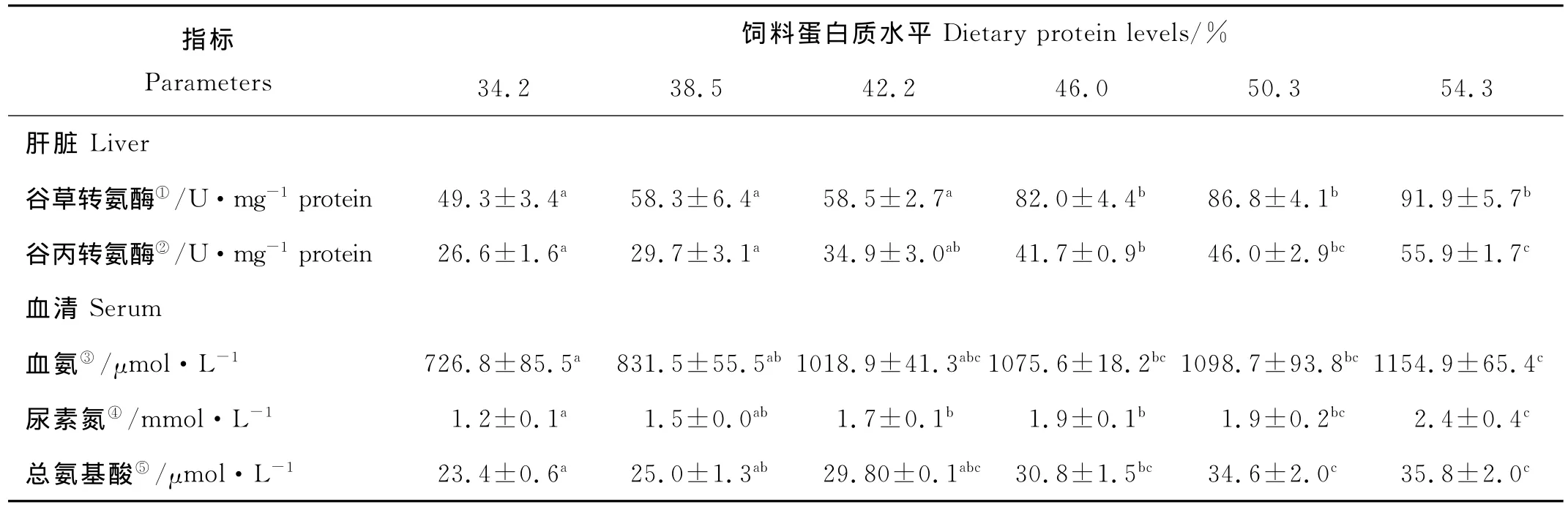
表3 饲料蛋白质水平对大黄鱼中规格鱼代谢反应的影响(平均值±标准误,n=3)1Table 3 Effects of dietary protein levels on protein metabolic responses in serum and in liver of large yellow croaker(MF)(means±S.E.M.,n=3)1
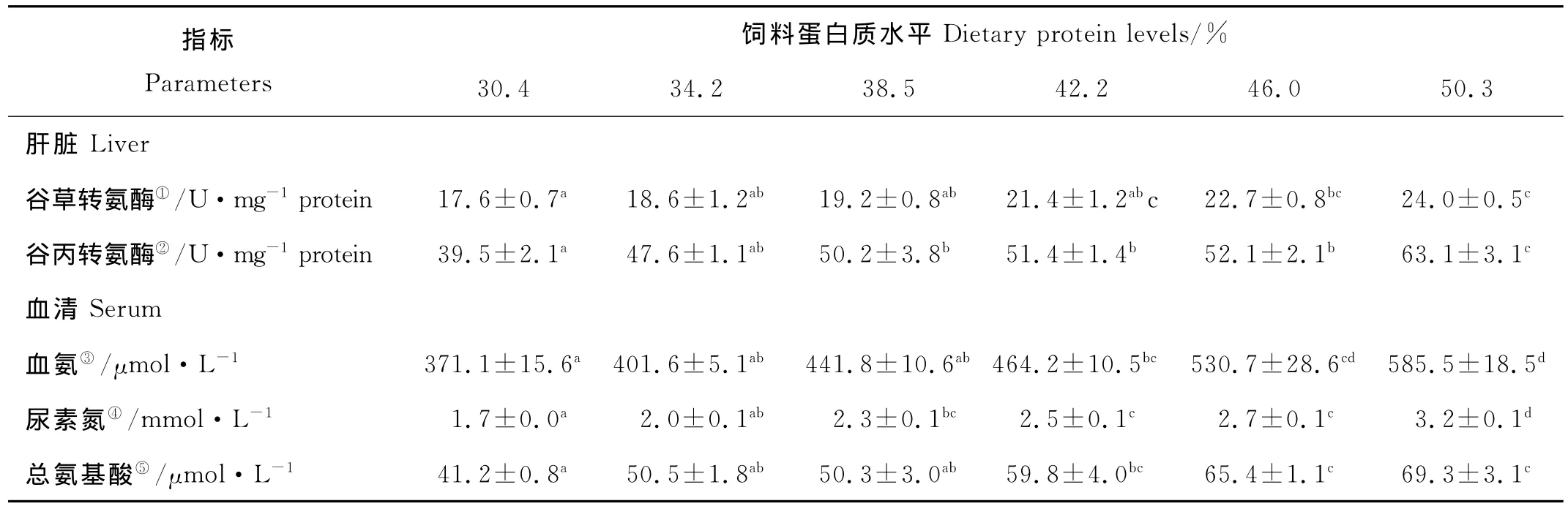
表4 饲料蛋白质水平对大黄鱼大规格鱼代谢反应的影响(平均值±标准误,n=3)1Table 4 Effects of dietary protein levels on protein metabolic responses in serum and liver of large yellow croaker(LF)(means±S.E.M.,n=3)1
2.3 饲料蛋白质水平对大黄鱼血清指标的影响
饲料蛋白质水平对SF、MF和LF血清中血氨、尿素氮和总氨基酸含量均有显著影响(P<0.05)。
SF血清中血氨、尿素氮和总氨基酸含量均随着饲料蛋白质水平的升高而显著升高(P<0.05)(见表2)。其中,血氨含量为432.7~579.4μmol/L,尿素氮含量为6.8~9.1mmol/L,总氨基酸含量为61.2~83.5 μmol/L。
MF血清中血氨、尿素氮和总氨基酸均随着饲料蛋白质水平的升高而显著升高(P<0.05)(见表3)。其中,血氨含量为726.8~1154.9μmol/L,尿素氮含量为1.2~2.4mmol/L,总氨基酸含量为23.4~35.8 μmol/L。
LF血清中血氨、尿素氮和总氨基酸也随着饲料蛋白质水平的升高而显著升高(P<0.05)(见表4)。其中,血氨含量为371.1~585.5μmol/L,尿素氮含量为1.7~3.2mmol/L,总氨基酸含量为41.2~69.3 μmol/L。
大黄鱼血清中血氨含量在3个不同生长阶段之间存在显著差异(P<0.05)(见图5)。MF阶段血氨含量取得最高值984.4μmol/L,显著高于SF和LF。而SF和LF之间血氨含量没有显著差异。其中,SF血氨含量为511.2μmol/L,LF血氨含量为465.8 μmol/L。
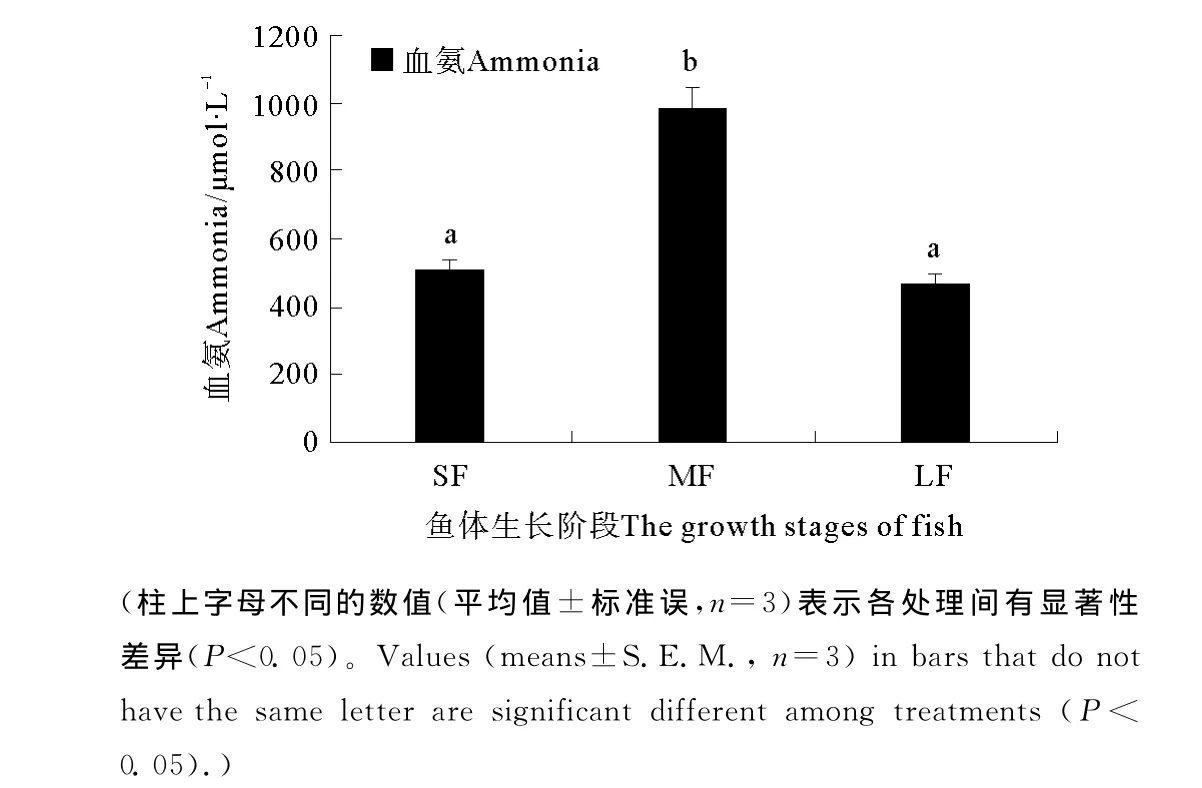
图5 不同生长阶段对大黄鱼血清中血氨含量的影响(平均值±标准误,n=3)Fig.5 Effects of growth stages on the ammonia in serum of large yellow croaker(means±S.E.M.,n=3)
3 讨论
3.1 饲料蛋白质水平对3个生长阶段大黄鱼蛋白质沉积的影响
饲料蛋白质水平对鱼体蛋白质含量的影响在不同的研究中结果不尽一致。对东海银鲳的研究表明鱼体蛋白质含量随着饲料蛋白质水平的上升而逐渐增加[6]。但也有研究发现鱼体蛋白质含量没有显著受到饲料蛋白质水平的影响,如美洲黑石斑[8]。本研究中,SF鱼体蛋白质含量随着饲料蛋白质水平的上升而逐渐上升,54.3%处理组的鱼体蛋白质含量显著高于34.2%处理组(见图1)。而MF和LF的鱼体蛋白质含量没有受到饲料蛋白质水平的显著影响(见图2和3)。Einen和Roem[13]在对大西洋鲑(Salmosalar)的研究中也得到类似的结果,即初始体重为1.6kg的大西洋鲑体蛋白质含量随着饲料蛋白质水平的上升而上升,但初始体重为2.48kg的大西洋鲑体蛋白质含量在不同饲料蛋白质水平之间没有显著差异。由此可见,同种鱼类由于生长阶段的不同,会导致鱼体蛋白质含量随着饲料蛋白质水平的变化趋势有所差异。因此,关于饲料蛋白质水平影响鱼体蛋白质含量在不同研究之间所得的不同结果,究其原因除了与种类差异有关外,不同的生长阶段也是一个重要的影响因素。
本研究中SF的氮保留率随着饲料蛋白质水平的升高而显著升高,MF和LF的氮保留率却没有受到饲料蛋白质水平的显著影响。但MF的氮保留率显著低于SF和LF。本研究所选择的3个规格的大黄鱼,在性成熟方面存在差异。林丹军等[13]的研究表明,大黄鱼的性腺发育分为6个时期。其中,5月龄的大黄鱼,卵巢和精巢都处于第Ⅰ期,性腺呈丝状,外观不易辨认。8月龄开始,雌鱼卵原细胞进入小生长期形成初级卵母细胞,雄鱼精原细胞也迅速增值,都进入大黄鱼性腺发育的第Ⅱ期。1~2.5年龄的大黄鱼,卵巢长期处于第Ⅱ期。1龄雄鱼开始,精巢已有各期精原细胞和少量精子为发育的第Ⅲ、Ⅳ期。3年龄大黄鱼雌鱼性腺发育进入第Ⅲ期,初级卵母细胞进入大生长期,开始积累营养物质[14]。由此可见,8月龄(体重为100g左右)开始是大黄鱼性腺发育的一个重要时期,此过程中性腺的发育需要消耗大量能量物质,尤其是蛋白质和脂肪[15-17]。本研究中 SF(12.8g)、MF(137.9g)和 LF(194.1g)分别是5月龄、9月龄和17月龄大黄鱼。取样发现,SF鱼体内没有明显的性腺组织,MF中性腺组织较少,而LF时期大黄鱼体内性腺组织较发达,这与林丹军等[14]研究中的描述相符。因此可以推断,MF时期饲料蛋白质较大一部分用于性腺的发育,为性腺发育提供能量,鱼体生长发育相对较缓,体内蛋白质沉积相对较少。
3.2 饲料蛋白质水平对3个生长阶段大黄鱼肝脏转氨酶活性的影响
本研究中,大黄鱼3个生长阶段的肝脏AST和ALT活性均随着饲料中蛋白质水平的升高而显著升高。Melo等在克琳雷氏鲶(Rhamdiaquelen)的研究中表明饲料中蛋白质水平越高,鱼体内AST和ALT的活性越强[5],其他一些研究中也得到类似结果[18-19]。饲料中蛋白质进入鱼体后经过消化作用分解为氨基酸,然后转运到各组织中合成新的蛋白质。过量的氨基酸可被分解代谢排出体外,也可以转化为碳水化合物和脂肪储存在体内。AST和ALT是氨基酸代谢关键酶。由此可见,随着饲料蛋白质水平的升高,大黄鱼体内蛋白质代谢活力在增强。
3.3 饲料蛋白质水平对3个生长阶段大黄鱼血清中血氨、尿素氮和总氨基酸含量的影响
食物中的蛋白质经消化分解产生氨基酸通过吸收进入体内氨基酸代谢库,有一部分氨基酸被氧化分解,产生氨和尿素等。其中氨是鱼类氨基酸分解代谢的主要产物。鱼体内肝脏代谢产生的氨,在血液中逐渐累积,最后由鳃排出体外。本研究中,3个生长阶段的大黄鱼血清中血氨含量和尿素氮含量均随着饲料蛋白质水平的上升而升高。在克琳雷氏鲶、石首鱼(Bidyanus bidyanus)和欧洲黑鲈(Dicentrarchuslabrax)的研究中也得到相同的结果[5,20-21]。
本研究中,MF阶段大黄鱼血清中血氨含量显著高于SF和LF。这表明在MF阶段,大黄鱼体内氨基酸的分解代谢旺盛,此结果与MF的氮保留率显著低于SF和LF的结果相统一。MF时期,饲料中较大一部分蛋白质为大黄鱼的性腺发育提供能量,鱼体内氨基酸较大部分进入分解代谢,在大黄鱼体内生成新蛋白质沉积下来的比例相对减少。这可能是造成MF的氮保留率显著低于SF和LF,而血清中血氨含量显著高于SF和LF的一个重要原因。
本研究中,SF、MF和LF的血清总氨基酸含量均随着饲料蛋白质水平的升高而显著升高。在克琳雷氏鲶、虹鳟(Salmogairdneri)和欧洲鳗鲡(Anguillaanguilla)的研究中表明饲料蛋白质水平能显著提高血液中游离氨基酸的含量[5,22-23]。血液中游离氨基酸含量是饲料中氨基酸摄入水平与组织氨基酸新陈代谢动态平衡的综合结果,它是氨基酸在组织间转运的主要形式,其含量的变化在一定程度上反映了机体蛋白质代谢和能量代谢水平。血清游离氨基酸受多种因素的调节,其中以饲料成分影响为主,而饲料中蛋白质含量是其主要影响因素[24-25]。本研究中随着饲料蛋白质水平升高,血清总氨基酸含量显著上升,这也从另外一方面说明大黄鱼体内蛋白质代谢强度与饲料蛋白质供给量之间有着密切的关系。
本研究表明,大黄鱼体蛋白质的沉积不仅受到饲料蛋白质水平的影响,同时还与大黄鱼的生长阶段密切相关;饲料中蛋白质水平的升高,增强了3个生长阶段大黄鱼体内的蛋白质代谢。
[1]Houlihan D F,Mathers E,Foster A R.Biochemical correlates of growth rate in fish[M].//Rankin J C,Jensen F B.Fish Ecophysiology.London:Chapman & Hall,1993:45-72.
[2]National Research Council(NRC).Committee on animal nutrition.Nutrient requirements of fish[M].Washington:National A-cademies Press,2011.
[3]Ballantyne J S.Amino acid metabolism [J].Fish Physiology,2001,20:77-107.
[4]Stone D A J,Allan G L,Anderson A J.Carbohydrate utilization by juvenile silver perch,Bidyanusbidyanus(Mitchell).III.The protein-sparing effect of wheat starch-based carbohydrates [J].Aquaculture Research,2003,34(2):123-134.
[5]Melo J F B,Lundstedt L M,Metón I,et al.Effects of dietary levels of protein on nitrogenous metabolism ofRhamdiaquelen(Teleostei:Pimelodidae)[J].Comp Biochem Physiol,2006,145(2):181-187.
[6]Arshad Hossain M,Almatar S M,James C M.Optimum dietary protein level for juvenile silver pomfret,Pampusargenteus(Euphrasen)[J].Journal of the World Aquaculture Society,2010,41(5):710-720.
[7]Khan S,Ang K J,Ambak M A.The effect of varying dietary protein level on the growth,food conversion,protein utilization and body composition of tropical catfishMystusnemurus(C.& V.)cultured in static pond water system [J].Aquaculture Research,1996,27(11):823-829.
[8]Shah Alam M,Watanabe W O,Carroll P M.Dietary protein requirements of juvenile black sea bass,Centropristisstriata[J].Journal of the World Aquaculture Society,2008,39(5):656-663.
[9]Deng J,Zhang X,Bi B,et al.Dietary protein requirement of juvenile Asian red-tailed catfishHemibagruswyckioides[J].Animal Feed Science and Technology,2011,170:231-238.
[10]Duan Q,Mai K,Zhong H,et al.Studies on the nutrition of the large yellow croaker,Pseudosciaena crocea R.I:growth response to graded levels of dietary protein and lipid[J].Aquaculture Research,2001,32:46-52.
[11]Garling J D L,Wilson R P.Optimum dietary protein to energy ratio for channel catfish fingerlings,Ictaluruspunctatus[J].The Journal of Nutrition,1976,106(9):13-68.
[12]Association of Official Analytical Chemists (AOAC).Official Methods of Analysis of Official Analytical Chemists International[M].16th edn.Arlington,USA:Association of Official Analytical Chemists,1995.
[13]Einen O,Roem A J.Dietary protein/energy ratios for Atlantic salmon in relation to fish size:growth,feed utilization and slaughter quality[J].Aquaculture Nutrition,2003,3(2):115-126.
[14]林丹军,张健,骆嘉,等.人工养殖的大黄鱼性腺发育及性周期研究 [J].福建师范大学学报:自然科学版,1992,8(3):81-87.
[15]Einen O,Roem A J.Dietary protein/energy ratios for Atlantic salmon in spawning performance and amino acid composition of eggs of Nile tilapia,Oreochromisniloticus[J].Aquaculture,1997,146:121-134.
[16]Palitha Kithsiri H M,Prakash Sharma S G,Syeddain Zaidi A K,et al.VenkateshwarluGrowth and reproductive performance of female guppy,poecilia reticulate(peters)fed diets with different nutrient levels[J].Indian Journal of Fisheries,2010,157:65-71.
[17]施瑔芳.鱼类性腺发育研究新进展 [J].水生生物学报,2005,12(3):248-258.
[18]Sánchez-Muros M J,García-Rejón L,García-Salguero L,et al.Long-term nutritional effects on the primary liver and kidney metabolism in rainbow trout.Adaptive response to starvation and a high-protein,carbohydrate-free diet on glutamate dehydrogenase and alanine aminotransferase kinetics [J].Biochem Cell Bio,1998,30(1):55-63.
[19]Sung-Sam,Kim Kyeong-Jun Lee.Dietary protein requirement of juvenile tiger puffer (Takifugurubripes)[J].Aquaculture,2009,287:219-222.
[20]Yang S,Liou C,Liu F.Effects of dietary protein level on growth performance,carcass composition and ammonia excretion in juvenile silver perch(Bidyanusbidyanus)[J].Aquaculture,2002,213:363-372.
[21]Peres H,Oliva-Teles A.Effect of dietary protein lipid level on metabolic utilization of diets by European sea bass(Dicentrarchus labrax)juveniles[J].Fish Physiology and Biochemistry,2001,25:269-275.
[22]Lone K P,Ince B W,Matty A J.Changes in the blood chemistry of rainbow trout,Salmogairdnerifish,in relation to dietary protein level,and an anabolic steroid hormone,ethylestrenol[J].Journal of Fish Biology,1982,20:597-606.
[23]Suárez M D,Hidalgo M C,García Gallego M,et al.Influence of the relative proportions of energy yielding nutrients on liver intermediary metabolism of the European eel[J].Comparative Bio-chemistry and Physiology Part A:Physiology,1995,111(3):421-428.
[24]Grove D J,Loizides L G,Nott J.Satiation amount,frequency of feeding and gastric emptying rate in Salmo gairdner[J].Journal of Fish Biology,1981,12:507-516.
[25]Darcy B.Availability of amino acids in monogastric animals[J].Diabetes Metabolism,1984,10:121-133.
