温度骤变对栉孔扇贝全血细胞和颗粒血细胞数量的影响*
2014-04-17张冬冬战文斌
张冬冬,邢 婧,战文斌
(中国海洋大学教育部海水养殖重点实验室,山东 青岛266003)
血细胞是贝类免疫防御的主要组成部分,不仅参与吞噬、包囊、胞吐及活性氧产生等细胞免疫,还通过分泌和释放各种免疫因子参与体液免疫[1-2],血细胞及其亚群的数量变化是贝类的重要免疫指标之一。贝类血细胞一般分为颗粒血细胞和透明血细胞两大类,前者具有更强的吞噬力及活性氧产生量[3-4],是贝类细胞免疫的主要细胞群。众多研究发现,环境因子如温度[5-8]和干露[9-11],外源刺激[12-15]及饥饿、生殖等[16-19]均会引起贝类血细胞及其亚群数量的变化。
栉孔扇贝(Chlamysfarreri)是我国北方主要的养殖贝类,水温是影响其免疫防御的重要环境因子。有研究发现过高的水温是扇贝大规模死亡发病的主要原因之一[5,20-21],水温的骤然改变会引起贝类血细胞吞噬率、活性氧产量及酶活性等免疫指标的变化[6-8]。此外,干露是贝类运输采取的主要措施之一[22-23],贝类暂时处于缺水低氧状态,血细胞吞噬率、活性氧产量及溶菌酶酶活力均显著降低[9-11],但在不同温度下干露处理后血细胞及其亚群数量变化的报道较少,且对血细胞数量的检测多是应用血球计数法[9]或流式细胞术[6-8,10-11]。本文应用血细胞单克隆抗体,通过测定与血细胞结合的抗原决定簇数量变化的间接ELISA方法,以吸光值的变化间接反映血细胞相关抗原的变化[24-25],尤其是颗粒血细胞单抗的应用能够从抗原抗体角度单独地监测该重要细胞亚群的变化,且结合流式细胞术[26-28]直观地分析其占全血细胞的比例,为栉孔扇贝血细胞及其亚群的免疫防御研究提供数据。
1 材料与方法
1.1 实验动物
栉孔扇贝(Chlamysfarreri,壳长(7.0±0.3)cm)采自青岛八号码头扇贝养殖场,于实验室暂养备用,暂养水温17℃。
1.2 单克隆抗体
抗栉孔扇贝全血细胞单克隆抗体(单抗)1F7[29]、抗栉孔扇贝颗粒血细胞单抗6H7[15]均由本研究室研制,本论文应用二单抗的杂交瘤上清液作为酶联免疫吸附实验(ELISA)的第一抗体。
1.3 水温变化实验
取暂养扇贝280只随机分成4组,每组70只,分别放置于水温为11、17、23、28℃的容器中,17℃组为对照。分别于处理后0、6、12h和1、2、3、4、5、6、7d随机取扇贝6只,抽取血细胞,用于ELISA和流式细胞术测定。
1.4 干露实验
取暂养扇贝250只随机分成5组,每组50只,分别转至5、11、17和23℃湿度100%的密闭无水恒温箱,黑暗中暴露24h,之后转入17℃海水中恢复24h,对照组为17℃海水养殖组。分别于干露后0、2、6、12、24h及海水恢复24h后随机取扇贝6只,抽取血细胞,用于ELISA和流式细胞术测定。
1.5 血细胞样品制备
以装有预冷抗凝剂(PBSE:8g NaCl,0.2g KCl,2.9g Na2HPO4,0.2g KH2PO4,5.58g EDTA,加蒸馏水至1L,pH=7.2)的无菌注射器从取样扇贝闭壳肌血窦中以1∶1比例抽取血淋巴,之后在400×g,4℃下离心10min,以PBS重悬血细胞沉淀,再离心洗涤2次,最后以等量的PBS重悬,即为血细胞悬液。将所得血细胞悬液分成2份:一份将血细胞浓度调节至107cells/mL,为血细胞悬液,用于流式细胞术检测;另一份经超声波破碎后,为血细胞破碎液,用于ELISA。
1.6 酶联免疫吸附实验(ELISA)
将血细胞破碎液包被于96孔酶标板孔内,每孔100μL,4℃过夜,加入300μL含1.0%吐温20的PBS(PBST)洗涤3次,每次5min,以0.5mol/L EDTA室温孵育10min,抑制内源酶活性[30],PBST洗3次,之后加入200μL 5.0%牛血清白蛋白溶液,37℃封闭1h,PBST洗涤,然后分别加入100μL单抗1F7和6H7,37℃孵育1.5h,PBST洗3次。加100μL碱性磷酸酶(AP)标记的羊抗小鼠(Sigma)二抗稀释液,37℃孵育1h,PBST再洗3次。加100μL新配的、pNPP底物显色液,室温反应20min,加50μL 2mol/L NaOH 终止显色反应,于酶标仪405nm波长下读数,记录数据。每组样品重复测定3次。
1.7 流式细胞术
取500μL的血细胞悬液上样流式细胞仪、流式细胞仪正散射光(FSC)和侧散射光(SSC)分别分析血细胞的大小和胞质颗粒度,结果应用 WinMDI 2.9软件分析颗粒血细胞占总全血细胞的比例[26]。本实验重复3次。
1.8 数据分析
用Origin 8.0软件处理数据并作图;其中实验组与对照组间,用one-way ANOVA统计分析差异,P<0.05表示差异显著。
2 结果
2.1 水温骤变全血细胞及颗粒血细胞数量的变化
水温骤变,11℃组栉孔扇贝全血细胞数量显著增加,OD405nm值(全血细胞抗原在405nm处的吸光值)6、12h约为0.52,明显高于对照组(17℃,0.493±0.099,P<0.05),之后恢复到对照水平;23℃组OD405nm值显著增加,6h达峰值(0.545±0.006),显著高于对照组(P<0.05),之后逐渐下降,48hOD405nm值为(0.505±0.006)与对照组无显著差异;28℃组OD405nm逐渐下降,至24h最低(0.405±0.008),显著低于对照组(P<0.05),之后逐渐回升,72h 开始基本稳定于0.442,显著低于对照组(P<0.05)(见图1A)。
水温骤变,11℃组颗粒血细胞数量逐渐增加,12h OD405nm(颗粒血细胞抗原在405nm处的吸光值)值达峰值(0.540±0.010),24h下降至(0.522±0.100),之后OD405nm值变化不大,始终高于17℃水平(0.479±0.030)(P<0.05);23℃组 OD405nm值逐渐下降,24h达最低值 (0.403±0.006),之后逐渐上升,144h 为(0.464±0.030),与对照组无显著差异(P>0.05);28℃组OD405nm值显著降低,24h达最低值(0.364±0.006),之后逐渐上升,96h开始基本维持在0.433,显著低于对照组(P<0.05)(见图1B)。
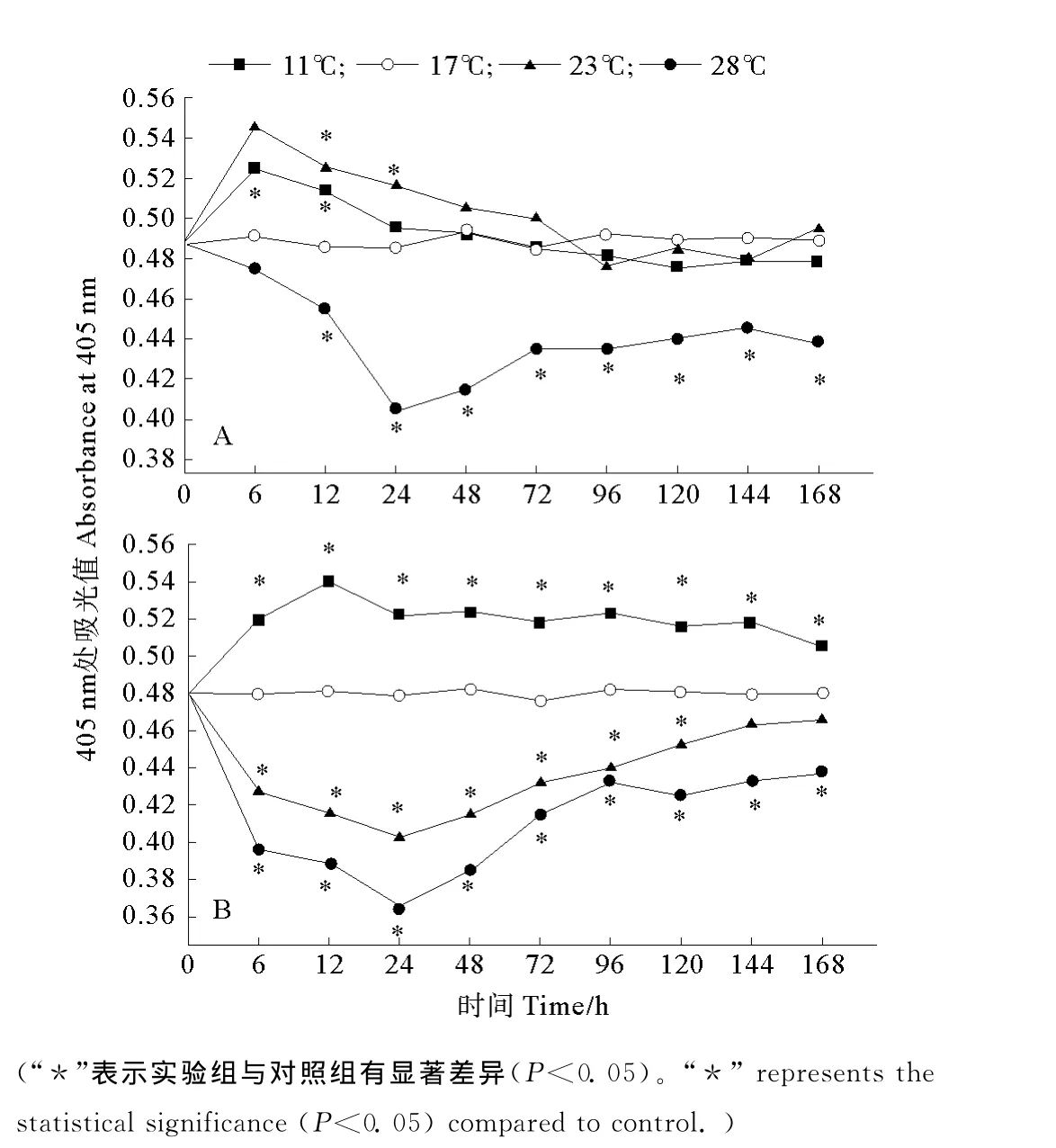
图1 ELISA检测水温骤变后栉孔扇贝全血细胞数量(A)和颗粒血细胞数量(B)的变化Fig.1 Variations of hemocyte count(A)and granulocyte count(B)in C.farreri after acute temperature challenge detected by ELISA.
水温骤变后,栉孔扇贝颗粒血细胞占全血细胞的比例有显著变化(见图2A)。17℃对照组,颗粒血细胞占全血细胞的比例基本稳定在47%,对应的流式散点图为图2a;11℃组颗粒血细胞比例逐渐增加,12h达峰值(65.59%±3.60%,见图2b),之后缓慢下降,基本稳定在60%水平,始终显著高于对照水平(P<0.05);23℃组颗粒血细胞比例缓慢降低,24h下降至最低值(38.25%±1.70%,见图2c),之后逐渐回升,96h开始与对照组无显著差异;28℃组颗粒血细胞比例显著下降,24h达最低值(26.07%±1.20%,见图2d),之后逐渐上升,120h开始稳定在39%水平,显著低于对照组(P<0.05)。
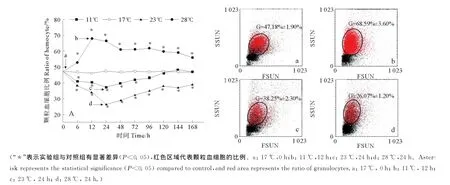
图2 流式细胞术分析水温骤变后栉孔扇贝颗粒血细胞比例变化(A)及对应的部分流式细胞术散点图(a,b,c,d)Fig.2 Variations of granulocyte ratio(A)in C.farreri after acute temperature challenge detected by flow cytometry and part of corresponding scatter diagrams(a,b,c,d)
2.2 不同温度干露全血细胞及颗粒血细胞数量的变化
栉孔扇贝不同温度下干露处理后,5℃组全血细胞数量在2h显著降低,OD405nm值(全血细胞抗原在405nm处的吸光值)约为0.336±0.00,显著低于对照组(0.677±0.023)(P<0.05),6hOD405nm值 最 低(0.278±0.009),12、24h逐渐回升,仍显著低于对照组(P<0.05);11℃组 OD405nm2h 下降至0.341±0.026,6、12和24h增加至0.289±0.029,显著低于对照组(P<0.05);17℃组 OD405nm24h降至最低(0.153±0.013),显著低于对照组(P<0.05);23℃组栉孔扇贝6h后死亡率达100%,2、6hOD405nm值分别为0.330±0.030和0.289±0.007,显著低于对照组(P<0.05);5、11和17℃下干露处理后扇贝放回海水中恢复24h,OD405nm值分别为0.525±0.004、0.481±0.020和0.433±0.009,均低于对照水平(P<0.05)(见图3A)。
栉孔扇贝不同温度下干露处理,5℃组颗粒血细胞数量在2、6h显著降低,OD405nm值(颗粒血细胞抗原在405nm处的吸光值)6h最低(0.290±0.020),12h、24h逐渐增加仍显著低于对照组(P<0.05)(见图3B);11℃组 OD405nm值2、6h降至0.346±0.041,12、24h OD405nm值分别为0.330±0.019和0.289±0.029,显著低于对照组(P<0.05);17℃组 OD405nm值24h降至最低约为0.1218显著低于对照组(P<0.05);23℃组2、6hOD405nm值分别为0.313±0.037和0.338±0.023,均显著低于对照组(P<0.05);海水中恢复后,5、11和17℃组颗粒血细胞数量 OD405nm值分别为0.369±0.022、0.268±0.012和0.305±0.008,显著低于对照组(P<0.05)(见图3B)。

图3 ELISA检测干露刺激后栉孔扇贝全血细胞数量(A)和颗粒血细胞数量(B)的变化Fig.3 Variations of hemocyte count(A)and granulocyte count(B)in C.farreri after air exposure at different temperatures detected by ELISA
栉孔扇贝对照组颗粒血细胞比例约为48.3%(见图4a),不同温度下干露处理后颗粒血细胞的比例变化显著(见图4A)。5和11℃组颗粒血细胞比例2、6h显著降低,6h比例分别约为31%和29%,12h分别增加至38%和37%,24h达最低值,分别为29.27%±1.80%,31.37%±2.10%(见图4b,c),显著低于对照组(P<0.05);17℃组,颗粒血细胞比例6h显著低于对照组,比例约为39%,24h比例最低(20.17%±1.30%,见图4d);23℃干露2h颗粒血细胞比例显著降低,约为33%,6h回升至45%左右;海水恢复后,5、11和23℃颗粒血细胞比例分别约为42%,28%和32%。
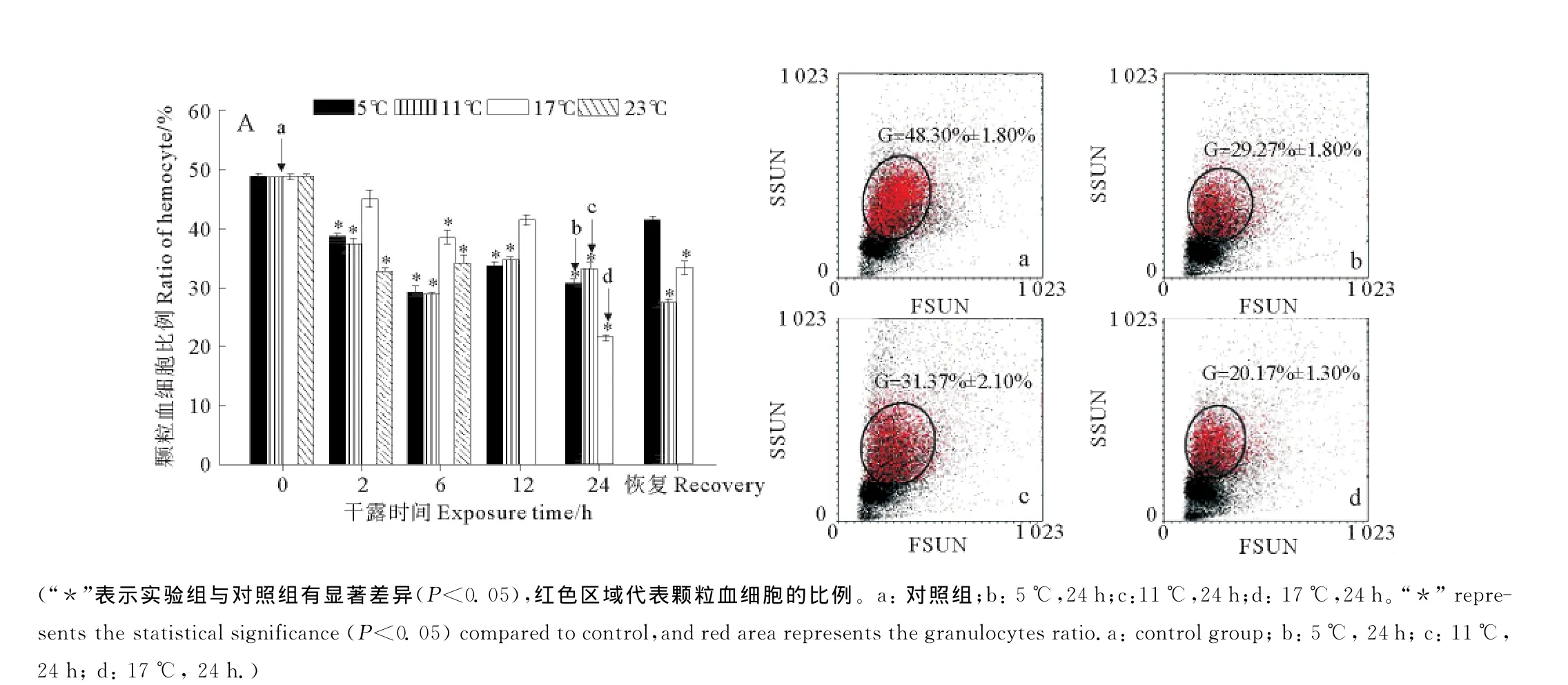
图4 流式细胞术分析不同温度下干露刺激后栉孔扇贝颗粒血细胞比例变化(A)及对应的部分流式细胞术散点图(a,b,c,d)Fig.4 Variations of granulocyte ratio(A)in C.farreri after air exposure at different temperatures detected by flow cytometry and part of corresponding scatter diagrams(a,b,c,d)
3 讨论
本文应用全血细胞和颗粒血细胞单抗,通过测定与全血细胞及颗粒血细胞结合的抗原决定簇数量变化的间接ELISA方法检测全血细胞及颗粒血细胞数量的变化,同时应用流式细胞术[30-32]根据细胞大小及胞质内颗粒度直观的分析颗粒血细胞占全血细胞的比例。结果表明,ELISA与流式细胞术结果显示的颗粒血细胞的数量与比例变化基本一致。
水温突变11、23℃组全血细胞数量均有显著增加,可能是因为水温骤然变化,血细胞大量增殖或血细胞由组织到血淋巴间隙的移动。随着扇贝对温度的适应,血细胞在血淋巴和各个组织的移动达到平衡,逐渐回复到对照水平[5]。适当的提高温度,贝类机体代谢加快,全血细胞数量增加。但是温度过高,28℃下血细胞数量始终低于对照组,持续高温使活性氧累积增多损害机体细胞,导致血细胞死亡率增加[2,5],全血细胞数量减少。
颗粒血细胞数量和比例在水温降低时显著增加并且始终高于对照水平。较低水温下,贝类机体代谢下降,但是血细胞容量并没有降低[31],颗粒血细胞数量增加。温度升高时,颗粒血细胞数量和比例有显著的降低,贝类血细胞中起吞噬作用的主要是颗粒血细胞。随温度升高,血细胞尤其是颗粒血细胞的死亡率会增加,并且伴随脱颗粒现象,颗粒血细胞数量及比例下降。在研究蛤(Chameleagallina)[6]、扇贝(C.farreri)[8]免疫指标对于温度变化的应激中也发现,温度升高有吞噬作用的血细胞比例降低。此外,有研究发现,细胞的分裂及增殖在异常高温下受到抑制,并且颗粒血细胞更易受到温度的诱导[33],28℃水温下贝类机体处于严重胁迫状态,血细胞的增殖减弱甚至停止,血细胞数量、颗粒血细胞数量及比例始终低于对照水平。本研究认为,栉孔扇贝血细胞及颗粒血细胞数量对于水温的变化较敏感,温度升高较多时,血细胞及颗粒血细胞数量明显降低,免疫力较差。
当栉孔扇贝处于干露状态时,温度的影响更加明显,23℃下干露扇贝对于低氧的耐受性较低,干露12h时全部死亡。各温度下干露处理,血细胞数量、颗粒血细胞数量及比例均显著降低,主要是由于栉孔扇贝处于缺水低氧胁迫状态,血细胞尤其是颗粒血细胞死亡率增加,此时贝类血细胞吞噬率下降,免疫力降低[11]。另外有研究者发现太平洋牡蛎(Crassostreagigas)、蛤(C.gallina)干露处理后血细胞总数及吞噬率均降低,而较短时间的干露能够使贻贝(Mytilusgalloprovincialis)血细胞数量及吞噬率有显著的增加[33],可能与物种及实验设置等有关。
17℃下干露12h内,扇贝血细胞及颗粒血细胞数量无显著变化,而温度变化较大的5、11℃干露组细胞数量减少较快,主要是温度变化引起。较长时间干露处理后海水中恢复,5℃组全血细胞及颗粒血细胞数量显著高于11、17℃组,说明较低温度干露对扇贝的损伤较小,血细胞数量恢复好。实验统一设置为17℃海水中恢复24h是根据生产实际而定,干露前后扇贝均处于最适的环境中,然后进行不同温度下的干露,海水中恢复主要是通过其恢复的效果来评估在不同温度下的干露效果。本研究表明,干露后栉孔扇贝血细胞及颗粒血细胞数量显著降低,并且表现出明显的温度相关性,5℃组海水恢复效果较好,干露温度较高达到23℃时,扇贝的死亡率较高。在实际生产当中,要综合考虑干露时间和温度的影响,选择合适干露条件,避免高温干露。
综合分析水温变化及不同温度下干露处理后血细胞数量的变化,表明温度对于扇贝血细胞及其亚群的数量具有重要影响,无论是水体中还是干露状态下,高温均会导致贝类机体的血细胞数量降低,死亡率增加,并且干露状态下贝类机体对于温度的耐受性更低,23℃时短时间内大量死亡。同时该研究表明,血细胞数量是衡量贝类免疫状态的一个重要指标,其对温度的反应较为敏感,扇贝的养殖及运输过程中要注意避免高温。
[1]杜丽,张巍,陆逵,等.动物免疫机制研究进展 [J].动物医学进展,2008,29(3):77-80.
[2]刘世良,麦康森.贝类免疫系统和机理的研究进展 [J].海洋学报,2003,25(2):95-105.
[3]Hine P M.The inter-relationships of bivalve haemocytes[J].Fish Shellfish Immunology,1999,9(5):367-385.
[4]Aladaileh S,Nair S V,Birch D,et al.Sydney rock oyster(Saccostreaglomerata)hemocytes:morphology and function[J].Journal of Invertebrate Pathology,2007,96(1):48-63.
[5]许友卿,吴卫君,蒋伟明,等.温度对贝类免疫系统的影响及其机理研究进展 [J].水产科学,2012,31(3):176-180.
[6]Gagnaire B,Frouin H,Moreau K,et al.Effects of temperature and salinity on haemocyte activities of the pacific oyster,Crassostreagigas(Thunberg)[J].Fish Shellfish Immunology,2006,20(4):536-547.
[7]Monari M,Matozzo V,Foschi J,et al.Effects of high temperatures on functional response of hemocytes in the clamChamelea gallina[J].Fish Shellfish Immunology,2007,22(1/2):98-114.
[8]Chen M Y,Yang H S,Maryse D,et al.Immune condition ofChlamysfarreriin response to acute temperature challenge[J].Aquaculture,2007,271(1-4):479-487.
[9]Boyd J N,Burnett L E.Reactive oxygen intermediate production by oyster hemocytes exposed to hypoxia[J].The Journal of Experimental Biology,1999,202:3135-3143.
[10]Matozzo V,Monari M,Foschi J,et al.Exposure to anoxia of the clamChameleagallina.I:Effects on immune responses [J].Journal of Experimental Marine Biology and Ecology,2005,325(2):163-174.
[11]Chen M Y,Yang H S,Maryse D,et al.Immune responses ofChlamysfarreriafter air exposure to different temperatures[J].Aquaculture,2007,345(1-4):52-60.
[12]Caterina C,Barbara C,Michele B,et al.Functional differential immune responses ofMytilusgalloprovincialisto bacterial challenge[J].Comparative Biochemistry and Physiology,2009,153:365-371.
[13]Chenga W,Hsiaob S,Hsuc S H.The immune response of Taiwan abaloneHaliotisdiversicolorsupertextaand its susceptibility toVibrioparahaemolyticusat different salinity levels[J].Fish Shellfish Immunology,2004,13(3):295-306.
[14]Xing J,Lin T T,Zhan W B.Variations of enzyme activities in the haemocytes of scallopChlamysfarreriafter infection with the acute virus necrobiotic virus(AVNV)[J].Fish Shellfish Immunology,2008,25(6):847-852.
[15]Lin T T,Xing J,Sheng X Z,et al.Development of a monoclonal antibody specific to granulocytes and its application for variation of granulocytes in scallopChlamysfarreri after acute viral necrobiotic virus(AVNV)infection [J].Fish Shellfish Immunology,2011,30(6):1348-1353.
[16]Xu B,Chen M Y,Yang H S,et al.Starvation-induced changes of hemocyte parameters in the zhikong scallopChlamysfarreri[J].Journal of Shellfish Res,2008,27(5):1195-1200.
[17]Matthieu B D,Michel F,Michel A,et al.Seasonal variations of immune parameters in diploid and triploid Pacific oysters,Crassostreagigas(Thunberg)[J].Aquaculture,2007,264(1-4):73-81.
[18]Lemaire N,Pellerin J,Fournier M,et al.Seasonal variations of physiological parameters in the blue musselmytilusspp.from farm sites of eastern Quebec[J].Aquaculture,2006,261(2):729-751.
[19]Yan L,Jian G Q,Xiao X L,et al.Spawning-dependent stress responses in pacific oystersCrassostreagigas:A simulated bacterial challenge in oysters[J].Aquaculture,2009,293:164-171.
[20]Chu F L E.Defence mechanisms in marine bivalves.In:Fingerman M,Nagabhushanam R,editors.Recent Advances in Marine Biotechnology[M]//Immunobiology and Pathology.Plymouth,UK:Science Publishers,2000:1-42.
[21]Jie X,Susan E F,Yang H S,et al.Studies on mass summer mortality of cultured zhikong scallops(ChlamysfarreriJones et Preston)in China[J].Aquaculture,2005,250(3-4):602-615.
[22]Maguire J A,Cashmore D,Burnell G M.The effect of transportation on the juvenile scallopPectenmaximus(L.)[J].Aquaculture research,1999,30(5):325-333.
[23]Bremec C S,Lasta M L,Hernández D.Survival of Patagonian scallop(Zygochlamyspatagonica,King and Broderip,1832)after the size selection process on commercial fishing vessels[J].Fisheries research,2004,66(1):49-52.
[24]方平,李英文.酶联免疫吸附法在水产养殖中的应用[J].水利渔业,2004,24(1):12-14.
[25]林听听,邢婧,蒋经伟,等.栉孔扇贝(Chlamysfarreri)血细胞数量变化与生长的关系 [J].中国海洋大学学报:自然科学版,2011,41(7/8):54-59.
[26]Zhan W B,Wang X J,Chen J,et al.Elimination of shrimp endogenous alkaline phosphatase background and development of enzyme immunoassays for the detection of white spot syndrome virus(WSSV)[J].Aquaculture,2004,239(1-4):15-21.
[27]许秀芹,王宜艳,孙虎山.流式细胞术比较研究4种双壳贝类血细胞的分群 [J].海洋湖沼通报,2006(1):46-50.
[28]Hélène H,Gary H W,Philippe S.Flow-cytometric analysis of haemocytes from eastern oysters,Crassostreavirginica,subjected to a sudden temperature elevation:I.Haemocyte types and morphology[J].Journal of Experimental Marine Biology and E-cology,2009,293(2):237-248.
[29]Xing J,Zhan W B.Characterization of monoclonal antibodies to haemocyte types of scallop(Chlamysfarreri)[J].Fish &Shellfish Immunology,2005,19:17-25.
[30]Hélène H,Gary H W,Philippe S.Flow cytometric analysis of haemocytes from eastern oysters,Crassostreavirginica,subjected to a sudden temperature elevation:II.Haemocyte functions:aggregation,viability,phagocytosis,and respiratory burst[J].Journal of Experimental Journal of Experimental Marine Biology and Ecology,2003,293(2):249-265.
[31]Jonathan F S M,Philippe S,Christophe L,et al.Variability of the hemocyte parameters ofRuditapesphilippinarumin the field during an annual cycle[J].Journal of Experimental Marine Biology and Ecology,2009,377:1-11.
[32]Kiuchi K,Aoki F,Nagata M,et al.Effects of high temperature on the hemocyte cell cycle in silkworm larvae[J].Journal of Insect Physiology,2008,54:454-461.
[33]Malagoli D,Casarini L,Sacchi L,et al.Stress and immune response in the musselMytilusgalloprovincialis[J].Fish &Shellfish Immunology,2007,23(1):171-177.
