结直肠癌患者RASSF1A基因启动子区甲基化及表达缺失的研究
2014-04-14潘宝龙黄尤光林明李树德巫玲高琨
潘宝龙 黄尤光 林明 李树德 巫玲 高琨
结直肠癌患者RASSF1A基因启动子区甲基化及表达缺失的研究
潘宝龙 黄尤光 林明 李树德 巫玲 高琨
目的 检测结直肠癌组织中RASSF1A基因启动子区CpG岛甲基化状况,分析其mRNA表达缺失情况,探讨其与结直肠癌临床病理特征的关系。方法采用甲基化特异性聚合酶链反应检测31份结直肠癌组织、29份正常肠黏膜组织的RASSF1A基因启动子区甲基化程度,统计分析该基因甲基化程度与结直肠癌临床病理特征的关系;以RT-PCR检测各组中RASSF1AmRNA表达情况,统计分析该基因表达水平与结直肠癌临床病理特征的关系。结果结直肠癌组及对照组中RASSF1A基因启动子区CpG岛甲基化发生率分别为67.7%和0.0%,两组间差异有统计学意义(P<0.01);RASSF1A基因启动子区CpG岛甲基化情况与结直肠癌患者的年龄、性别、肿瘤的分化程度、分期及有无淋巴结转移均无关(P均>0.05);RASSF1AmRNA在31份结直肠癌组织中有6份表达缺失(19.35%),25份表达,在29份对照组织中全部表达,两组间表达水平差异有统计学意义(P<0.01);RASSF1AmRNA的表达水平与患者性别、年龄、肿瘤的分化程度、分期及有无淋巴结转移均无关(P均>0.05)。结论结直肠癌组织中RASSFlA基因启动子区CpG岛的高甲基化与结直肠癌发生关系密切,可能是结直肠癌早期发生中的一个重要的分子机制,但与患者的年龄、性别及疾病的进展无关。
RASSF1A基因;甲基化;表达缺失;结直肠癌
肿瘤的形成是一个多阶段多步骤的过程,涉及众多癌基因和抑癌基因的异常表达[1],阐明基因表达调控机制是揭示肿瘤发生机制的关键。甲基化是脊椎动物DNA表观遗传学修饰的唯一天然方式,具有基因表达调控、发育调节、基因印迹和X染色体失活等重要生物学功能。近年来,肿瘤发生发展的表观遗传学机制,特别是DNA甲基化和组蛋白去乙酰化与肿瘤发生发展关系的研究,已经成为肿瘤研究领域的热点。
RASSF1A基因位于染色体3p21.3,是RAS相关区域家族1(RAS-association domain family 1,RASSF1)基因的一个重要转录本[2]。自2000年以来,国内外众多学者对其生物学性状和其在多种肿瘤中的表达情况、失活原因以及其抑癌机制等方面进行了广泛的研究,确认了该基因失活与肿瘤发生发展关系密切。进一步研究证实该基因可通过多种途径抑制细胞生长、促进细胞衰老和凋亡,表明RASSF1A具有抑癌基因的特性。
结直肠癌是最常见的消化道恶性肿瘤之一,在我国男、女性恶性肿瘤发病率排名中分别列第三位、第二位。自2000年以来,结直肠癌的发病率和病死率有不断上升趋势(以结肠癌上升为主)。近年来,结直肠癌的表观遗传学研究[3-5],主要集中于AKAP12、P16、DAPK等基因的研究,而对于RASSF1A基因的研究报道很少。
本文研究旨在以癌旁及正常组织为对照,检测结直肠癌组织中RASSF1A基因启动子区CpG岛甲基化状况,以PCR-DNA测序验证检测的可靠性,分析其启动子区甲基化后mRNA表达缺失情况,探讨其与结直肠癌临床病理特征的关系,为结直肠癌的表观遗传学研究提供理论和事实依据,为早期诊治、复发监测、基因治疗结直肠癌提供一条新的思路。
1 资料与方法
1.1 临床资料结直肠癌标本取自31例结直肠癌患者,为2007-2011年云南省肿瘤医院和玉溪市人民医院外科接受结直肠癌手术患者,所有患者均有明确的术后病理诊断。所有病例术前均未做过放、化疗。其中,男18例,女13例,年龄31~76岁,中位年龄54岁;有淋巴结转移17例,无淋巴结转移14例;低分化腺癌16例,中分化腺癌11例,高分化腺癌4例;早期结直肠癌3例,进展期结直肠癌28例。对照黏膜组织标本29份,其中28份为与结直肠癌标本同期获得的远端(距癌组织5 cm以远)非肿瘤黏膜组织(以下简称远端黏膜);1份为升结肠炎性包块手术标本中的正常结肠黏膜组织(以下简称正常黏膜)。其中男16例,女13例,年龄33~75岁,中位年龄52岁。
1.2 方法
1.2.1 基因组DNA的提取采用酚-氯仿抽提法提取DNA。用日本UV-2450紫外分光光度计检测其含量和纯度,OD260/OD280均在1.6~1.8之间,均值1.74。
1.2.2 基因组DNA的亚硫酸氢盐修饰(甲基化修饰)采用Wiz-ard DNA Clean-up System试剂盒,操作步骤按试剂盒说明书进行。
1.2.3 设计引物根据GenBank序列及相关参考文献[6-8],由上海生工生物工程有限公司合成。
1.2.4 甲基化特异性PCR(methylation specific PCR,MSP)按照Herman等[6]提出的甲基化特异性PCR方法,每份标本都分别用甲基化与非甲基化引物进行扩增。其中,甲基化上游引物5'-GGGTTTTGCGAGAGCGCG-3',下游引物5'-GCTAACAAACGCGAACCG-3',扩增目的片段长度为160 bp;非甲基化上游引物5'-GGTTTTGTGAGAGTGTGTTTAG-3',下游引物5'-CACTAACAAACACAAACCAAAC-3',扩增目的片段长度为171 bp。
1.2.5 结果判定PCR产物经溴化乙啶琼脂糖凝胶电泳分析,在凝胶成像分析仪上观察电泳结果。如甲基化特异性引物扩增出目的条带,而非甲基化特异性引物无条带扩出,视为纯合型甲基化;如两对引物均扩增出目的条带,视为杂合型甲基化;以上两种类型均视为甲基化阳性;如非甲基化特异性引物扩增出目的条带,而甲基化特异性引物无条带扩出,视为非甲基化。
1.2.6 DNA序列测定随机选取2例结直肠癌RASSF1A基因甲基化和非甲基化PCR产物,纯化后进行测序验证(AB 13700测序仪,北京华大基因公司深圳分公司)。
1.2.7 组织总RNA的提取及cDNA合成组织总RNA提取按照TRIZOL试剂盒操作说明书进行(Inv itrogen公司),用日本UV-2450紫外分光光度计检测其含量和纯度,OD260/OD280均在1.7~2.0之间,均值1.82。以提取的总RNA为模板,按照反转录试剂盒说明书进行cDNA合成,所用反转录第一链cDNA合成试剂盒为K 1622(Fearentas公司)。
1.2.8 半定量RT-PCR检测mRNA基因表达使用引物设计软件primer 5设计RASSF1A基因和内对照基因GAPDH的RT-PCR引物序列,由上海生工生物工程技术有限公司合成。其中,RASSF1A mRNA上游引物5'-GTTCTTGGTGGTGGATGACC-3',下游引物5'-CCTT-CAGGACAAAGCTCAGG-3',扩增目的片段长度为342 bp;GAPDH上游引物5'-GAAGGTGAAGGTCGGAGTCA-3',下游引物5'-GAAGATGGTGATGGGATTTC-3',扩增目的片段长度为260 bp。2%琼脂糖凝胶电泳检测,采用图像分析系统进行积分吸光度测定,计算组织中RASSF1A基因mRNA半定量表达值。RASSF1A基因mRNA半定量表达值=RASSF1A积分光吸收值/GAPDH积分光吸收值。
1.3 统计学处理采用SPSS 15.0统计软件进行统计学分析,以χ2检验分析组间RASSF1A基因甲基化差别及与各临床病理特征之间的关系;RASSF1A mRNA表达数据使用表示,组间比较进行两独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 甲基化检测结果31例结直肠癌组织中有21例出现甲基化条带,甲基化发生率67.7%(21/31)。29例对照组织中均为非甲基化条带,甲基化发生率0.0%。两组间甲基化发生率比较,差异有统计学意义(χ2=30.223,P<0.01),见图1、2。
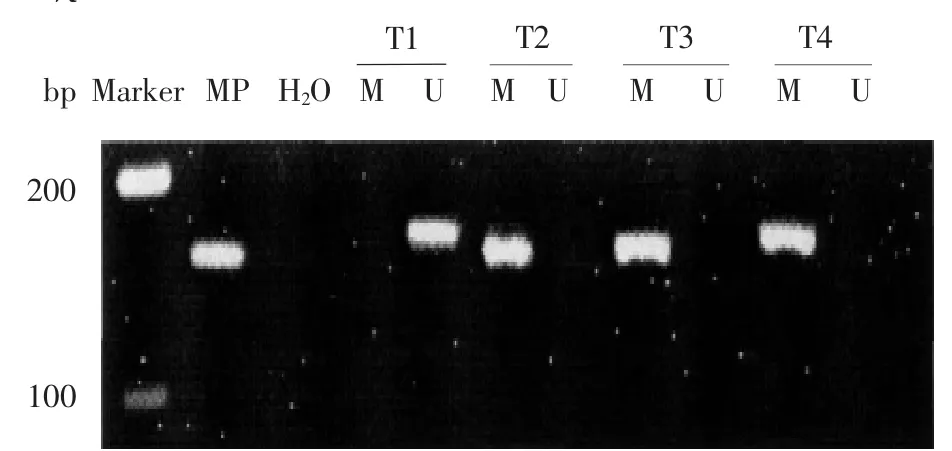
图1 结直肠癌组RASSF1A基因MSP反应产物琼脂糖凝胶电泳图
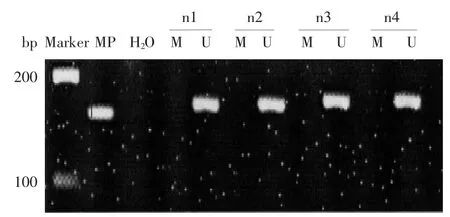
图2 对照组RASSF1A基因MSP反应产物琼脂糖凝胶电泳图
2.2 测序结果在RASSF1A基因甲基化结直肠癌标本中,其基因启动子CpG岛的16个CpG位点均发生了甲基化,即CpG位点的C仍然保持C,而未甲基化结直肠癌标本中,CpG岛的C全部转变为T,见图3。
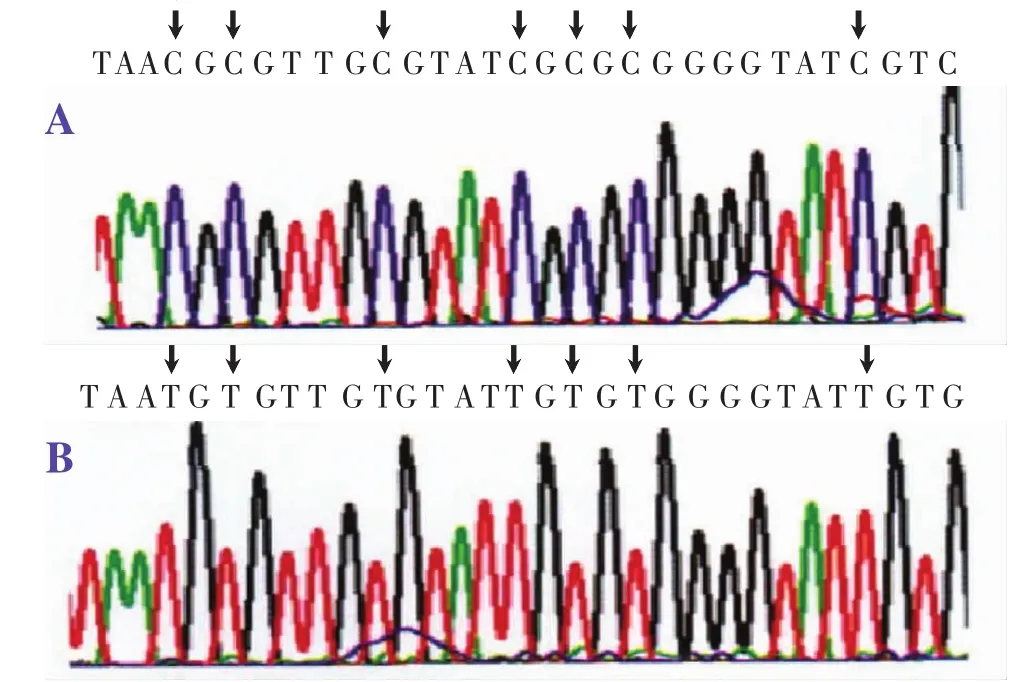
图3 测序图:RASSF1A基因甲基化者CpG岛中的C在未甲基化者均转变为T
2.3 RASSF1A基因启动子区甲基化与结直肠癌临床病理特征的关系由表1可见,结直肠癌组织中,RASSF1A基因启动子区甲基化与患者的性别、年龄、肿瘤分化程度、分期以及有无淋巴结转移均无关(P均>0.05)。
2.4 RASSF1AmRNA在结直肠癌组织及对照组织中的表达RASSF1AmRNA在31例结直肠癌组织中有6例表达缺失(19.35%),25例表达,riOD为0.6971±0.2648,而在29例对照组织中全部表达,ri-OD为1.1417±0.2013,癌组织与对照组织比较,差异有统计学意义(t=6.9986,P<0.01),见图4。
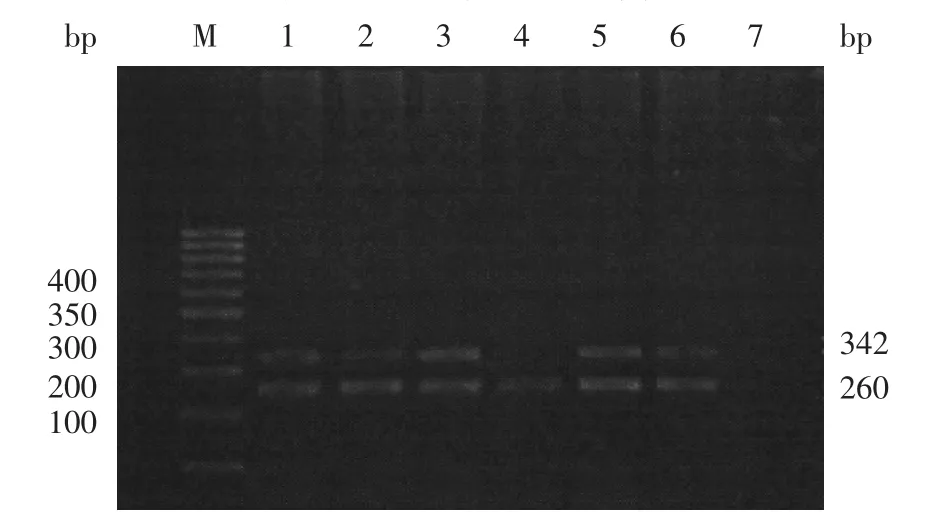
图4 RASSF1AmRNA在结直肠癌组织及对照组织中表达的凝胶电泳图
2.5 结直肠癌组织中RASSF1AmRNA表达水平与肿瘤临床病理特征的关系由表2可见,结直肠癌组织中RASSF1AmRNA表达水平与患者的性别、年龄、分化程度、肿瘤分期以及有无淋巴结转移均无关(P均>0.05)。
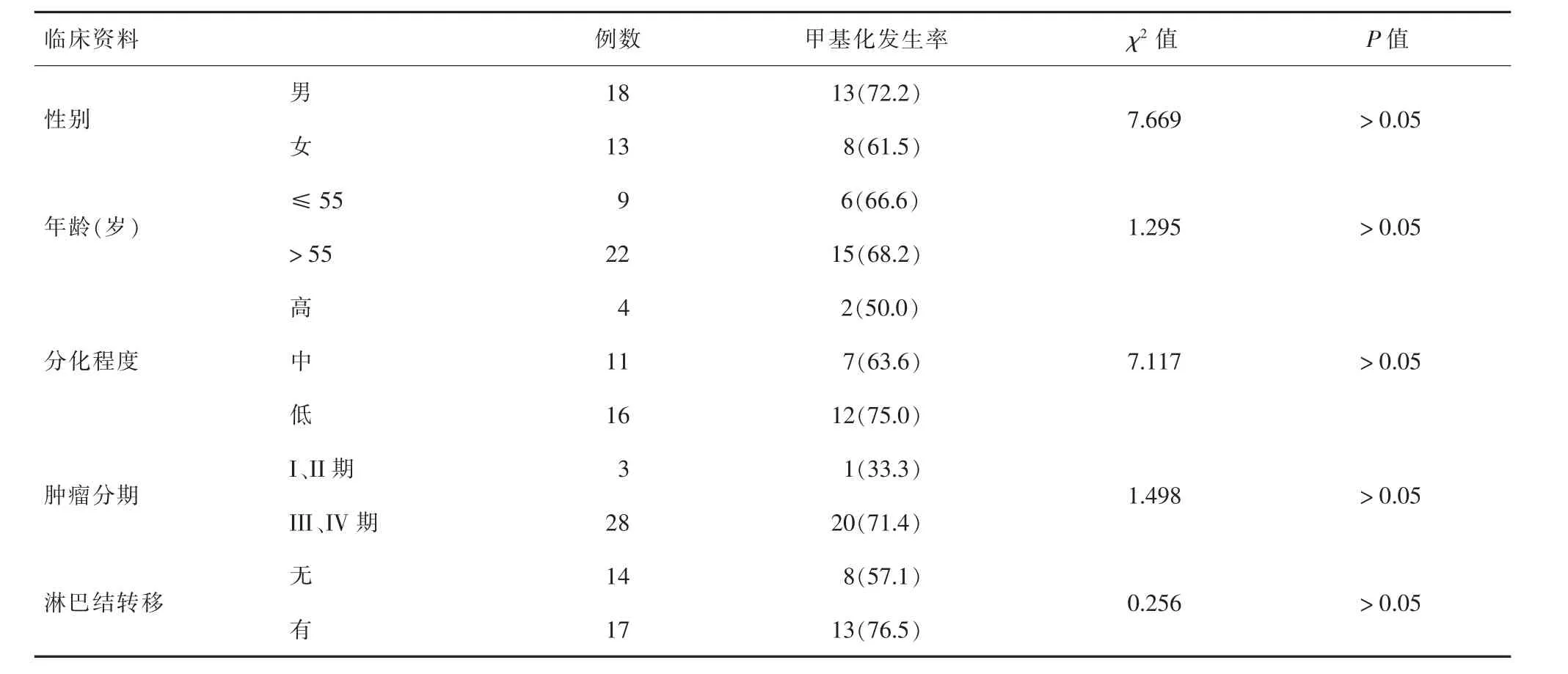
表1 RASSF1A基因启动子区甲基化与结直肠癌临床病理特征的分析[n(%)]
表2 结直肠癌RASSF1AmRNA表达水平与肿瘤临床病理特征的关系
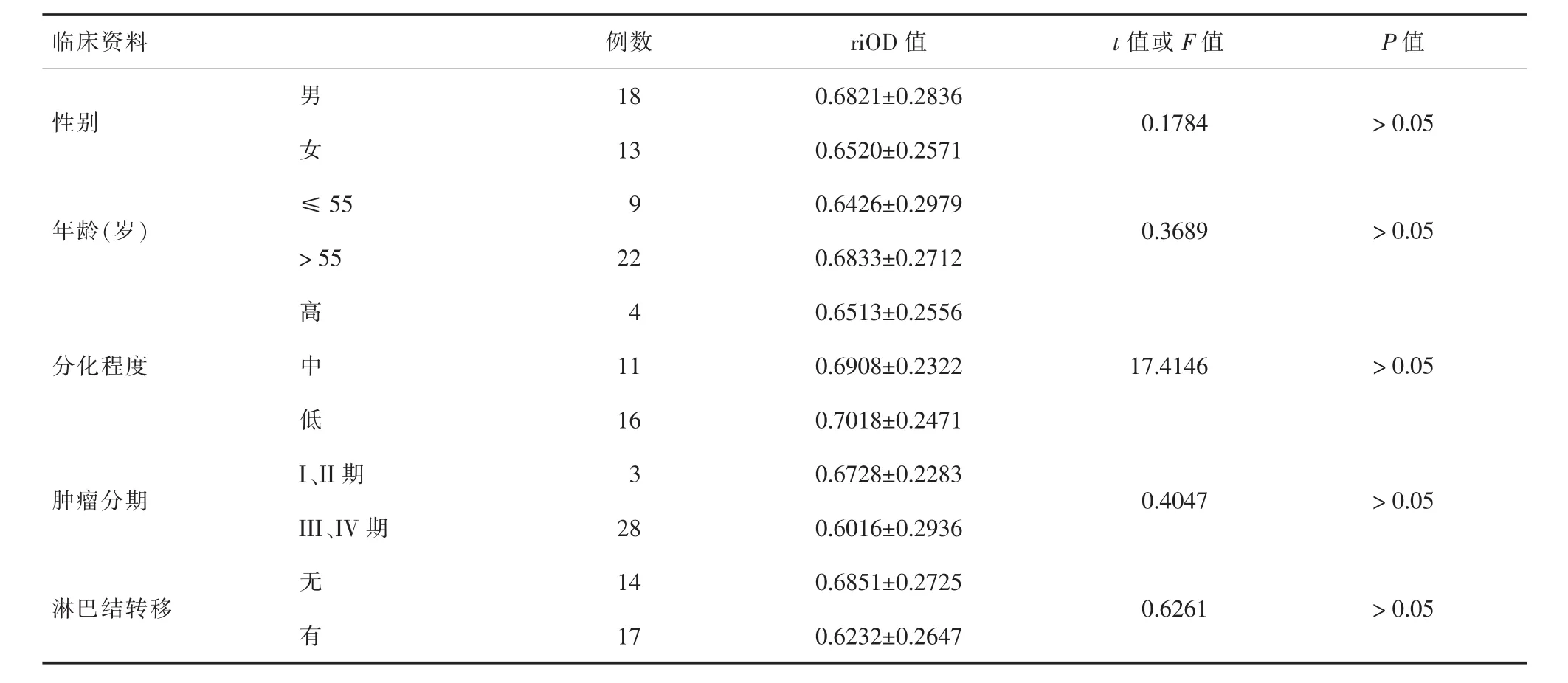
表2 结直肠癌RASSF1AmRNA表达水平与肿瘤临床病理特征的关系
临床资料例数riOD值t值或F值P值男18 0.6821±0.2836性别0.1784>0.05女13 0.6520±0.2571年龄(岁)≤55 9 0.6426±0.2979 0.3689>0.05>55 22 0.6833±0.2712高4 0.6513±0.2556分化程度17.4146>0.05中11 0.6908±0.2322低16 0.7018±0.2471肿瘤分期I、II期3 0.6728±0.2283 0.4047>0.05 III、IV期28 0.6016±0.2936无14 0.6851±0.2725淋巴结转移0.6261>0.05有17 0.6232±0.2647
3 讨论
RASSF1A在正常组织中几乎全部表达,而在多种恶性肿瘤中表达明显降低或缺失。大量研究[7-9]表明,RASSF1A在肿瘤中表达失活主要是由于其启动子区CpG岛的高甲基化所致。DNA甲基化是具有可逆性与遗传性的一种表观遗传学修饰方式。CpG岛即CpG核苷酸集中的区域,其最显著的特征是保持严格的非甲基化,一般位于第一外显子及启动子区,当其发生甲基化,可通过多种机制抑制基因转录造成基因表达缺失。RASSF1A未表达的肿瘤标本中未发现其体细胞突变现象。由此可见,启动子区甲基化也是RASSF1A基因在结直肠癌中失活的重要原因。
本文研究采用MSP技术检测结直肠癌组织中RASSF1A基因启动子区CpG岛甲基化情况,结果显示29例对照组标本均未发生RASSF1A基因启动子区甲基化,该基因启动子区甲基化在结直肠癌组发生率为67.7%,显著高于对照组(P<0.01)。RASSF1A启动子区甲基化在结直肠癌中出现频率之高,提示其在结直肠癌发生发展中起着一定的作用,可能是参与结直肠癌形成的一个重要分子机制。
DNA甲基化的检测有多种方法,MSP是敏感性特异性较好、操作又相对简便的CpG岛甲基化检测方法[10]。根据胞嘧啶经亚硫酸氢盐处理后转变为胸腺嘧啶、而甲基化的胞嘧啶不能转变为胸腺嘧啶的原理,针对目的CpG岛设计甲基化和未甲基化特异性引物,以敏感高效的DNA扩增方法PCR进行目的CpG岛的扩增,然后对PCR产物进行鉴定来确定目的CpG岛是否发生甲基化。该方法经过不断的改进,目前已成为一种快速、敏感、实用的基因甲基化分析方法,其灵敏度高,特异性强,能同时检测多个CpG位点的甲基化情况,是目前国际上比较通用的CpG岛甲基化检测方法。
结直肠癌的发生是个渐进过程,在发展为恶性肿瘤之前,常经历多年持续癌前病变。一些关于RASSF1A基因甲基化在胃良性病变及癌前病变中的研究[11-12]结果发现,RASSF1A甲基化现象在结直肠癌中出现频繁,而在胃腺瘤、肠上皮化生及慢性胃炎等癌前病变中出现很少。从本文研究RASSF1A基因甲基化与临床病理特征相关性分析中发现,RASSF1A基因启动子区甲基化率与患者年龄、性别、肿瘤分化程度、分期及有无淋巴结转移无关,提示RASSF1A甲基化可能只是结直肠癌早期发生发展中的一个重要的分子机制,一旦早期形成后,并不随其他临床病理改变而发生大的变化。
DNA的甲基化可以改变染色质的结构,从而引起不同的DNA结合蛋白的结合。启动子区CpG岛的甲基化可引起甲基化CpG结合蛋白和转录抑制物组蛋白已酞化酶等结合到CpG岛,从而阻断转录因子结合到启动子上,抑制基因的表达。因此,目前认为,启动子区的超甲基化、杂合性丢失及等位基因缺失是RASSF1A失活的主要机制,而突变并不是很常见。
为了探讨RASSF1A基因在结直肠癌组织中的表达情况,本文研究采用RT-PCR法检测了31例结直肠癌组织及29例正常大肠黏膜组织中该基因的表达,结果表明,RASSF1AmRNA在31例结直肠癌组织中有6例表达缺失(缺失率19.35%),25例表达,riOD为0.6971±0.2648,而在29例对照组织中全部表达,riOD为1.1417±0.2013,癌组织与对照组织比较差异有统计学意义(t=6.9986,P<0.01)。这说明RASSF1A表达缺失或下调是结直肠癌发生过程中的一个常见事件,其启动子区甲基化与其表达缺失明显相关,可能是导致其表达缺失或下调的主要原因。然而,在对RASSF1A表达水平与结直肠癌患者临床病理资料的关系研究中发现,其表达水平与患者性别、年龄无关(P均>0.05),同时,在肿瘤分化程度、分期、有无淋巴结转移各组间差异也无统计学意义(P均>0.05),说明RASSF1A基因表达缺失可能是结直肠癌早期发展中的一个分子事件,而与患者性别年龄及疾病后期进展没有关系。
综上所述,RASSF1A基因启动子区高甲基化及表达缺失与结直肠癌的发生密切相关,可能是结直肠癌早期发展中的一个重要因素,但与患者性别年龄及一些临床病理特征无明显关系。随着对RASSF1A基因研究的深入,必将在肿瘤的发生机制、分子水平监测以及基因治疗恶性肿瘤方面提供新的参考依据。
1 Jablonka E,Lamb MJ.The changing concept of epigenetics.Ann NY Acad Sci,2002,981:82-96.
2 Wolffe AP,Matzke MA.Epigenetics:regulation through repression. Science,1999,286:481-486.
3 孙树汉.肿瘤的表观遗传学研究.中国肿瘤生物治疗杂志,2008,15:8-12.
4 刘维薇.结直肠癌中AKAP12基因甲基化及其肿瘤抑制作用.复旦大学博士学位论文,2009,10.
5 陈龙,李贞茂,陈和平,等.p16、hMLHl基因甲基化与结肠癌的相关性研究.胃肠病学和肝病学杂志,2011,20:216-218.
6 Herman,Lee MG,Chae KS,et al.Frequent epigenetic inactivation of RASSF1A by aberrant promoter hypermethylation in human gastric adenocarcinoma.CancerRes,2003,8:1016-1018.
7 Yan PS,Shi H,Rahmatpanah F,et al.Differential distribution of DNA methylation within the RASSF1A CpG island in breast cancer. Cancer Res,2003,63:6178-6186.
8 Wong ML,Tao Q,Fu L,et al.Aberrant promoter hypermethylation and silencingof the critical3p21 tumour suppressor gene,RASSF1A,in Chinese oesophageal squamous cell carcinoma.Int J Oncol,2006,28:767-773.
9 Dammann R,LiC,Yoon JH,etal.Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus3p21.3.NatGenet,2000,25:315-319.
10 Dammann R,YangG,PfeiferGP.Hypermethylation of the cpG island of Ras association domain family 1A(RASSF1A),a putative tumor suppressor gene from the3p21.3 locus,occurs in a large percentage of human breastcancers.CancerRes,2001,61:3105-3109.
11 Yamaguchi S,Kato H,Miyazaki T,et al.RASSF1A gene promotermethylation in esophageal cancer specimens.Dis Esophagus,2005,18:253-256.
12 Murray PG,Qiu GH,Fu L,etal.Frequentepigenetic inactivation of the RASSF1A tumor suppressor gene in Hodgkin's lymphoma.Oncogene,2004,23:1326-1331.
Research on promoter methylation and expression deletion of RASSF1A in patients with colorectal cancer
PAN Bao-long1,HUANG You-guang2,LIN Ming1,etal.1DepartmentofClinical Laboratory,People's Hospitalof YuxiCity,Yuxi653100,China2DepartmentofOncology Institute,Tumour Hospitalof Yunnan,Kunming650031,China
ObjectiveTo detect the RASSF1A gene CpG islandmethylation status in colorectal cancer,analyze themRNA expression,and to investigate its relationship with clinicopathological features of colorectal cancer.MethodsRASSF1A gene promoter areamethylation statuswere detected by usingmethylation-specific polymerase chain reaction in 31 casesof colorectal cancermucosa tissue,29 casesofnormalmucosa tissue.The relationship between methylation and clinicopathological features was analyzed statistically. RASSF1AmRNA expression in each group were detected by RT-PCR,The correlation between gene expression levelwith clinicopathological characteristics of colorectal cancerwas analyzed statistically.ResultsThe positive rate ofRASSF1A gene CpG islandmethylation was67.7%in colorectal cancer group and 0.0%in corresponding controlgroup,and the difference had statistical significance(P<0.01).Therewere no correlation between RASSF1Amethylation rate and clinicopathological features including age,sex,degree of tumor differentiation,staging and lymph nodemetastasis(P all>0.05).In 31 cases of colorectal cancer tissues,there were 6 casesofRASSF1AmRNA expression deletion(19.35%),while in 29 casesof control tissue,RASSF1A mRNA were all expressed.There was statistical significance in the difference of expression level between the twogroups(P<0.01).Therewereno correlation between RASSF1AmRNA expression leveland clinicopathological features includingage,sex,degreeof tumor differentiation,staging and lymph nodemetastasis(P all>0.05).ConclusionThe highmethylation rate of RASSF1A in colorectal cancer indicates its closely relationship with colorectal canceroccurrence,itmay be an importantmolecularmechanism in early onsetof colorectalcancer.But there isno correlationwith age,genderand progression ofcolorectalcancer.
RASSF1A gene;Methylation;Expression deletion;Colorectalcancer
10.3969/j.issn.1674-7151.2014.04.003
2014-07-18)
(本文编辑:杨军)
653100 玉溪市,玉溪市人民医院检验科(潘宝龙林明巫玲高琨)
650031 昆明市,云南省肿瘤医院肿瘤研究所(黄尤光)
650500 昆明市,昆明医科大学检验科(李树德)
