伊曲康唑对Lewis肺癌荷瘤裸鼠恶性胸腔积液生成的抑制作用
2014-04-09王允芬姚艳雯刘红兵吕镗烽袁冬梅宋勇
王允芬,姚艳雯,刘红兵,吕镗烽,袁冬梅,宋勇
0 引言
肺癌在发病率和死亡人数方面已跃居全球首位,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)因其极易发生淋巴管新生和区域淋巴结转移,预后较差,5年生存率低于15%[1]。既往多项研究证实,肿瘤的血管生成在肿瘤形成、生长、浸润和转移方面起到促进的作用[2]。相对于血管,肿瘤淋巴管管腔较粗大、迂曲,肿瘤细胞较易沿淋巴管道转移。大量肿瘤细胞聚集在淋巴管内易形成团块阻塞管腔,且淋巴管壁脆性高,因而更容易引起管腔破裂,导致淋巴液的渗漏,最终在肿瘤周围形成淋巴水肿或积液,在胸膜转移瘤附近则形成恶性胸腔积液(malignant pleural effusion,MPE)[3]。
Aftab等[4]的研究表明,抗真菌药物伊曲康唑具有抑制内皮细胞生长作用,通过抑制肿瘤血管内皮细胞生长,进而阻遏肿瘤的发展、浸润、转移。肿瘤的淋巴管新生与血管类似,但迄今未见有关伊曲康唑能否抑制淋巴管新生及淋巴结转移相关方面报道。恶性肿瘤的淋巴管新生和淋巴结转移与VEGF-C的高表达有关。VEGF-C的特异性酪氨酸激酶受体VEGFR-3主要表达于淋巴管上皮细胞内,VEGF-C通过与VEGFR-3的结合,诱导瘤内和瘤旁淋巴管形成及淋巴管转移[5]。在胸膜转移瘤中,肿瘤细胞分泌较多的VEGF-C,致使肿瘤淋巴管生成及区域淋巴结转移增多,且新生的淋巴管官腔较脆,较正常淋巴管更易于破裂,导致淋巴液渗漏形成MPE[6]。本实验拟通过动物模型来测定伊曲康唑对裸鼠胸腔积液量及VEGF-C浓度的影响,进而研究伊曲康唑在体内对荷瘤裸鼠MPE抑制作用,为其临床应用于肿瘤MPE治疗提供理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞及动物GFP-LLC细胞购自美国组织细胞库。BALB/c裸鼠雌雄各15只,4~6周龄,体重19~25 g。所有试验裸鼠由军事医学科学院提供,在SPF级屏障系统中饲养并进行试验,许可证编号:SCXK-(军)2007-004。饲养环境温度19~22℃,湿度50%~60%。
1.1.2 试剂及仪器伊曲康唑溶液(杨森公司,比利时),羟丙基β-环糊精(奥尼多福公司,南京),小鼠VEGF-C ELISA试剂盒(R&D,美国),西门子SENSATION 16获取CT扫描图像,近红外荧光Xenogen IVIS小动物活体成像系统购自美国Caliper公司。
1.2 方法
1.2.1 MPE裸鼠的建立GFP-LLC细胞系培养于10%小牛血清的高糖DMEM完全培养基中(100IU/mL青霉素、100μg/mL链霉素)37℃、5%CO2饱和湿度条件下培养,每隔3天传代1次,取对数生长期细胞用于实验。以PBS洗涤3次,将GFP-LLC细胞悬浮于PBS中,调整细胞浓度为1×106/50 μL。无菌条件下10%水合氯醛腹腔注射麻醉,小鼠仰卧位大字型固定,消毒胸前区皮肤,胸前第6肋间近右侧胸骨处做一约3 mm切口。分开皮肤和皮下筋膜,于体视显微镜下避开血管及其他组织,经肋间隙将肿瘤细胞悬液注入胸膜腔,建立裸鼠移植瘤模型,进行抑制肿瘤生长实验的观察[7]。
1.2.2 伊曲康唑对荷瘤裸鼠肿瘤生长的抑制实验GFP-LLC细胞注射后第4天开始,动物单纯随机抽样法分为3组,每组10只,雌雄各半。按照预实验结果,分别经胸膜腔注射25 mg/kg伊曲康唑溶液(H组)、8 mg/kg伊曲康唑溶液(L组)及50 μL 130 mg/mL羟丙基-β-环糊精溶液(C组)。每3天注射1次,持续4次。
1.2.3 CT扫描及近红外活体荧光成像GFP-LLC细胞接种后第14天,小鼠行胸部CT检查,观察胸腔积液形成情况。CT扫描方法:小鼠麻醉后,胶布固定其呈仰卧位,探测器准直器64×0.6 m,机架旋转时间为0.5 s,螺距为1.4,管电压为120 kVp,参考管电流93 A,将扫描获得的图像实时传输到多功能图像后处理工作站。GFP-LLC细胞接种后第16天麻醉处死全部实验小鼠,抽吸全部胸腔积液后进行近红外荧光成像。将小鼠放置近红外荧光成像仪内,观察脏、壁层胸膜及肺内肿瘤生成情况。
1.2.4 荷瘤小鼠MPE定量及VEGF-C浓度测定GFP-LLC细胞接种后第16天麻醉处死全部裸鼠,用1 mL注射器经横膈下抽取全部胸腔积液,计量各组胸腔积液平均体积。所有小鼠胸腔积液行ELISA法检测VEGF-C浓度,胸腔积液离心后细胞涂片行改良吉姆萨染色,部分肿瘤组织行HE染色,其余肿瘤组织标本经甲醛溶液固定保存。
1.3 统计学分析数据采用SPSS 18.0软件进行统计学分析,以均数±标准差(x±s)表示。组间各参数比较采用单因素方差分析(one-way ANOVA),方差齐时用LSD法进行统计比较,当方差不齐时采用Dunnett T3法进行多重比较。以P≤0.05为差异有统计学意义。
2 结果
2.1 各组小鼠胸腔积液形成情况GFP-LLC细胞接种后第14天,各组小鼠行胸部CT检查C组可见大量胸腔积液,L组也可见明显胸腔积液,H组可见较少量胸腔积液。EGFP-LLC细胞接种后第16天处死小鼠后抽取胸腔积液,所有胸腔积液均为血性,静止后不凝固。H组、L组和C组小鼠平均胸腔积液体积分别为(311.19±27.20)、(445.64±27.75)、(575.76±32.61)μL。实验结果提示,随着药物浓度的增高,伊曲康唑对MPE生成的抑制作用愈加明显,H组小鼠胸腔积液量最少。H组与L组及对照组之间比较,差异均有统计学意义(P<0.01)。见图1、图2,表1。
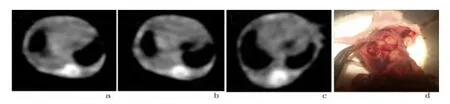
图1 小鼠胸腔积液CT扫描图及解剖实物图Figure 1 Malignant pleural effusion in the mouse models

图2 各组小鼠胸腔积液量比较Figure 2 Comparison of MPE volume among the three groups of mouse models

表1 各组小鼠胸腔积液体积及胸腔积液中VEGF-C浓度Table 1 Volume of MPE and level of VEGF-C in the mouse models
2.2 胸膜上肿瘤形成鉴定近红外荧光成像可见小鼠肿瘤广泛转移,遍及脏、壁层胸膜并累及肺门、纵膈淋巴结,少数肿瘤结节出现破溃和坏死。相对于肉眼大体观察,近红外荧光成像对肿瘤转移灶显像更加清晰,能够更准确的确认肿瘤转移病灶。见图3。
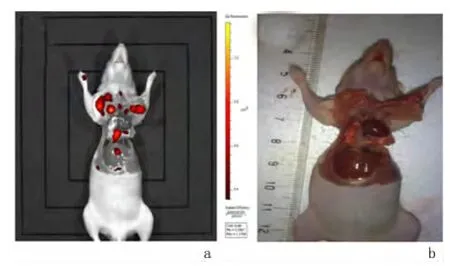
图3 小鼠解剖后胸腔肿瘤结节Figure 3 Tumor foci in the mouse models of MPE
2.3 胸腔积液脱落细胞学检查壁层胸膜上肿瘤组织切片行HE染色,提示胸膜上肿瘤为腺癌。胸腔积液涂片改良型吉姆萨染色,见腺癌细胞,细胞核大,染色深。
2.4 ELISA法检测小鼠胸腔积液VEGF-C浓度取全部小鼠胸腔积液按商品化ELISA试剂盒说明方法检测VEGF-C浓度,H组、L组、C组胸腔积液VEGF-C浓度分别为(336.87±32.12)、(421.64±15.76)、(493.90±40.93)ng/L。随着浓度升高,伊曲康唑对MPE中VEGF-C的抑制作用逐渐加强,各组间VEGF-C浓度比较,差异分别具有统计学意义(P<0.01)。见表1、图4。

图4 小鼠胸腔积液中VEGF-C表达水平Figure 4 Expression of VEGF-C in MPE in the mouse models
3 讨论
MPE是肿瘤累及胸膜或发生胸膜转移所致,是晚期恶性肿瘤常见并发症之一,治疗难度大、预后差[8]。MPE引起的胸痛、咳嗽、严重的呼吸困难及其他相关症状,影响患者的生存质量[9]。目前MPE的发病原因及相关机制尚未完全明确,缺乏有效的治疗手段,临床常以临终关怀或姑息方法治疗,故MPE患者生存时间短、病死率高,其成为了恶性肿瘤治疗的瓶颈之一[10-11]。原发于胸膜或经血管、淋巴管转移的肿瘤细胞进入胸膜腔内,并分泌VEGF等细胞因子,促进新生血管及淋巴管的形成,并增加肿瘤细胞周围组织的通透性,易于胸膜表面肿瘤脉管形成及产生MPE[12]。
淋巴管新生是肿瘤实现转移的重要因素之一。研究发现,恶性肿瘤的淋巴管新生和淋巴结转移与VEGF-C高表达密切相关[13-14]。目前VEGF-C作为强势的促淋巴管生成因子,在肿瘤转移中发挥重要作用。VEGF-C主要通过与特异性酪氨酸激酶受体VEGFR-3结合,使其胞内酪氨酸发生自身磷酸化,促发促分裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)级联反应,诱导淋巴管内皮细胞增生、瘤内和瘤旁淋巴管形成,并促进淋巴管转移[5,14-15]。
伊曲康唑是经美国食品药品监督管理局批准的三唑类抗真菌药物,广泛应用于临床,不良反应较小。研究证明,伊曲康唑在细胞实验和体内试验均表现出较强的抑制血管内皮细胞能力,且其抑制血管增生是通过抑制具有重要血管生成作用的固醇类激素的生物合成[4,16]。如上所述,相对于血管,淋巴管在肿瘤晚期MPE的形成过程中发挥更为重要的作用[17-18]。两者生成机制类似,但迄今没有关于伊曲康唑是否能够抑制淋巴管新生或淋巴结转移方面的研究。因此通过相应的实验验证伊曲康唑抗淋巴生成机制或找到有力的抑制淋巴生成药物在MPE的治疗中显得尤为重要。
根据既往经验,本实验采取胸腔注射的方式来建立胸膜转移瘤及MPE动物模型,这为验证药物对MPE的抑制作用提供了更加直观的观察手段。实验中选择了GFP-LLC肿瘤细胞系来建立模型。GFP转染肿瘤细胞后,将随着肿瘤细胞的分裂、生长而传给下代,也将随着肿瘤细胞的死亡而消亡。本实验用GFP转染的LLC肿瘤细胞建立小鼠胸膜转移瘤模型,增加了实验的准确性及有效性。其次,用近红外荧光显微镜手段辅助证实了荷瘤裸鼠模型的成功建立。在荧光显微镜下,脏、壁层胸膜上的肿瘤结节发出荧光,与病理染色结果具有一致性。这为直接辨认实验小鼠模型的成功建立提供了简便快捷的手段。
实验组分别用高、低浓度伊曲康唑及安慰剂注射荷瘤裸鼠胸腔,胸部CT扫描辅助证实了3组小鼠胸腔积液量的差异。解剖小鼠后经纵膈开窗抽吸胸腔积液进行精确定量,3组小鼠胸腔积液平均值结果也显示高剂量伊曲康唑处理组小鼠胸腔积液量最少,低剂量伊曲康唑组次之,对照组胸腔积液最多。且3组积液量差异分别具有统计学意义,进一步证实伊曲康唑能抑制荷瘤裸鼠MPE的生成。最后,使用ELISA法检测胸腔积液中VEGF-C的表达。与之前结果类似,高剂量伊曲康唑组胸腔积液中VEGF-C浓度最低,对照组浓度最高。各组间差异分别具有统计学意义。
VEGF-C是影响淋巴管生成和淋巴结转移的重要细胞因子。通过之前的实验结果观察有理由推测伊曲康唑可能通过抑制VEGF-C的表达来抑制肿瘤淋巴管生成,最终抑制MPE形成。该实验结果还需要大规模的临床试验以进一步验证。如今,淋巴循环在MPE形成中的作用逐步受到人们的重视,期待伊曲康唑抗淋巴管生成和抑制胸腔积液生成治疗能为肿瘤MPE的治疗现状带来突破。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[2]Hsu IL,Su WC,Yan JJ,et al.Angiogenetic biomarkers in nonsmall cell lung cancer with malignant pleural effusion:correlations with patient survival and pleural effusion control[J].Lung Cancer,2009,65(3):371-376.
[3]Christiansen A,Detmar M.Lymphangiogenesis and cancer[J].Genes Cancer,2011,2(12):1146-1158.
[4]Aftab BT,Dobromilskaya I,Liu JO,et al.Itraconazole inhibits angiogenesis and tumor growth in non-small cell lung cancer[J].Cancer Res,2011,71(21):6764-6772.
[5]Tammela T,Alitalo K.Lymphangiogenesis:Molecular mechanisms and future promise[J].Cell,2010,140(4):460-476.
[6]Stathopoulos GT,Kalomenidis I.Malignant pleural effusion:tumorhost interactions unleashed[J].Am J Respir Crit Care Med,2012,186(6):487-492.
[7]Ma X,Sun Y,Wang S,et al.Establishment of a malignant pleural effusion mouse model with lewis lung carcinoma cell lines expressing enhanced green fluorescent protein[J].Zhongguo Fei Ai Za Zhi,2012,15(6):317-323.
[8]Maldonado F,Astoul P.Management of recurrent malignant pleural effusions:an ever-recurring issue?[J]Chest,2012,142(6):1696-1697.
[9]Wu SG,Yu CJ,Tsai MF,et al.Survival of lung adenocarcinoma patients with malignant pleural effusion[J].Eur Respir J,2013,41(6):1409-1418.
[10]Botana-Rial M,De Chiara L,Valverde D,et al.Prognostic value of aberrant hypermethylation in pleural effusion of lung adenocarcinoma[J].Cancer Biol Ther,2012,13(14):1436-1442.
[11]Nishioka Y.Malignant pleural effusion:further translational research is crucial[J].Translational Lung Cancer Research,2012,3(1):167-169.
[12]Puri V,Pyrdeck TL,Crabtree TD,et al.Treatment of malignant pleural effusion:a cost-effectiveness analysis[J].Ann Thorac Surg,2012,94(2):374-380.
[13]Hirakawa S.From tumor lymphangiogenesis to lymphvascular niche[J].Cancer Sci,2009,100(6):983-989.
[14]Niemiec J,Adamczyk A,Ambicka A,et al.Lymphangiogenesis assessed using three methods is related to tumour grade,breast cancer subtype and expression of basal marker[J].Pol J Pathol,2012,63(3):165-171.
[15]Li T,Yang J,Zhou Q,et al.Molecular regulation of lymphangiogenesis in development and tumor microenvironment[J].Cancer Microenviron,2012,5(3):249-260.
[16]Chong CR,Xu J,Lu J,et al.Inhibition of angiogenesis by the antifungal drug itraconazole[J].ACS Chem Biol,2007,2(4):263-270.
[17]Gomes FG,Nedel F,Alves AM,et al.Tumor angiogenesis and lymphangiogenesis:Tumor/endothelial crosstalk and cellular/microenvironmental signaling mechanisms[J].Life Sci,2012,92(2):101-107.
[18]Lee AS,Kim DH,Lee JE,et al.Erythropoietin induces lymph node lymphangiogenesis and lymph node tumor metastasis[J].Cancer Res,2011,71(13):4506-4517.
