刺激隐核虫感染对褐菖的胁迫及鱼体的免疫应答
2014-03-29飞龚颀杨施兆鸿孙鹏彭士明高权新但学明李安兴
尹 飞龚颀杨施兆鸿孙 鹏彭士明高权新但学明李安兴
(1. 中国水产科学研究院东海水产研究所, 农业部东海与远洋渔业资源开发利用重点实验室, 上海 200090; 2. 中山大学生命科学学院, 水产品安全教育部重点实验室/生物防治国家重点实验室, 广州 510275; 3. 华南农业大学动物科学学院, 广州 510642)
尹 飞1龚颀杨2施兆鸿1孙 鹏1彭士明1高权新1但学明3李安兴2
(1. 中国水产科学研究院东海水产研究所, 农业部东海与远洋渔业资源开发利用重点实验室, 上海 200090; 2. 中山大学生命科学学院, 水产品安全教育部重点实验室/生物防治国家重点实验室, 广州 510275; 3. 华南农业大学动物科学学院, 广州 510642)
为探明刺激隐核虫感染对褐菖生理机能的影响, 研究分别用2500、5000、7500和10000幼虫/鱼的刺激隐核虫感染褐菖, 并分别检测感染后24h、48h、72h 和96h各时间点血清中皮质醇(COR)、血糖(GLU)、总蛋白(TP)含量; 肝脏中丙二醛(MDA)和维生素 C(VC)含量, 超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力; 鳃和皮肤中溶菌酶(LZM)活力。结果显示, 随着感染浓度的增加, 血液中COR和GLU含量均出现不同程度的升高, 其中2500、 5000和7500幼虫/鱼组COR含量的最高值均出现在感染后第3天; 而TP含量总体呈现逐步下降的趋势, 尤其当感染浓度达到5000幼虫/鱼后, TP含量的下降程度明显增加; 肝脏中MDA含量呈先降后升的变化趋势, 其中24h、48h和72h 各点MDA含量的最大值均出现在10000幼虫/鱼组, 最小值则集中出现于在2500和5000幼虫/鱼组; 而VC含量则与MDA含量的趋势相反; SOD和CAT活力均出现不同程度的升高; 鳃和皮肤 LZM活力总体呈先上升后回落的变化趋势。综上可知, 刺激隐核虫感染会对鱼体造成氧化胁迫和脂质过氧化反应, 其严重程度与感染的虫细胞浓度相关。低浓度感染组的鱼所受胁迫较轻, 在滋养体脱落后仍具有一定的自我修复能力; 而高浓度感染组鱼免疫因子的释放受到抑制或出现紊乱,即便在虫体脱落后, 其体质也很难恢复。
刺激隐核虫; 褐菖; 皮质醇; 抗氧化酶; 溶菌酶
1 材料与方法
1.1 刺激隐核虫
实验所用的刺激隐核虫虫株为中山大学病害实验室建立的刺激隐核虫GD1株。该虫株源自自然感染的卵形鲳[(500±50) g], 并继续以卵形鲳作为动物模型, 建立起GD1株传代系统。在传代第5次时,收集足量幼虫用于实验。
1.2 实验鱼
1.3 实验方法
参照Dan, et al.[15]的方法, 在18:00—21:00, 收集脱包囊孵化 1h 内的活跃幼虫于洁净烧杯中。随机吸取已知体积且均匀的虫液数滴, 分别滴于载玻片上。用甲醛杀死幼虫后于显微镜下计数, 并计算出虫液浓度。分别按Ⅰ︰2500幼虫/鱼 、Ⅱ ︰5000幼虫/鱼 、Ⅲ ︰7500幼虫/鱼 和Ⅳ ︰10000幼虫/鱼的浓度感染4组实验鱼, 另外以未感染组 (0幼虫/鱼) 作为对照, 每组设3个平行。感染在容积为252 L 的水族缸中进行, 每尾鱼用水5 L, 每缸含水共计100 L。在黑暗条件下, 将所需数量的虫液倒入实验缸中, 感染2h 后放入干净海水正常饲养。在整个实验过程中,水质理化条件与暂养期间相同。
1.4 样品采集和检测
分别于24h、48h、72h和96h从各浓度感染组和对照组取样。每次从各水族缸中随机取出3尾, 用0.15 mL/L丁香油将试验鱼麻醉后, 用1 mL无菌注射器尾静脉采血, 置于无菌离心管中, 室温静置1h后, 于4℃静置过夜, 3500 r/min 离心10min, 取上层血清置于−20℃冰箱保存备用。随后将鱼置于冰盘上解剖, 取出肝脏、鳃和皮肤后, 用预冷生理盐水快速冲洗, 并用吸水纸小心吸干。测定前先在冰盘内将样品剪碎, 向各组样品中分别加入9倍体积(w/v)预冷匀浆介质(试剂盒), 将匀浆液置于TGL-16G型冷冻离心机(3500 r/min、4℃)离心10min。根据需要, 将上清液稀释后进行酶活力及总蛋白测定。
血清COR的测定采用酶联免疫法, 试剂盒为美国R&D公司的海水鱼皮质醇ELISA试剂盒。血清GLU和TP含量用迈瑞MINDRAY-BS200全自动生化分析仪测定。MDA和VC分别按照说明书在532 nm波长下测定。
酶活力测定均采用试剂盒 (南京建成) 检测,相应操作参照说明书进行。其中, SOD 活力按黄嘌呤氧化酶法, 活力单位定义为1 mg组织蛋白在1 mL反应液中SOD 抑制率达50%时所对应的SOD量为1个SOD活力单位 (U)。CAT活力采用比色法, 活力单位定义为每分钟分解1 μmol的过氧化氢即为1个酶活力单位 (U)。血清中LZM活力通过浊度比色法测定。反应底物为用磷酸缓冲溶液 (0.05 mol/L pH 6.1) 配制的0.2 mg/mL微壁溶球菌 (Micrococcus lysoleikticus) 悬液。100 μL血清与1900 μL菌悬液混合, 在530 nm波长下, 分别在0.5min和4.5min测定吸光值(OD)。活力单位定义为LZM每分钟使含菌酶液吸光值减少0.001所需的能力即为1个酶活力单位(U)。
各组织总TP测定按照考马斯亮蓝法[16], 以牛血清白蛋白 (BSA) 作为标准, 采用试剂盒 (南京建成) 进行。
1.5 数据分析与统计方法
试验数据以一元方差分析 (One-way analysis of variance, ANOVA) 和Duncan法进行多重比较。以上统计分析在SPSS 11.5环境下进行。数据结果为平均值±标准差 (mean±SD)。P<0.05为差异显著。采用Sigmaplot作图。
2 结果

图1 刺激隐核虫感染对褐菖血清生化指标的影响Fig. 1 Serum biochemical parameters of Sebastiscus marmoratus to the acute Cryptocaryon irritans infection
多重比较表明, 随着感染浓度的增加, 肝脏中MDA含量呈先降后升的变化趋势 (P<0.05)。其中24h、48h和72h 各点MDA含量的最大值均出现在10000幼虫/鱼组(P<0.05), 且96h时的最大值也出现在相对高的感染浓度组 (7500幼虫/鱼)(P<0.05)。而24h、48h和96h各点MDA含量的最小值则出现在5000幼虫/鱼组 (P<0.05); 72h时则出现在2500幼虫/鱼组 (P<0.05)。而VC含量则随着感染浓度的增加呈先升后降的变化趋势 (P<0.05)。其中, 7500幼虫/鱼组在第96h和10000幼虫/鱼三个时间点的VC含量均显著低于其他各组的各个时间点的所测得的结果 (P<0.05)。
与对照组相比, 各感染组的SOD活力均出现不同程度的升高 (P<0.05)。其中, 随着感染浓度的增加, 除5000幼虫/鱼(P>0.05) 和7500幼虫/鱼(P<0.05)两组SOD活力在第96h出现小幅回落外, 其余各组各时间点 SOD活力均随着感染后时间的推移表现出升高的趋势。除对照和 2500幼虫/鱼组各时间点间CAT活力差异不显著外 (P>0.05), 其余三组CAT活力随着感染后时间的推移总体呈升高的趋势(P<0.05)。与对照组相比, 5000幼虫/鱼和7500幼虫/鱼两组的CAT活力在第72h之后出现显著升高 (P<0.05), 而10000幼虫/鱼则从第24h开始其CAT活力就显著高于对照组 (P<0.05)。

图2 刺激隐核虫感染对褐菖肝脏脂质过氧化和抗氧化力的影响Fig. 2 Lipid peroxidation and antioxidant activities of Sebastiscus marmoratus to the acute Cryptocaryon irritans infection
3 讨论
COR是鱼体中一种与应激有关的重要激素。在受到胁迫时, 血液中COR浓度升高, 这往往会导致机体免疫力下降, 长此以往, 会引起生长变缓。寄生虫感染会对鱼体造成胁迫[17]。Bowers, et al.的研究显示, 大西洋鲑 (Salmo salar L.) 感染了鲑疮痂鱼虱 (Lepeophtheirus salmonis) 后, 血清 COR含量显著升高[10]。在本研究中, 褐菖血清中COR含量随着感染浓度的升高而上升。其中2500幼虫/鱼、5000幼虫/鱼和7500幼虫/鱼3个感染组褐菖血清COR含量的最高值均出现在感染后3d, 而此时也正是滋养体发育成熟, 鱼体表“白点”最明显的时候。此时患病严重的鱼摄食量逐步减弱乃至停止, 呼吸速度加快, 并出现不同程度死亡[13]。上述结果说明, 感染后3d鱼体的应激反应最为强烈。因此建议在实际生产中, 此时应尽量减少对鱼的干扰, 否则会增加鱼体应激。2500幼虫/鱼和5000幼虫/鱼组鱼在感染后4d,即虫体大量脱落后, 血清COR含量出现显著回落。这说明相对低感染浓度组的鱼所受胁迫较轻, 仍具有一定的自我调节力。而高浓度感染组的鱼, 即便在虫体脱落后, 体质也很难恢复, 随后相继死亡。
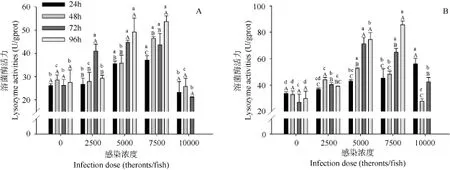
图3 刺激隐核虫感染对褐菖鳃(A)和皮肤(B)溶菌酶活性的影响Fig. 3 Branchial (A) and cutaneous (B) LZM activity of Sebastiscus marmoratus to the acute Cryptocaryon irritans infection
此外, GLU和电解质也被认为是应对胁迫的响应因子[18]。在急性胁迫情况下, GLU浓度往往随着COR和肾上腺素含量的升高而上升。如在寄生虫感染中, 在鲑疮痂鱼虱感染大西洋鲑第21天时, GLU和COR含量均显著升高[10]。这是因为COR可以促进肝内糖原异生, 增加糖原储存, 促使GLU升高。在本研究中, 各感染组褐菖GLU含量均显著高于对照组, 且与COR含量的升高情况相似。另外, 5000幼虫/鱼和7500幼虫/鱼组血清Na+、Cl–离子浓度和Na+/K+-ATP酶活力随着感染时间的增加, 在96h内出现先升后降的趋势; 而10000幼虫/鱼组的上述指标, 在感染48h后均显著升高, 并维持在较高水平[13]。这说明鱼体严重感染刺激隐核虫时, 鳃部的泌氯细胞遭到破坏, 这极大的干扰了离子的排出, 并造成血清渗透压失衡[19]。研究认为, 胁迫严重时应激激素 (COR和儿茶酚胺) 可以起到调控ATP酶活性的作用, 并以此来弥补由于泌氯细胞受损而减弱的离子泵功能。除此之外, 血清蛋白含量和血细胞容积也被认为是评价组织损伤的指标。在鱼体感染疮痂鱼虱后, 随着Cl–离子浓度的升高, 血清蛋白含量和血细胞容积则显著降低[17], 这与本研究中蛋白含量的变化情况相似。因此也进一步说明患“白点病”的褐菖鱼体渗透调节出现了异常。
MDA 是机体脂质过氧化反应的终产物之一,对其含量的测定可以间接反应细胞的损伤[20]。在寄生虫感染中, MDA也被当作评价组织受寄生虫伤害程度的生物学指标。Gismondi, et al.的研究显示, 当钩虾 (Gammarus roeseli) 感染了棘头虫(Polymorphus minutes) 后, 降低的MDA含量说明机体具备了较强的自我保护力, 其细胞所受的损伤也有所减轻[21]。在本研究中, 2500幼虫/鱼和5000幼虫/鱼感染组鱼肝脏中MDA含量与对照组相比显著降低。这可能由于寄生虫为了能依附宿主生存, 通过抑制脂质的过氧化或消除脂质过氧化物进而对宿主进行了一定程度的保护。而高浓度刺激隐核虫感染组, 鱼体肝脏MDA含量却随感染时间的延长而显著升高。这说明寄生虫感染后, 机体中脂质过氧化反应明显加强[22]。但要想详细了解肝细胞在刺激隐核虫寄生后的损伤程度, 还需要最直接的组织病理学观察结果来说明。
SOD和CAT是清除活性氧自由基的重要酶蛋白,对机体细胞损伤后的氧化过程和吞噬作用具有很强的防御功能。通常认为, SOD在清除活性氧的过程中最早发挥作用, 它首先促使O2–歧化为H2O2和O2, 随后CAT再将H2O2催化为H2O和O2, 从而达到为机体解毒的目的。Morga, et al.的研究显示, 包拉米虫(Bonamia ostreae) 感染欧洲牡蛎 (Ostrea edulis) 后,血细胞中SOD基因过表达, 起到了抑制活性氧分子(ROS)过量产生的作用[23,24]。在本研究中, SOD、CAT含量随着感染浓度的升高, 分别于感染后(1—3)d开始不断升高。这说明刺激隐核虫感染致使褐菖肝脏中的自由基大量积累, 而SOD和CAT活力升高则有望降低肝脏所受到的伤害。此外, 有研究显示虽然扁弯口吸虫 (Clinostomum detruncatum) 感染克林雷士鲶鱼 (Rhamdia quelen) 后, 肌肉中SOD和CAT活性与对照组相比未发生显著改变。但通过检测“叔丁基过氧化氢引发的化合光”的升高情况, 该作者认为鲶鱼肌肉中非酶系统的抗氧化防御力有所减弱[25]。并据此推测, 上述情况导致了机体的氧化胁迫和随之而来的肌肉脂质过氧化损伤[25]。在本研究中, 非酶系中的VC含量在高浓度感染组显著降低的现象也进一步证明, 褐菖肝脏受到了严重氧化胁迫和脂质过氧化反应的不利影响。
LZM是白细胞中的一类先天免疫防御成分, 它通过水解细胞壁中的肽聚糖来杀灭细菌。研究显示, LZM在抗寄生虫的免疫防御中发挥作用[26]。Dan, et al.研究认为, 用刺激隐核虫滋养体细胞制备疫苗,并通过腹腔注射给点带石斑鱼后, 血液中LZM活力显著升高, 并在第4周达到最大值[11]。此外, 在理化和生物因子异常引起的急性胁迫情况下, LZM活性也可以作为鱼类应激程度的指示信号[27]。Zhou, et al.研究显示, 当水体中悬浮物过多时, 半滑舌鳎(Cynoglossus semilaevis) 肝脏中LZM活力在5d内显著升高[28]。Hua, et al.研究了嗜水气单胞菌(Aeromonas hydrophila)感染后的史氏鲟(Aclpenser Schrenckii)血清及各组织中LZM活力的变化, 结果显示血清、肝脏和黏液中LZM活力与对照组相比出现不同程度升高; 而肠道、胃和鳃等组织中LZM活力低于或仅仅接近于对照组[29]。在本研究中, 鳃和皮肤是刺激隐核虫寄生的部位, 也是受到直接损害最严重的组织。刺激隐核虫寄生后, 鳃部和皮肤LZM活力在5000幼虫/鱼和7500幼虫/鱼这两组中出现大幅度升高; 而在10000幼虫/鱼组时却有所降低。这说明在中度感染后, LZM活力升高是机体受到胁迫的指示; 而在高度感染后, 由于组织损伤或病理变化程度较重造成LZM分泌出现紊乱或被抑制。此外值得注意的是, 2500幼虫/鱼这一低浓度感染组LZM活力分别在鳃或皮肤中的第72h或48h出现了短暂的升高后又有所降低。这可能由于寄生虫要依附宿主才能生存, 因此物种经过长期进化后形成了某种共存机制[21], 比如在较低感染浓度下, 寄生虫诱使鱼体LZM等免疫因子含量在短期内升高, 以控制寄生的虫体数量和活力, 从而达到某种平衡, 以减轻对鱼体的伤害。但详细情况仍需更多研究加以证明。
综上可知, 刺激隐核虫感染会对鱼体造成氧化胁迫和脂质过氧化反应, 其严重程度与感染的虫细胞浓度相关。低浓度感染组的鱼所受胁迫较轻, 在滋养体脱落后仍具有一定的自我修复能力; 而高浓度感染组鱼的免疫因子释放受到抑制或出现紊乱,即便在虫体脱落后, 其体质也很难恢复。
[1] Matthews R A, Burgess P J. Cryptocaryon irritans (ciliophora): Primary infection in thick-lipped mullet, Chelon labrosus (risso) [J]. Journal of Fish Diseases, 1995, 18(4): 329—335
[2] Cheung P J, Nigrelli R F, Ruggieri G D. Studies on Cryptocaryoniasis in marine fish: Effect of temperature and salinity on the reproductive cycle of Cryptocaryon irritans brown, 1951 [J]. Journal of Fish Diseases, 1979, 2(2): 93—97
[3] Colorni A. Burgess P. Cryptocaryon irritans brown 1951, the cause of ‘white spot disease’ in marine fish: An update [J]. Aquarium Sciences and Conservation, 1997, 1(4): 217—238
[4] Colorni A. Aspects of the biology of Cryptocaryon irritans, and hyposalinity as a control measure in cultured gilt-head sea bream Sparus aurata [J]. Diseases of Aquatic Organisms, 1985, 1: 19—22
[5] Li Y W, Dan X M, Zhang T W, et al. Immune-related genes expression profile in orange-spotted grouper during exposure to Cryptocaryon irritans [J]. Parasite Immunology, 2011, 33(12): 679—987
[6] Yan M C, Shao X B, Shan L Z, et al. Study on prevention and treatment of Cryptocaryon irritans with formalin for brown croaker, Miichthys miiuy [J]. Modern Fisheries Information, 2008, 23(11): 16—19 [闫茂仓, 邵鑫斌, 单乐州, 等. 福尔马林防治鱼 Miichthys miiuy (Basilewsky)刺激隐核虫(Cryptocaryon irritans) 的研究. 现代渔业信息, 2008, 23(11): 16—19]
[7] Qiao W, Li Y W, Li A X. Molecular cloning and characterization of a TLR3 from Epinephelus coioides infected with Cryptocaryon irritans [J]. Acta Hydrobiologica Sinica, 2012, 36(3): 385—392 [乔玮, 李言伟, 李安兴. 斜带石斑鱼 TLR3 基因的克隆及其在刺激隐核虫感染时的表达分析. 水生生物学报, 2012, 36(3): 385—392]
[8] Li R J, Liu F, Wang F H, et al. Skin mucus of rabbitfish (Siganus oramin) is lethal to Cryptocaryon irritans and someother pathogenic organisms [J]. Acta Hydrobiologica Sinica, 2013, 37(2): 243—251 [黎睿君, 刘芳, 王方华, 等. 黄斑蓝子鱼皮肤黏液对刺激隐核虫及一些病原菌的抑杀作用.水生生物学报, 2013, 37(2): 243—251]
[9] Huang X, Sun Z, Guo G, et al. Cloning and characterization of a surface antigen cisa-32.6 from Cryptocaryon irritans [J]. Experimental Parasitology, 2012, 130(3): 189—194
[10] Bowers J M, Mustafa A, Speare D J, et al. The physiological response of Atlantic salmon, Salmo salar L., to a single experimental challenge with sea lice, Lepeophtheirus salmonis [J]. Journal of Fish Diseases, 2000, 23(3): 165—172
[11] Dan X M, Zhang T W, Li Y W, et al. Immune responses and immune-related gene expression profile in orange-spotted grouper after immunization with Cryptocaryon irritans vaccine [J]. Fish & Shellfish Immunology, 2013, 34(3): 885—891
[12] Sun Z Y, Zheng C F, Wu X Y, et al. The strain and life-cycle of Cryptocaryon irritans isolated from Pseudosciaena crocea cultured in Xiapu Fujian [J]. Journal of Fujian Normal University (Natural Science Edition), 2011, 27(2): 101—108 [孙志宇, 郑昌峰, 武晓燕, 等. 福建霞浦海区刺激隐核虫虫株鉴定及生活史观察. 福建师范大学学报(自然科学版), 2011, 27(2): 101—108]
[13] Yin F, Gong Q Y, Li Y W, et al. Effects of Cryptocaryon irritans infection on the survival, feeding, respiratory rate, and ionic regulation of the marbled rockfish Sebastiscus marmoratus [J]. Parasitology, 2014, 141(2): 279—286
[14] Bai J S, Xie M Q, Zhu X Q, et al. Comparative studies on the immunogenicity of theronts, tomonts and trophonts of Cryptocaryon irritans in grouper [J]. Parasitology Research, 2008, 102(2): 307—313
[15] Dan X M, Li A X, Lin X T, et al. A standardized method to propagate Cryptocaryon irritans on a susceptible host pompano Trachinotus ovatus [J]. Aquaculture, 2006, 258(1—4): 127—133
[16] Bradford M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(1—2): 248—254
[17] Grimnes A, Jakobsen P J. The physiological effects of salmon lice infection on post-smolt of Atlantic salmon [J]. Journal of Fish Biology, 1996, 48(6): 1179—1194
[18] Wedemeyer G A, Barton B A, McLeay D J. Stress and acclimation. In: Schreck C B, Moyle P B (Eds.), Methods for Fish Biology [M]. American Fisheries Society, Bethesda, MD. 1990, 451—489
[19] Misumi I. The ciliated protozoan parasite, Cryptocaryon irritans, and protective immunity in marine fish. Hawai’i [D]. Ph.D. thesis, The University of Hawai’i, Hawai’i. 2009
[20] Janero D R. Malondialdehyde and thiobarbituric acidreactivity as diagnostic indices of lipid peroxidation and peroxidative tissue injury [J]. Free Radical Biology and Medicine, 1990, 9(6): 515—540
[21] Gismondi E, Cossu-leguille C, Bbisel J N. Does the acanthocephalan parasite Polymorphus minutus modify the energy reserves and antitoxic defences of its intermediate host Gammarus roeseli [J]? Parasitology, 2012, 139(8): 1054—1061
[22] Belló A, Fortes E, Belló-Klein A, et al. Lipid peroxidation induced by clinostomum detruncatum in muscle of the freshwater fish Rhamdia quelen [J]. Diseases of Aquatic Organisms, 2000, 42(3): 233—236
[23] Morga B, Arzul I, Chollet B, et al. Infection with the protozoan parasite Bonamia ostreae modifies in vitro haemocyte activities of flat oyster Ostrea edulis [J]. Fish & Shellfish Immunologyol, 2009, 26(6): 836—842
[24] Morga B, Arzul I, Faury N, et al. Molecular responses of Ostrea edulis haemocytes to an in vitro infection with Bonamia ostreae [J]. Developmental and Comparative Immunology, 2011, 35(3): 323—333
[25] Gonzalez Flecha B, Llesuy S, Boveris A. Hydroperoxideinitiated chemiluminescence: An assay for oxidative stress in biopsies of heart, liver, and muscle [J]. Free Radical Biology and Medicine, 1991, 10(2): 93—100
[26] Alishahi M, Buchmann K. Temperature-dependent protection against Ichthyophthirius multifiliis following immunisation of rainbow trout using live theronts [J]. Diseases of Aquatic Organisms, 2006, 72(3): 269—273
[27] Fevolden S E, Refstie T, Gjerde B. Genetic and phenotypic parameters for cortisol and glucose stress response in Atlantic salmon and rainbow trout [J]. Aquaculture, 1993, 118(3-4): 205—216
[28] Zhou Y, Ma Z S, Qu K M, et al. Effects of suspended substance concentration on activities of lysozyme, superoxide dismutase, and Na+-K+-ATPase in juvenile Cynoglossus semilaevis [J]. Oceanologia et Limnologia Sinica, 2009, 40(3): 367—372 [周勇, 马绍赛, 曲克明, 等.悬浮物对半滑舌鳎 (Cynoglossus semilaevis)幼鱼肝脏溶菌酶、超氧化物歧化酶和鳃丝Na+-K+-ATPase活力的影响.海洋与湖沼, 2009, 40(3): 367—372]
[29] Hua Y P, Liu H B, Zhang Y. Lysozyme levels in serum and different tissues of Amur sturgeon at different temperatures in normal and pathological status [J]. Journal of Northeast Forestry University, 2005, 33(3): 63—66 [华育平, 刘红柏, 张颖. 温度、疾病感染对史氏鲟血清和各组织中溶菌酶水平的影响. 东北林业大学学报, 2005, 33(3): 63—66]
STRESS AND IMMUNE RESPONSES OF THE MARBLED ROCKFISH SEBASTISCUS MARMORATUS INFECTED WITH CRYPTOCARYON IRRITANS
YIN Fei1, GONG Qi-Yang2, SHI Zhao-Hong1, SUN Peng1, PENG Shi-Ming1, GAO Quan-Xin1,
DAN Xue-Ming3and LI An-Xing2
(1. Key Laboratory of East China Sea and Oceanic Fishery Resources Exploitation, Ministry of Agriculture, East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China; 2. Key Laboratory for Aquatic Products Safety of Ministry of Education, State Key Laboratory of Biocontrol, The School of Life Sciences, Sun Yat-sen University, Guangzhou 510275, China; 3. College of Animal Science, South China Agricultural University, Guangzhou 510642, China)
To investigate the effects of a Cryptocaryon irritans infection on the biochemical functions and immune responses of the marbled rockfish Sebastiscus marmoratus, this study utilized C. at concentrations of 2,500, 5,000, 7,500, and 10,000 theronts/fish to infect marbled rockfish weighing (45±3) g. Within 96 hours after the infection we measured a variety of parameters at different time points, including (in the serum) cortisol (COR), glucose (GLU), total protein (TP) contens, (in the liver) the malondialdehyde (MDA) and vitamin C (VC) contents, the superoxide dismutase (SOD) and catalase (CAT) activities, and (in the gill and skin) the lysozyme (LZM) activities of the marbled rockfish. The results showed that the serum COR and GLU contents of the marbled rockfish gradually increased along with the infection concentration and the lapse of time after the infection. However, the TP content decreased while infection concentration increased. Compared to the control, MDA contents in the liver decreased significantly in the 5 000 theronts/fish infection group, then increased significantly and reached the maximum in the 10000 theronts/fish infection group. VC contents in the liver initially rose and then dropped. Compared to the control group, the SOD and CAT activities of the fish were significantly elevated. The LZM activities in the gill and skin initially increased and then decreased. In conclusion, C. irritans infection may result in adverse effects on the rockfish, probably through oxidative stress and lipid peroxidation. The physiological functions of the fish infected with low concentrations of C. irritans theronts could be effectively restored after the removal of trophont from the host; however the infection with high concentrations irreversibly impaired the release of immune factors.
Cryptocaryon irritans; Sebastiscus marmoratus; Cortisol; Antioxidant enzyme; Lysozyme
Q175; Q18
A
1000-3207(2014)04-0681-08
2013-05-17;
2013-12-28
国家自然科学基金 (NSFC 31101932; 31272681; 31172443)资助
尹飞(1980—), 男, 内蒙古包头人; 博士, 副研究员; 从事水产经济动物病原学研究。E-mail: feige895@gmail.com
李安兴, E-mail: lianxing@mail.sysu.edu.cn和0[13]。本研究使用不同浓度的刺激隐核虫幼体感染褐菖, 通过比较感染后不同时间点褐菖血清中皮质醇 (COR)、血糖 (GLU)、总蛋白 (TP)含量; 肝脏中丙二醛 (MDA)和维生素C (VC) 含量, 超氧化物歧化酶 (SOD) 和过氧化氢酶 (CAT) 活力; 鳃和皮肤溶菌酶(LZM)活力的变化特征, 深入探讨鱼体的病理变化和生理响应机制。
10.7541/2014.97
刺激隐核虫 (Cryptocaryon irritans) 俗称“海水小瓜虫”, 是一种可以寄生在大多数海水硬骨鱼类的纤毛虫[1]。鱼在感染刺激隐核虫后, 病灶处形成边缘明显的白点, 故该寄生虫病也称海水鱼“白点病”[2,3]。多年来, 随着海水鱼类人工养殖业的发展, 由于养殖密度的增加及养殖管理方面的失误等问题, “白点病”在海水鱼养殖区常有发生, 造成大量养殖鱼死亡, 给养殖从业者带来了极大的经济损失[4]。
为了探明刺激隐核虫对鱼体的致病机理并找到有效的防治方法, 学者们分别从鱼体组织病理学[5]、行为活动、药物杀虫[6]、鱼体免疫响应机制[7]、抗虫蛋白效力[8]和保护性抗原筛选[9]等方面进行了大量研究。使用生化指标评定鱼体的受损伤程度也是鱼类病理、免疫学研究的重要手段[10]。Dan, et al. 向点带石斑鱼(Epinephelus coioides)腹腔注射刺激隐核虫细胞疫苗并比较了血液中溶菌酶活力的变化规律[11]。而在刺激隐核虫感染后, 鱼体中应激激素含量和免疫酶活力的变化情况仍未见报道。
