酵母葡聚糖衍生物对凡纳滨对虾血细胞免疫反应的影响
2014-03-29张文兵麦康森
白 楠 谷 珉 张文兵 麦康森
(中国海洋大学水产动物营养与饲料农业部重点实验室, 海水养殖教育部重点实验室, 青岛 266003)
酵母葡聚糖衍生物对凡纳滨对虾血细胞免疫反应的影响
白 楠 谷 珉 张文兵 麦康森
(中国海洋大学水产动物营养与饲料农业部重点实验室, 海水养殖教育部重点实验室, 青岛 266003)
酵母葡聚糖是水产养殖中使用最广泛的免疫增强剂之一, 但其不溶解性不利于其免疫增强作用的发挥。为了增加酵母葡聚糖的溶解性, 研究共制备了8种酵母葡聚糖衍生物, 即4种不同取代度的羧甲基葡聚糖和磺乙基葡聚糖。将葡聚糖和其8种衍生物分别按照5、25和100μg/mL的浓度分别添加到原代培养凡纳滨对虾血细胞的培养液中。以空白血细胞作为对照。孵育6h、12h和24h后分别取样, 测定血细胞的酚氧化酶和呼吸暴发活力。结果表明, 在 6h时, 所有葡聚糖衍生物处理组的酚氧化酶活力均显著高于相同浓度下的未衍生葡聚糖处理组(P<0.05)。而25μg/mL酵母葡聚糖衍生物处理组的呼吸暴发活力显著高于同浓度未经衍生葡聚糖处理组(P<0.05)。在12h时, 所有酵母葡聚糖衍生物处理组的酚氧化酶和呼吸暴发活力均显著高于未衍生葡聚糖处理组(P<0.05)。在6h和12h时, 同浓度各葡聚糖衍生物处理组的血细胞酚氧化酶和呼吸暴发活力并无显著差异(P>0.05)。研究结果表明, 羧甲基葡聚糖和磺乙基葡聚糖均比未衍生葡聚糖具有更强的免疫促进作用, 而且这种免疫促进作用在两种衍生物之间没有显著差异; 另一方面, 酵母葡聚糖衍生物的免疫促进作用与其使用浓度有关, 而与其取代度没有明显的关系。
葡聚糖衍生物; 羧甲基葡聚糖; 磺乙基葡聚糖; 凡纳滨对虾; 细胞培养
对虾养殖在我国水产养殖中占有举足轻重的地位。但在过去的数十年中, 对虾疾病的发生严重制约了该产业的持续健康发展[1]。酵母葡聚糖作为水产养殖中广泛使用的免疫增强剂, 能够激活对虾的免疫系统, 提高其免疫力[2], 从而减少对虾疾病的发生[3, 4]。然而葡聚糖富含羟基, 羟基之间易形成具有疏水性的氢键, 从而造成葡聚糖在水中的不溶解性[5]。因此, 对虾饲料中添加的酵母葡聚糖很难从饲料中溶出, 穿过肠道并作用于血细胞。另外, 在哺乳动物中的研究已经证实, 葡聚糖的不溶解性会降低其免疫活性[6]。因此, 增加葡聚糖的溶解性有利于提高其免疫活性。
通过化学改性将多糖中的羟基被某些化学基团取代, 制备多糖衍生物是提高多糖溶解性的有效途径[7]。近年来研究表明, 多糖衍生物相比多糖具有更高的免疫活性, 且这种活性与引入化学基团的种类和取代度有关[8]。目前, 尚没有关于葡聚糖衍生物对于甲壳动物生长、存活、免疫力和抗病力的报道。
本研究拟采用羧甲基化和磺乙基化2种化学改性法分别制备2类酵母葡聚糖衍生物——羧甲基葡聚糖和磺乙基葡聚糖, 通过调节反应条件, 分别制备2类衍生物4种不同的取代度, 考察其对凡纳滨对虾血细胞免疫反应的影响, 筛选出更有效的酵母葡聚糖类免疫增强剂。
1 材料与方法
1.1 酵母葡聚糖的提取和不同取代度酵母葡聚糖衍生物的制备
葡聚糖提取于干酵母(湖北安琪酵母股份有限公司), 提取方法参考Suphantharika, et al.[9]的方法。以此酵母葡聚糖为原料, 制备了 4种不同取代度的羧甲基葡聚糖(分别命名为CMGA、CMGB、CMGC和 CMGD)和 4种不同取代度的磺乙基酵母葡聚糖(分别命名为SEGA、SEGB、SEGC和SEGD)。制备方法参考Machová, et al.[10]和Šandula, et al.[5]的方法。
1.2 酵母葡聚糖衍生物取代度的测定
羧甲基葡聚糖取代度的测定参考 Stojanović, et al.[11]的方法。具体步骤如下: 首先将1 g羧甲基葡聚糖溶解于15 mL丙酮中, 充分混匀。在上述体系中加入3 mL 6 mol/L盐酸溶液, 反应30min, 在此期间不断搅拌使之充分反应。将反应液过滤, 以 80%的甲醇洗涤滤渣, 使滤渣呈中性。将滤渣在 50℃下烘烤2h, 使其充分干燥。取0.5 g滤渣, 溶于20 mL 0.2 mol/L氢氧化钠溶液中, 并用蒸馏水定容到100 mL。取25 mL定容液, 加入1滴酚酞试剂, 以0.05 mol/L盐酸滴定至无色, 记下所用体积 V1。另取 20 mL 0.2 mol/L氢氧化钠溶液, 并用蒸馏水定容到100 mL。取25 mL定容液, 加入1滴酚酞试剂, 以0.05 mol/L盐酸溶液滴定至无色, 记下所用体积 V2。取代度的计算公式如下:

磺乙基葡聚糖的取代度的测定参考Zhang, et al.[12]的方法。用元素分析仪(CHNS/O Analyzer, Vario EI III, Perkin Elmer)测定样品中的碳元素和硫元素的百分含量。取代度的计算公式如下:

1.3 葡聚糖及其衍生物溶解率的测定
溶解率的测定方法参考Byun, et al.[13]的方法。称取大约2 g(精确到0.0001 g, 记为M)酵母葡聚糖或其衍生物, 加入到 10 mL去离子水中, 振荡20min。在振荡结束后, 将上述混合液于 3500×g速度下离心20min, 取上清液, 于105℃下烘干。记下干燥出的粉末重量M1(精确到0.0001 g)。溶解率的计算公式如下:

1.4 凡纳滨对虾血细胞的原代培养
凡纳滨对虾血细胞原代培养的方法参考 Zhou, et al.[14]的方法。实验用虾购买于青岛宝荣水产科技发展有限公司, 平均体重8 g左右。将购买的虾放于室内海水循环养殖系统中进行暂养。在暂养过程中,每天2次(08: 00和18: 00)投喂商业对虾饲料至表观饱食。每天清理残饵和粪便。水温保持在20 , pH ℃ 7.5—8.0, 溶解氧为6—7 mg/L。
在两周暂养结束后, 取健康对虾 20只, 先在4℃无菌海水中浸泡 5—10min, 再用 75%的酒精喷洒体表, 用无菌纱布拭干体表后, 再用1 mL注射器吸入抗凝剂(10 mmol/L EDTA Na2, 450 mmol/L NaCl, 10 mmol/L KCl, 10 mmol/L HEPES, pH调至7.3, 渗透压调至850 mOsm/kg, 以0.22 μm滤膜滤过除菌,分装, 于4℃保存), 等比自腹血窦抽取血淋巴。将抽取的血淋巴离心10min (4 ℃ , 400×g), 弃上清, 加入无血清培养基(2×Leibovitz’s L-15, 并补充 100 U/mL青霉素和100 μg/mL链霉素。调节pH至7.2, 经0.22 μm滤膜滤过除菌, 分装, 于 4℃保存, 用前添加 20%胎牛血清), 打散细胞, 离心 10min(400×g, 4 ℃) , 弃上清。用添加有 20%胎牛血清的培养基重悬血细胞, 充分轻柔吹散细胞, 吸取少量细胞悬液用血球计数板计数, 调整细胞密度至1×106个/mL。然后, 加200 μL细胞悬液于96孔细胞培养板, 28℃恒温培养24h, 使血细胞充分贴壁。
1.5 实验设计和指标测定
在血细胞培养 24h后, 将培养板离心(800×g, 10min), 弃上清。然后加入含有特定免疫增强剂的培养液。免疫增强剂(酵母葡聚糖或其衍生物)的浓度如下: 0(对照组)、5、25和100 μg/mL。分别培养6h、12h和24h后, 取样, 测定血细胞酚氧化酶和呼吸暴发活力。加入免疫增强剂 24h后, 测定血细胞活力。免疫增强剂浓度和取样时间的选择点参考Gu, et al.[15]的方法。
酚氧化酶活力的测定 酚氧化酶活力的测定方法参考Zhou, et al.的方法[14]。取样时, 首先将离心培养板离心10min (4000×g, 28 ℃)后弃上清, 加入等体积的预冷PBS缓冲液, 超声破碎细胞(40 amplitude, 2s×4 次, 0 ℃)。然后再次将培养板离心10min (800×g, 0 ℃ ), 取上清液用于酚氧化酶活力检测。
取50 μL上述血细胞破碎液与50 μL胰蛋白酶溶液(0.1 mg/mL 溶于CAC 缓冲液: 10 mmol/L二甲胂酸钠, 10 mmol/L氯化钙, 将pH调节至7.0)加入到96孔细胞培养板中, 室温下温育 10min。然后加入50 μL L-DOPA 溶液(3 mg/mL溶于CAC 缓冲液),室温下温育10min后, 立刻放入酶标仪(Model Multiskan spectrum, Thermo MA, Waltham, USA)中, 在492 nm波长下测定酶活力。在此反应条件下, 每分钟每毫升血细胞上清液OD值增加0.001 为一个酶活力单位。
呼吸暴发活力的测定 呼吸暴发活力的测定参考Song和Herish[16]的方法并略有改动。首先于4000×g条件下离心细胞培养板10min, 弃上清, 加入100 μL 0.3% NBT, 37℃温育30min。温育结束后,以800×g, 4℃离心10min, 去除上清, 加入200 μL纯甲醇终止反应。10min后, 以800×g, 4℃离心10min,去除上清, 并以70%甲醇洗涤三次, 离心去除上清后, 室温晾干。干燥后, 加入 120 μL 2 mol/L KOH和 140 μL DMSO, 充分溶解, 测定溶液在波长630 nm下的吸光值。呼吸暴发活力表示为OD 630 nm。
细胞活力的测定 细胞活力以比色法测定[17]。待免疫增强剂处理血细胞24h后, 将50 μL MTT (购买于Sigma-Aldrich, 产品编号M5655)溶液(5 mg/mL溶于PBS溶液)加入每个细胞培养孔中, 在黑暗中反应5h。在反应结束后, 离心细胞培养板, 弃上清, 加入200 μL DMSO溶解MTT颗粒。然后在酶标仪(Model Multiskan spectrum, Thermo MA, Waltham, USA)中读取570 nm波长下的吸光值。细胞活力的计算公式如下:
细胞活力%=(各实验处理组吸光值/对照组吸光值)×100
1.6 数据处理
实验结果以平均数±标准差来表示。采用 SPSS 17.0软件包进行数据分析。采用双因素方差分析酵母葡聚糖衍生物的取代度和浓度对凡纳滨对虾血细胞免疫反应的影响, 当差异显著时(P<0.05), 采用Tukey检验进行多重比较。在每个取样时间点, 分别从羧甲基酵母葡聚糖处理组和磺乙基酵母葡聚糖处理组中选取免疫指标最高的处理组进行独立样本 T检验, 从而比较羧甲基葡聚糖和磺乙基葡聚糖免疫活力的高低。当P<0.05时视为差异显著。
2 结果
2.1 酵母葡聚糖衍生物的取代度和溶解率
经过测定和计算(表1), 酵母葡聚糖溶解率仅为4.07%。随着取代度的增加, 溶解率显著增加。羧甲基葡聚糖的溶解率从 33.76%增加到 86.56%; 而磺乙基葡聚糖的溶解率从27.56%增加到81.69%。
2.2 酵母葡聚糖及其衍生物对凡纳滨对虾血细胞活力的影响
从图 1可以看出, 经酵母葡聚糖和酵母葡聚糖衍生物作用24h后, 对虾血细胞活力仍然高于90%,且各处理组之间没有显著差异(P>0.05)。这表明,酵母葡聚糖和葡聚糖衍生物对细胞活力没有显著影响。

图 1 与葡聚糖(GLU)、羧甲基葡聚糖(CMG, 图 A)或磺乙基葡聚糖(SEG, 图B)孵育24h后凡纳滨对虾血细胞的细胞活力Fig. 1 Viability of haemocytes of L. vannamei, which were incubated 24h with β-glucan (GLU), carboxymethylglucan (CMG, Fig. A) or sulfoethylglcuan (SEG, Fig. B) at three concentrations
2.3 酵母葡聚糖及其衍生物对凡纳滨对虾血细胞酚氧化酶活力的影响
从图2中可以看出, 在6h时, 免疫增强剂处理组的酚氧化酶活力显著高于对照组(P<0.05)。在相同的浓度下, 葡聚糖衍生物处理组的酚氧化酶活力显著高于未衍生葡聚糖处理组(P<0.05, 图2)。葡聚糖衍生物的浓度显著影响了血细胞的酚氧化酶活力(P<0.05, 表 2), 酚氧化酶活力随着葡聚糖衍生物的浓度的增加而显著增加(P<0.05, 图2)。在此时间点,羧甲基葡聚糖和磺乙基葡聚糖的取代度对血细胞酚氧化酶活力无显著影响(P>0.05, 表 2), 二者相比也无显著差异(P>0.05, 表3)。

表1 葡聚糖及其衍生物的取代度和溶解率Tab. 1 The degree of substitution and solubility of glucan and its derivatives

图 2 与葡聚糖(GLU)、羧甲基葡聚糖(CMG, 图 A)或磺乙基葡聚糖(SEG, 图B)孵育6h后凡纳滨对虾血细胞的酚氧化酶活力Fig. 2 Phenoloxidase (PO) activity of haemocytes of L. vannamei, which were incubated 6h with β-glucan (GLU), carboxymethylglucan (CMG, Fig. A) or sulfoethylglcuan (SEG, Fig. B) at three concentrations
在12h时, 5、25 μg/mL酵母葡聚糖处理组的血细胞的酚氧化酶活力仍然显著高于对照组(P>0.05,图3)。酵母葡聚糖衍生物处理组的血细胞的酚氧化酶活力显著高于同浓度未衍生葡聚糖处理组(P<0.05, 图3)。羧甲基酵母葡聚糖的取代度和浓度都显著影响了对虾血细胞的酚氧化酶活力(P<0.05,表 2)。但是, 磺乙基酵母葡聚糖的取代度和浓度并不能显著影响对虾血细胞的酚氧化酶活力(P>0.05,表 2)。在此时间点, 羧甲基酵母葡聚糖和磺乙基酵母葡聚糖对于血细胞酚氧化酶活力的影响无显著差异(P>0.05, 表3)。
在 24h时, 所有处理组之间的酚氧化酶活力无显著差异(P>0.05, 图4)。

图 3 与葡聚糖(GLU)、羧甲基葡聚糖(CMG, 图 A)或磺乙基葡聚糖(SEG, 图B)孵育12h后凡纳滨对虾血细胞的酚氧化酶活力Fig. 3 Phenoloxidase (PO) activity of haemocytes of L. vannamei, which were incubated 12h with β-glucan (GLU), carboxymethylglucan (CMG, Fig. A) or sulfoethylglcuan (SEG, Fig. B) at three concentrations

表2 葡聚糖衍生物的取代度、浓度及其交互作用对于凡纳滨对虾血细胞酚氧化酶活力和呼吸暴发活力的影响Tab. 2 Effects of degree of substitution, concentration and their interaction on the phenoloxidase activity and respiratory burst of haemocytes of white shrimp Litopenaeus vannamei

表3 羧甲基葡聚糖和磺乙基葡聚糖的比较Tab. 3 The comparison of carboxymethylglucan and suloethylglucan
2.4 酵母葡聚糖及其衍生物对凡纳滨对虾血细胞呼吸暴发活力的影响
从图5中可以看出, 在6h时, 所有免疫增强剂处理组的血细胞呼吸暴发活力显著高于对照组(P<0.05)。其中25 μg/mL羧甲基酵母葡聚糖处理组和磺乙基葡聚糖处理组的血细胞呼吸暴发活力显著高于同浓度未衍生葡聚糖处理组(P<0.05)。在此时间点, 酵母葡聚糖衍生物的浓度显著影响了呼吸暴发活力(P<0.05, 表 2), 但取代度没有显著影响(P>0.05,表2)。羧甲基酵母葡聚糖和磺乙基酵母葡聚糖对于血细胞呼吸暴发活力的影响无显著差异(P>0.05, 表3)。
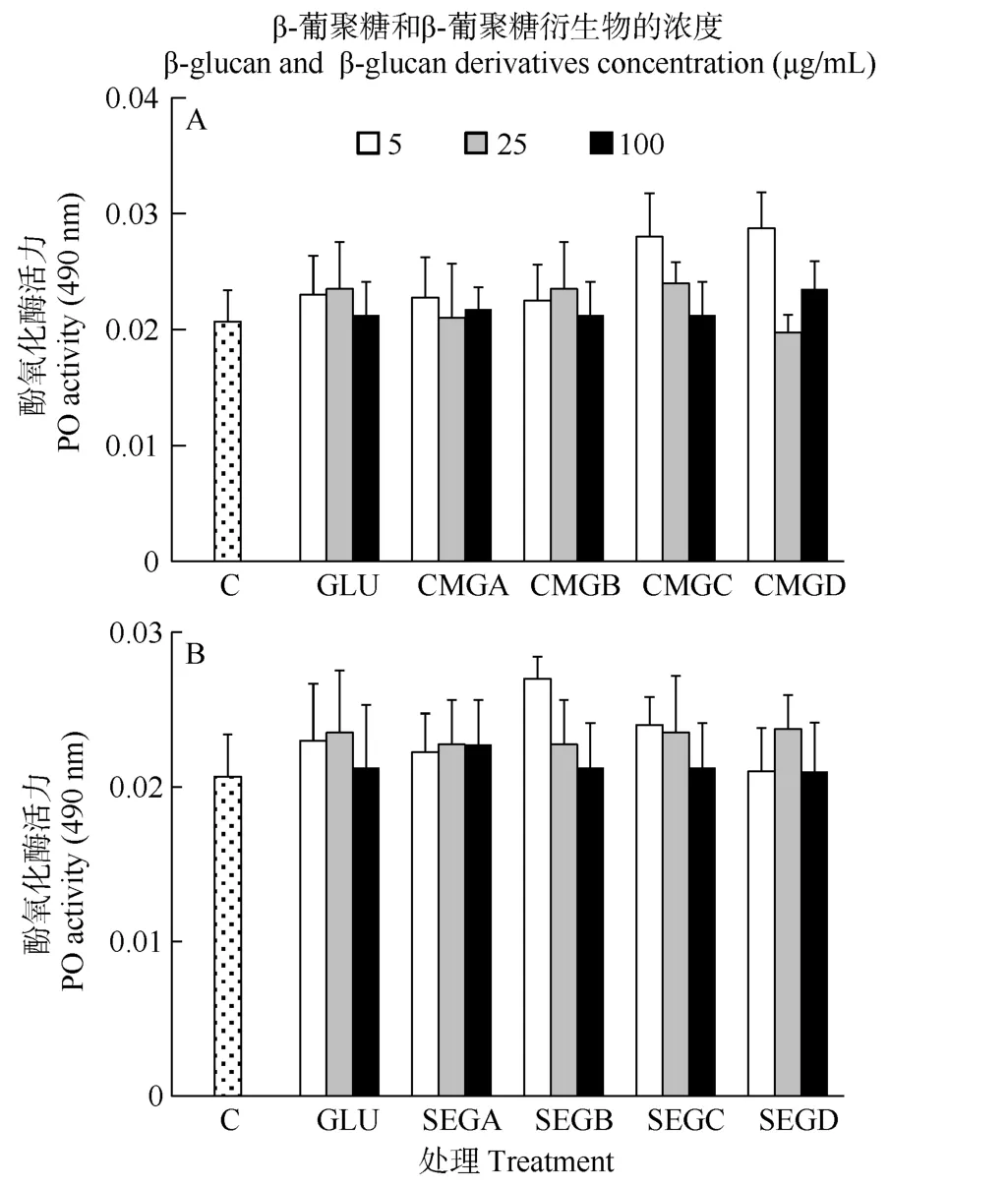
图 4 与葡聚糖(GLU)、羧甲基葡聚糖(CMG, 图 A)或磺乙基葡聚糖(SEG, 图B)孵育24h后凡纳滨对虾血细胞的酚氧化酶活力Fig. 4 Phenoloxidase (PO) activity of haemocytes of L. vannamei, which were incubated 24h with β-glucan (GLU), carboxymethylglucan (CMG, Fig. A) or sulfoethylglcuan (SEG, Fig. B) at three concentrations
在12h 时, 所有酵母葡聚糖处理组的血细胞呼吸暴发活力与对照组相比无显著差异(P>0.05, 图6)。但是, 酵母葡聚糖衍生物处理组的血细胞呼吸暴发活力仍然显著高于对照组(P<0.05, 图6)。酵母葡聚糖衍生物处理组的血细胞呼吸暴发活力显著高于未衍生葡聚糖处理组(P<0.05, 图 6)。在此时间点,酵母葡聚糖衍生物的取代度和浓度均不能显著影响血细胞呼吸暴发活力(P>0.05, 表2)。羧甲基酵母葡聚糖和磺乙基酵母葡聚糖对于血细胞呼吸暴发活力的影响无显著差异(P>0.05, 表3)。
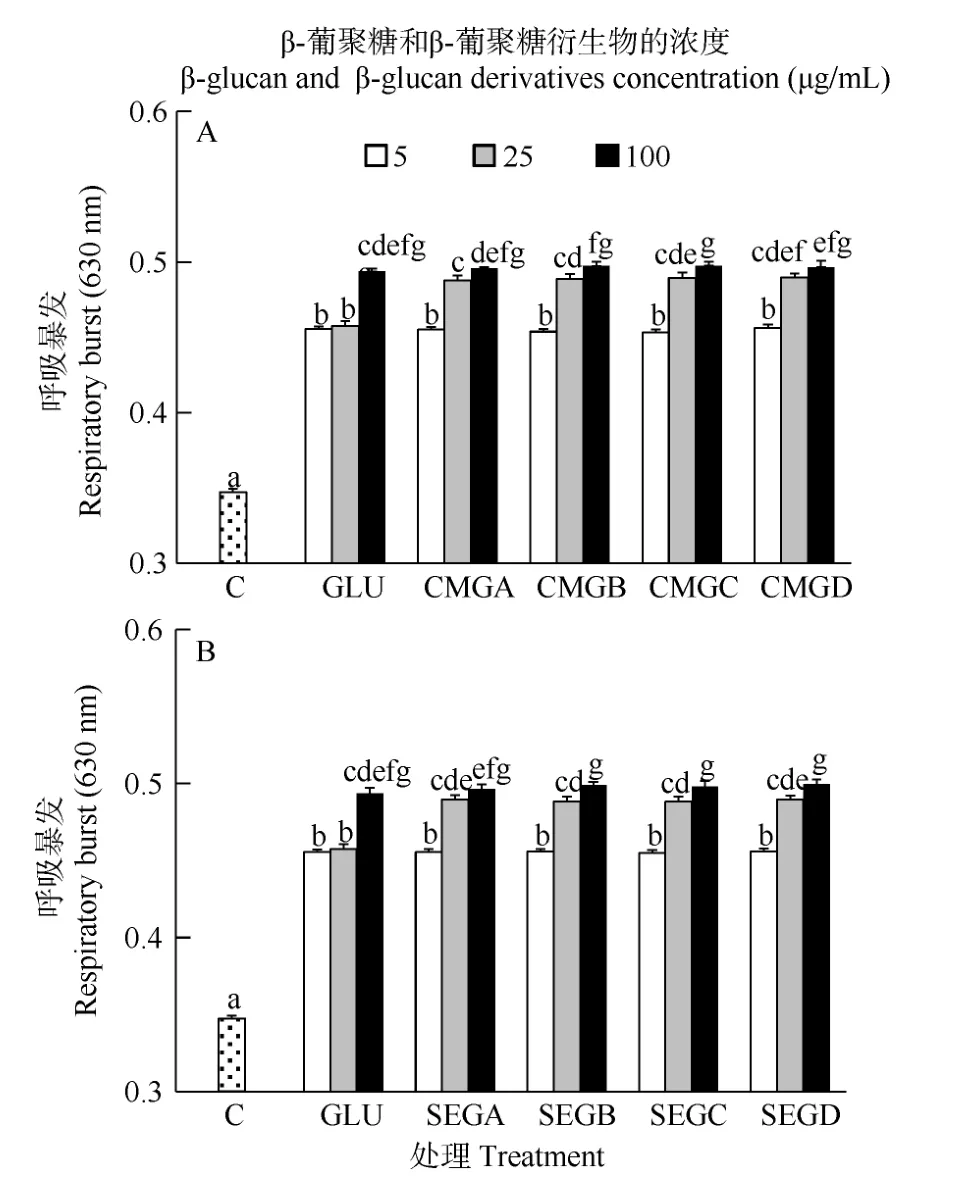
图5 与葡聚糖(GLU)、羧甲基葡聚糖(CMG, 图A)或磺乙基葡聚糖(SEG, 图B)孵育6h后凡纳滨对虾血细胞的呼吸暴发活力Fig. 5 Respiratory burst (RB) of haemocytes of L. vannamei, which were incubated 6h with β-glucan (GLU), carboxymethylglucan (CMG, Fig. A) or sulfoethylglcuan (SEG, Fig. B) at three concentrations

图6 与葡聚糖(GLU)、羧甲基葡聚糖(CMG, 图A)或磺乙基葡聚糖(SEG, 图B)孵育12h后凡纳滨对虾血细胞的呼吸暴发活力Fig. 6 Respiratory burst (RB) of haemocytes of L. vannamei, which were incubated 12h with β-glucan (GLU), carboxymethylglucan (CMG, Fig. A) or sulfoethylglcuan (SEG, Fig. B) at three concentrations
在 24h时, 所有处理组之间的呼吸暴发活力无显著差异(P>0.05, 图7)。
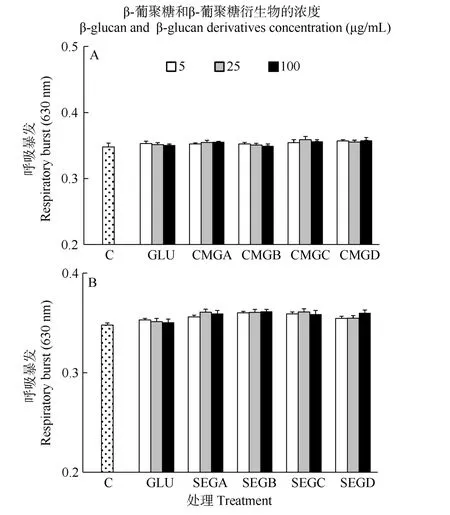
图 7 与葡聚糖(GLU)、羧甲基葡聚糖(CMG, 图 A)或磺乙基葡聚糖(SEG, 图B)孵育24h后凡纳滨对虾血细胞的呼吸暴发活力Fig. 7 Respiratory burst (RB) of haemocytes of L. vannamei, which were incubated 24h with β-glucan (GLU), carboxymethylglucan (CMG, Fig. A) or sulfoethylglcuan (SEG, Fig. B) at three concentrations
3 讨论
3.1 化学改性葡聚糖对凡纳滨对虾血细胞免疫反应的影响
本研究结果表明, 羧甲基葡聚糖和磺乙基葡聚糖在适宜的孵育时间内均能显著提高葡聚糖的免疫活性。研究表明, 化学改性法可以提高葡聚糖的生物活性, 如羧甲基化可以显著提高灵芝葡聚糖[18]和茯苓葡聚糖[19]的抗氧化力; 羧甲基化可以提高桑黄菌多糖[20]、虎奶菇葡聚糖[21,22]和灵芝多糖[23]的抗肿瘤能力; 硫酸化可以提高虎奶菇葡聚糖抗肿瘤能力[24]。Wang, et al.[19]认为, 衍生物生物活性的提高主要是因为化学改性方法提高了多糖的溶解性, 并改变了多糖的结构。Zhang, et al.[21—23]也发现具有较高生物活性的羧甲基葡聚糖比未衍生的葡聚糖具有更伸展的构象。
在本研究中, 酵母葡聚糖表现出了免疫增强作用缺失的现象, 即酵母葡聚糖组的血细胞酚氧化酶和呼吸暴发活力与对照组相比无显著差异。这与在仿刺参体腔细胞实验中的结果一致[14]。但是在 12h时, 酵母葡聚糖衍生物处理组并未表现出免疫增强作用缺失的现象, 在各添加浓度中其酚氧化酶和呼吸暴发活力仍然显著高于对照组。这说明化学改性不仅能够提高酵母葡聚糖的免疫增强作用, 而且能够延长其免疫作用的时间。这可能与溶解性的提高和结构的改变有关, 但具体的原因仍然需要进一步的分析。
3.2 葡聚糖衍生物的取代度对凡纳滨对虾血细胞免疫反应的影响
化学基团的引入会改变多糖分子内和分子间的氢键, 影响其电子排斥力, 从而使多糖分子的结构发生变化[23,25]。化学取代会造成多糖结构的改变,而改变的程度与取代度有关[22,23]。多糖的结构决定着多糖功能和生物活性[26]。取代度是决定多糖衍生物生物活性的最重要的因素之一[8]。但是, 关于葡聚糖衍生物的最适取代度尚无统一结论。Šandula, et al.[6]制备了不同取代度(0.56、0.75、0.89、1.08和1.15)的羧甲基葡聚糖, 并发现取代度为0.75的羧甲基葡聚糖在小鼠胸腺细胞的有丝分裂实验中显示出最高的活力, 而取代度大于 1的羧甲基葡聚糖则无生物活性。Bao, et al.[27]制备了7种羧甲基葡聚糖, 其取代度从0.17到1.44。与Šandula, et al.[6]的报道不同, Bao, et al.[27]发现最低取代度(小于0.28)的羧甲基葡聚糖表现出最高的生物活力。与Bao, et al.[27]类似, Zhang, et al.[23]也发现低取代度(0.38)的羧甲基葡聚糖比较高取代度(0.43和 0.54)的葡聚糖的抗肿瘤活力要高。对于磺乙基葡聚糖, 目前尚没有关于最适取代度的报道。但是, Jung, et al.[28]发现, 取代度对于硫酸化杏鲍菇葡聚糖的抗癌细胞生长的性能无显著影响。
本研究证明, 不同取代度的羧甲基葡聚糖和磺乙基葡聚糖处理组的血细胞酚氧化酶和呼吸暴发活力并无显著差别。这与Jung, et al.[28]所报道的结果类似, 表明取代度的不同并不能够显著影响原代培养凡纳滨对虾血细胞的免疫反应。
3.3 酵母葡聚糖的羧甲基和磺乙基衍生物对凡纳滨对虾血细胞免疫反应的影响的比较
羧甲基葡聚糖和磺乙基葡聚糖生物活性的不同与实验动物或细胞系、实验目的或监测指标有关。注射羧甲基葡聚糖和磺乙基葡聚糖都可以提高断奶仔猪嗜中性粒细胞还原酶的活力, 而羧甲基葡聚糖对还原酶活力的提高作用高于磺乙基葡聚糖[29]。但是, 当以小鼠胸腺细胞的有丝分裂实验进行二者比较时, 磺乙基葡聚糖比羧甲基葡聚糖表现出更高的生物活力[6]。Slameňová, et al.[30]也证明磺乙基葡聚糖保护 DNA不被过氧化氢氧化损坏的能力要高于羧甲基葡聚糖。但是, Mucksová, et al.[31]的研究表明,羧甲基葡聚糖和磺乙基葡聚糖对于小鼠腹膜黏附细胞的过氧化物酶活力和一氧化氮合成酶活力的提高能力并无显著差别。
在本研究中, 羧甲基酵母葡聚糖和磺乙基酵母葡聚糖处理组的血细胞酚氧化酶和呼吸暴发活力并无显著差异。这与Mucksová, et al.[31]的研究相似,表明酵母葡聚糖衍生物对于原代培养凡纳滨对虾血细胞的免疫促进作用不受本实验中所用衍生方法的影响。
总的来说, 研究证明羧甲基酵母葡聚糖和磺乙基酵母葡聚糖在适宜的孵育时间内均比酵母葡聚糖对凡纳滨对虾血细胞有更高的免疫促进作用。这种免疫促进作用不受本研究中所用衍生方法的影响, 每种衍生物的取代度之间也没有表现出显著的差异。
[1] Xie Z X, Xie L J, Pang Y S. Development of a multiplex real-time PCR assay for detection of WSSV and IHHNV [J]. Acta Hydrobiologica Sinica, 2009, 33(1): 22—27 [谢芝勋,谢丽基, 庞耀珊. WSSV和IHHNV二重实时荧光PCR检测方法的建立. 水生生物学报, 2009, 33(1): 22—27 ]
[2] Dalmo R A, Bøgwald J. β-glucans as conductors of immune symphonies [J]. Fish & Shellfish Immunology, 2008, 25(4): 384—396
[3] Sajeevan T P, Philip R, Bright Singh I S. Dose/frequency: A critical factor in the administration of glucan as immunostimulant to Indian white shrimp Fenneropenaeus indicus [J]. Aquaculture, 2009, 287(3): 248—252
[4] Sukumaran V, Lowman D W, Sajeevan T P, et al. Marine yeast glucans confer better protection than that of baker’s yeast in Penaeus monodon against white spot syndrome virus infection [J]. Aquaculture Research, 2009, 41(12), 1799—1805
[5] Šandula J, Machová E, Hfíbalová V. Mitogenic activity of particulate yeast β-(1-3)-D-glucan and its water-soluble derivatives [J]. International Journal of Biological Macromolecules, 1995, 17(6): 323—326
[6] Williams D L, McNamee R B, Jones E L, et al. A method for the solubilization of a (1-3)-β-D-glucan isolated from Saccharomyces cerevisiae [J]. Carbohydrate Research, 1991, 219(1): 203—213
[7] Wang Y F, Zhang L N, Li Y Q, et al. Correlation of structure to antitumor activities of five derivatives of a β-glucan from Poria cocos sclerotium [J]. Carbohydrate Research, 2004, 339(15): 2567—2574
[8] Zekovic D B, Kwiatkowski S, Vrvic M W, et al. Natural and modified (1-3)-β-D-glucans in health promotion and disease alleviation [J]. Critical Reviews in Biotechnology, 2005, 25(4): 205—230
[9] Suphantharika M, Khunrae P, Thanardkit P, et al. Preparation of spent brewer’s yeast β-glucans with a potential application as an immunostimulant for black tiger shrimp, Penaeus monodon [J]. Bioresource Technology, 2003, 88(1): 55—60
[10] Machová E, Kogan G, Alföldi J, et al. Enzymic and ultrasonic depolymerization of carboxymethylated β-1,3-D-glucans derived from Saccharomyces cerevisiae [J]. Journal of Applied Polymer Science, 1995, 55(5): 699—704
[11] Stojanović Ž, Jeremić K, Jovanović S, et al. A comparison of some methods for the determination of the degree of substitution of carboxymethyl starch [J]. Starch, 2005, 57(2): 79—83
[12] Zhang K, Brendler E, Gebauer K, et al. Synthesis and characterization of low sulfoethylated cellulose [J]. Carbohydrate Polymers, 2011, 83(2): 616—622
[13] Byun E H, Kim J H, Sung N Y, et al. Effects of gamma irradiation on the physical and structural properties of β-glucan [J]. Radiation Physics and Chemistry, 2008, 77(6): 781—786
[14] Zhou Y, Zhang W B, Mai K S, et al. TAT improves in vitro transportation of fortilin through midgut and into hemocytes of white shrimp Litopenaeus vannamei [J]. Journal of Ocean University of China, 2012, 11(2): 192—204
[15] Gu M, Ma H M, Mai K S, et al. Immune response of sea cucumber Apostichopus japonicus coelomocytes to several immunostimulants in vitro [J]. Aquaculture, 2010, 306(1): 49—56
[16] Song Y L, Hsieh Y T. Immunostimulation of tiger shrimp (Penaeus monodon) hemocytes for generation of microbiotical sunstances: analysis of reactive oxygen species [J]. Developmental & Comparative Immunology, 1994, 18(3): 201—209
[17] Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays [J]. Journal of Immunological Methods, 1983, 65(1): 55—63
[18] Xu J, Liu W, Yao W B, et al. Carboxymethylation of a polysaccharide extracted from Ganoderma lucidum enhances its antioxidant activities in vitro [J]. Carbohydrate Polymers, 2011, 78(2): 227—234
[19] Wang Y, Yu Y, Mao J. Carboxymethylated beta-glucan derived from Poria cocos with biological activities [J]. Journal of Agriculture and Food Chemistry, 2009, 57(1): 10913—10915
[20] Shin J Y, Lee S, Bae I Y, et al. Structural and biological study of carboxymethylated Phellinus linteus polysaccharides [J]. Journal of Agriculture and Food Chemistry, 2007, 55(9): 3368—3372
[21] Zhang M, Zhang L N, Cheung P C. Molecular mass and chain conformation of carboxymethylated derivatives of beta-glucan from sclerotia of Pleurotus tuber-regium [J]. Biopolymers, 68(1): 150—159
[22] Zhang M, Cheung P C K, Zhang L N, et al. Carboxymethylated β-glucans from mushroom sclerotium of Pleurotus tuber-regium as novel water-soluble anti-tumor agent [J]. Carbohydrate Polymers, 2004, 57(3): 319—325
[23] Zhang L N, Zhang M, Chen J H, et al. Solution properties of antitumor carboxymethylated derivatives of α-(1-3)-D-glucan from Ganoderma lucidum [J]. Chinese Journal of Polymer Science, 2001, 19(3): 283—289
[24] Tao Y, Zhang L, Cheung P C. Physicochemical properties and antitumor activities of water-soluble native and sulfated hyperbranched mushroom polysaccharides [J]. Carbohydrate Research, 2006, 341(13): 2261—2269
[25] Adachi Y, Ohno N, Ohsawa M, et al. Physicochemical properties and antitumor activities of chemically modified derivatives of antitumor glucan “Grifolan LE” from Grifola frondosa [J]. Chemical & Pharmaceutical Bulletin, 1989, 37(7): 1838—1843
[26] Bohn J A, BeMiller J N. (1-3)-β-D-glucans as biological response modifiers: a review of structure-functional activity relationships [J]. Carbohydrate Polymers, 1995, 28(1): 3—14
[27] Bao X F, Duan J Y, Fang X Y, et al. Chemical modifications of the (1→3)-α-d-glucan from spores of Ganoderma lucidum and investigation of their physicochemical properties and immunological activity [J]. Carbohydrate Research, 2001, 336(2): 127—140
[28] Jung H Y, Bae I Y, Lee S Y, et al. Effect of the degree of sulfation on the physicochemical and biological properties of Pleurotus eryngii polysaccharides [J]. Food Hydrocolloids, 2011, 25(5): 1291—1295
[29] Mucksová J, Babíček K, Placerova I. The immunomodulatory activity of soluble beta-1,3-D-glucan derivatives in piglets after weaning [J]. Czech Journal of Animal Science, 2001, 46(8): 339—347
[30] Slameňová D, Lábaj J, Križková L, et al. Protective effects of fungal (1→3)-β-d-glucan derivatives against oxidative DNA lesions in V79 hamster lung cells [J]. Cancer Letters, 2003, 198(2): 153—160
[31] Mucksová J, Babíček K, Pospíšil M. Particulate 1,3-β-D-glucan, carboxymethylglucan and sulfoethylglucan—Influence of their oral or intraperitoneal administration on immunological respondence of mice [J]. Folia Microbiologica, 2001, 46(6): 559—563
THE EFFECTS OF YEAST β-GLUCAN DERIVATIVES ON THE IMMUNE RESPONSES OF THE HAEMOCYTES OF WHITE SHRIMP LITOPENAEUS VANNAMEI
BAI Nan, GU Min, ZHANG Wen-Bing and MAI Kang-Sen
(Key Laboratory of Aquaculture Nutrition and Feeds (Ministry of Agriculture), Key Laboratory of Mariculture (Ministry of Education), Ocean University of China, Qingdao 266003, China)
Yeast β-glucan is a widely-used immunostimulant in aquaculture. However, the insolubility of β-glucan reduces its efficiency as an immunostimulant. In our study, carboxymethylglucan (CMG) and sulfoethylglcuan (SEG) were generated to increase the solubility of β-glucan. Both CMG-type and SEG-type of glucans had four derivatives with different degree of substitution (DS), so in total eight kinds of immunostimulants and β-glucan as the control were tested in our study. Each immunostimulant was added to the primary culture of the haemocytes of white shrimp Litopenaeus vannamei at different concentrations of 5, 25 and 100 μg/mL. With each concentration of every immunostimulant the primary culture was incubated for 6, 12 and 24 hours, before the haemocytes were sampled and their phenoloxidase (PO) activity and respiratory burst (RB) were assayed. After 6 hours, the PO activity of the haemoctyes incubated with all the eight β-glucan derivatives was significantly higher than those incubated with β-glucan control at the same concentration (P<0.05). The RB of the haemocytes incubated with 25 μg/mL of all the β-glucan derivatives was significantly higher than those incubated with 25 μg/mL of β-glucan (P<0.05). After 12 hours, PO activity and RB of the haemoctyes incubated with all the β-glucan derivatives were significantly higher than those with β-glucan (P<0.05). However, the eight β-glucan derivatives showed no significant difference among each other in their effects on the PO activity or RB of the haemoctyes (P>0.05). Our study revealed that the immune-enhancing effects of β-glucan derivatives were higher than β-glucan. However, there was no significant difference in immune-enhancing effects between CMG and SEG. The concentration of β-glucan derivatives could significantly influence their immune-enhancing effects, but DS did not affect the immune-enhancing effects of β-glucan derivatives.
Glucan derivative; Carboxymethylglucan; Sulfoethylglcuan; Litopenaeus vannamei; Cellculture
S963.73
A
1000-3207(2014)04-0642-09
10.7541/2014.91
2013-03-25;
2013-12-10
国家公益性行业(农业)科研专项经费(201103034)资助
白楠(1984—), 男, 河南郑州市人; 博士; 主要从事水生动物营养生理与免疫方面的研究。E-mail: bainan668@gmail.com
张文兵, 教授, E-mail: wzhang@ouc.edu.cn
