长江流域种群遗传多样性和遗传结构分析
2014-03-29启何舜平
范 启何舜平
(1. 中国科学院水生生物研究所, 水生生物多样性与保护重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
范 启1,2何舜平1
(1. 中国科学院水生生物研究所, 水生生物多样性与保护重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
鱼类群体遗传学研究主要集中在经济鱼类或濒危物种, 然而一些经济价值较低的物种的遗传结构却甚少关注。因此, 研究选择了经济价值较低的(Hemiculter leucisculus), 共计323尾个体分别来自13个长江流域及其附属湖泊的自然群体。通过扩增线粒体DNA Cytb基因序列片段(1100 bp), 以探讨种群遗传结构和遗传多样性。遗传多样性分析呈现出高单倍型多样性和高核苷酸多样性的模式, 表明该种群在长江流域较为稳定。另外, 基于线粒体细胞色素b基因的系统发育分析, 显示有5个线粒体谱系(谱系A-F)组成。中性检验和核苷酸错配分布分析均显示谱系A、B、E、F曾经历过种群扩张, 并且呈现从上游向中游扩张的规律。谱系间较高且显著的遗传分化指数和显著的系统进化关系, 均表明谱系 A-F之间存在明显的遗传分化,暗示长江流域可能至少存在4个不同线粒体DNA水平上的种。种群的遗传结构和多样性可能受到了长江流域特定格局的影响。
; 遗传结构; 细胞色素b基因; 遗传多样性; 长江流域
1 材料与方法
1.1 样本鉴定与收集
1.2 DNA提取、扩增和测序
DNA提取的方法是, 取其左侧偶鳍或者背侧肌肉, 置于95%酒精中, 保存于4℃冰箱中备用。采用标准的酚-氯仿法提取基因组DNA。Cyt b基因扩增的通用引物序列: L14724 (5′-GACTTGAAAAA CCACCGTTG-3′), H15915 (5′-CTCCGATCTCCGGA TTACAAGAC-3′)。PCR反应总体积为30 μL, 其中含60 ng基因组DNA, 10 ×缓冲液3 μL, dNTP(各2.5 mmol/L)1.5 μL, 正反向引物(10 mmol/L)各1.5 μL, Taq聚合酶1.5 U, 最后补足灭菌双蒸水至终体积。PCR反应条件为: 94℃预变性3min, 然后30个循环(包括94℃变性1min, 50℃退火1min, 72℃延伸1min),最后在72℃延伸10min。PCR产物使用1%的琼脂糖凝胶电泳检测完整性。PCR产物经过纯化, 送商业测序公司测序, 测序引物与PCR引物相同。
1.3 数据统计与分析
在SeqMan Ⅱ 程序中手工校正DNA序列, 序列的多重比对在Clustal W软件中进行。用MEGA4.0软件计算样品之间的遗传距离。
用 MEGA5.0构建所有序列的和单倍型的邻接树(NJ)。 选择翘嘴 鲌(Culter alburnus)作为外类群。
单倍型之间的进化关系采用系统发育网络分析,在network4.611软件中完成。用dnasp5.10.0.1软件统计群体单倍型多样性(Hd)和核苷酸多样性(π); 并用 ARLEQUIN3.0软件包中的 AMOVA方法(Analysis of molecular variance)估计可能的群体遗传结构和遗传变异的地理分布。AMOVA根据单倍型的频率及单倍型序列之间的差异, 来检验不同等级水平(地理群体、组内不同地理群体之间、不同组间)的遗传结构在变异参数上是否存在显著差异。其中, 使组间差异(Fct值为衡量标准)达到最大的划分方式是群体遗传变异最为合理的分布格局。本研究将323个样本分别按地理分布、系统树识别的进化谱系划分为不同的组, 用于估计群体结构及遗传变异的地理分布。利用ARLEQUIN 3.0软件包中的蒙特尔测验(Mantel test)(1000置换)进行IBD (Isolation by distance), 估计地理距离矩阵与遗传分化矩阵的相关系数, 地理距离可以大致通过取样点的经纬度坐标(表1)来测定。
联合使用Fu’Fs检验、Tajima’D中性检验和核苷酸不配对分布(Mismatch distribution)推断群体是否发生扩张的历史。一般地, 群体如果遵守严格分子钟模式, 则可以用T群体的扩张时间(T = τ/2u)进行估算, τ是根据广义非线性最小二乘法所估计的群体扩张参数; u 依据 u = 2×µ×k 计算, 其中 µ 是基因序列每一世代的突变率, k是分析序列的碱基数。
2 结果
2.1 遗传多样性
对来自长江流域及其周围湖泊的323尾个体的Cyt b序列进行排序较对后, 得到长为1110 bp的细胞色素b序列片段。GenBank登录号为: KF020899-KF021222。
经过分析, 研究的所有序列中, A、T、C、G四种碱基平均含量分别为28.0%、28.2%、28.4%、15.4%, A+T的含量为 56.2%, 明显高于 G+C的含量43.8%。323条序列检测到175个单倍型, 变异位点244个, 约占全序列的 21.98%, 其中单核苷酸变异位点56个, 简约信息位点有188个。这244 个突变位点, 有18个为非同义突变, 226个为同义突变。突变方式检验结果显示, 转换位点(Ts)有 35个, 颠换位点(Tv)2个, 平均转换和颠换比(Ts/Tv)为 19.50。323条Cyt b序列定义了175个单倍型。
遗传多样性分析结果如表1 所示, 所有样本平均单倍型多样性(h)为0.9789±0.0041, 核苷酸多样性(π)为0.03289±0.00224。在所有独立种群中, 嘉鱼群体单倍型多样性与核苷酸多样性均为最高(1.000± 0.126、0.0618±0.0158), 合江群体则最低(0.400±0.237、0.0004±0.0002)。
2.2 群体遗传分化
表1 长江中13个群体代码、样本量及遗传多样性Tab. 1 Codes, sample numbers and genetic diversity of 13 Hemiculter leucisculus populations in the Yangtze River
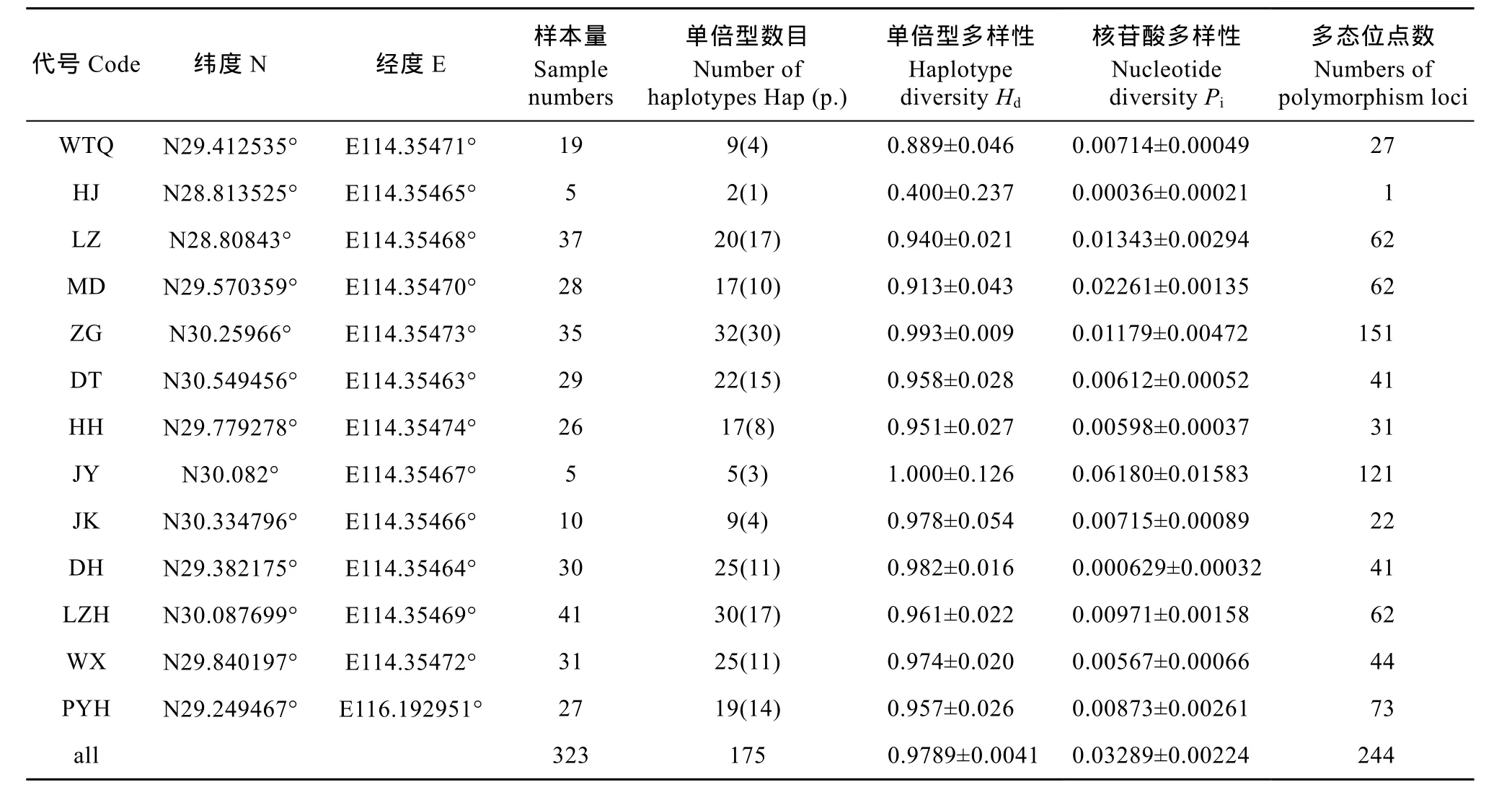
表1 长江中13个群体代码、样本量及遗传多样性Tab. 1 Codes, sample numbers and genetic diversity of 13 Hemiculter leucisculus populations in the Yangtze River
代号Code 纬度N 经度E样本量Sample numbers单倍型数目Number of haplotypes Hap (p.)单倍型多样性Haplotype diversity HdWTQ N29.412535° E114.35471° 19 9(4) 0.889±0.046 HJ N28.813525° E114.35465° 5 2(1) 0.400±0.237 LZ N28.80843° E114.35468° 37 20(17) 0.940±0.021 MD N29.570359° E114.35470° 28 17(10) 0.913±0.043 ZG N30.25966° E114.35473° 35 32(30) 0.993±0.009 DT N30.549456° E114.35463° 29 22(15) 0.958±0.028 HH N29.779278° E114.35474° 26 17(8) 0.951±0.027 JY N30.082° E114.35467° 5 5(3) 1.000±0.126 JK N30.334796° E114.35466° 10 9(4) 0.978±0.054 DH N29.382175° E114.35464° 30 25(11) 0.982±0.016 LZH N30.087699° E114.35469° 41 30(17) 0.961±0.022 WX N29.840197° E114.35472° 31 25(11) 0.974±0.020 PYH N29.249467° E116.192951° 27 19(14) 0.957±0.026 all 323 175 0.9789±0.0041核苷酸多样性Nucleotide diversity Pi多态位点数Numbers of polymorphism loci 0.00714±0.00049 27 0.00036±0.00021 1 0.01343±0.00294 62 0.02261±0.00135 62 0.01179±0.00472 151 0.00612±0.00052 41 0.00598±0.00037 31 0.06180±0.01583 121 0.00715±0.00089 22 0.000629±0.00032 41 0.00971±0.00158 62 0.00567±0.00066 44 0.00873±0.00261 73 0.03289±0.00224 244

表2 ?13个群体的遗传距离(对角线下)和遗传分化指数(Fst)(对角线上)Tab. 2 Pairwise genetic distances (below diagonal) and fixation index (above diagonal) among 13 populations of Hemiculter leucisculus from the middle and upper Yangtze River drainage
表3 利用Arlequin 软件计算的13个地理群体间基因流Nm值Tab.3 Nmvalues among 13 populations of Hemiculter leucisculus analyzed by Arlequin3.0

表3 利用Arlequin 软件计算的13个地理群体间基因流Nm值Tab.3 Nmvalues among 13 populations of Hemiculter leucisculus analyzed by Arlequin3.0
群体Population WTQ HJ LZ MD ZG DT HH JY JK DH LZH WX PYH WTQ —HJ 0.067 —LZ 0.074 –45.372 —MD 6.023 0.239 0.200 —ZG 0.072 37.174 –187.969 0.200 —DT 1.589 0.945 0.684 2.587 0.695 —HH 0.061 0.064 0.055 0.079 0.055 0.109 —JY 0.112 5.057 6.274 0.248 21.368 0.919 0.064 —JK 0.360 0.412 0.212 0.241 0.213 0.482 0.772 0.266 —DH 0.068 4.558 9.159 0.194 505.051 0.673 0.053 –290.697 0.199 —LZH 0.068 53.475 –33.400 0.200 –35.997 0.698 0.055 10.091 0.222 25.038 —WX 0.124 14.814 13.089 0.232 31.606 0.771 0.064 17.966 0.239 24.213 24.331 —PYH 0.082 3.843 3.496 0.231 2.757 0.833 0.061 2.655 0.282 1.969 2.909 3.280 —

表4 六个谱系个体来源数目统计Tab. 4 Statistics of the individuals according to the sources for the 6 lineages
表5群体分子变异分析结果Tab. 5 Analysis of molecular variance (AMOVA) for the Hemiculter leucisculus populations

表5群体分子变异分析结果Tab. 5 Analysis of molecular variance (AMOVA) for the Hemiculter leucisculus populations
分组Groups θSTθCTθsc组间% Among groups湖泊/非湖泊Lake/Non-lake 0.72328 0.14672 0.67569 14.67上下游Upstrem/Downstream 0.74581 0.29695 0.63844 29.7线粒体DNA谱系mtDNA lineage 0.92258 0.56818 0.92258 56.82群体Population 0.70370 — — 70.37种群内% Within populations P 27.67 0.07527 25.42 0.00587 7.74 0.25220 29.63 0.00000
以翘嘴 鲌(Culter alburnus)为外类群, 采用 NJ法构建了单倍型关系树(图1), 显示了175个单倍型之间的相互关系。H3、H50、H72、H101、H98、H135、H146为主要的单倍型, 具有较大的频率或处在网络中的辐射中心。多个单倍型通过短枝与之相连, 表明近期突变形成的单倍型。单倍型进化网络图(图2)与单倍型系统树的拓扑结构大体相一致, 形成了5个明显的谱系。各类群都含有自己特有的单倍型。其中单倍型H3、H45、H50、H40、H22、H45、H98、H135被多个群体共享, 其中出现频率最高的是单倍型(H3), 被38 个体, 11个群体共享。

图 1 基于细胞色素b基因序列片段的邻接树Fig. 1 Phylogenetic relationships of all individuals based on the NJ tree analysis of the Cyt b gene fragment

图2单倍型中值连接网络分析图Fig. 2 The geographical distribution of 175 haplotypes of Hemiculter leucisculus analyzed by median-joining network using NETWORK 4.6
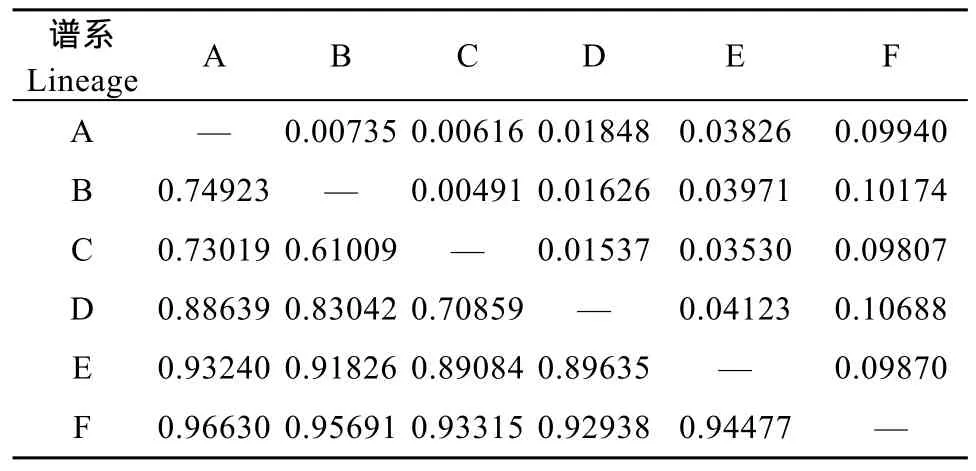
表 6 六个谱系间的遗传距离(对角线上)和遗传分化指数(Fst) (对角线下)Tab.6 6 pairwise genetic distances (below diagonal) and fixation index (above diagonal) among 6 lineages of Hemiculter leucisculus from the middle and upper Yangtze River drainage
2.3 种群扩张
用 Fu’Fs法对所有样品进行中性检验, 结果未显示显著负值, 说明群体历史上没有明显扩张。但是, 根据图1显示的5个谱系分别进行中性检验,其中4个(A、B、E、F)的Fu’Fs出现显著负值。采用碱基错配分布分析, A、B、E、F这4个谱系呈明显单峰。暗示这4个谱系的群体在历史上发生过种群扩张[5]。以硬骨鱼类Cyt b 突变速率0.65%[6,7]为基准, 按世代为2年, 计算出这4个谱系的群体扩张时间(图3)。
3 讨论
遗传多样性、生物多样性和生态系统多样性是多样性三个层次的概括, 其中遗传多样性是物种多样性和生态系统多样性的基础, 也是生物多样性的核心组成部分。遗传多样性是指生物种内的遗传变异度, 是生物适应环境与进化的基石[8]。单倍型多样性指数(h)、核苷酸多样性指数(π)值是衡量一个物种群体多样性的两个非常重要的指标[9]。
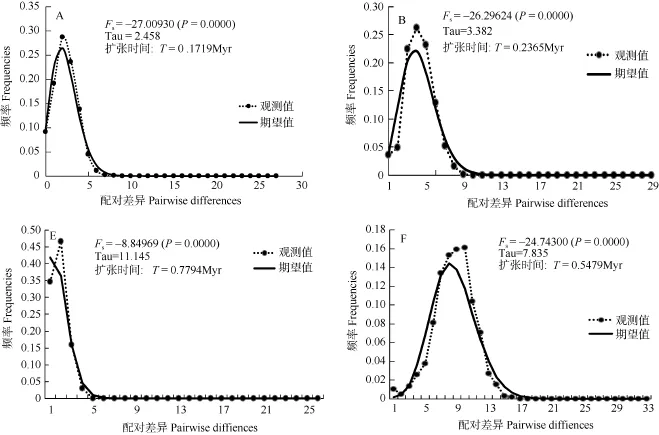
图 3 四个谱系错配分布图呈现单峰及Fu’Fs检验结果、种群扩张时间实线显示的是期望值(虚线显示的是观测值)Fig. 3 Mismatch distributions of Hemiculter leucisculus mtDNA lineages with unimodal distributions (A, B, E and F) (Solid lines show the simulated values and dash lines show the observed values)
13个种群AMOVA分析显示, 大多数上游群体间以及上游群体与中游群体间的分化系数均大于0.25, 各群体之间缺乏明显的基因交流, 表明种群间的遗传分化很大[14]。仅大多数中游类群间遗传分化系数小于 0.05, 表明分化程度较低。上游群体的净遗传距离明显比中游群体的净遗传距离大。中游群体间净遗传距离小于 0.00899, 推测历史上存在长江中游的湖泊与长江的连通, 或者湖泊之间以前存在流通, 导致长江中游的群体间存在较高水平的基因交流, 从而显现单倍型比较丰富, 遗传距离较小的现象, 这也可能与全新世以来, 长江中下游频繁发洪水泛滥, 长江两岸湖沼发育, 导致种群之间的交流机会增多。
基于NJ树和单倍型网络, 可以将323个体分为6个大的谱系, 谱系A、B、E、F用Fu’Fs中性检验显著偏离中性突变, 被认为群体在历史上有扩张的迹象[15]。用323 个个体按谱系分组, 分别对A、B, C、D、E、F作错配分布图(图3) , 除了谱系C、D, 谱系 A、B、E、F均呈单峰分布, 表明群体存在近期扩张[10]。谱系E的扩张时间, 大致和三峡形成贯通的时间吻合(70万—100万年前)[16,17], 暗示合江泸州木洞群体扩张与三峡形成这一历史地理事件有关。谱系A的扩张时间, 这一时期刚好处在第四纪冰期的庐山亚冰期(20万—23万年前)与大理亚冰期(1万—11万年前)之间的间冰期[16,17], 间冰期相对于冰期而言, 气候相对温暖, 总体上, 冰期间冰期温度相差约12℃[18]。不仅有利于物种生存, 也有助于物种从冰期的“避难所”向外扩散, 为发展不同的种群储备; 逐步建立起来的种群在随后的进化过程中逐渐产生不同的周单倍型, 形成现今的遗传结构模式。谱系B扩张可能是导致群体单倍型多样度高而核苷酸多样度低的重要原因。另外, 谱系 E主要是包括泸州群体和木洞群体, 谱系 F主要是秭归群体, 而谱系 A主要是长江中游及毗邻湖泊群体, 谱系B主要是中游群体和少量五通桥个体, 主要由泸州及木洞群体组成的谱系 E最先扩张, 而后是秭归群体组成的谱系F扩张, 然后是谱系B, 再就是谱系A扩张, 呈现出由上游群体向中游扩散的规律。在单倍型网络图中, 五通桥群体的单倍型也是处在网络的中心位置, 但是祖先单倍型缺失。推测长江流域的古老单倍型应该在长江上游附近, 也支持可能从上游向中游扩张。
从图1的拓扑结构、群体间的和谱系间的遗传距离和遗传分化指数(表 2,6)来看, 长江中上游mtDNA谱系产生了明显的遗传结构分化, 较高的Fst表明谱系间的遗传分化程度很高[19]。另外, 根据一些关于中国鲤形目鱼类的研究, 发现广布种可能不是一个单系类群[20]。整体的遗传距离达到3.531%,暗示条可能存在物种分化, 当前的物种数目很可能被低估, 如长江流域的宽鳍、马口鱼均存在隐存种[21,22]。的遗传结构和地理分隔值得更进一步地研究, 可能还有更多的谱系更多物种存在。根据目前的研究可能存在4个不同的种。从图3来看, E谱系主要是合江、泸州、木洞群体为代表, F谱系主要是秭归群体为代表, 谱系 A、B谱系主要是长江中游群体, 且互相掺杂, 相似的遗传分隔与共同的历史因素有关, 如河流形成。在长江中游, 独特地理湖泊格局暗示, 湖泊分布格局可能重塑(Reshape)种内的关系相近的群体遗传结构, 并反映出不同的假想的时间框架。另外, 长江中游和上游分化明显, 也可能是与上中游的差异有关, 因为长江上游和中游曾经是两条独立的河流[23]。为了进一步证实以上观点, 需要更多的样本量, 另外增加采样点予以补充。另外,群体食性和繁殖能力强, 能很好地适应长江流域复杂生境, 呈现复杂遗传多样性和结构,更多的详细机理还有待进一步地研究。
[1] Chen Y Y. Fauna Sinica: Osteichthyes (Cypriniformes Ⅲ ). 1st edition [M]. Beijing: Science Press. 1998, 163—171 [陈宜瑜. 中国动物志: 硬骨鱼纲. 第一版. 北京: 科学出版社. 1998, 163—171]
[2] Cao Y P, Wen Z G. The biology of Hemiculuter leucisculus in Baiyangdian Lake [J]. Journal of Hebei University, 1996, 16: 27—33 [曹玉萍, 温振刚. 白洋淀白鲦鱼的生物学研究.河北大学学报, 1996, 16: 27—30]
[3] Zeng G Q, Lü Y P, Huang P P, et al. Analysis of flesh content and nutritional component in the muscle of Hemiculter leucisculus Basilewksy and Sinibrama macrops Gunther [J]. Journal of Wenzhou University, 2012, 33: 1—7 [曾国权, 吕耀平, 黄佩佩, 等.条、大眼华鳊含肉率和肌肉营养成分分析 温州大学学报, 2012, 33: 1—7]
[4] Wright S. The genetic structure of population structure [J]. Annals of Eugenics, 1951, 323—354
[5] Barluenga M, Meyer A. Old fish in a young lake: stone loach (Pisces: Barbatula barbatula) populations in Lake Constance are genetically isolated by distance [J]. Molecular Ecology, 2005, 14: 1229—1239
[6] Avise J C, Walker D, Johns G C. Speciation durations and Pleistocene effects on vertebrate phylogeography [J]. Proceedings of the Royal Society B-Biological Sciences, 1998, 265: 1707—1712
[7] Zardoya R, Doadrio I. Molecular evidence on the evolutionary and biogeographical patterns of European cyprinids [J]. Journal of Molecular Evolution, 1999, 49: 227—237
[8] Avise J C, Hamrick J L. Conservation Genetics, Case Histories from Nature [M]. New York: Chapman and Hall. 1996, 160—189
[9] Vrijenhoek R C. Genetic Diversity and Fitness in Small Populations [J]. Conservation Genetics, 1994, 68: 37—53
[10] Yuan X P, Yan L, Xu S Y, et al. Genetic diversity of bronze gedgeon (Coreius heterodon) and largemouth bronze (C. guichenoti) in Yangtze River Basin [J]. Journal of Fishery Sciences of China, 2008, 15: 377—385 [袁希平, 严莉, 徐树英, 等. 长江流域铜鱼和圆口铜鱼的遗传多样性. 中国水产科学, 2008, 15: 377—385]
[11] Grant W S, Bowen B W. Shallow population histories in deep evolutionary lineages of marine fishes: Insights from sardines and anchovies and lessons for conservation [J]. Journal of Heredity, 1998, 89: 415—426
[12] Yu F Y. Study on genetic diversity of Siniperca chuatisi/kneri complex in the Yangtze River [D]. JinanUniversity Master’s Degree Thesis. Guangzhou. 2011 [余帆洋. 长江鳜/大眼鳜复合种的遗传多样性研究. 暨南大学硕士学位论文. 广州. 2011]
[13] Zhou L. Studies on genetic diversity and Structure of mtDNA control region of Mystus macropterus Bleeker [D]. Southwest University Master’s Degree Thesis Chongqing. 2008 [周丽. 鳠大鳍 (Mystus macropterus Bleeker)遗传多样性及其线粒体控制区结构的研究. 西南大学硕士学位论文. 重庆, 2008]
[14] Wright S. Evolution and the Genetics of Populations: Variability Within and Among Natural Populations [M]. Chicago: University of Chicago Press. 1984, 590
[15] Tajima F. DNA polymorphism in a subdivided population: the expected number of segregating sites in the twosubpopulation model [J]. Genetics, 1989, 229—240
[16] Tang G Z, Tao M. Discussion on relationship between the middle pleistocene glaciation and formation of the Yangtze Gorges [J]. Geology and Mineral Resources of South China, 1997, 10—16 [唐贵智, 陶明. 论长江三峡形成与中更新世大姑冰期的关系. 华南地质与矿产, 1997, 10—16]
[17] Xiang F, Zhu L D, Wang C S, et al. Character of Basaltic Gravels in Quaternary Sediments in Yichang Area and Its Relationship with Formation of Yangtze Three Gorges [J]. Journal of Earth Sciences and Environment, 2006, 28: 6—11 [向芳, 朱利东, 王成善, 等. 宜昌地区第四纪沉积物中玄武岩砾石特征及其与长江三峡贯通的关系. 地球科学与环境科学报, 2006, 28: 6—11]
[18] Liu J L, Ni Y Y, Chu G Q. Main paleoclimatic events in the quaternary [J]. Quaternary Science, 2001, 21: 239—248 [刘嘉麟, 倪云燕, 储国强. 第四纪的主要气候事件. 第四纪研究, 2001, 21: 239—248]
[19] Wright S. The Interpretation of Population-Structure by F-Statistics with Special Regard to Systems of Mating [J]. Evolution, 1965, 19: 395—420
[20] Su R F, Yang J X, Cui G H. The nominal invalidity of the cyprinid genus, Parasinilabeo, with descriptions of a new genus and species [J]. Zoological Studies, 2001, 40: 134—140
[21] Perdices A, Cunha C, Coelho M M. Phylogenetic structure of Zacco platypus (Teleostei, Cyprinidae) populations on the upper and middle Chang-Jiang (= Yangtze) drainage inferred from cytochrome b sequences [J]. Molecular Phylogenetics and Evolution, 2004, 31: 192—203
[22] Perdices A, Cunha C, Coelho M M. Mitochondrial diversity of Opsariichthys bidens (Teleostei, Cyprinidae) in three Chinese drainages [J]. Molecular Phylogenetics and Evolution, 2005, 37: 920—927
[23] Yang L, Mayden R L, He S P. Population genetic structure and geographical differentiation of the Chinese catfish Hemibagrus macropterus (Siluriformes, Bagridae): Evidence for altered drainage patterns [J]. Molecular Phylogenetics and Evolution, 2009, 51: 405—411
THE PATTERN OF UPPER AND MIDDLE YANGTZE DRAINAGES SHAPES THE GENETIC STRUCTURE AND DIVERSITY OF HEMICULTER LEUCISCULUS REVEALED BY MITOCHONDRIAL DNA LOCUS
FAN Qi1,2and HE Shun-Ping1
(1. The Key Laboratory of Aquatic Biodiversity and Conservation of Chinese Academy of Science, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Fish population genetics have mainly focused on economic fish or endangered species, while the knowledge on genetic structure of the fish with low economic value is limited. In the present study, we collected a total of 323 sharpbelly (Hemiculter leucisculus) individuals from 13 populations in Yangtze River Basin and the affiliated lakes to evaluate their genetic diversity and population structure by amplifying the mitochondrial DNA Cyt b gene fragments (1100 bp). Genetic diversity analysis showed the pattern of high haplotype diversity and high nucleotide diversity, suggesting that the populations in the Yangtze River Basin were fairly stable. In addition, based on mitochondrial cytochrome b gene phylogenetic analysis, there were five mitochondrial lineages (lineage A-F). The neutral test of Fu’Fs and mismatch distributions with negative Tajima’s D values indicated that the lineage A, B, E, and F underwent population expansion, and the expansion was from the upper section to the middle section of the Yangtze drainage. Fstand phylogenetic analysis and the significant divergence among lineages A-F implied that there are at least four different species on the level of mitochondrial DNA in the Yangtze River Basin. The population genetic structure and diversity of Hemiculter leucisculus may reflect the distribution pattern in Yangtze River Basin.
Hemiculter leucisculus; Genetic structure; Cyt b; Genetic diversity; Yangtze drainage
Q346+.5
A
1000-3207(2014)04-0627-9
10.7541/2014.89
2013-05-08;
2013-12-01
重大基金项目(Y11321-1-101)资助
范启(1986— ), 男, 湖北浠水人; 硕士研究生; 主要从事种群遗传研究。E-mail: fanqi0.618@163.com
何舜平, E-mail: clad@ihb.ac.cn
