何首乌R50部位诱导人结直肠癌细胞凋亡的作用机制
2014-03-23杨红莉李瑞婧李子木张瑞晨李宝赛孙震晓
杨红莉,李瑞婧,李子木,张瑞晨,李宝赛,孙震晓
(北京中医药大学中药学院生物制药系,北京 100102)
何首乌R50部位诱导人结直肠癌细胞凋亡的作用机制
杨红莉*,李瑞婧*,李子木,张瑞晨,李宝赛,孙震晓
(北京中医药大学中药学院生物制药系,北京 100102)
目的考察何首乌R50部位对体外培养的人结直肠癌细胞活性的影响,探究其对人结直肠癌细胞周期和凋亡的作用。方法体外培养人结直肠癌HT29和HCT116细胞24 h,加入何首乌R50部位50~300 m g·L-1继续培养24,48和72 h,MTT法检测细胞存活率;何首乌R50部位50,100和200 mg·L-1分别与HCT116和HT29细胞作用48 h,流式细胞术检测细胞周期和细胞凋亡;何首乌R50部位100 mg·L-1与HCT116和HT29细胞作用48 h,Giemsa染色检测细胞及核的变化,Western蛋白质印迹法检测胱天蛋白酶原3和Pdcd4蛋白的表达。结果何首乌R50部位对HCT116和HT29细胞存活抑制作用显著,呈时间和浓度依赖性;不同浓度何首乌R50部位与HCT116和HT29细胞作用48 h后,对细胞周期的影响均不显著;但随着何首乌R50部位浓度的增加,细胞凋亡率明显增加,200 mg·L-1组HCT116细胞凋亡率由对照组的(5.85±0.35)%增加至(27.65±1.62)%(P<0.05),HT29细胞的凋亡率由(10.25±0.77)%增加至(35.35±0.35)%(P<0.05);何首乌R50部位100 m g·L-1作用HCT116和HT29细胞48 h,Giem sa染色可见部分细胞出现细胞固缩、核染色质凝集、凋亡小体形成等细胞凋亡形态;胱天蛋白酶原3和Pdcd4蛋白表达均下降。结论何首乌R50部位主要通过诱导人结直肠癌HCT116和HT29细胞凋亡而使其存活率下降,并通过胱天蛋白酶依赖信号通路诱导人结直肠癌细胞凋亡,Pdcd4蛋白表达下调可能与其相关。
何首乌R50部位;HCT116细胞;HT29细胞;细胞凋亡;胱天蛋白酶原3;Pdcd4
DO l:10.3867/j.issn.1000-3002.2014.01.008
何首乌为蓼科植物何首乌(Polygonum multiflorum Thunb.)的干燥块根,中医临床应用十分广泛。我国药典记载,何首乌味苦、甘、涩,性微温,归肝、心、肾经,有消痈、解毒、截疟和润肠通便的功效[1]。何首乌的化学成分以二苯乙烯苷类、蒽醌类、磷脂类和多糖类化合物为主[2],近年药理学研究发现,何首乌及其炮制品具有抗衰老及神经保护、降血脂及抗动脉粥样硬化、免疫调节、乌发生发等药理作用[3]。有关何首乌中某些单体成分如大黄素等的抗肿瘤作用虽有一些研究[4],但这些成分存在于多种药材中,并非何首乌特有,而且大黄素等游离蒽醌在相同剂量范围下对正常细胞也有很大毒性,不是一个很好的待选药物[5];近年虽有零星报道何首乌总提物[6]及何首乌主要成分二苯乙烯苷[7]有抗肿瘤活性,但研究并不深入,而何首乌R50部位是本研究团队对何首乌总提物的逐级分离筛选后获得的对肿瘤细胞有显著杀伤活性而对正常细胞生长没有明显影响的一个分离部位[8]。
结直肠癌是一种常见的胃肠道肿瘤,其发病率居全球常见恶性肿瘤的第3位。虽已有新药应用于临床,但新药仍存在较强的毒性作用,因而进一步寻找低毒有效的抗结直肠癌药物成分或其前体势在必行。本研究主要观察何首乌R50部位对人结直肠癌HCT116和HT29细胞存活和凋亡的影响,初步探讨其诱导细胞凋亡的可能机制。
1 材料与方法
1.1 药物、试剂和主要仪器
实验所用何首乌药材购自北京同仁堂饮片有限责任公司(批号为701001037),产地为湖北,由北京中医药大学中药学院中药生药系张贵君教授鉴定。
RPMI1640培养基、胎牛血清、青霉素、链霉素,购自美国Gibco公司;胰蛋白酶、去甲斑蝥素(norcantharidin,NCTD,母液浓度10 g·L-1)、碘化丙啶(propidium iodide,PI)、二甲亚砜(dim ethyl sulfoxide,DMSO)及四甲基偶氮唑蓝〔3-(4,5-dim ethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT〕购自美国Sigma公司;RNA酶A购自德国Merck公司;BCA蛋白测定试剂盒和ECL试剂购自美国Therm o Scientific公司;AnnexinⅤ-FITC细胞凋亡检测试剂盒购自中国南京凯基生物公司;小鼠抗人胱天蛋白酶3(caspase-3)抗体购自美国Cell Signaling Technology公司;兔抗人Pdcd4抗体为杨新盛博士(美国肯塔基大学癌症研究中心)惠赠。超低温冰箱,美国Revco公司;高速台式离心机,美国Sigma公司;倒置相差显微镜,日本Nikon公司;CO2恒温培养箱,日本Sanyo公司;纯水仪,美国Millipore公司;酶标仪,美国Molecular Devices公司;流式细胞仪,美国Beckman Coulter公司;渗压仪,美国Cwescor公司;PAC3000型电泳仪、电转仪,美国Bio-Rad公司。
1.2 细胞株来源及培养
人结直肠癌细胞系HCT116和HT29,购自中国医学科学院细胞库,均为北京中医药大学中药学院生物制药系保存。实验所用人肿瘤细胞系均在含10%胎牛血清和1%双抗的RPMI 1640完全培养基于37℃,5%CO2及饱和湿度条件下进行常规培养,所有实验均在细胞对数生长期进行。
1.3 何首乌R50部位的获取
[5,8],取上述批号的何首乌饮片200 g,用70%乙醇提取两次,第1次加10倍量溶剂,提取2 h,第2次加8倍量溶剂,提取1.5 h。合并2次乙醇提取液,回收溶剂至无醇味,加水分散,通过AB-8型大孔树脂吸附,先用水洗脱,再用50%乙醇洗脱大孔树脂柱后收集洗脱液,减压回收溶剂,残留物减压干燥,得何首乌50%乙醇洗脱物(何首乌R50部位),分装后-20℃存放。
1.4 MTT比色法检测细胞存活
取处于对数生长期的两种人结直肠癌细胞消化计数后接种于96孔板中,密度为每孔2.0×103;培养24 h后弃去培养液,分别加入每孔200μL下述各培养液:RPMI1640完全培养基(阴性对照组);终浓度为50,75,100,150,200和300 m g·L-1的何首乌R50部位;NCTD(终浓度10 m g·L-1,阳性对照组)。5%CO2,37℃下培养0,24,48和72 h后,弃去培养液,每孔加入100μl的MTT工作液,继续培养4 h,弃上清,加入150μL DMSO,震荡10 m in,酶标仪上550 nm波长处读取吸光度(A)值[9]。计算其抑制率(%)=(1-何首乌R50部位作用组/阴性对照组)×100%。
1.5 流式细胞仪检测细胞周期
参考文献[8],取对数生长期的人结直肠癌HCT116和HT29细胞接种于直径10 cm的细胞培养皿。培养24 h后加何首乌R50部位50,100和200 m g·L-1处理48 h,收集全细胞,PBS洗1遍,70%冷乙醇重悬,4℃固定过夜;离心后弃去固定液,用适量PBS重悬,加入RNA酶A,37℃水浴45 m in后加入PI染液4℃避光染色30 m in。最后用流式细胞仪检测1×104细胞,上机前进行常规光路校准,ModFit LT软件分析细胞周期结果。
1.6 细胞形态学观察
取对数生长期的人结直肠癌HCT116和HT29细胞,分别给予何首乌R50部位100 mg·L-1处理48 h,胰酶消化后PBS洗2次,最后PBS重悬后离心涂片,乙醇固定,Giemsa染色观察细胞及其核的变化。
1.7 AnnexinⅤ/Pl双染法检测细胞凋亡
参考文献[10],取对数生长期的人结直肠癌HCT116和HT29细胞接种于直径10 cm的细胞培养皿。培养24 h后加何首乌R50部位50,100和200 mg·L-1处理48 h,分别收集正常对照组和何首乌R50部位各组全细胞,4℃,800×g离心5 m in后,弃上清。加入1 m L预冷的PBS,4℃,800×g离心5 m in后,弃上清,重复洗2次。按照细胞凋亡检测试剂盒使用说明书操作:将细胞重悬于500μL结合缓冲液,分别加入5μL AnnexinⅤ-FITC和5μL PI轻轻混匀后,避光室温反应15 m in,上机前进行常规光路校准,流式细胞仪检测,BD FACS Diva software v6.1.3软件分析细胞凋亡结果。
1.8 Wes tern蛋白质印迹法检测胱天蛋白酶原3和Pdcd4蛋白的表达
处于对数生长期的HCT116和HT29细胞经何首乌R50部位100 mg·L-1处理48 h,分别收集对照组和处理组细胞,PBS洗2次,加入细胞裂解液〔Tris-HCl(pH 8.0),50μmol·L-1;NP-40,1%;NaCl,150μmol·L-1;SDS,0.1%,Protease Inhibitor Cocktail SetⅢ,1%〕破碎细胞,收集蛋白,BCA法测定蛋白样品的含量。50μg细胞总蛋白热变性后,SDS-PAGE电泳(5%浓缩胶,12%分离胶),硝酸纤维素膜电转1 h,5%脱脂奶粉封闭1.5 h,加小鼠抗人胱天蛋白酶3单抗(1∶1000稀释),4℃过夜,HRP标记的山羊抗小鼠二抗(1∶2500稀释)室温40 m in,最后加入ECL试剂,于暗室压片曝光,图像扫描后用Quantity One分析软件对其进行定量与分析[11]。以目标蛋白条带积分吸光度值与内标β肌动蛋白质条带积分吸光度值之比表示蛋白质相对表达水平。
检测Pdcd4蛋白表达时,兔抗人Pdcd4一抗需1∶1500稀释,4℃过夜后山羊抗兔二抗需1∶2000稀释。
1.9 统计学分析
2 结果
2.1 何首乌R50部位对人结直肠癌HCT116和HT29细胞存活的影响
何首乌R50部位对HCT116和HT29细胞杀伤作用显著,并且作用效果呈时间和浓度依赖性(图1A和B)。何首乌R50部位与HCT116细胞作用24,48和72 h的IC50分别为195.59±2.29,80.44±1.78和(50.03±1.69)mg·L-1,与HT29细胞作用24,48和72 h的IC50分别为161.55±2.21,70.42±1.83和(67.87±1.83)m g·L-1。

Fig.1 lnhibitory effects of P.multiflorum R50 on survival of HCT116 cells(A)and HT29 cells(B).
2.2 何首乌R50部位对HCT116和HT29细胞周期的影响
流式细胞术检测发现,何首乌R50部位作用HCT116(图2A)和HT29细胞(图2B)48 h后,细胞周期各时相细胞比例无明显影响,说明何首乌R50部位对人结直肠癌HCT116和HT29细胞周期影响不显著。

Fig.2 Effect of P.multiflorum R50 on HCT116(A)and HT29(B)cell cycle distributions detected by flow cytometry.The cells were treated with P.multiflorum R50 for 48 h.,n=3.
2.3 何首乌R50部位对人结直肠癌HCT116和HT29细胞形态的影响
Giemsa染色结果显示(图3),与正常对照组(图3A,C)相比,何首乌R50部位100 mg·L-1作用于HCT116和HT29细胞48 h(图3B,D)后,出现多核、核碎裂细胞及凋亡小体。
2.4 何首乌R50部位对HCT116和HT29细胞凋亡的影响
如图4和表1所示,何首乌R50部位50,100和200 mg·L-1与HCT116细胞作用48 h,随着药物浓度的增加,细胞的凋亡率明显增加,分别由正常对照组的(5.8±0.4)%增加至(9.7±0.6)%,(12.3±1.0)%和(27.6±1.6)%(P<0.05)。
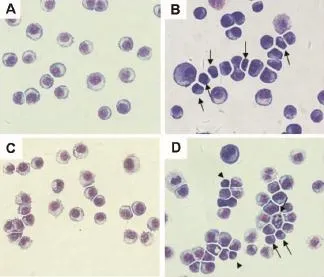
Fig.3 Effect of P.multiflorum R50 on morphology of HCT116(A,B)and HT29 cells(C,D)(Giemsa staining×20).A:normal control of HCT116 cells;B:HCT116 cells treated with P.multiflorum R50 100 m g·L-1for48 h;C:normal control of HT29 cells;D:HT29 cells treated with P.multiflorum R50 100 mg·L-1for 48 h.↑:apoptotic cells,▲:apoptotic bodies.

Fig.4 Effect of P.multiflorum R50 on apoptosis of HCT116 cells detected by flow cytometry.A:normal control;B-D:P.multiflorum R50 50,100 and 200 mg·L-1for 48 h,respectively.

Tab.1 Effect of P.multiflorum R50 on apoptosis of HCT116 cells
由图5和表2可见,何首乌R50部位50和100 mg·L-1处理HT29细胞48 h,细胞凋亡率分别为(12.1±0.4)%和(12.5±0.8)%,与正常对照组凋亡率相比无显著差异,但200 mg·L-1组细胞凋亡率则明显增加(P<0.05)。
2.5 何首乌R50部位对胱天蛋白酶原3和Pdcd4蛋白表达的影响

Fig.5 Effect of P.multiflorum R50 on apoptosis of HT29 cells detected by flow cytometry.A:normal control;B-D:P.multiflorum R50 50,100 and 200 m g·L-1for 48 h,respectively.

Tab.2 Effect of P.multiflorum R50 on apoptosis of HT29 cells
由图6可见,人结直肠癌HCT116和HT29细胞经何首乌R50部位100 m g·L-1处理48 h后,胱天蛋白酶原3和Pdcd4蛋白表达均显著下调。HCT116细胞中胱天蛋白酶原3蛋白表达水平由正常对照组的1.21±0.22下降为0.63±0.13(P<0.05),HT29细胞中胱天蛋白酶原3蛋白表达水平由正常对照组的1.47±0.26的下降为0.87± 0.20(P<0.05);HCT116细胞中Pdcd4蛋白表达水平由正常对照组的1.59±0.27下降为0.65±0.22(P<0.05),HT29细胞中Pdcd4蛋白表达水平由正常对照组的1.17±0.16下降为0.18± 0.06(P<0.05)。

Fig.6 Effect of P.multiflorum R50 on procaspase-3(A)and Pdcd4 protein(B)of HCT116 and HT29 cells detected by Western blotting.Lane 1:control of HCT116 cells;lane 2:HCT116 cells treated with P.multiflorum R50 100 m g·L-1for 48 h;lane 3:control of HT29 cells;lane 4:HT29 cells treated with P.multiflorum R50 100 mg·L-1for 48 h.
3 讨论
本研究结果表明,何首乌R50部位对人结直肠癌HCT116和HT29细胞杀伤作用显著,并且呈时间和浓度依赖性。形态学观察及流式细胞术检测结果显示,何首乌R50部位能够诱导人结直肠癌HCT116和HT29细胞凋亡,并随着药物浓度的增加,细胞的凋亡率明显增加,与MTT结果一致,但其对细胞周期分布并没有产生明显的影响,可见何首乌R50部位对2种人结直肠癌细胞均主要通过诱导人结直肠癌细胞凋亡而使其存活率下降。
本研究证实何首乌R50部位对2种人结直肠癌细胞均有明显的杀伤活性,因而对从何首乌中进一步开发低毒高效的抗肿瘤药物或药物前体有一定参考价值。
本研究发现,何首乌R50部位诱导细胞凋亡时伴随凋亡相关蛋白胱天蛋白酶原3和Pdcd4表达明显下调。细胞凋亡的途径包括胱天蛋白酶依赖和非胱天蛋白酶依赖信号通路等,而胱天蛋白酶依赖信号通路是细胞凋亡的一条重要的信号通路,多种药物、细胞因子等均可激活胱天蛋白酶依赖信号通路,最终诱导胱天蛋白酶3活化而凋亡。细胞凋亡胱天蛋白酶通路被激活时,可以诱导胱天蛋白酶原3发生断裂,产生约17 ku的有活性的小片段胱天蛋白酶3,同时胱天蛋白酶原3表达下降,因而胱天蛋白酶原3表达下降是胱天蛋白酶依赖凋亡信号通路激活的一个指标。可见何首乌R50部位是通过胱天蛋白酶依赖凋亡信号通路诱导人结直肠癌细胞凋亡的。另外,虽然Pdcd4最早是作为一个细胞凋亡因子被发现的,近期有研究表明,药物等多种细胞内外因子引起的Pdcd4表达下调与细胞凋亡成正相关性[12]。本研究也发现,何首乌R50部位诱导人结直肠癌细胞凋亡时伴随Pdcd4蛋白下调表达,但要揭示何首乌R50部位诱导细胞凋亡与Pdcd4蛋白表达下调之间的因果关系还需要更多的实验数据。
参考文献:
[1]Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia VolⅠ(中华人民共和国药典一部)[M].Beijing:Chinese Medical Science and Technology Press,2010:164-165.
[2] Zhang C,Sun ZX.Advance in the research on chemical constitute and in-vivo metabolism of Polygonum multiflorum[C]∥The Biochemical and Biotechnological Drug Conference.Mianyang:China Association of Chinese Medicine,2010:130-133.
[3] Yang HL,Ge ZZ,Sun ZX.Latest pharmacological development in Polygonum multiflorum[J].Chin Med Mat(中药材),2013,36(10):186-190.
[4] Ma YS,Weng SW,Lin MW,Lu CC,Chiang JH,Yang JS,et al.Antitumor effects of emodin on LS1034 human colon cancer cells in vitro and in vivo:roles of apoptotic cell death and LS1034 tumor xenografts model[J].Food Chem Toxicol,2012,50(5):1271-1278.
[5] Zhang RC,Liu B,Sun ZX,Xu DY.Effects of extract of Polygonum multiflorum on cell cycle arrest and apoptosis of human liver cell line L02[J].J Chin Integr Med,2010,8(6):554-561.
[6] Chen HS,Liu Y,Lin LQ,Zhao JL,Zhang CP,Jin JC,et al.Anti-proliferative effect of an extract of the root of Polygonum multiflorum Thunb.on MCF-7 human breast cancer cells and the possible mechanism s[J].Mol Med Rep,2011,4(6):1313-1319.
[7] Sun FL,Zhang L,Zhang RY,Li L.Tetrahydroxystilbene glucoside protects human neuroblastoma SH-SY5Y cells against MPP+-induced cytotoxicity[J].Eur J Pharmacol,2011,660(2-3):283-290.
[8] Zhang RC,Zhang C,Sun ZX,Deng QH.Damage effect of Polygonum multiflorum fractions on human normal liver cells L02 and liver cancer cells HepG2[J].China J Chin Mater Med(中国中药杂志),2012,37(12):1833-1835.
[9] LiRJ,Hong XF,Ji YY,Sun ZX.Norcantharidin induced mitotic arrest and apoptosis in human ovarian cancer SK-OV-3 cells[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(2):180-186.
[10] Feng T,Tian JX,LiZM,Lin HY,Sun ZX.Studies on the antitumor activities of the water extract of Arca subcrenata Lischke[J].Chin J Mar Drugs(中国海洋药物),2013,32(3):40-48.
[11] W u Y,Cao CM,Wang HQ,Li ZM,Sun ZX.Norcantharidin downregulates programmed cell death 4 expression in human gastric cancer ce lls[J].Chin J Pha rmacol Toxicol(中国药理学与毒理学杂志),2013,27(4):622-628.
[12] Eto K,Goto S,Nakashima W,Ura Y,Abe SI.Loss of programmed cell death 4 induces apoptosis by promoting the translation of procaspase-3 mRNA[J].Cell Death Differ,2012,19(4):573-581.
Mechanism of Polygonum multiflorum R50 on apoptosis of human colorectal cancer cells
YANG Hong-li*,LI Rui-jing*,LI Zi-m u,ZHANG Rui-chen,LI Bao-sai,SUN Zhen-xiao
(Department of Biopharmaceutics,College of Chinese Pharmacy,Beijng University of Chinese Medicine,Beijing 100102,China)
OBJECTlVETo investigate the mechanism of 50% ethanol eluted extract of raw Polygonum multiflorum(R50)on cell cycle and apoptosis of human colorectal cancer cells.METHODSCell viability was detected by MTT assay after HT29 and HCT116 cells were treated with R50 50-300 mg·L-1for 24,48 and 72 h,respectively.Cell cycle and apoptosis were assayed by flow cytometry after the cells were treated with R50 50,100 and 200 m g·L-1for 48 h.The morphological changes of cells and nuclei were observed under a light microscope in Giemsa staining and the expression of procaspase-3 and Pdcd4 proteins was detected by Western blotting after the cells were treated with R50 100 m g·L-1for 48 h.RESULTSHCT116 and HT29 cells were inhibited by R50 in a time-and concentration-dependent manner.There was no significant change was observed in cell cycle in the two human colorectal cancer cells treated with R50.R50 induced cell apoptosis in a concentration-dependent manner with R50 50,100 and 200 mg·L-1for48 h.The apoptotic rate of HCT116 cells in R50 200 mg·L-1group increased to(27.65±1.62)%from(5.85±0.35)%of control group(P<0.05),and that of HT29 cells in R50 200 mg·L-1group increased to(35.35±0.35)%from(10.25±0.77)%of control group(P<0.05).Cell shinkage,nuclear condensation and apoptotic bodies were observed.Procaspase-3 and Pdcd4 proteins were down-regulated in HCT116 and HT29 cells after R50 100 m g·L-1was treated for 48 h.CONCLUSlONR50 inhibits the viability of HCT116 and HT29 cells largely by inducing cell apoptosis through the caspase pathway.The down-regulation of Pdcd4 may be related to cell apoptosis.
Polygonum multiflorum R50;HCT116 cells;HT29 cells;apoptosis;procaspase-3;Pdcd4
SUN Zhen-xiao,E-mail:sunzxcn@hotmail.com,Tel:(010)84738646
R285,R975
A
1000-3002(2014)01-0051-06
Foundation item:The project supported by Beijing University of Chinese Medicine(2013JYBzz-XS088)
2013-09-10 接受日期:2013-12-30)
(本文编辑:乔 虹)
北京中医药大学自主选题项目(2013JYBzz-XS088)
杨红莉(1988-),女,硕士研究生;李瑞婧(1987-)女,硕士研究生;孙震晓(1967-),女,教授,博士,主要从事中药及其有效成分抗肿瘤分子细胞药理学研究。
孙震晓,E-m ail:sunzxcn@hotmail.com,Tel:(010)84738646
*共同第一作者.
*Co-first authors.
