转录因子RUNX2对IPO8基因启动子的调节作用
2014-03-21熊建军龚帧周小鸥王庭刘建云李卫东
熊建军,龚帧,周小鸥,王庭,刘建云,李卫东
(1.九江学院基础医学院药理学教研室,江西九江332000;2.江西省系统生物医学重点实验室,江西九江332000)
转录因子RUNX2对IPO8基因启动子的调节作用
熊建军1,龚帧1,周小鸥1,王庭1,刘建云2,李卫东2
(1.九江学院基础医学院药理学教研室,江西九江332000;2.江西省系统生物医学重点实验室,江西九江332000)
目的研究转录因子RUNX2对IPO8基因启动子的调控作用。方法基于PCR技术,分别突变和剔除IPO8基因启动子片段P-732/+134上RUNX2结合位点(-497~-502 bp),改造后的启动子片段定向插入荧光素酶表达载体PGL⁃3 Basic。重组质粒分别转染Saos⁃2与HeLa细胞,检测报告基因荧光素酶活性。应用染色质免疫共沉淀(ChIP)证实RUNX2与IPO8启动子在Saos⁃2细胞内结合。慢病毒介导RUNX2在Saos⁃2细胞的靶向沉默,定量PCR检测相应组别中IPO8mRNA的表达。结果成功突变和剔除IPO8启动子上RUNX2结合位点,破坏RUNX2结合位点导致IPO8启动子活性在Saos⁃2细胞中显著下降(P<0.05)。转录因子RUNX2在Saos⁃2细胞与IPO8启动子有效结合,下调RUNX2的表达导致IPO8转录水平下降(P<0.05)。结论转录因子RUNX2正性调控IPO8基因的转录。
IPO8;RUNX2;启动子;荧光素酶
IPO8基因是核质转运受体Importin β基因家族成员之一[1]。既往研究认为,IPO8是一个在细胞内稳定表达的基因,并在多种肿瘤细胞中作为参照基因用于PCR检测[2,3]。但是近来研究显示IPO8蛋白的功能并不局限于核质转运,有文献报道,IPO8的表达与众多microRNA介导的基因沉默有着复杂的联系,而抑制IPO8表达可导致部分microRNA靶基因上调[4],进而影响细胞内多个基因的表达水平。由此可见,IPO8的表达对于细胞的生理活动可能具有重要意义,但是IPO8基因表达的调控机制尚未见研究报道。前期研究中我们克隆了IPO8基因启动子,发现其正性调控序列中含有一个典型的RUNX2结合位点。本研究通过定点突变、脂质体瞬时转染、染色质免疫共沉淀(chromatin immunoprecipita⁃tion,CHIP)及RNA干扰等技术方法证实转录因子RUNX2对IPO8启动子的转录调控作用。
1 材料与方法
1.1 细胞与主要试剂
人骨肉瘤细胞Saos⁃2、人宫颈癌细胞HeLa,均为本室保存;基因突变试剂盒TaKaRa Mutan BEST Kit,购自大连宝生物公司;转染试剂Fugene6.0及双荧光素酶检测试剂盒,购自美国Promega公司;靶向沉默RUNX2基因的慢病毒颗粒(sc⁃37145⁃V)、RUNX2的羊多克隆抗体(sc⁃8566),购自美国Santa Cruz公司;McCOY′s 5A、DMEM培养基和胎牛血清,购于美国Gibco公司;ChIP试剂盒,购自美国Milli⁃pore公司;反转录试剂盒、实时PCR试剂盒,购自日本TOYOBO生物公司。
1.2 突变和剔除修饰RUNX2结合位点
以IPO8启动子片段-732/+134连接的PMD⁃18载体为模板,分别设计合成随机突变导入引物,剔除导入引物和对应的反向引物。突变引物序列:5′⁃AGCCTGACCTAAAAATCCTAGTACTC⁃3′;剔除引物序列:5′⁃ACCTAAAAATCCTAGTACTC⁃3′;反向引物序列:5′⁃TTATAACAAGATGAATTCCA⁃3′。PCR扩增,凝胶电泳后切胶回收目的DNA片段。产物DNA片段经Blunting Kination反应后进行自身连接反应,转化感受态菌,挑选变异体,测序。将测序正确的修饰片段利用MluⅠ和BglⅡ酶切,定向插入PGL3⁃Basic,分别命名为P-732/RUNX2 MUT及P-732/RUNX2 DEL。
1.3 细胞的瞬时转染与荧光素酶的检测[5]
转染前1 d将细胞按1×105/mL密度接种于24孔板,贴壁后12 h后采用Fugene 6.0介导质粒转染。P-732/WT、P-732/RUNX2 MUT及P-732/RUNX2 DEL 3种质粒各0.5 μg,分别与内参质粒PRL⁃TK 0.1 μg混合转染各孔。24 h后吸弃培养基,PBS洗涤细胞2次,随后每孔中加入100 μL细胞裂解液,室温水平摇动,以充分溶解转染细胞。20 min后吸取细胞裂解液,12 000 g离心5 min,取50 μL上清液上机检测,操作严格遵循试剂盒说明书,以萤火虫荧光素酶/海肾荧光素酶的荧光活性值为相对荧光素酶表达量。
1.4 ChIP
在Saos⁃2细胞中进行CHIP分析的方法参照文献[6]。RUNX2结合位点所在区域的PCR扩增引物为:5′⁃TTCACTTCGCCCATCCCTAT⁃3′,5′⁃CATTCATTCATTCGCTTTCA⁃3′。预期产物大小为240 bp。
1.5 慢病毒感染
靶细胞Saos⁃2培养于含10%胎牛血清的Mc⁃COY′s 5A培养基中,病毒感染前24 h消化,接种细胞密度为1×103/mL。待细胞生长铺满至50%,吸弃培养基,加入稀释后的病毒上清液1 mL,并按8 μg/ mL浓度加入聚凝胺。细胞置32℃、5%CO2条件下培养12 h,吸弃培养液,McCOY′s 5A清洗2次,加入正常培养液于37℃、5%CO2条件下继续培养72 h。
1.6 实时PCR
RNA提取、逆转录及实时PCR方法参照文献。引物序列如下:IPO8:5′⁃TGTTCAGCTCCTTCCTGAT TC⁃3′,5′⁃CTTCTTACACTTCCACCATAC⁃3′;RUNX2:5′⁃GCCTTCAAGGTGGTAGCCC⁃3′,5′⁃AAGGTGAAACTCTTGCCTCGTC⁃3′;GAPDH:5′⁃AGAAGGCTGGGGCTCATTTG⁃3′,5′⁃AGGGGCCAT CCACAGTCTTC⁃3′。
1.7 统计学处理
应用统计学软件SPSS 12.0进行相应的统计学分析。2组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 突变和剔除修饰IPO8启动子上RUNX2结合位点
近期我们研究IPO8启动子区域时,发现一个经典的RUNX2结合位点,位于转录起始点上游(-497~-502 bp)。为了证实该位点是否参与了IPO8基因的转录调控,我们对该位点进行突变和剔除修饰。测序结果显示,成功突变和剔除IPO8启动子RUNX2结合位点(图1)。
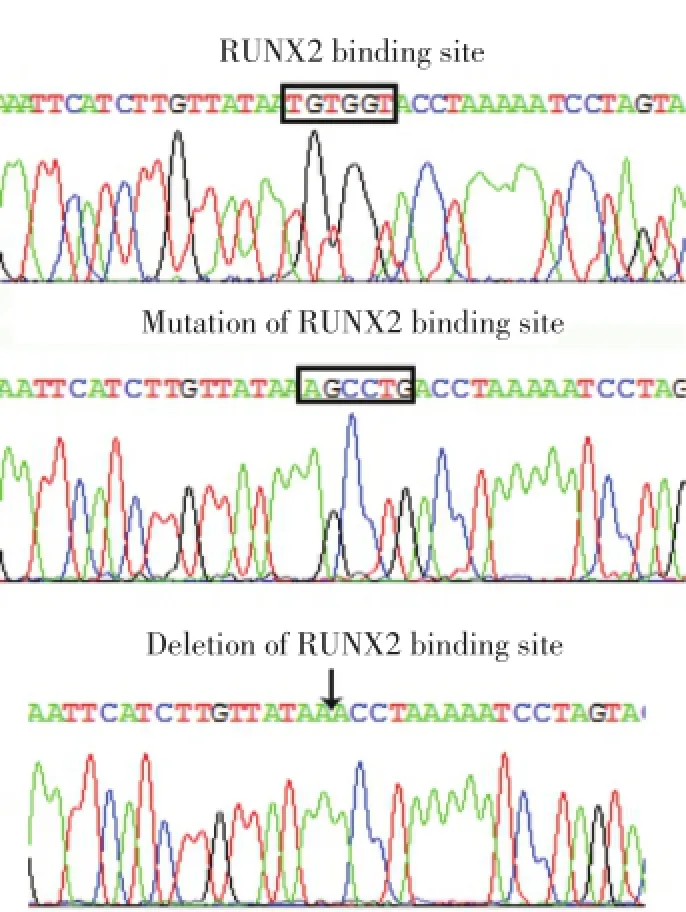
图1 IPO8启动子上RUNX2结合位点的测序图Fig.1 DNA sequencing for RUNX2 binding site in IPO8 promoter
2.2 破坏RUNX2结合位点导致IPO8启动子活性在Saos⁃2细胞中下降
为研究RUNX2结合位点对IPO8基因启动子活性的影响,我们将重组质粒P-732/WT、P-732/ RUNX2 MUT及P-732/RUNX2 DEL分别转染Saos⁃2细胞,经双荧光素酶报告系统检测萤光素酶的活性值,结果显示,重组质粒P-732/RUNX2 MUT及 P-732/RUNX2 DEL在Saos⁃2细胞中荧光素酶活性与P-732/WT相比下降约40%。
为进一步证实RUNX2对IPO8启动子的调控作用,我们将以上3种质粒分别转染入RUNX2缺失的HeLa细胞,通过双荧光检测仪检测荧光素酶活性。结果显示,3组质粒的荧光素酶活性无统计学差异(P>0.05),见图2。
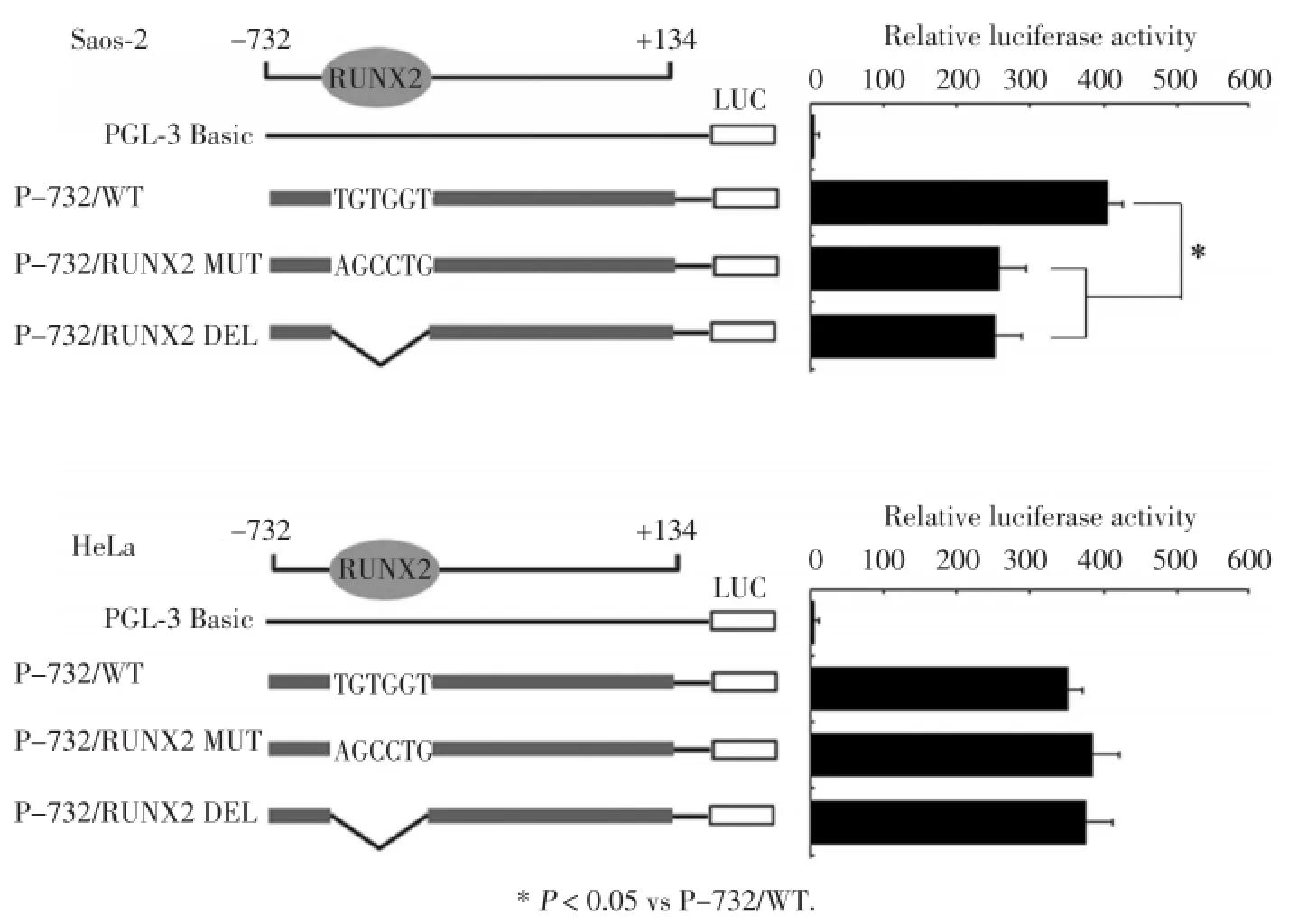
图2 突变型和剔除型IPO8启动子报告重组体荧光素酶活性Fig.2 Luciferase activity of the mutant or deleted IPO8promoter reporter constructs
2.3 RUNX2在Saos⁃2细胞内与IPO8启动子结合
为了探索转录因子RUNX2是否与IPO8启动子在Saos⁃2细胞内有效结合,本研究对从Saos⁃2细胞提取的染色质进行ChIP分析。染色质经IgG或RUNX2抗体免疫共沉淀后,经PCR扩增显示,内源性RUNX2结合在IPO8启动子区(图3)。
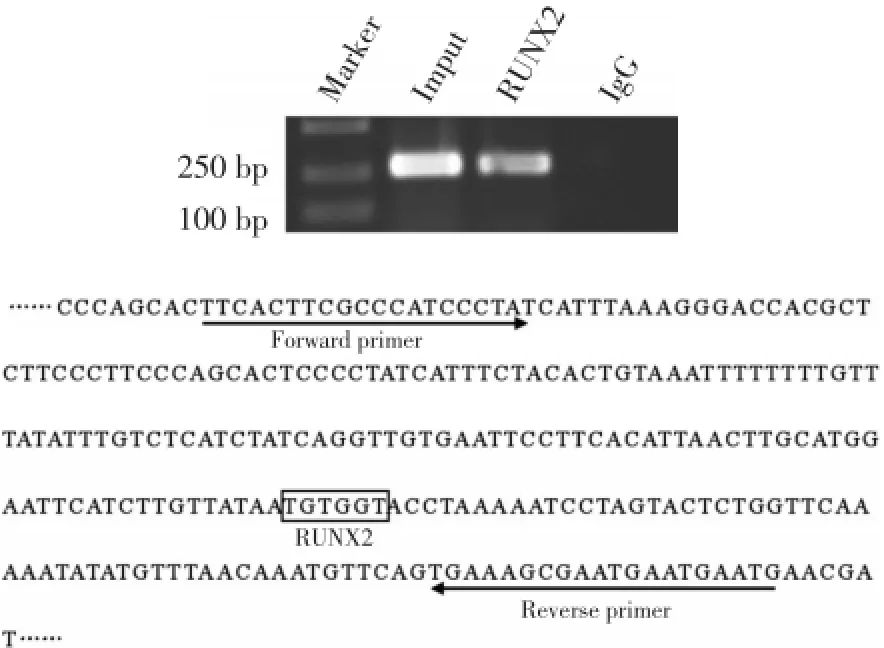
图3 RUNX2结合在IPO8启动子Fig.3 Identification of RUNX2 binding to the IPO8promoter
2.4 下调RUNX2表达抑制IPO8转录
为了检测下调RUNX2的表达对IPO8转录活性的影响,慢病毒介导的RNA干扰下调Saos⁃2细胞中80%左右RUNX2mRNA的表达。进一步结果显示,RUNX2下调的同时导致IPO8转录活性显著下降(图4),表明RUNX2表达与IPO8的转录水平存在正性调控关系。
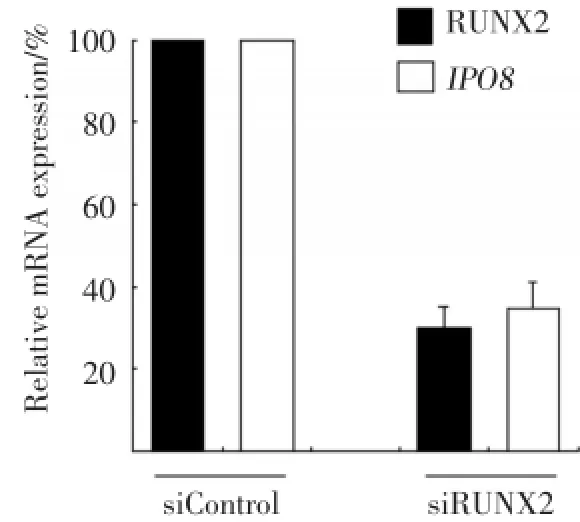
图4 沉默RUNX2抑制Saos⁃2细胞中IPO8mRNA表达Fig.4 Silencing of RUNX2 reduces IPO8 mRNA expression in Saos⁃2 cells
3 讨论
核转运受体包括Importin α和Importin β两个家族,分别识别不同的蛋白质核定位信号,在蛋白质入核的主动运输过程中发挥重要作用[7]。本研究中的IPO8即是Importin β家族成员之一,定位于人类常染色体的12p11.21。
有研究认为,IPO8是一个在细胞内稳定表达的基因,在多种肿瘤细胞中可作为参照基因用于PCR检测[2,3]。但还有研究显示,IPO8蛋白的表达对细胞生理活动有直接影响,例如抑制IPO8表达可导致部分miRNA靶基因的上调,进而影响细胞的生理功能,其原因在于IPO8蛋白与Argonaute蛋白的相互作用是介导靶mRNA降解的必经环节[4]。此外,IPO8也是Smad蛋白、糖皮质激素受体入核转运的主要核受体[8,9]。由此可见,IPO8的表达对于细胞正常功能具有重要意义,但是IPO8表达的调控机制尚不清楚。
利用生物信息学分析,我们发现一个典型的RUNX2结合位点,位于IPO8启动子的正性调控区域,而荧光素酶实验显示包含该区域的5′端非编码区具有最高的转录活性(另文发表),这促使我们对RUNX2调控IPO8转录的可能性进行验证。实验结果显示,突变或剔除RUNX2结合位点可导致IPO8启动子片段活性在Saos⁃2细胞明显下降,而在无RUNX2表达的HeLa细胞内,以上差异则不明显。随后ChIP实验也进一步证实,在Saos⁃2细胞内RUNX2与IPO8启动子中RUNX2结合位点所在区域(-424~-663 bp)有着直接结合。最后,我们利用慢病毒介导RUNX2在Saos⁃2细胞的下调,发现IPO8mRNA水平随之明显下降。基于以上研究结果,我们认为转录因子RUNX2与IPO8启动子相互作用是调控IPO8转录的重要因素。
RUNX2蛋白结构含有1个与DNA结合的runt结构域、3个转录激活区、1个转录抑制区和1个短的核定位信号,通过识别靶基因启动子中TGTGGT序列,进而调控相关基因的转录[10]。RUNX2的3种异构体分别在成骨细胞的早期增殖和后期成熟中的多种信号途径中起中心作用[11]。此外,RUNX2也被认为与多种肿瘤的发生、进展有内在联系[12]。基于RUNX2对IPO8基因在转录水平上的表达调控,我们推测IPO8也许存在众多未知的功能,而这些功能可能与成骨分化或肿瘤发生、进展有关。
[1]Gorlich D,Dabrowski M,Bischoff FR,et al.A novel class of RanGTP binding proteins[J].J Cell Biol,1997,138(1):65-80.
[2]Hurtado del Pozo C,Calvo RM,Vesperinas⁃Garcia G,et al.IPO8 and FBXL10:new reference genes for gene expression studies in hu⁃man adipose tissue[J].Obesity(Silver Spring),2010,18(5):897-903.
[3]Kreth S,Heyn J,Grau S,et al.Identification of valid endogenous control genes for determining gene expression in human glioma[J]. Neuro Oncol,2010,12(6):570-579.
[4]Weinmann L,Hock J,Ivacevic T,et al.Importin 8 is a gene silenc⁃ing factor that targets argonaute proteins to distinct mRNAs[J]. Cell,2009,136(3):496-507.
[5]熊建军,周英妹,干丽君,等.原癌基因USP22启动子的克隆及转录活性分析[J].中国医科大学学报,2011,40(7):580-583.
[6]Xiong J,Che X,Li X,et al.Cloning and characterization of the hu⁃man USP22 gene promoter[J].PLoS One,2012,7(12):e52716.
[7]Cook A,Bono F,Jinek M,et al.Structural biology of nucleocytoplas⁃mic transport[J].Annu Rev Biochem,2007,76:647-671.
[8]Yao X,Chen X,Cottonham C,et al.Preferential utilization of Imp7/ 8 in nuclear import of Smads[J].J Biol Chem,2008,283(33):22867-22874.
[9]Freedman ND,Yamamoto KR.Importin 7 and importin alpha/impor⁃tin beta are nuclear import receptors for the glucocorticoid receptor[J].Mol Biol Cell,2004,15(5):2276-2286.
[10]van der Deen M,Akech J,Lapointe D,et al.Genomic promoter oc⁃cupancy of runt-related transcription factor RUNX2 in osteosarco⁃ma cells identifies genes involved in cell adhesion and motility[J]. J Biol Chem,2012,287(7):4503-4517.
[11]Stock M,Otto F.Control of RUNX2 isoform expression:the role of promoters and enhancers[J].J Cell Biochem,2005,95(3):506-517.
[12]Barnes GL,Javed A,Waller SM,et al.Osteoblast-related transcrip⁃tion factors Runx2(Cbfa1/AML3)and MSX2 mediate the expres⁃sion of bone sialoprotein in human metastatic breast cancer cells[J].Cancer Res,2003,63(10):2631-2637.
(编辑 陈姜)
Regulation of Human IPO8 Promoter by Transcription Factor RUNX2
XIONG Jian⁃jun1,GONG Zhen1,ZHOU Xiao⁃ou1,WANG Ting1,LIU Jian⁃yun2,LI Wei⁃dong2
(1.Department of Pharmacology,College of Basic Medical Science,Jiujiang University,Jiujiang 332000,China;2.Key Laboratory of Jiangxi Province for the Systems Biomedicine,Jiujiang 332000,China)
ObjectiveTo investigate the regulation effects of transcription factor RUNX2 on human importin 8(IPO8)promoter.MethodsMu⁃tation or deletion of the RUNX2⁃binding site(-497 to-502 bp)within theIPO8promoter region was performed by PCR technology.The modifiedIPO8promoters were subsequently inserted into luciferase report vector PGL⁃3 Basic.The recombinant plasmids were transfected into human Saos⁃2 and HeLa cells respectively and the reporter gene luciferase activities were measured by dual luciferase reporter system.Furthermore,ChIP assay was performed to confirm the binding of RUNX2 toIPO8promoter in Saos⁃2 cells.In addition,lentivirus⁃mediated siRNA down⁃regulated RUNX2 expression in Saos⁃2 cells and expression ofIPO8mRNA was determined by real⁃time PCR.ResultsThe RUNX2 binding site was mutated and deleted withinIPO8promoter.Disruption of RUNX2 binding site led to significant decrease ofIPO8promoter activity in Saos⁃2 cells(P<0.05). ChIP assay demonstrated that RUNX2 binds toIPO8promoter.Down⁃regulation of RUNX2 attenuated the transcription level ofIPO8gene(P<0.05).ConclusionTranscription factor RUNX2 positively regulates the activity ofIPO8promoter.
IPO8;RUNX2;promoter;luciferase
R34
A
0258-4646(2014)07-0585-04
国家自然科学基金(81060075,81260140);江西省教育厅科学研究项目(GJJ12683)
熊建军(1975-),男,副教授,博士.
李卫东,E-mail:lwd626518@163.com
2014-04-22
网络出版时间:
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
