骨髓间充质干细胞移植在肺气肿大鼠模型肺组织内定植研究*
2014-03-15何桦赵祝香张颖
何桦赵祝香张颖
骨髓间充质干细胞移植在肺气肿大鼠模型肺组织内定植研究*
何桦①赵祝香①张颖①
目的:观察骨髓间充质干细胞移植在肺气肿大鼠模型肺组织内的定植情况。方法:选择健康SD大鼠34只,按随机数字表法分为MSCs干预组(A组,10只,慢阻肺大鼠,尾静脉输注MSC 1×106个/mL),肺气肿模型组(B组,10只,慢阻肺大鼠,尾静脉输注等体积PBS)及MSC对照组(C组,10只,正常大鼠,尾静脉输注MSCs 1×106个/mL),正常对照组(D组,4只,正常大鼠,尾静脉输注等体积PBS),采用烟熏法复制大鼠肺气肿模型。全骨髓培养法体外培养扩增雄性SD大鼠来源的MSCs,经GFP标记细胞后将其经尾静脉注入肺气肿模型SD大鼠体内,24 h内处死大鼠,取肺组织迅速冰冻切片,共聚焦激光显微镜下观察观察转染GPF的间充质干细胞在大鼠肺内定植情况。结果:成功培养具有分化潜能的骨髓间充质干细胞,MSCs传至第4代时有99.5%表达CD44、99.6%表达CD29等间充质干细胞表面标志,仅有0.4%表达CD34、1.0%表达CD45单核细胞以及造血干细胞表型;成功复制大鼠肺气肿模型,香烟烟雾暴露组(A、B组)平均肺泡间隔为(119.0±26.2)μm,高于对照组(C、D组)的(89.8±17.3)μm,差异有统计学意义(P<0.05);平均肺泡数为(173.9±68.3)个/mm2低于对照组的(280.3±104.0)个/mm2,差异有统计学意义(P<0.05);显微共聚焦发现MSCs经尾静脉注入大鼠体内24 h后可见A组大鼠肺组织内转染绿色荧光蛋白质粒的MSCs,而B组、C组及D组均未见转染荧光。结论:骨髓间充质干细胞经尾静脉输注入后可在肺气肿模型大鼠肺内定植,为MSCs治疗慢阻肺可能提供理论依据。
骨髓间充质干细胞; 肺气肿; 移植
慢性阻塞性肺疾病(慢阻肺,COPD)严重影响人类健康,与慢性支气管炎及阻塞性肺气肿密切相关,而阻塞性肺气肿可出现肺泡、支气管上皮细胞的损伤,造成肺实质结构的破坏,且随着病情进展,肺功能进行性下降。现行的内科治疗手段是尽早去除致病因素,最大限度减少损伤细胞的数量及损伤程度,但往往无满意的疗效。肺移植是目前终末期间质性肺疾病、慢阻肺患者唯一有效的治疗方法,但由于存在供体数量的下降、免疫排斥反应等问题而限制了其应用。目前人民迫切寻求一种新的、组织替代疗法来治疗这类不可逆的肺部疾病。骨髓间充质干细胞(mesenchymal stem cells,MSCs)由于来源方便、分离简单、扩增迅速,可以取材于患者本人,传代扩增并定向诱导为特异细胞后,回输给患者本人,安全性高,免疫原性低,且具有多向分化潜能引起广泛的关注,被认为是细胞移植和组织工程的种子细胞[1-3]。本实验将骨髓间充质干细胞(MSCs)经尾静脉注入肺气肿大鼠体内,观察MSCs植入大鼠体内后在肺组织中的存活,为MSCs治疗慢阻肺提供实验依据。
1 材料与方法
1.1 大鼠MSCs的体外分离与鉴定 (1)MSCs的分离与培养:无菌条件下取出大鼠双侧股骨和胫骨,无菌PBS冲洗骨髓腔获取骨单细胞悬液,将单细胞悬液1000 r/min,离心5 min,10%胎牛血清的DMEM培养液5 mL重悬细胞,接种于培养瓶37 ℃、5% CO2培养箱培,每3天换液一次。倒置相差显微镜逐日观察并记录的形态及生长情况,当细胞融合达90%时,按1∶3比例传代培养。取第4代MSCs进行鉴定。(2)流式细胞仪检测细胞CD表型:取第3 代MSCs,生长至90%融合时PBS洗涤2次,1×106的MSCs重悬于含0.1 mL PBS的PE管中,各管加入CD34、CD45、CD44及CD29,加入抗兔FITC,室温孵育40 min,流式细胞仪检测上述细胞表型,阴性对照为未加荧光抗体的MSCs细胞悬液。
1.2 移植MSCs的培养、标记 取6孔培养板,向每孔中加入2 mL含(1~2)×105个细胞培养液,37 ℃ 5% CO2培养至40%~50%汇合时转染(汇合过度,不利于转染细胞)。PBS洗细胞,10% FBS的DMEM/F12继续培养,72 h后荧光显微镜下观察转染细胞的绿色荧光,弃病毒混合培养液,流式细胞仪检测转染效率,转染后携带GFP的MSCs(GFP-MSCs)按1:3传代培养,取第4代MSCs进行鉴定。
1.3 实验动物分组及大鼠肺气肿模型建立 SD大鼠34只按随机数字表分为四组,MSCs干预组(A组,10只,慢阻肺大鼠,尾静脉输注MSCs 1×106个/mL),肺气肿模型组(B组,10只,慢阻肺大鼠,尾静脉输注等体积PBS)及MSCs对照组(C组,10只,正常大鼠,尾静脉输注MSCs 1×106个/mL),正常对照组(D组,4只,正常大鼠,尾静脉输注等体积PBS)。采用烟熏法复制大鼠肺气肿模型。将A、B组大鼠置于烟室内,采用静式吸入染毒方法,10支椰树牌香烟置于吸烟孔内,点燃香烟,每支香烟每分钟吸一次,35 mL/次,收集主流烟气和侧流烟气,通过塑料软管与熏烟箱相连,将烟雾导入熏烟箱。其间,每隔5秒将箱内流风机开启10 s,使箱内气体分布均匀。8 min香烟点燃完毕,关闭吸烟系统。动物每次暴露45 min,45 min后取出动物,清洗熏烟箱。2次/d,共12周。烟雾暴露时动物可在箱内自由取食饮水。按上述方法将MSCs干预组第3代的转染GFP质粒的间充质干细胞(每只1×106个/mL)尾静脉注入A组大鼠体内,B组注入等体积PBS;C组在相同时间内注入1×106个/mL骨髓间充质干细胞等,D组注入等体积PBS,注入后24 h内处死大鼠,取肺组织迅速冰冻切片,共聚焦激光显微镜下观察观察转染GPF的间充质干细胞在大鼠肺内定植情况。第3代的转染GFP质粒的间充质干细胞(每只1×106)进行下一步实验。
1.4 统计学处理 采用SPSS 12.0统计学软件对数据进行统计分析,计量资料以(±s)表示,比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 MSCs培养与鉴定 原代培养的MSCs第24小时即可见梭形细胞贴壁生长,到第6天时有大量梭形细胞呈克隆生长,第10天左右细胞可长满皿底。细胞长满后与成体MSCs相似,呈旋涡状(图1)。按1:3进行传代培养,细胞在体外培养可稳定传至48代,在第4代做流式细胞表型鉴定,符合目前公认间充质干细胞细胞表型标志。经流式细胞仪检测,分离细胞传至第4代时有99.5%表达CD44、99.6%表达CD29等间充质干细胞表面标志,0.4%表达CD34、1.0%表达CD45单核细胞以及造血干细胞表型(图2)。

图1 MSCs的原代培养(×400)

图2 间充质干细胞表面标志的表达
2.2 SD大鼠肺气肿模型的建立 香烟烟雾暴露后A、B组大鼠小气道上皮呈锯齿状增生增厚,上皮脱落,纤毛倒伏,气管内见大量炎性渗出物,管壁结缔组织增生,可见炎性细胞,及淋巴小结。肺泡结构紊乱,肺泡壁断裂,肺泡腔扩大,部分融合成肺大疱(图3A)。C、D对照组大鼠小气道黏膜上皮完整,纤毛未见黏连脱落,管壁规整未见增厚,未见炎细胞浸润,管腔内未见炎性渗出物,肺泡腔未见病理性扩大(图3B)。
香烟烟雾暴露组(A、B组)平均肺泡间隔为(119.0±26.2)μm,高于对照组(C、D组)的(89.8±17.3)μm,差异有统计学意义(P<0.05);平均肺泡数为(173.9±68.3)个/mm2低于对照组的(280.3±104.0)个/mm2,差异有统计学意义(P<0.05),见表1。
表1 大鼠肺组织病理学改变情况(±s)

表1 大鼠肺组织病理学改变情况(±s)
肺泡数(个/mm2)组别 支气管数(只)平均肺泡间隔(μm)对照组(n=14) 27 89.8±17.3 280.3±104.0香烟组(n=20) 28 119.0±26.2 173.86±68.3 F值 - 3.8 4.7 P值 - <0.01 <0.01
2.3 各组转染GPF绿色荧光蛋白的表达 取第8代培养的间充质干细胞,调整合适的间充质干细胞培养密度,细胞融合40%~5%时转染GPF绿色荧光蛋白质粒,24 h后观察转染效果,在转染GPF绿色荧光蛋白质粒后48~96 h表达效果最好,质粒发光强度大、数量多,效率可达40%左右。微共聚焦发现MSCs经尾静脉注入大鼠体内24 h后,A组大鼠肺组织内可见携带MSCs的绿色荧光,而B组、C组及D组均未见转染荧光(图4)。
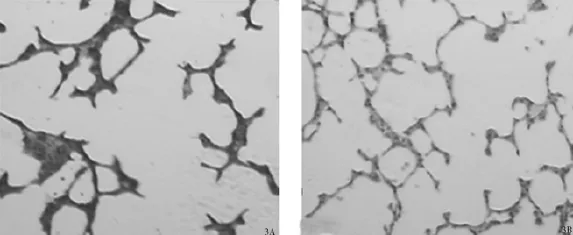
图3 大鼠肺组织病理形态(HE×100)

图4 间充质干细胞转染GFP质粒及大鼠肺气肿模型肺内定植(×200)
3 讨论
慢阻肺是一种全球性患病率较高的疾病,40岁以上人群,慢阻肺患病率为8.2%[5]。其患病率之高十分惊人,死亡率高,目前居全球死亡原因的第4位,经济负担重,已成为世界第5大负担的疾病,由于慢阻肺的发病机制复杂,病理改变可引起气道结构重塑、肺泡结构破坏及肺血管减少,依靠机体的自我再生能力无法达到完全的修复,导致病情进行性进展。目前慢阻肺的内科治疗以抗炎、扩张支气管、氧疗、呼吸运动锻炼及增强免疫力等来缓解患者症状及降低患者未来健康恶化的风险,其作用非常有限,外科肺减容术及经纤支镜肺减容术等治疗目的在于缓解症状和改善生活质量,二者均不能阻止病情的进行性发展。因此,如能寻找到一种有效修复气道及肺部组织结构,从而恢复肺功能的方法,将在慢阻肺的治疗上将具有里程碑式的意义。
骨髓间充质干细胞是一类具有自我更新和多向分化潜能的成体干细胞。在一定条件下它可分化为心肌细胞、支气管上皮细胞、肺泡上皮细胞等多个胚层来源的细胞[6-8]。而且骨髓间充质干细胞在体外易于分离、培养和扩增,免疫原性低,使其在组织工程、细胞移植、基因治疗等领域具有十分广阔的应用前景[1]。近年来许多研究表明,干细胞移植可能为某些肺部疾病的治疗带来新希望[9-13]。1995年Pereira等[14]从表达人小基因胶原酶I的转基因鼠中分离获得成年骨髓间充质干细胞,体外扩增、培养,再通过尾静脉注射入受致死剂量照射的小鼠中,1~5个月后,发现肺实质、骨、软骨细胞中都含有胶原酶I阳性的细胞,骨髓来源干细胞移植移植到博莱霉素肺纤维化小鼠体内,可产生肺泡I型细胞,并使其肺纤维化程度得到改善。目前MSCs在肺部疾病治疗研究主要集中于急性肺损伤与肺间质纤维化,在慢阻肺中的研究较少,骨髓间充质干细胞是否在慢阻肺大鼠体内定植、分化呢?本研究通过全骨髓贴壁法获得了足够数量和活力的骨髓间充质干细胞,培养的MSCs不表达CD34和CD45,表达CD29和CD44,在一定的诱导条件下可向脂肪细胞骨细胞及软骨细胞分化,提示成功培养MSCs。应用GFP标记的MSCs可表达绿色荧光蛋白,可应用于体内实验。笔者应用香烟烟熏成功复制肺气肿大鼠,观察经尾静脉注入的MSCs在肺气肿大鼠肺内的生存。将转染GFP质粒的大鼠骨髓间充质干细胞经尾静脉输注入肺气肿模型大鼠体内,经快速冰冻切片发现肺气肿模型大鼠肺内骨髓间充质干细胞有骨髓间充质干细胞定植,这与Kidds等[15]报道相一致,为MSCs治疗慢阻肺提供理论基础。
[1] Le B K,Tammik C,Rosendahl K,et al.HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells[J].Exp Hematol,2003,31(10):890-896.
[2] Sun Y Q,Deng M X,He J,et al.Human pluripotent stemcellderived mesenchymal stem cells prevent allergic airway inflammation in mice[J].Stem Cells,2012,30(12):2692-2699.
[3] Luo D,Yan X,Liu D,et al.Differential effects of mesenchymal stem cells on a heterogeneous cell population within lung cancer cell lines[J]. Mol Cell Biochem,2013,378(1-2):107-116.
[4] Menge T,Zhao Y,Zhao J,et al.Mesenchymal stem cells regulate blood-brain barrier integrity through TIMP3 release after traumatic brain injury[J].Sci Transl Med,2012,4(161):150-161.
[5] Zhong N,Wang C,Yao W,et al.Prevalence of chronic obstructive pulmonary disease in China: a large, population-based survey[J].Am J Respir Crit Care Med,2007,176(8):753-760.
[6] Kotton D N,Ma B Y,Cardoso V,et al.Bone marrow-derived cells as progenitors of lung alveolar epithelium[J].Development,2001,128 (24):5181-5188.
[7] Wang G,Bunnell B A,Painter R G,et al.Adult stem cells from bone marrow stroma differentiate into airway epithelial cells: potential therapy for cystic fibrosis[J].Proc Natl Acad Sci USA,2005,102(1):186-191.
[8] Gregory C A,Prockop D J,Spees J L.Non-hematopoietic bone marrow stem cells: molecular control of expansion and differentiation[J].Exp Cell Res,2005,306(2):330-335.
[9] Yen C C,Yang S H,Lin C Y,et al.Stem cells in the lung parenchyma and prospects for lung injury therapy[J].Eur J Clin Invest,2006,36(5):310-319.
[10] Spaeth E L,Kidd S,Marini F C.Tracking inflammation-induced mobilization of mesenchymal stem cells[J].Methods Mol Biol,2012,904(12):173-190.
[11] Kidd S,Spaeth E,Watson K,et al.Origins of the tumor microenvironment: quantitative assessment of adipose-derived and bone marrow-derived stroma[J].PLoS One,2012,7(2):e30 563.
[12] Zhang W G,He L,Shi X M,et al.Regulation of transplanted mesenchymal stem cells by the lung progenitor niche in rats with chronic obstructive pulmonary disease[J].Respir Res,2014,15(5):33.
[13] Scarritt M E,Bonvillain R W,Burkett B J,et al.Hypertensive rat lungs retain hallmarks of vascular disease upon decellularization but support the growth of mesenchymal stem cells[J].Tissue Eng Part A,2014,20(9-10):1426-1443.
[14] Pereira R F,Halford K W,O'Hara M D,et al.Cultured adherent cells from marrow can serve as long-lasting precursor cells for bone,cartilage, and lung in irradiated mice[J].Proc Natl Acad Sci USA,1995,92(11):4857-4861.
[15] Kidd S,Spaeth E,Dembinski J L,et al.Direct evidence of mesenchymal stem cell tropism for tumor and wounding microenvironments using in vivo bioluminescent imaging[J].Stem Cells,2009,27(10):2614-2623.
Study on the Bone Marrow Mesenchymal Stem Cell Transplantation in Rats Lung Tissue with Emphysema/
HE Hua,ZHAO Zhu-xiang,ZHANG Ying.//Medical Innovation of China,2014,11(21):026-030
Objective:To observe the situation of bone marrow mesenchymal stem cell transplantation in rats lung tissue with emphysema.Method:34 healthy rats were randomly divided into the MSCs intervention group (the group A, 10 COPD rats, tail intravenous MSC 1×106cells/mL), the emphysema model group(the group B, 10 COPD rats,tail intravenous the same volume PBS), the MSC control group(the group C, 10 normal rats, tail intravenous MSCs 1×106cells/mL) and the normal control group (the group D, 10 normal rats, tail intravenous the same volume PBS). Copy the rats emphysema model used smoke, proliferated the male SD rats MSCs by whole bone marrow culture method in vitro. The cells with GFP labeled were injected into SD emphysema rats serum, killed the rats within 24 h, got the lung tissue to rapid frozen section. The homing capacity of mesenchymal stem cells with GPF transfection in rat lung was analyzed by observing pathological section.Result:The differentiation potential of bone marrow mesenchymal stem cells were successfully developed. 99.5% marrow mesenchymal stem cells expressed CD44, 99.6% expressed CD29, 0.4% expressed CD34 and 1.0% expressed CD45 when MSCs to the fourth generation. The model of rat emphysema was made successfully. The average alveolar interval in the cigarette smoke exposure group(the group A,B) was (119.0±26.2)μm higher than the control group(the group C,D), and the average number of alveolar was (173.9±68.3)/mm2lower than the control group. The MSCs with transfection in the rats after 24 h green fluorescent protein were observed in the group A, but not in the group B, C and D.Conclusion:The bone marrow mesenchymal stem cells can colonize in pulmonary emphysema model rats by tail intravenous injection. This may provide theoretical basis for MSCs in the treatment of COPD.
Mesenchymal stem cells; Pulmonary emphysema; Transplant
10.3969/j.issn.1674-4985.2014.21.008
2014-05-20) (本文编辑:蔡元元)
广东省科技厅研究基金资助项目(00317761120224027)
①广州市第一人民医院 广东 广州 510180
张颖
First-author’s address:The First People’s Hospital of Guangzhou City,Guangzhou 510180,China
