脂肪来源的间充质干细胞对大鼠心肌梗死后心功能的保护作用
2014-03-13李佳丹易军陈江田洪榛陈光辉
李佳丹,易军,陈江,田洪榛,陈光辉
·基础研究·
脂肪来源的间充质干细胞对大鼠心肌梗死后心功能的保护作用
李佳丹,易军,陈江,田洪榛,陈光辉
目的探讨脂肪来源的间充质干细胞(ADSCs)对大鼠急性心肌梗死(AMI)后心功能的影响。方法 结扎SD大鼠左冠状动脉前降支制备心肌梗死模型。同种异体ADSCs体外分离、培养、纯化、扩增,在大鼠AMI区域周围进行心外膜下移植。将24只大鼠随机分为3组,每组8只:A组为AMI模型组,只给予前降支结扎;B组为细胞培养基(DMEM)移植组,结扎后心外膜注射DMEM;C组为ADSCs治疗组,结扎前降支后接受ADSCs移植治疗。术后7 d、28 d各组大鼠行心脏超声检测左室射血分数(LVEF)、左室短轴缩短率(FS),28 d超声检测后行血流动力学测量左室收缩压、左室舒张末压、左心室压力最大变化速率,评价ADSCs移植对AMI后大鼠心功能的影响;心脏组织行TTC染色,观察AMI面积。结果与AMI模型组比较,ADSCs治疗组的LVEF、FS及血流动力学指标明显提高(P<0.01)。TTC染色观察心肌梗死面积,ADSCs治疗组心肌梗死面积明显减小(P<0.01)。结论 ADSCs可减少AMI的面积,改善心功能。
脂肪间充质干细胞;急性心肌梗死;心功能;大鼠
在心血管疾病研究领域,心肌梗死已成为全球性的医学难题。当发生心肌梗死时,大量心肌细胞丧失,并继以瘢痕组织形成,严重影响了心脏的收缩和舒张功能,长期的过程导致了慢性心力衰竭。而目前的治疗手段只能改善部分临床症状,心肌梗死后心力衰竭的发生率仍较高,严重影响着患者的生活质量和生存率。心肌细胞的凋亡和坏死形成不可逆损伤,是导致急性心肌梗死(acute myocardial in⁃farction,AMI)后心力衰竭的主要原因,在此种情况下,心肌细胞的修复日益得到关注。
干细胞具有自我更新和定向分化能力,在再生医学领域得到广泛和深入的研究,并开始应用于AMI的治疗及AMI后心衰的预防[1-3]。2001年Zuk等[4]成功分离出脂肪间充质干细胞(adipose-de⁃rived mesenchymal stem cells,ADSCs),较其他来源的干细胞,其来源广泛,取材方便,可大量扩增,低免
疫原性,无免疫排斥及伦理问题,而成为理想的治疗心肌损伤的种子细胞。本实验进行同种异体ADSCs移植治疗大鼠心肌梗死模型,观察ADSCs对大鼠心功能的影响。
1 材料和方法
1.1 实验动物与主要试剂 将24只大鼠随机分为3组,每组8只:A组为AMI模型组;B组为细胞培养基(DMEM)移植组;C组为ADSCs治疗组。清洁级SD大鼠由解放军医学院动物中心提供。Ⅱ型胶原酶(Gibco)、L-DMEM培养基(Gibco)、特级胎牛血清(Gibco)。
1.2 ADSCs的分离培养 SD乳鼠(3~5 d)5只,雌雄不限,无菌条件下取乳鼠肩胛及腹股沟皮下脂肪,PBS清洗2~3次,剪成云雾状,1%Ⅱ型胶原酶置于37℃恒温水浴锅内震荡消化40 min后,加入含10%胎牛血清的DMEM中和胶原酶。200目筛网过滤两次,管内离心(1 500 r,10 min),弃上清,完全DMEM接种,置于37℃、5%CO2培养箱内孵育,24 h后首次换液,去除未贴壁的细胞,随后2~3 d换一次液。镜下观察培养,待细胞融合至80%~90%时,加入0.25%+0.04%乙二胺四乙酸(EDTA)进行消化,以1∶3进行传代,继续培养。
1.3 AMI模型的建立 大鼠称重,2%戊巴比妥钠(0.2 ml/100 g)腹腔麻醉,分离气管,行气管插管,调节微型动物呼吸机,呼吸频率55次/min,潮气量30 ml/kg,呼吸比2∶1,于大鼠第3、4肋间竖行剪开皮肤,钝性分离肌肉组织,开胸,暴露心脏,剪开心包,在肺动脉圆锥与左心耳交界处下1~2 mm结扎前降支,造成左室前壁心肌梗死(左室前壁心肌组织搏动减弱,颜色苍白,心电图显示ST段弓背抬高示结扎成功)。
1.4 ADSCs移植 AMI模型制作成功后,待大鼠呼吸、心律平稳,用1 ml注射器于梗死区与正常心肌交界处4点注射100 ul细胞悬液(约1×106/100 ul),DMEM移植组同样方式注射 100 ul无血清DMEM,待大鼠各项指标平稳后,进行缝合,术后给予青霉素腹腔注射抗感染。
1.5 超声心动图检测 移植后7 d、28 d,各组心脏超声检测,测量左心室收缩末期直径(LVESD)、左心室舒张末期直径(LEVDD);计算左室短轴缩短率(FS)以及射血分数(EF)。采集3~6个心动周期测量的数据,计算平均值。
1.6 血流动力学检测 超声心动图检测后,进行血流动力学检测。大鼠称重,2%戊巴比妥钠(0.2 ml/
100g)进行腹腔麻醉。颈部正中切开皮肤,钝性分离肌肉,暴露右颈总动脉,钝性分离约1.5~2 cm右颈总动脉,远心端结扎,近心端以动脉夹夹住。动脉夹与结扎点之间的动脉上剪开V型切口,将连接测压器的导管经动脉上的切口插入,松开动脉夹,将导管插入到左心室,记录动物心功能参数左室射血分数(LVEF)、FS、左心室收缩压(LVSP),左心室舒张末期压(LVEDP)以及左心室压力最大变化速率(+dp/dtmax)等。
1.7 组织化学染色 各组动物完成心功能检测后,立即开胸,取出心脏,用生理盐水去血污,剔除血管脂肪等非心肌组织,用吸水纸吸取水分,将全心置于-20℃冻存5 min,从心尖至心底,按厚度分为五等份,TTC染色,观察心肌梗死区域面积。
1.8 统计学方法 采用SPSS17.0统计软件,所有数据以均数±标准差(x¯±s)表示,多组比较采用方差分析,以P<0.05为统计学有意义。
2 结 果
2.1 ADSCs的培养 24 h换液后,原代细胞明显贴壁,多为不规则或短梭形,之后逐渐变为长梭形似成纤维细胞,成旋涡状生长,随着换液和传代,一些似内皮样的铺路石样的细胞逐渐消失,本实验细胞为第三代细胞,见图1。

图1 光镜下第三代ADSCs
2.2 AMI模型的建立 结扎前降支后,左室前壁心肌组织搏动减弱,颜色苍白,此时心电图可见R波振幅升高,ST段弓背向上抬高,表明AMI模型建立成功。
2.3 心功能检测 与AMI模型组和DMEM移植组比较,ADSCs治疗组心功能明显改善,LVEF、FS、LVSP、LVEDP、+dp/dt显著升高(P<0.01),AMI模型组与DMEM移植组相比,无统计学差异。移植后28 d的LVEF和FS与移植后7 d比较,无统计学意义,见表1、表2。
2.4 TTC染色 大鼠处死后取出心脏,AMI模型组及DMEM组大鼠心脏扩大,左室壁塌陷,室壁心肌被疤痕组织所替代,颜色灰白;ADSCs治疗组大鼠
表1 大鼠超声心动图检测结果比较(n=8,±s)

表1 大鼠超声心动图检测结果比较(n=8,±s)
注:与AMI模型组比较,∗P<0.01;与DMEM移植组比较,#P<0.01。
分组 LVEF(%)FS(%)术后7 d 术后28 d 术后7 d 术后28 d AMI模型组 57.47±5.35 54.98±8.71 23.65±2.92 24.76±5.55 DMEM移植组 50.51±5.25 53.33±7.48 22.29±3.17 22.81±4.72 ADSCs治疗组 67.91±4.17∗#71.66±5.05∗#33.26±2.79∗#36.04±3.64∗#
表2 大鼠血流动力学检测结果比较(±s)
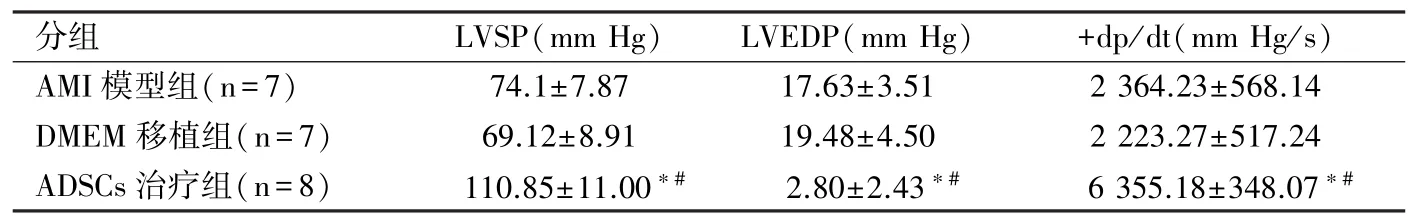
表2 大鼠血流动力学检测结果比较(±s)
注:与AMI模型组比较,∗P<0.01;与DMEM移植组比较,#P<0.01。
分组 LVSP(mm Hg) LVEDP(mm Hg) +dp/dt(mm Hg/s)AMI模型组(n=7) 74.1±7.87 17.63±3.51 2 364.23±568.14 DMEM移植组(n=7) 69.12±8.91 19.48±4.50 2 223.27±517.24 ADSCs治疗组(n=8) 110.85±11.00∗#2.80±2.43∗#6 355.18±348.07∗#
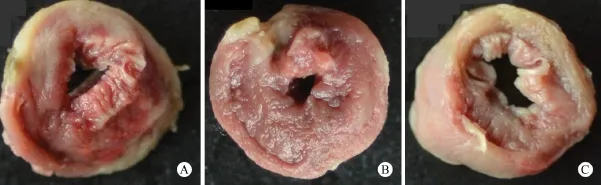
图2 大鼠心肌组织TTC染色
心脏不大,左室壁弹性良好,灰白区域较AMI组面积显著较小(如图2 A、B、C),图像分析软件分析,ADSCs治疗组的梗死面积(18.40±3.65)%明显低于AMI模型组(31.01±2.34)%及DMEM移植组(28.77±1.95)%,P<0.01。
3 讨 论
本实验制备SD大鼠模型过程中AMI模型组和DMEM移植组分别有1只动物死亡,分析原因,可能为结扎位置过高,造成心肌梗死面积过大,大鼠心衰严重;心外膜下移植DMEM过程中,影响左右束支传导功能,造成恶性心律失常。将分离培养的同种异体ADSCs心外膜下移植于梗死区周围,实验终点28 d时行血流动力学检查和心脏超声检查,结果显示ADSCs治疗组与AMI模型组和DMEM移植组相比,各项指标明显提高,而DMEM移植组与AMI模型组相比,无统计学意义,说明ADSCs对大鼠AMI后心功能有显著改善作用。而在7 d、28 d的LVEF、FS相比较,无明显差异,提示ADSCs在移植后一周内的治疗作用较明显。28 d大鼠AMI面积的比较,AD⁃SCs治疗组梗死面积明显减小,ADSCs改善心功能的作用可能与其可减小AMI面积有关。
干细胞移植治疗缺血性心脏病的研究已开展多年,目前研究和应用最为深入和广泛的为骨髓间充质干细胞[5]。但骨髓间充质干细胞存在一些缺陷如:取材困难,患者较痛苦;取材部位局限,获取细胞数量少。而ADSCs的出现克服了骨髓间充质干细胞的不足,成为理想的种子细胞。有研究人员证实了ADSCs与骨髓间充质干细胞具有相似的表型和特性[6],同时有研究结果表明ADSCs移植可促进AMI区域的血管和神经的再生,有效保护心功能,且移植细胞可存活至1个月,但没有证据表明这些细胞可直接转化为宿主的心肌组织而发挥治疗作用[7]。尽管目前干细胞的移植治疗作用存在争议,但目前研究的主流结果仍然可以说明ADSCs在AMI治疗中的积极作用[8-9]。目前ADSCs改善心功能的机制尚不明晰,Shah等人总结其机制主要为:血管再生、心肌再生、免疫调节,这三个方面可以减少心肌细胞凋亡和瘢痕组织的形成[10]。
ADSCs的优越性给再生医学的发展带来了新的希望,且取得了一些进展,但是细胞移植生存率低、移植方式的选择及安全性等问题,仍是值得研究与关注的问题。
[1] Moerkamp AT,Goumans MJ.Cardiac regeneration:stem cells and beyond[J].Curr Med Chem,2012,19(35):5993-6002.
[2] Abdelwahid E,Siminiak T,Guarita-Souza LC,et al.Stem cell therapy in heart diseases:a review of selected new perspectives,practical considerations and clinical applications[J].Curr Car⁃diol Rev,2011,7(3):201-212.
[3] Lu HH,Li YF,Sheng ZQ,et al.Preconditioning of stem cells for the treatment of myocardial infarction J〛.Chin Med J(Engl),2012,125(2):378-384.
[4] Zuk PA,Zhu M,Ashjian P,De Ugarte DA,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279-4295.
[5] San Roman JA,Fernandez-Aviles F.The role of noninvasive im⁃aging techniques in the assessment of stem cell therapy after a⁃cute myocardial infarction[J].Nat Clin Pract Cardiovasc Med,2006,3 Supply 1:S38-41.
[6] Lee RH,Kim B,Choi I,et al.Characterization and expression a⁃ nalysis of mesenchymal stem cells from human bone marrow and adi⁃posetissue[J].Cell Physiol Biochem,2004,14(4-6):311-324.
[7] Cai L,Johnstone BH,Cook TG,et al.IFATS collection:Hu⁃man adipose tissue-derived stem cells induce angiogenesis and nerve sprouting following myocardial infarction,in conjunction with potent preservation of cardiac function[J].Stem Cell,2009,27(1):230-237.
[8] Mazo M,Planat-Benard V,Abizanda G,et al.Transplantation of adipose derived stromal cells is associated with functional im⁃provement in a rat model of chronic myocardial infarction[J].European Journal of Heart Failure,2008,10(5):454-462.
[9] Yamada Y,Wang XD,Yokoyama S,et al.Cardiac progenitor cells in brown adipose tissue repaired damaged myocardium[J].Biochem Biophys Res Commun,2006,342(2):662-670.
[10] Shah VK,Shalia KK.Stem cell therapy in acute myocardial in⁃farction:A pot of gold or pandora's box[J].Stem Cell Interna⁃tional,2011,2011(5):536758.
The protection of adipose-derived mesenchymal stem cells on cardiac function after myocardial infarction in rats
Li Jia-dan,Yi Jun,Chen Jiang,Tian Hong-zhen,Chen Guang-hui
Department of Cardiology,PLA General Hospital,Beijing 100853,China
Chen Guang-hui,Email:chen kevin301@msn.com
ObjectiveTo investigate the effects of adipose-derived mesenchymal stem cells(ADSCs)transplanted on cardiac function after acute myocardial infarction in rats.MethodsThe model of acute myocardial infarction(AMI)was created by occluding the left anterior descending artery(LAD)in SD rats.Allogeneic ADSCs were isolated,purified,amplifed and conducted epicardial trans⁃plantation.The rats were randomly divided into 3 groups with 8 rats for each group.Group A was the model of AMI.Group B(control group)was injected DMEM.Group C received ADSCs treatment.After 1 and 4th week,cardiac ultrasound was inspected.After the in⁃spection of cardiac ultrasound at 4th week,index of hemodynamics were tested to evaluate the cardiac function.The area of myocardial in⁃farction wre calculated with TTC staining.ResultsCompared with AMI group,left ventricular ejection fraction,fractional shortening and index of hemodynamics of ADSCs group were significantly increased(P<0.01),and the myocardial infarction area of ADSCs group was significantly lower(P<0.01).ConclusionADSCs can reduce area of myocardial infarction and improve the function of heart.
Adipose-derived stem cells;Acute myocardial infarction;Cardiac function;Rat
2013⁃10⁃18)
2013⁃11⁃04)
10.13498/j.cnki.chin.j.ecc.2014.01.15基金项目:国家高技术研究发展计划(2011AA020101)作者单位:100853北京,中国人民解放军总医院心内科通讯作者:陈光辉,Email:chenkevin301@msn.com
