山桃稠李果实花色苷对Nrf2/Keap1通路的影响
2014-02-21姜元松杨巍巍
刘 荣,姜元松,辛 越,王 蕾,杨巍巍
(东北林业大学,黑龙江哈尔滨150040)
山桃稠李(Padus maackii)为蔷薇科稠李属的三种植物,在我国南北部地区均有分布生长,是多年生的落叶乔木[1]。我国学者在此植物的种植技术等方面研究颇多,而对其果实的花色苷抗氧化机制的研究利用未见报道。
本实验以山桃稠李果实花色苷作为抗氧化酶的诱导物,探究花色苷作用于HepG2细胞后,抗氧化系统的分子机制。从mRNA水平上分析花色苷对HepG2细胞的GSTP1、Nrf2、Keap1的基因表达的影响,探讨PI3K-Nrf2/Keap1信号通路在HepG2细胞抗氧化机制中的作用,以期为今后研究山桃稠李果实花色苷提供理论依据。
目前研究发现,调控抗氧化酶的表达的途径较多,其中诱导物对Nrf2/Keap信号通路的调控的途径研究的比较明确[2-3]。在正常状态下,Nrf2/Keap1复合物被控制在胞浆中,当受到诱导物的诱导后,Nrf2从Nrf2/Keap1复合物上解偶联释放,进入核内与ARE相互作用,促进抗氧化酶基因的转录。并且研究表明,磷酯酰肌醇-3-激酶(phosph oinositol-3-kinase,PI3K)能够激活Nrf2使其进入细胞核,并引起抗氧化基因表达上调[4]。
1 材料与方法
1.1 材料与仪器
肝癌HepG2细胞 哈医大肿瘤医院馈赠;山桃稠李 哈尔滨双环园林采摘;小牛血清 杭州四季青产品;噻唑蓝(MTT)、二甲基亚砜(DMSO) Sigma进口分装;改良型RPM I 1640培养基 赛默飞世尔生物化学制品有限公司;胰蛋白酶(2×105U/g) Sigma公司;双抗试剂(100U/m L青霉素、100μg/m L链霉素)北京索莱宝试剂公司;磷酯酰肌醇-3-激酶(PI3K)、焦炭酸二己醋(DEPC) Sigma公司;Trizol氯仿、总RNA提取试剂盒 北京赛百盛基因技术有限公司;RT-PCR试剂盒 宝生物工程(大连)有限公司;2000bPDNALadder 宝生物工程有限公司。
DF-110型电子分析天平 中国轻工业机械总公司;GL-16G-C型高速冷冻离心机 上海科兴仪器有限公司;低温冰箱 美国FORMA公司;酶标仪 美国Biocell公司;CO2培养箱 Thermo Forma公司;倒置显微镜 Nikon公司;ABI PRISM 7500型荧光定量PCR扩增仪 App lied Biosystems公司。
1.2 实验方法
1.2.1 花色苷的制备 分别取山桃稠李果实适量剪枝,榨汁,同pH=2的酸化乙醇按照料液比1∶4(W∶V)混合,提取2次,每次提取12h,合并提取液,旋转蒸发除去乙醇后,经X-5大孔树脂上柱纯化,减压浓缩,真空冷冻干燥得到山桃稠李果实花色苷粉末,-20℃保存。实验时将山桃稠李果实花色苷用PBS缓冲液稀释到一定浓度,0.22μm滤膜过膜备用[5]。
1.2.2 细胞的复苏与培养 从液氮中取出冻存的HepG2细胞迅速放入37℃水浴1m in,并不断摇动使其解冻。1000r/m in离心5m in,吸取上清液,培养于改良型RPMI 1640培养基中加入l00U/m L青霉素,100μg/m L链霉素以及10%的灭活胎牛血清的培养液中。将细胞置于37℃,5%CO2培养箱中培养,HepG2细胞在细胞培养瓶贴壁生长,每种培养液培养细胞均大于3次,每3~4d传代一次。
1.2.3 MTT法检测HepG2细胞生长抑制率 参照文献[6],取对数生长期的HepG2细胞,经胰酶消化后,调整细胞密度为1×105Cell/m L,接种于96孔培养板,每孔100μL,将未经处理的细胞作为对照组,质量浓度为0.05、0.2、0.8mg/m L的花色苷的细胞作为处理组,只加花色苷和培养液而不含细胞的为空白组。其中处理组、对照组及空白组每个浓度各设3个复孔。培养24、48、72h后,每孔加入10μL MTT,继续培养4h,弃上清液,每孔加入150μL DMSO,利用酶标仪在490nm测A值,并计算细胞的生长抑制率。公式如下:
细胞生长抑制率(%)=[1-(处理组A值-空白组A值)/(对照组A值-空白组A值)]×100
1.2.4 细胞内GSH含量与GSH-ST、PI3K活性的测定
参照文献[7]的作法并有所改进,取对数生长期的细胞105Cell/m L均匀铺于24孔板,待细胞贴壁生长后更换培养液,实验组加入质量浓度为0.05、0.2、0.8mg/m L的山桃稠李果实花色苷的培养液,对照组加入正常的细胞培养液。在37℃,5%CO2培养箱中继续培养48h后,弃培养液,PBS清洗两遍,胰酶消化,1000r/m in离心5m in后收集细胞,细胞裂解液裂解细胞,离心后得细胞上清液,取适量进行蛋白质含量测定。按试剂盒说明进行操作,测定GSH含量与GSH-ST、PI3K活性。
1.2.5 山桃稠李花色苷对Nrf2/Keap1的基因表达的影响 实时荧光定量RT-PCR实验方法检测山桃稠李果实苷对HepG2细胞的Nrf2、Keap1、GSTP1的基因表达的影响。Gene Bank中找到Nrf2、Keap1、GSTP1基因序列,并利用加拿大Prem ier公司的Primer primer 5.0引物设计软件进行引物的设计,委托博仕生物公司进行合成。采用Trizol法提取细胞总RNA,紫外分光光度计测定总RNA的含量与纯度,反应条件设置为预变性温度95℃时间10min,变性温度95℃时间15s,退火温度60℃时间30s,延伸温度72℃时间30s,循环40次,缓慢升温的温度60~95℃,产生溶解曲线。
所有样本重复检测3次,每次均设空白对照,以GAPDH作内参基因。反应结束后,使用ABI PRISM 7500型荧光定量PCR扩增仪检测样品中目标基因的含量,以2-ΔΔCT作为目的基因的表达量,2-ΔΔCT表示处理组的目的基因相对于对照组原始模板浓度的倍数差异。
1.3 数据分析
作图采用Origin 8.0软件,统计学处理实验数据采用SPSS 13.0统计软件,One-Way ANOVA进行处理和显著性分析检验,在p>0.05水平上差异不显著;在p<0.05水平上差异显著。
2 结果与分析
2.1 山桃稠李果实花色苷对HepG2细胞增殖抑制结果
山桃稠李果实花色苷作用HepG2细胞24、48、72h后,结果如表1所示。随着花色苷浓度的升高以及作用时间的延长,对HepG2细胞增殖的抑制作用都逐渐增强,并呈浓度依赖与时间依赖。与对照组(未经处理的细胞)相比差异显著(p<0.05),并且在同一时间点各浓度之间,同一浓度各时间点之间,山桃稠李果实花色苷对HepG2细胞的抑制率均有显著差异(p<0.05)。当质量浓度为0.8mg/m L山桃稠李果实花色苷处理HepG2细胞24、48、72h后,抑制率分别为30.79%±2.38%、47.77%±3.61%、54.11%±3.47%。
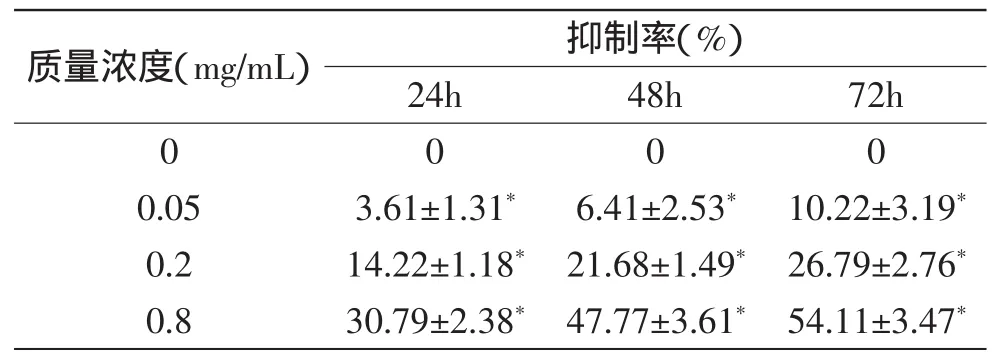
表1 MTT法检测山桃稠李果实花色苷对HepG2细胞抑制率Table1 Inhibition of the anthocyanin extracted from Prunusmaackii on the proliferation of HepG2 cell tested by MIT
2.2 细胞内GSH含量与GSH-ST、PI3K活性的测定结果
山桃稠李果实花色苷作用于HepG2细胞48h后,由表2可知,随山桃稠李花色苷质量浓度的增大,GSH的含量与对照组相比逐渐减少,且呈一定的量效关系,质量浓度为0.05mg/m L山桃稠李花色苷与对照组相比差异显著(p<0.05),且当质量浓度大于0.2mg/m L时,HepG2细胞内GSH的含量与对照组相比差异极显著(p<0.01)。细胞内GSH-ST的活性出现下降趋势,即随着花色苷质量浓度的增大,GSH-ST的活性逐渐降低:当质量浓度为0.05mg/m L时,山桃稠李与对照组的差异显著(p<0.05);当质量浓度大于0.2mg/m L时,与对照组的差异极显著(p<0.01)。而在检测PI3K活性时发现处理组的OD值虽均大于对照组,但却随着三种果实花色苷质量浓度的升高PI3K激酶的活性在逐渐降低,且各浓度与对照组比差异极显著(p<0.01),呈量效关系。
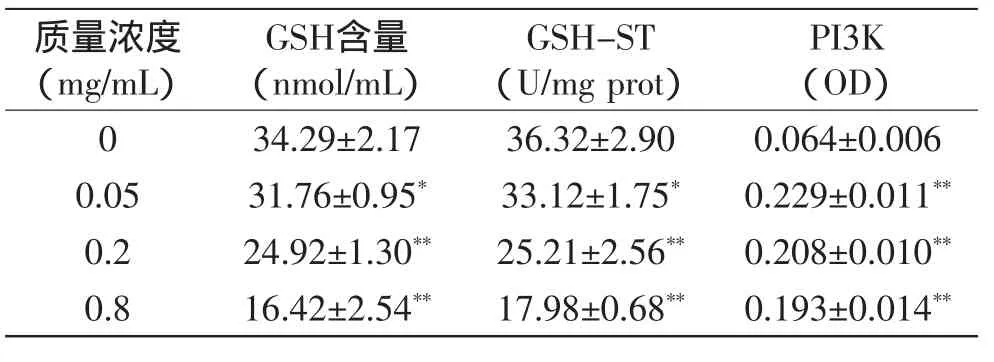
表2 山桃稠李花色苷对HepG2细胞内GSH含量及GSH-ST、PI3K激酶活性的影响Table2 Effectof anthocyanins extracted from Prunusmaackii on the contentof GSH and activity of GSH-ST、PI3K in the HepG2 cells
2.3 山桃稠李花色苷对Nrf2、Keap1、GSTP1的基因表达的影响
2.3.1 山桃稠李花色苷对GSTP1的基因表达的影响采用实时荧光定量RT-PCR法,深入探讨稠李属果实花色苷对GSTP1 mRNA在HepG2细胞中的表达的影响。结果如图1所示,山桃稠李果实花色苷作用于HepG2细胞48h后,GSTP1 mRNA的表达与对照组相比较均下调,且随花色苷质量浓度的增大而逐渐降低。与对照组相比较GSTP1 mRNA的表达水平极显著降低(p<0.01),说明山桃稠李果实花色苷影响了HepG2细胞中GSTP1的转录因子的表达,从而下调了HepG2细胞的抗氧化酶的表达。
2.3.2 山桃稠李花色苷对Nrf2的基因表达的影响
本实验同时探讨了稠李属果实花色苷对PI3K-Keap1/ Nrf2通路的影响,检测了山桃稠李果实花色苷作用HepG2细胞48h后,Nrf2 mRNA在细胞中的表达情况。结果见图1,山桃稠李果实花色苷作用于HepG2细胞48h后,Nrf2 mRNA的表达均随花色苷质量浓度的增大而逐渐降低。与对照组相比较Nrf2 mRNA的表达水平极显著降低(p<0.01),说明由于花色苷的作用,PI3K激酶活力的下降,抗氧化系统受到破坏,影响了Nrf2与Keap1解离。
2.3.3 山桃稠李花色苷对Keap1的基因表达的影响
为进一步探究稠李属果实花色苷对PI3K-Keap1/Nrf2通路的影响,检测了山桃稠李果实花色苷作用HepG2细胞48h后,Keap1 mRNA在细胞中的表达情况。结果如图1所示,在花色苷的质量浓度为0.05mg/m L时,山桃稠李与对照组比较差异不显著(p>0.05)。在花色苷的质量浓度增加到0.2mg/m L时,山桃稠李与对照组相比Nrf2 mRNA的表达水平均极显著降低(p<0.01)。并且,山桃稠李果实花色苷作用于HepG2细胞48h后,Keap1的基因表达均随花色苷质量浓度的增大而下调。说明由于花色苷的作用,使得Nrf2与Keap1的基因表达量均有所减少。

图1 山桃稠李花色苷对Nrf2、Keap1、GSTP1的基因表达的影响Fig1 Effectof anthocyanins extracted from Prunusmaackii on Nrf2、Keap1、GSTP1 in genetic expression
3 结论与讨论
GSTP1属于谷胱甘肽转移酶系(GSTs),存在于胎盘和肺脏中,是重要的解毒酶。能够保护正常细胞免有毒化合物的攻击,分解代谢有毒物质,若抑制GSTP1的活性则可增强DNA损伤的敏感性。GSTP1在HepG2等肿瘤细胞组织中易表达调控,具有紧密的关系且大量存在[8]。
在细胞内调节抗氧化反应的一个重要的核转录因子为Nrf2,正常状态下,与Keap1结合,同时被一些活性酶类降解,使细胞内部处于动态平衡状态。但当Nrf2受外界因子及自身蛋白激酶(PKC)的影响而激活后,Nrf2与Keap1解离后进入细胞核内,影响抗氧化酶的表达[9]。
由山桃果实花色苷对HepG2细胞抗氧化系统的影响实验结果[10]可知,细胞内抗氧化酶GSH-ST的活性随着花色苷质量浓度的增大而逐渐降低,细胞内GSH的含量也随着花色苷质量浓度的增大而逐渐减少,即GSH-ST活性以及GSH的含量均出现下降的趋势。花色苷可引起HepG2细胞内PI3K激酶活性的降低,而PI3K途径参与了Nrf2/Keap1激活及其基因表达的调控。所以当PI3K激酶活性的降低时,Nrf2、Keap1的mRNA的表达受到抑制,使得Nrf2、Keap1的含量降低,Nrf2与抗氧化反应原件结合减小,导致抗氧化酶GSTP1mRNA的表达下调。而山桃稠李果实花色苷可通过降低胞内抗氧化酶活性而增加HepG2细胞内的ROS含量,ROS又会直接攻击抗氧化酶,迫使细胞内氧化应激压力增加导致细胞过氧化损伤,甚至凋亡。
近些年,Keap1/Nrf2信号通路成为抗氧化机制研究的热点[11-14]。但机体的抗氧化机制依然存在许多无法解释说明的问题,仍需要更深入的研究。
[1]王宝臣,王文珍,王振东,等.山桃稠李育苗技术探讨[J].绿色科技,2012(2):93.
[2]刘晓平.癌症预防中的Nrf2-Keap1-ARE通路[J].中国临床药理学与治疗学,2008,13(6):712-716.
[3]江刚,戴爱国,胡瑞成.Nrf2调控C-谷氨酰半胱氨酸合成酶表达与慢性阻塞性肺疾病[J].国际呼吸杂志,2007,27(4):265-269.
[4]Bertram J,Peacock JW,Tan C,et al.Inhibition of the phosphatidylinositol 3’-kinase pathway promotes auto-crine Fas-induced death of phosphatase and tensin hom-ologuedeficient prostate cancer cells[J].Cancer Res,2006,66(9):4781-4788.
[5]王以美,彭双清,董延生,等.丁烯酸内酯对HepG2细胞抗氧化功能的影响[J].毒理学杂志,2008,22(4):252-254.
[6]Mosmann T.Rapid colorimetric assay for cellular growth and survival:applicatio to proliferation and cytotoxicit yassays[J].ImmunolMethods,1983,65(1-2):55-63.
[7]张婷,陈倩,汤树生,等.喹乙醇对HepG2细胞抗氧化系统的影响[J].癌变·畸变·突变,2010,22(5):361-365.
[8]闵翠丽.谷胱甘肽转移酶P1在肿瘤诊治中的研究进展[J].中国现代药物应用,2009,3(14):203-204.
[9]Dinkova-Kostova AT,Holtzclaw WD,Cole RN et al.Direct evidence that sulfhydryl groups of Keap1 are the sensors regulating induction of phase 2 enzymes that protect against carcinogens and oxidant ts[J].Proc Natl Acad Sci USA,2002,99(18):11908-11913.
[10]刘荣,辛越,何娇.山桃稠李果实花色苷对HepG2细胞抗氧化系统的影响[J].食品工业科技,2013,34(9):348-351.
[11]Cullinan B,Zhang D,HanninkM,et al.Nrf2 was a direct PERK substrate and effector of PERK-dependent cell survival [J].Mol Cell Biol,2003,23(20):7198-7209.
[12]Nguyen T,Yang CS,PickettCB.The pathways andmolecular mechanisms regulating Nrf2 activation inresponse to chemical stress[J].Free Radic BiolMed,2004,37(4):433-441.
[13]Itoh K, Tong KI, Yamamoto M.Molecular mechanismactivating Nrf2-Keap1 patway in regulation of adaptiveresponse to electrophiles[J].Free Radic Biol Med,2004,3(10):1208-1213.
[14]Motohashi H, Yamamoto M.Nrf2-Keap1 defines aphysiologically important stress resp onsemechanism[J].Trends MolMed,2004,10(11):549-557.
