内源乳化凝胶化法制备海藻酸钙微胶珠的工艺优化
2014-02-13梁新晓贠婷婷田科雄付亭亭李爱科赵明久王永伟侯义江綦文涛
梁新晓,贠婷婷,田科雄,付亭亭,李爱科,赵明久,王永伟,侯义江,綦文涛,
(1.国家粮食局科学研究院,北京 100037;2.湖南农业大学动物科技学院,湖南 长沙 410128)
微胶囊技术是一种保护性技术,它能把化工产品、生物制品,甚至细胞等物质固定和隔离在球形微粒中,使其避免外部胁迫的影响,最大限度地保护产品质量稳定性,同时还具有缓控释放的特点,已在医药食品、化工和饲料行业中得到广泛应用[1]。NaAlg由于具有良好的成膜性、生物相容性和可生物降解性等优点,成为微胶囊包被材料研究的热点[2]。通常,微胶囊制备的首要步骤是得到粒径尺寸适宜、分布均匀、形态良好的微胶珠,同时,为降低成本,微胶珠的回收率和产率也是重点考虑的制备参数。在目前的微胶珠制备技术中,挤压法具有设备简单、成本低廉等优势,其缺点是生产的微胶珠粒径较大(通常在1~2 mm之间),制得产品易破碎、传质性能差且生产效率较低[3-4]。喷雾法也具有成本低廉的特点,且产量大,易于规模化生产,但其缺点是制备过程机械强度大、产品粒径大小不易控制,分布不均匀等,因此不适合用于细胞等活性物质的包埋。此外,常见的微胶珠制备技术还有静电法和振动喷头法等,但普遍存在生产设备复杂、投入大、生产效率低等缺点,因此限制了其广泛应用[5]。
许多研究表明,利用乳化法可以规模化生产较小粒径微胶珠(<1 mm),具有生产设备和操作简单的优点[6-7]。乳化法制备海藻酸钙微胶珠可分为内部凝胶化和外部凝胶化两种。乳化-外部凝胶化是指NaAlg溶液与油相混合形成乳化液,通过加入CaCl2溶液,从NaAlg外部引发凝胶化反应,但由于CaCl2难溶于油相,破坏乳状液滴形成,在完全固化前出现凝胶相互聚集现象,导致微胶珠形态差,粒径分布广[8-9]。而入源乳化凝胶化可很好解决这些问题,它是利用NaAlg与不溶性钙盐混合作为水相分散到油相中形成稳定的乳化液,通过降低体系pH值,释放Ca2+与海藻酸根离子结合形成海藻酸钙微胶珠,利用该方法能制备出形态好、粒径均匀的海藻酸钙微胶珠[10-11]。同时具有制备设备简单、操作简单、反应条件温和等优点,非常适合用作DNA[12]、细胞[13-14]、激素[15-16]、蛋白质[17]等的包埋。然而,系统研究制备过程关键工艺参数及石蜡重复利用次数等对海藻酸钙微胶珠性能,包括形态、产率和粒度分布等的研究还较少。微胶囊由于其独特的优势在益生菌的应用领域日益受到重视。基于不同原理基础之上的益生菌微胶囊制备方法层出不穷。然而益生菌作为活细胞,其包被对微胶囊的要求也较高,除了微胶囊粒径大小和均匀性有一定限制外,为了充分保持微生物细胞的活性,对微胶囊制备过程的降低胁迫要求也较高。本实验利用内源乳化凝胶化原理制备微胶珠,整个过程条件温和,制得的微胶珠形态良好、产率较高、粒径合适,在微生物等活细胞的包被领域具有很好的应用前景。
本研究的主要目的是利用内源乳化凝胶化法对制备粒径在300~600 μm用于发酵前包被益生菌微胶珠的工艺参数进行了优化,并考察油相液体石蜡回收重复利用次数对微胶珠产品质量的影响,以期在获得乳化法制备益生菌发酵前包被微胶囊最佳工艺参数的基础上,进一步降低工艺成本,为微胶囊在益生菌领域的广泛应用提供技术支持。
1 材料与方法
1.1 材料与试剂
NaAlg、Span 80、Tween 80、液体石蜡(均为化学纯),CaCO3、冰醋酸(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
JJ-4A六联电动搅拌器 上海乔跃电子有限公司;CKX41生物倒置显微镜 日本Olympus公司;Mastersizer 2000 激光粒度仪 英国马尔文仪器有限公司;LVDVC黏度计 美国Brook field公司。
1.3 方法
1.3.1 微胶珠的粒径分布
用激光粒度仪测定微胶珠粒径分布及体积平均粒径,取制备的海藻酸钙微胶珠样品30 mL左右,去离子水作为分散剂,泵速为2 500 r/min,遮光度控制在10%~15%之间,每个样品测定3 次,取平均值。
1.3.2 海藻酸钙微胶珠形态
在倒置显微镜下观察微胶珠的球形度和表面光洁度,用“++、+、-”分别来表示“好、一般、差”。
1.3.3 海藻酸钙微胶珠产率计算
滤纸放置烘箱中65 ℃干燥30 min并记录质量,用滤纸过滤得到海藻酸钙微胶珠,微胶珠与滤纸一同放置烘箱中65 ℃干燥至质量恒定,计算微胶珠的干质量,根据式(1)计算海藻酸钙微胶珠的产率[18]。
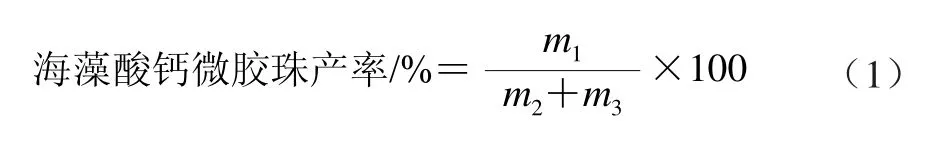
式中:m1为海藻酸钙微胶珠的干质量;m2为加入反应体系中NaAlg的干质量;m3为CaCO3的干质量。
1.3.4 分离效率测定
固化结束后,加去离子水分离沉淀海藻酸钙微胶珠。通过测定在10 min内海藻酸钙微胶珠从油相沉降进入水相中的速度来表征其分离效率好坏。用“++、+、-”分别来表示“快、中速、慢”。
1.3.5 海藻酸钙微胶珠制备工艺
按与NaAlg一定的质量比,称取CaCO3,分散于少量蒸馏水中,然后加入一定质量浓度完全溶解的NaAlg溶液,搅拌均匀,作为水相;表面活性剂Span 80充分分散于液体石蜡中作为油相,按一定水油两相体积比值,往油相中加入水相,以400 r/min搅拌5 min形成稳定的乳化液;向其中加入冰醋酸酸解CaCO3解离出Ca2+,与NaAlg产生凝胶化反应,形成海藻酸钙微胶珠,固定化时间为10 min,最后用体积分数1% Tween 80溶液和去离子水依次冲洗,通过分液漏斗分离沉降海藻酸钙微胶珠。
1.3.6 制备工艺条件优化
对海藻酸钙微胶珠制备过程中各变量进行单因素分析,各变量水平包括:NaAlg原液质量浓度(5、10、15 g/L和20 g/L);表面活性剂Span 80分散于液体石蜡中的质量浓度(1、5、10 g/L和15 g/L);CaCO3和NaAlg质量比(1∶1、1∶3、1∶5和1∶7);水与油两相体积比(1∶1、1∶3、1∶5、1∶7)。以微胶珠形态、粒径大小和产率为评价指标,通过正交试验L9(34)摸索最佳制备工艺条件。将回收微胶珠后的液体石蜡收集,并用于下一次的微胶珠制备,依次类推,并对制备所得的微胶珠进行质量和产率分析。另外,对于分离回收的液体石蜡,记录回收体积和使用黏度计测定其黏度值,式(2)计算液体石蜡回收率。每个实验重复3 次,每个样品测定3 次,结果取平均值。
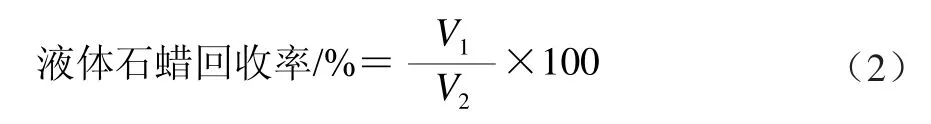
式中:V1为液体石蜡利用回收后的体积;V2为液体石蜡利用前的体积。
2 结果与分析
2.1 NaAlg质量浓度对微胶珠品质的影响
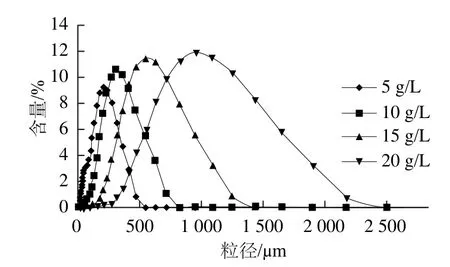
图1 NaAlg质量浓度对海藻酸钙微胶珠粒径的影响Fig.1 Effect of sodium alginate concentration on the particle size of calcium alginate microbeads

表1 NaAlg质量浓度对海藻酸钙微胶珠品质的影响Table 1 Effect of sodium alginate concentration on the quality of calcium alginate microbeads
Ca2+与海藻酸根离子结合形成海藻酸钙凝胶是微胶珠成型的关键,海藻酸根的质量浓度,即NaAlg的质量浓度在决定凝胶结构和致密性的同时,还会影响微胶珠的粒径大小、分布和形态等[19]。由图1和表1可知,在本工艺条件下,NaAlg质量浓度越大,海藻酸钙微胶珠的平均粒径越大,其分布也越宽,但分离效果较好。原因是质量浓度的提高增加了NaAlg溶液的黏度,当在一定剪切力下,高黏度NaAlg不易被分散,所以形成的油包水体系粒径较大,粒径分布也较宽[20]。尽管低黏度NaAlg可以制备粒径较小的微胶珠,但此时的微胶珠容易聚结成团,造成分离效率较低。通常用于包被微生物细胞的微胶囊尺寸以400 μm左右为最佳。粒径过大,微胶囊的机械性能差,易破碎,内部传质效果不利于微生物的充分增殖;粒径过小,微胶囊膨胀系数小,微生物生长过程易造成细胞的泄漏和微胶囊的破碎[13]。因此,综合以上各个因素,结果表明,NaAlg质量浓度为15 g/L时,微胶珠产率高、形态良好、易于分离。此时微胶珠平均粒径大小为481 μm,适合微生物包被用微胶囊的制备。
2.2 表面活性剂Span 80质量浓度对微胶珠品质的影响
由于油相表面张力较大,与水相混合时,形成稳定乳化体系的难度较大,不利于微胶珠的制备,因此制备过程中,需要加入一定量表面活性剂,以调节油相的表面张力。选择好的乳化剂是制备稳定乳状液的关键,表面活性剂亲水亲油平衡值(hydrophilic lypophilic balance,HLB)越低,亲油性越强,愈易形成油包水型乳状液,通常选择HLB值小的Span类表面活性剂,研究比较表面活性剂Span 85与Span 80对乳状液稳定性影响发现,Span 80能更快地稳定乳状液,防止液滴重聚,粒径分布也越窄,同时,Span 80具有无毒、不溶于水等特性,广泛应用于化妆品、生物医药、化工等行业中[21]。

图2 Span 80质量浓度对海藻酸钙微胶珠粒径的影响Fig.2 Effect of Span 80 concentration on the particle size of calcium alginate microbeads

表2 Span 80质量浓度对海藻酸钙微胶珠品质的影响Table 2 Effect of Span 80 concentration on the quality of calcium alginate microbeads
由图2可见,随着表面活性剂Span 80质量浓度的增加,微胶珠粒径变小,粒径分布变窄,但分离效果变差,导致回收率降低。同时,表面活性剂质量浓度的增大,增加了吸附在水油界面上分子的紧密度,致使界面膜强度增强,增加了醋酸分子通过水油界膜的难度,因此降低了微胶珠产率,如表2所示。因此,综合考虑微胶珠的形态、回收率及粒径大小和分布等因素,表面活性剂Span 80的质量浓度为1 g/L时可满足粒径为400 μm左右微胶囊的制备。
2.3 CaCO3与NaAlg质量比对微胶珠品质的影响
由图3可见,CaCO3与NaAlg的不同质量比对微胶珠粒径的影响不显著。从表3可以看出,不同质量比条件下制备的微胶珠都具有良好的形态和分离效率,粒径分布均在450 μm左右。酸引发的钙离子数与NaAlg结合引起凝胶化反应,当CaCO3与NaAlg质量比在1∶1~1∶3左右时,此时钙离子质量浓度相对较大,酸引发CaCO3时产生二氧化碳气体破坏了微胶珠表面结构,出现小孔现象,这影响了微胶珠产品形态和性能。当CaCO3与NaAlg质量比为1∶5时,钙离子质量浓度相对较低,同时海藻酸钙微胶珠结构较紧密,生成的CO2气体不足以对微胶珠结构造成较大的破坏,因此制备的微胶珠形态良好,回收率和产率都较高。当CaCO3与NaAlg质量比进一步增大至1∶7时,由于钙离子数量少,形成微胶珠结构强度不足,清洗过程易破碎,因此大大降低了微胶珠的产率。
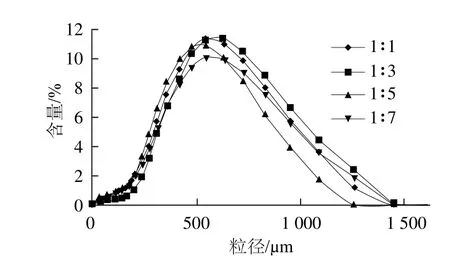
图3 CaCO3与NaAlg质量比对海藻酸钙微胶珠粒径的影响Fig.3 Effect of mass ratio of CaCO3 to sodium alginate on the particle size of calcium alginate microbeads
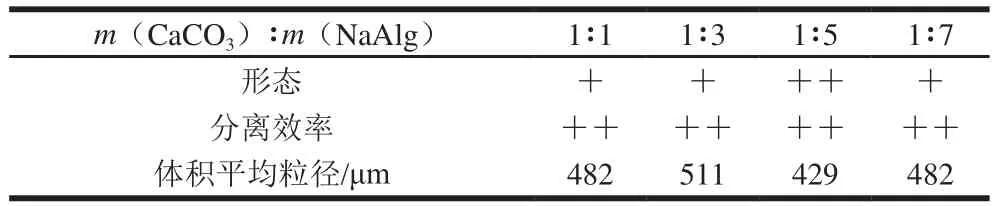
表3 CaCO3与NaAlg质量比对海藻酸钙微胶珠品质的影响Table 3 Effect of mass ratio of CaCO3 to sodium alginate on the quality of calcium alginate microbeads
2.4 水油两相体积比值对微胶珠品质的影响

图4 水油两相体积比值对海藻酸钙微胶珠粒径的影响Fig.4 Effect of volumetric ratio of water to oil on the particle size of calcium alginate microbeads
从图4可知,随着水油两相体积比值的减少,微胶珠粒径逐渐增大,分布变宽。从表4可知,在本实验所选择的不同水油两相体积比值下,水油两相体积比值越小,微胶珠的形态越好,回收率越高。然而,过低的水油两相比值不但显著增加了微胶珠的制备成本,也使得微胶珠的分离难度加大。另一方面,水油相比值过高,形成的微胶珠密度过大,增加了微胶珠之间相互接触和聚结的机会,因此影响了其单分散性和形态。结果表明当水油相体积比为1∶3时,微胶珠生产性能最优。
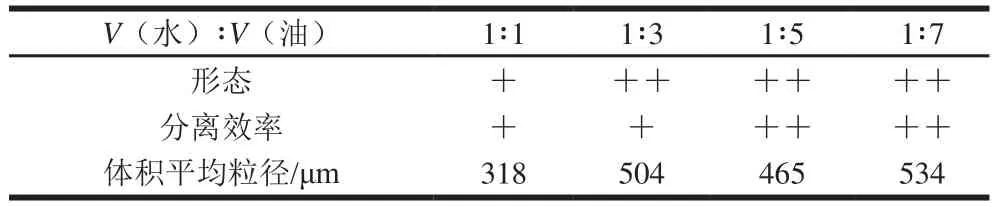
表4 水与油两相体积比值对海藻酸钙微胶珠品质的影响Table 4 Effect of volumetric ratio of water to oil on the quality of calcium alginate microbeads
2.5 正交试验
在上述单因素试验结果分析的基础上,以微胶珠粒径和分离效率作为评价指标,对影响内源乳化凝胶化法制备微胶珠的4 个主要影响因素,包括NaAlg质量浓度、Span 80质量浓度、CaCO3与NaAlg质量比及水油两相体积比值等,采用L9(34)正交设计对工艺条件进行了优化,试验各因素水平设计如表5、6所示。

表5 正交试验因素水平表Table 5 Coded levels for independent variables used in orthogonal array design

表6 正交试验设计及结果Table 6 Orthogonal array design and results
由表6可知,影响海藻酸钙微胶珠产率因素大小为水油两相体积比值>NaAlg质量浓度>Span 80质量浓度>CaCO3与NaAlg质量比,最优组合为A1B2C3D1。即NaAlg质量浓度12 g/L、Span 80质量浓度2 g/L、CaCO3与NaAlg质量比1∶4、水油两相体积比值1∶3,根据优化工艺参数制备得到微胶珠显微镜照片如图5所示,微胶珠形态较好,粒径均匀,大小在450 μm左右,如图6所示,与单因素分布结果基本一致。

图5 海藻酸钙微胶珠示意图(×40)Fig.5 Micrograph of calcium alginate microbeads (× 40)

图6 海藻酸钙微胶珠粒径分布图Fig.6 Particle size distribution of calcium alginate microbeads
2.6 液体石蜡回收再利用

表7 回收利用液体石蜡对海藻酸钙微胶珠性能的影响Table 7 Effect of repeated use of liquid paraffin on properties of calcium alginate microbeads
按照上述优化得到最佳工艺对分离回收油相液体石蜡进行多次重复利用,通过测定海藻酸钙微胶珠形态和粒径表述液体石蜡重复利用最大次数。液体石蜡回收利用次数对其回收率、黏度、微胶珠形态及产率的影响,结果如表7和图7所示。液体石蜡重复利用次数并没有显著影响其黏度,因此,制备得到的微胶囊保持了很好的形态,粒径大小和分布也没有发生显著变化。液体石蜡的回收率基本维持在90%以上。液体石蜡的回收利用对微胶珠产率影响也不显著,保持在70%左右。由于液体石蜡在内源乳化凝胶化法制备微胶囊工艺中占据了较高的材料成本,因此其回收利用对于降低微胶囊产品成本,简化制备工艺具有重要的意义。

图7 第10次回收利用液体石蜡制备海藻酸钙微胶珠示意图(×40)Fig.7 Micrograph of calcium alginate microbeads prepared by tenth repeated use of liquid paraffin (× 40)
3 结 论
通过单因素分析和正交试验对内源乳化凝胶化法制备微胶珠的工艺进行了优化研究,得到最佳工艺参数为NaAlg质量浓度12 g/L、Span 80质量浓度2 g/L、CaCO3与NaAlg质量比1∶4、水相与油相体积比值1∶3,在此条件下制备的微胶珠形态良好、产率较高,粒径在450 μm左右,且分布均匀。同时,在此工艺条件下液体石蜡在不经过任何处理的条件下重复利用10 次,不会对微胶珠的制备性能产生显著影响,有效地降低了微胶珠的生产成本。
[1]许时婴.微胶囊技术: 原理与应用[M].北京: 化学工业出版社, 2006.
[2]SMIDSRØD O, SKJÅK-BRÆK G.Alginate as immobilization matrix for cells[J].Trends in Biotechnology, 1990, 8: 71-78.
[3]PONCELET D, LENCKI R, BEAULIEU C, et al.Production of alginate beads by emulsi fication/internal gelation.Ⅰ.Methodology[J].Applied Microbiology and Biotechnology, 1992, 38(1): 39-45.
[4]HOFFMAN A S.Hydrogels for biomedical applications[J].Advanced Drug Delivery Reviews, 2002, 54(1): 3-12.
[5]PONCELET D, de SMET B P, BEAULIEU C, et al.Production of alginate beads by emulsification/internal gelation.Ⅱ.Physicochemistry[J].Applied Microbiology and Biotechnology, 1995,43(4): 644-650.
[6]TAKEI T, YOSHIDA M, HATATE Y, et al.Preparation of lactic acid bacteria-enclosing alginate beads in emulsion system: effect of preparation parameters on bead characteristics[J].Polymer Bulletin,2009, 63(4): 599-607.
[7]CHAN L W, LEE H Y, HENG P W S.Production of alginate microspheres by internal gelation using an emulsi fication method[J].International Journal of Pharmaceutics, 2002, 242(1/2): 259-262.
[8]SONG Huiyi, YU Weiting, GAO Meng, et al.Microencapsulated probiotics using emulsi fication technique coupled with internal or external gelation process[J].Carbohydrate Polymers, 2013, 96(1):181-189.
[9]WAN L S, HENG P W, CHAN L W.Drug encapsulation in alginate microspheres by emulsification[J].Journal of Microencapsulation,1992, 9(3): 309-316.
[10]PONCELET D, BABAK V, DULIEU C, et al.A physico-chemical approach to production of alginate beads by emulsification-internal ionotropic gelation[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1999, 155(2/3): 171-176.
[11]PONCELET D.Production of alginate beads by emulsi fication/internal gelation[J].Annals of the New York Academy of Sciences, 2001, 944:74-82.
[12]ALEXAKIS T, BOADI D K, QUONG D, et al.Microencapsulation of DNA Within alginate microspheres and crosslinked chitosan membranes forin vivoapplication[J].Applied Biochemistry and Biotechnology, 1995, 50(1): 93-106.
[13]HOESLI C A, RAGHURAM K, KIANG R L J, et al.Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation[J].Biotechnology and Bioengineering, 2011, 108(2): 424-434.
[14]ZOU Qiang, ZHAO Jianxin, LIU Xiaoming, et al.Microencapsulation ofBifidobacterium bifidumF-35 in reinforced alginate microspheres prepared by emulsi fication/internal gelation[J].International Journal of Food Science and Technology, 2011, 46(8): 1672-1678.
[15]SILVA C M, RIBEIRO A J, FIGUEIREDO V F, et al.Alginate microspheres prepared by internal gelation: development and effect on insulin stability[J].International Journal of Pharmaceutics, 2006,311(1/2): 1-10.
[16]GUAN Huanan, CHI Defu, YU Jia, et al.Encapsulated ecdysone by internal gelation of alginate microspheres for controlling its release and photostability[J].Chemical Engineering Journal, 2011, 168(1):94-101.
[17]LI Ranran, ZHANG Xingxiang, SHI Haifeng.Effect of manufacturing parameters on the release profiles of casein-loaded alginate microspheres prepared by emulsi fication/internal gelation[J].Journal of Controlled Release, 2011, 152(Suppl 1): e154-e155.
[18]林军章, 于炜婷, 徐小溪, 等.乳化/内部凝胶化工艺制备海藻酸钙凝胶微球的研究[J].功能材料, 2008, 39(11): 1879-1881.
[19]LIU Xiudong, BAO Decai, XUE Weiming et al.Preparation of uniform calcium alginate gel beads by membrane emulsification coupled with internal gelation[J].Journal of Applied Polymer Science,2003, 87(5): 848-852.
[20]LEE H Y, CHAN L W, DOLZHENKO A V, et al.Influence of viscosity and uronic acid composition of alginates on the properties of alginate films and microspheres produced by emulsi fication[J].Journal of Microencapsulation, 2006, 23(8): 912-927.
[21]刘袖洞.膜乳化内部凝胶化过程及海藻酸钙凝胶珠性能研究[D].大连: 中国科学院大连化学物理研究所, 2002.
