IL-11对ITP患者Th1、Th2细胞及T-bet、GATA-3 mRNA的影响
2014-01-05姚荣欣李欠欠林颖周谢敏包云华
姚荣欣,李欠欠,林颖,周谢敏,包云华
(1.温州医科大学附属第二医院 血液科,浙江 温州 325027;2.耶鲁大学医学院 病理科,New Haven,Connecticut,06520)
细胞因子白细胞介素-11(IL-11)由人类骨髓基质细胞及间质细胞分泌产生,近年来,国内外有报道使用IL-11治疗免疫性血小板减少症(immune thrombocytopenia,ITP)取得了较好的效果[1-6],但其机制不明。本研究观察ITP患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)在体外加入IL-11培养后Th1、Th2细胞比例及T-bet mRNA和GATA-3 mRNA的改变,探讨IL-11治疗ITP的作用机制。
1 对象和方法
1.1 研究对象 选取2011年6月-2012年8月在本院住院的ITP患者10例,均符合下列条件:首次发病者院外未应用过丙种球蛋白、糖皮质激素;ITP复发者近半年未应用糖皮质激素;近4周无感染及其他急慢性疾病;无过敏和免疫性疾病史及家族史。其中男4例,女6例,平均年龄(32.8±9.4)岁。
1.2 试剂与仪器 IL-11(巨和粒)购自山东齐鲁制药厂;CD3 PerCP、IL-4 PE、IFN-γAPC、CD8 FITC、IGG1 PE、IGG1 APC、CD69 PE(BD Biosciences,美国);BFA、PMA、离子霉素(Sigma,美国);人淋巴细胞分离液(TBD,天津);胎牛血清(四季青,杭州);RPMI 1640培养液(Gibco,美国);Trizol(Invitrogen,美国);MBI RT试剂盒(Fermentas,加拿大);Roche SYBR Green I染料(Roche,瑞士);BD FACS Canto II流式细胞仪(BD Biosciences,美国);Roche LightCycler 480荧光定量PCR仪(Roche,瑞士);酶标仪(Tecan,瑞士)。
1.3 实验方法
1.3.1 PBMC分离:无菌抽取每例ITP患者外周静脉血10 mL,肝素抗凝,用PBS液1:1稀释后,用密度梯度离心法分离PBMC,锥虫蓝染色法测定细胞活率大于95%。
1.3.2 加IL-11后细胞培养:PBMC用培养液调整细胞浓度(分别加入100 U/mL青霉素+100 U/mL链霉素+100 U/mL IL-2)至6×107个细胞/mL,各取1 mL分装于6孔板内中,编号1、2、3、4、5,分别加入IL-11 0、25、50、100及200 ng。放入37 ℃、5%CO2恒温孵育箱内,培养4 d,锥虫蓝染色法测定细胞活率大于95%。
1.3.3 Th1、Th2细胞测定:将培养4 d后每孔细胞悬液分别取培养液200 L,用流式细胞仪测CD4+T细胞Th1细胞、Th2细胞比例。采用CD3与CD8反射门选取CD4+T细胞,即以CD3+CD8-IFN-γ+(APC标记IFN-γ)标记Th1,以CD3+CD8-IL-4+(PE标记IL-4)标记Th2,因Th1、Th2分群不明显,应用CD3+CD8-IFN-γ-及CD3+CD8-IL-4-作为阴性对照,设定细胞计数小于0.1%作为阴性阈值,在阴性阈值基线基础上计数CD3+CD8-IFN-γ+细胞及CD3+CD8-IL-4+细胞。采用流式细胞术检测淋巴细胞群中Th1、Th2细胞所占百分比,并计算Th1细胞与Th2细胞比值(Th1/Th2)。
1.3.4 T-bet mRNA、GATA-3 mRNA检测:培养4 d后每孔细胞悬液取1×106,采用Trizol试剂提取总RNA,采用Tecan酶标仪测量其浓度和纯度,用琼脂凝胶电泳检测RNA的完整性。取总RNA 1μg反转录为cDNA。用SYBR Green I染料检测T-bet mRNA、GATA-3 mRNA表达情况。引物序列见表1,以GAPDH作为内参基因,每个标本分别进行T-bet、GATA-3、GAPDH的检测。反应条件:热启动95 ℃ 5 min;扩增(95 ℃ 10 s,60 ℃ 20 s,60 ℃采集荧光信号一次)连续45个循环;熔解95 ℃ 15 s,65 ℃15 s,升温到95 ℃的同时连续检测荧光信号。每个标本重复设3个副孔。所有的PCR产物均经熔解曲线分析以分辨目的产物与非特异产物以及引物二聚体。质控:加一个空白管,用双蒸水替代cDNA。以Target/Ref进行相对定量,即分别以T-bet/GAPDH和GATA-3/GAPDH表示T-bet mRNA、GATA-3 mRNA表达量。并计算T-bet mRNA与GATA-3 mRNA的比值。
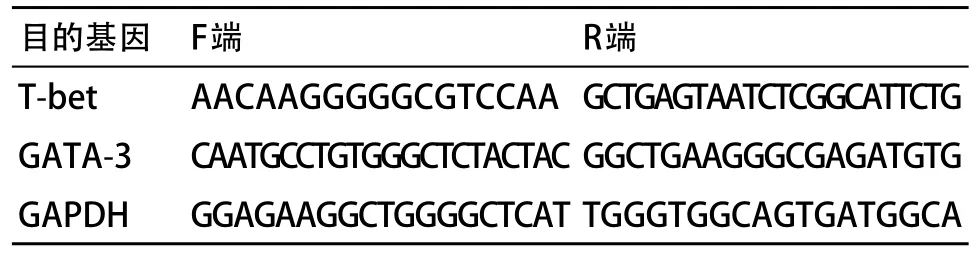
表1 引物序列
1.4 统计学处理方法 采用SPSS16.0软件作数据处理。检测指标以 ±s描述,多组间均数比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 CD4+T细胞Th1、Th2流式细胞仪测定结果 ITP患者PBMC加入不同浓度的IL-11培养后,对各组间Th1、Th2比例及Th1/Th2分别进行单因素方差分析(方差齐性检验P>0.1),结果显示P均小于0.05,说明不同浓度IL-11对Th1、Th2比例及Th1/Th2比值的影响作用差异具有统计学意义。
当IL-11浓度为100 ng/mL时,与浓度为0的对照组比较差异最大,表现为Th1比例及Th1/Th2比值下降,Th2比例升高(均P<0.01)。具体数值见表2。

表2 各组Th1、Th2及Th1/Th2测定结果(n=10, ±s)
2.2 T-bet mRNA、GATA-3 mRNA RT-PCR测定结果
提取mRNA反转录扩增后进行凝胶电泳检查,琼脂凝胶电泳分析条带明亮,无杂带,说明基因完整。目的基因T-bet mRNA、Gata-3 mRNA及内参基因GAPDH mRNA进行PCR扩增后可见3个副孔重复性好,曲线上升期明显,拐点清楚,基线平,可见平台期,表明扩增良好。扩增产物熔解曲线均为单峰,说明引物良好,提取的mRNA完整。
对各浓度组间T-bet mRNA、GATA-3 mRNA、T-bet/GATA-3分别进行单因素方差分析(方差齐性检验P>0.1),结果显示P均小于0.05,说明不同浓度IL-11对T-bet mRNA、GATA-3 mRNA、T-bet/GATA-3的影响作用差异具有统计学意义。
当IL-11浓度为100 ng/mL时,与浓度为0的对照组相比,T-bet mRNA表达下降,GATA-3 mRNA表达增加,T-bet/GATA-3比值显著下降,差异有统计学意义(均P<0.01)。具体数值见表3。
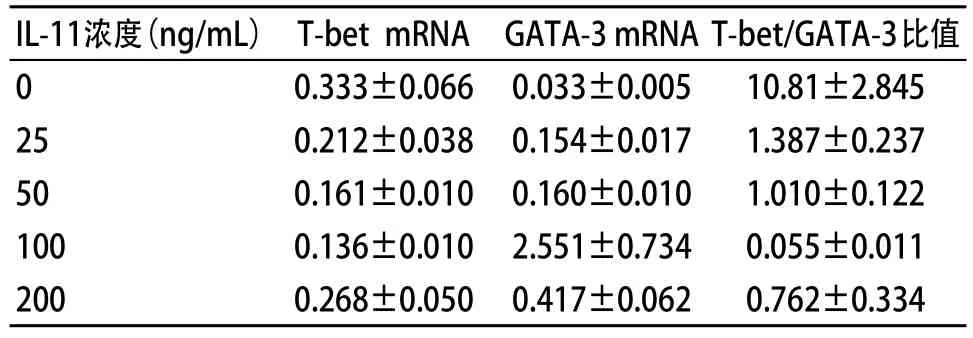
表3 各组T-bet mRNA、GATA-3 mRNA、T-bet/GATA-3检测结果(n=10, ±s)
3 讨论
IL-11主要由间充质来源的黏附细胞产生,具有多种生物活性,在免疫调节、造血调控方面具有重要作用。目前的研究认为IL-11能促进Th1细胞向Th2亚群分化[7-10]。
CD4+的T细胞在抗原的刺激下,分化为中间状态的Th0细胞,进而在不同的微环境条件下,分化为Thl和Th2类细胞。由于Th1、Th2细胞缺乏特异的细胞表面抗原标记,目前一般通过检测Th1、Th2细胞分泌的细胞因子IFN-γ、IL-4水平来作为其各自的表达量。本实验通过流式细胞仪以CD3、CD8反射门选取CD4+T细胞,Thl细胞应用IFN-γ APC荧光抗体标记,Th2细胞应用IL-4 PE荧光抗体标记,通过测定CD4+T细胞中IFN-γ、IL-4来确定Thl、Th2细胞百分率。
在本实验中,我们发现ITP患者PBMC在加入IL-11培养后,Th1细胞比例下降,Th2细胞比例升高,Th1/Th2比值下降,这种现象在IL-11浓度为100 ng/mL时最为明显,表明IL-11在体外培养条件下能促使ITP患者PBMC由Th1细胞极化向Th2细胞极化漂移。作为自身免疫性疾病,成人慢性ITP具有特异表达Th1极化以及Th1型细胞因子IFN-γ水平升高现象[11-12]。现有研究表明CD4+T细胞Th1/Th2细胞亚群比例失衡是ITP发病的机制之一[13-17],由此我们推测,通过促使CD4+T细胞更多地由Th1细胞极化向Th2细胞极化漂移,从而纠正ITP患者体内存在的免疫失衡可能是IL-11在临床上有效治疗ITP的机制之一。
T-bet和GATA-3是调节Th1和Th2类细胞因子表达的两个重要的转录调控因子[18-21]。T-bet是转录因子T-box家族成员之一,表达于包括骨髓、脐血祖细胞及干细胞在内的血细胞,主要为CD4+T细胞。T-et通过激活IFN-γ基因而发挥其对Th1细胞发育的正性调控作用,其高表达与Th1型细胞因子细胞的升高相符合。将T-bet基因反转录于成熟的Th2细胞能促使其转化为分泌IFN-γ的Th1细胞,并同时抑制IL-4、IL-5等细胞因子的表达,因此,T-bet在促使Th0细胞向Th1细胞极化的同时明显抑制了Th2细胞的极化[22]。T-bet的表达在Th1细胞发展的早期阶段明显增高,但是在Th2细胞的发育过程中并不表达。GATA-3是锌指蛋白GATA家族的成员之一,在促进Th2细胞形成和抑制Th1细胞形成过程中起核心作用。CD4+T细胞仅表达低水平的GATA-3,当CD4+T细胞向Th2分化时该表达上调,而当CD4+T细胞向Thl分化时该表达下调,在成熟Thl细胞中则不能被测到,故GATA-3仅特异表达于Th2细胞。此外,GATA-3既可抑制Thl细胞分化,亦可促使其向Th2细胞的极化方向发生改变,GATA-3在促使Th0细胞向Th2细胞极化的同时抑制了Thl细胞的极化[23]。在自身免疫性疾病和移植物抗宿主病中,可以观察到T-bet上升和GATA-3下降现象[24-25]。
Chakir等[26]发现,在多种产生Th1样和Th2样细胞因子的细胞中,T-bet mRNA和GATA-3 mRNA的表达上调,并且可以比较容易地从混合细胞群中提取总RNA,通过RT-PCR的方法测定,这提示T-bet/GATA-3可以在许多种情况下反映Th1/Th2细胞因子的平衡状况。
我们采用RT-PCR技术,从转录水平上测定Th1、Th2细胞的调控因子T-bet mRNA、GATA-3 mRNA的表达,结果发现,当ITP患者的PBMC经IL-11培养后,T-bet mRNA表达下降,而GATA-3 mRNA表达增强,T-bet mRNA/GATA-3 mRNA比值下降。
综上所述,我们分别通过流式细胞仪测定Th1、Th2细胞比例及Th1/Th2比值和RT-PCR方法测定Th1、Th2细胞的调控基因T-bet mRNA和GATA-3 mRNA的表达,从不同的角度表明,IL-11在体外能促使ITP患者CD4+T细胞从Th1极化优势向Th2极化优势转化,这种转化可能是通过其调控基因T-bet mRNA和GATA-3 mRNA来控制的。这可能是IL-11有效治疗ITP的机制之一。
[1] Feinglass S, Deodhar A .Treatment of lupus-induced thrombocytopenia with recombinant human interleukin-11[J]. Arthritis Rheum, 2001, 44(1): 170-175.
[2] Bussel JB, Mukherjee R, Stone AJ. A pilot study of rhuIL-11 treatment of refractory ITP[J]. Am J Hematol, 2001, 66(3):172-177.
[3] 陈曙平, 何群, 刘戈, 等. 重组人白细胞介素-11治疗慢性难治性特发性血小板减少性紫癜的临床观察[J]. 中国医学工程, 2006, 14(4): 417-418.
[4] 张秋荣, 吴德沛, 陈令松, 等. IL-11治疗慢性特发性血小板减少性紫癜的疗效观察[J]. 中国实验血液学杂志, 2006,14(1): 176-178.
[5] 潘斌华, 石淑文, 汤永民, 等. rhIL-11在儿童特发性血小板减少性紫癜中的临床应用[J]. 浙江预防医学, 2007, 19(1):53-58.
[6] 肖红, 彭秀兰, 刘华东, 等. 重组人白细胞介素-11治疗成人慢性难治性特发性血小板减少性紫癜临床观察[J]. 中国现代医学杂志, 2007, 17(8): 993-994, 998.
[7] Bozza M, Bliss JL, Dorner AJ, et al. Interleukin-11 modulates Th1/Th2 cytokine production from activated CD4+T cells[J]. J Interferon Cytokine Res, 2001, 21(1): 21-30.
[8] Curti A, Ratta M, Corinti S, et al. Interleukin-11 induces Th2 polarization of human CD4(+) T cells[J]. Blood, 2001,97(9): 2758-2763.
[9] Trepicchio WL, Ozawa M, Walters IB, et al. Interleukin-11 therapy selectively downregulates type I cytokine proinfl ammatory pathways in psoriasis lesions[J]. J Clin Invest,1999, 104(11): 1527-1537.
[10] 赵杰, 赵翔宇, 黄晓军, 等. 白细胞介素11联合粒细胞集落刺激因子对小鼠异基因骨髓移植后移植物抗宿主病影响的研究[J]. 中华医学杂志, 2005, 85(35): 2497-2502.
[11] Shan NN, Zhu XJ, Peng J, et al. Interleukin 18 and interleukin 18 binding protein in patients with idiopathic thrombocytopenic purpura[J]. Br J Haematol, 2009, 144(5): 755-761.
[12] Shan NN, Zhu XJ, Wang Q, et al. High-dose dexamethasone regulates interleukin-18 and interleukin-18 binding protein in idiopathic thrombocytopenic purpura[J]. Haematologica, 2009, 94(11): 1603-1607.
[13] Semple JW, Milev Y, Cosgrave D, et al. Differences in serum cytokine levels in acute and chronic autoimmune thrombocytopenic purpura: relationship to platelet phenotype and antiplatelet T-cell reactivity[J]. Blood, 1996, 87(10): 4245-4254.
[14] Andersson J. Cytokines in idiopathic thrombocytopenic purpura (ITP)[J]. Acta Paediatr Suppl, 1998, 424(1): 61-64.
[15] Panitsas FP, Theodoropoulou M, Kouraklis A, et al. Adult chronic idiopathic thrombocytopenic purpura (ITP) is the manifestation of a type-1 polarized immune response[J].Blood, 2004, 103(7): 2645-2647.
[16] Guo C, Chu X, Shi Y, et al. Correction of Th1-dominant cytokine profiles by high-dose dexamethasone in patients with chronic idiopathic thrombocytopenic purpura[J]. J Clin Immunol, 2007, 27(6): 557-562.
[17] 王宁玲, 戴海明, 祝怀平, 等. 特发性血小板减少性紫癜患儿Th1/Th2相关细胞因子的检测[J]. 中华血液学杂志, 2002,23(9): 486-487.
[18] Seki N, Miyazaki M, Suzuki W, et a1. IL-4-induced GATA-3 expression is a time-restricted instruction switch for Th2 cell differentiation[J]. Immunology, 2004, 172(10): 6158-6166.
[19] Zhuang Y, Huang Z, Nishida J, et a1. A continuous T-bet expression is required to silence the interleukin-4-producing potential in T helper type 1 cells[J]. Immunology, 2009,128(1): 34-42.
[20] Lametschwandtner G, Biedermann T, Schwärzler C, et a1. Sustained T-bet expression confers polarized human TH2 cells with TH1-like cytokine production and migratory capacities[J]. J Allergy Clin Immunol, 2004, 113(5): 987-994.
[21] Stevens L, Htut TM, White D, et a1. Involvement of GATA3 in protein kinase C theta-induced Th2 cytokine expression[J]. Eur J Immunol, 2006, 36(12): 3305-3314.
[22] Szabo SJ, kim ST, Costa GL, et a1. A novel transcription factor, T-bet, directs Th1 lineage commitment[J]. Cell, 2000,100(6): 655-669.
[23] Höfer T, Nathansen H, Löhning M, et al. GATA-3 transcriptional imprinting in Th2 lymphocytes: a mathematical model[J]. Proc Natl Acad Sci USA, 2002, 99(14): 9364-9368.
[24] Lazarevic V, Glimcher LH. T-bet in disease[J]. Nat Immunol, 2011, 12(7): 597-606.
[25] Ji N, Sosa RA, Forsthuber TG. More than just a T-box: the role of T-bet as a possible biomarker and therapeutic target in autoimmune diseases[J]. Immunotherapy, 2011, 3(3): 435-441.
[26] Chakir H, Wang H, Lefebvre DE, et a1. T-bet/GATA-3 ratio as a measure of the Th1/Th2 cytokine profi le in mixed cell populations: predominant role of GATA-3[J]. Immunol Methods, 2003, 278(1): 157-169.
