杂色鲍血淋巴双向电泳与质谱分析
2013-12-23姜敬哲王江勇
韩 焘, 姜敬哲, 王江勇
(1.中国水产科学研究院 南海水产研究所, 广东 广州510300; 2.上海海洋大学 水产与生命科学学院, 上海201306)
杂色鲍(Haliotisdiversicolor), 肉质鲜美、营养丰富, 是我国南方重要的鲍养殖品种, 是中华民族的传统珍馐佳肴。近年来养殖环境日益恶化, 鲍病害呈现爆发性的增长趋势, 对鲍养殖业造成了极大损 害[1-2]。然而, 从分子水平上对其先天免疫系统以及免疫因子的研究还十分有限, 客观上限制了鲍病害防控技术的发展[3]。
双向电泳(Two-dimensional gel electrophoresis, 2-DE)是1975年建立的[4], 现广泛应用于医学诊断、药物筛选[5]、毒性机理[6-7]、免疫机制[8]和水产动物的生理调控机制[9]等研究。
双向电泳技术作为蛋白质组学研究的重要技术, 可以从整体、动态水平上大规模、高通量地对总蛋白的分子组成和相互作用规律进行研究, 定量观察病害发生过程中蛋白质种类和数量的变化, 能更直接地了解致病机理和免疫机制, 为病害防治提供依据[10-11]。但双向电泳对研究者技术要求较高, 不同研究材料需要建立不同的双向电泳体系。目前针对海洋无脊椎动物已经建立的双向电泳体系包括: 西施舌(Coelomactra antiquata)的外套膜[12]、紫贻贝(Mytilus galloprovincialis)的消化腺[5]、泥蚶(Tegillarca granosa)的肌肉[13]、蓝斑背肛海兔(Notarchus leachii cirrosusStimpson)和褐云玛瑙螺(Achatina fulica(Ferussae))的大脑神经节(cerebral ganglion,CG)[6]、缢蛏(Sinonovacula constricta)[14]和牡蛎(Bonamia ostreae)[8]的血淋巴、南美白对虾(Penaeus vannamei)的血细胞[15]、中国明对虾(Fenneropenaeus chinensis)的血浆[16]以及杂色鲍的肝胰腺[7]等。
本文首次以杂色鲍血淋巴总蛋白为研究对象, 成功建立了双向电泳技术平台。
1 材料与方法
1.1 试验材料
杂交鲍(遗传背景不祥)购自广州下渡市场, 平均质量(30±5)g; 其他试验均使用购自汕尾市粤顺海珍品养殖有限公司的杂色鲍, 平均质量为(20±5)g, 暂养于水温15~18.5℃、盐度30、50 cm×30 cm×40 cm玻璃缸(带循环水和泵氧设备)中。
1.2 试剂与仪器
固相pH梯度干胶条IPG strip非线性(pH 3-10, 18 cm)、两性电解质IPG buffer(pH 3-10)和Drystrip Cover Fluid等购自美国GE Healthcare公司; 丙磺酸(CHAPS)、三羟甲基氨基甲烷(Tris)、四甲基乙二胺(TEMED)、尿素(Urea)、硫脲(Thiourea)、二硫苏糖醇(DTT)和碘乙酰胺(IAA)等购自美国Sigma公司; 乙醇、冰醋酸、Na2S2O3等均为国产分析纯; 蛋白标准2-D Protein MW Marker购自TaKaRa公司; 蛋白酶抑制剂 Protease &Phosphatease Inhibitor Single-Use Cocktail, EDTA-free(100×)购自美国Thermo公司; 蛋白定量试剂盒(RC DC Protein Assay)购自美国Bio-Rad公司; BCA、Bradford蛋白定量试剂盒购自香港昊柏生物公司, Lowry改良试剂盒购自美国andybio公司。
等电聚焦仪EttanIPGphor 3、ImageScanner扫描仪、ImageMaster 2D Platinum 7.0图像分析软件等购自美国GE Healthcare公司; 垂直电泳Protean Ⅱ XL系统购自美国Bio-Rad公司; 冻干机为美国Virtis公司Advantage桌上型冷冻干燥机; 纯水系统(ELGA PURELAB CLASSIC)购自英国ELGA公司。
1.3 蛋白样品的制备与定量
1.3.1 血淋巴样品的制备
血细胞和血浆的分离: 用解剖刀划开鲍腹足表面, 取血淋巴于离心管中, 500 r/min, 4℃离心5 min, 上清即为血浆, 沉淀为血细胞, 沉淀留在离心管中; 大分子血蓝蛋白的去除: 35 000 r/min, 4℃, 2 h, 弃沉淀, 取上清。
1.3.2 血淋巴和血浆总蛋白的提取
取血淋巴或血浆5 mL, 加入4倍体积的预冷丙酮, 搅拌均匀后–20℃沉淀过夜; 12 000 r/min, 4℃, 离心15 min, 弃上清; 重悬沉淀于预冷丙酮, –20℃沉淀3 h; 12 000 r/min, 4℃, 离心15 min, 弃上清; 重复前两个步骤1次; 加入少量预冷丙酮, 将混合均匀的蛋白丙酮液分装入1.5 mL离心管中, 每管0.2 mL; 12 000 r/min, 4℃, 离心15 min, 弃上清液; 用真空浓缩机抽干剩余丙酮, 直到样品完全干燥; 将制备好的蛋白丙酮干粉置于–80℃冰箱保存备用。
1.3.3 蛋白的溶解与定量
取血淋巴或血浆总蛋白的丙酮干粉, 或取血细胞沉淀, 按1∶10(W∶V)加入裂解液(7 mol/LUrea、2 mol/LThiourea、2% CHAPS、40 mmol/L DTT和0.5 % IPG Buffer), 振荡溶解, 冰上超声促融, 功率80 W, 周期0.5, 60次。12 000 r/min, 4℃离心30 min, 取上清即为蛋白样品。使用RC DC Protein Assay进行蛋白定量。
1.4 双向电泳
1.4.1 等电聚焦电泳
使用18 cm pH 3-10 IPG非线性胶条, 总蛋白量80~150 µg, 上样体积340 µL(血淋巴上样量150 µg时加入5 µL 2-D Protein MW Marker), 被动水化上样16 h。
参照IPGphor等电聚焦指南设置程序: 500 V 1 h、1 000 V 1 h、8 000 V 3 h、8 000 V 2 h、500 V保持。每根胶条电流50 µA, 温度20℃。
1.4.2 胶条平衡
采用两步平衡法, 每步15 min, 平衡液为6 mol/L urea, 2% SDS, 75 mmol/L Tris-HCl, 20%甘油, 1% DTT, 体积10 mL, 第二步平衡时用2.5% IAA代替DTT。
1.4.3 聚丙烯酰胺凝胶电泳(SDS-PAGE)
SDS-PAGE电泳胶浓度为12%。将平衡后的IPG胶条转移至SDS凝胶上端, 用0.5%琼脂糖溶液封顶。电泳参数设置: 50~100 V, 直至溴酚蓝指示剂到达底部边缘时电泳结束。
1.5 凝胶染色、扫描及图像分析
1.5.1 银染(每块凝胶使用250 mL的溶液体系)
固定 30 min(乙醇100 mL, 冰醋酸25 mL, 用超纯水定容至250 mL); 敏化 30 min(乙醇75 mL, Na2S2O30.5 g, NaAc17 g, 定容至250 mL); 漂洗 5 min×3(250 mL); 银染 20 min(AgNO30.625 g, 定容至 250 mL); 漂洗 1min×2(250 mL); 显色 5~10 min(Na2CO36.25 g, 甲醛0.1 mL(使用前加入), 定容至250 mL; 此步通过肉眼观察确定具体时间); 终止 10 min(EDTA-2Na 4.165 g, 冰醋酸25 mL, 定容至250 mL); 漂洗5 min×3(250 mL)。
1.5.2 凝胶扫描及图像分析
凝胶用 ImageScanner扫描仪扫描, 并用ImageMaster 2D Platinum 7.0图像分析软件对扫描图谱处理分析。
1.6 质谱分析
为检验双向电泳凝胶与质谱的兼容性, 同时也为建立蛋白样品本身蛋白标记以防止蛋白Marker对其他蛋白点的影响, 选取4个蛋白点, 切割后置于1.5 mL 离心管中, 送至暨南大学生命与健康工程研究院使用ABI 4800 plus MALDI-TOF/TOF质谱仪进行质谱分析。
2 结果
2.1 样品制备与蛋白定量方法的选择
样品制备先后尝试了3种方法: 直接裂解液处理、冻干法和丙酮沉淀法。直接裂解液处理是将血浆与裂解液按比例直接混合, 混合后出现大量沉淀。冻干法制备的血浆干粉可以较好地溶于裂解液, 但蛋白定量时加入的BCA和Bradford等试剂会产生大量沉淀, 干扰定量。改用丙酮沉淀法提取的蛋白干粉与几种蛋白定量试剂兼容良好, 无沉淀, 可准确定量。但当丙酮沉淀的蛋白干粉溶于裂解液后, 裂解液成分与部分定量试剂不能很好兼容: 如使用改良Lowry法测得的线性R2值只有0.3072, Bradford法的为0.9332, RC DC法的最高, 为0.9941(图1)。后续蛋白定量均使用RC DC法。
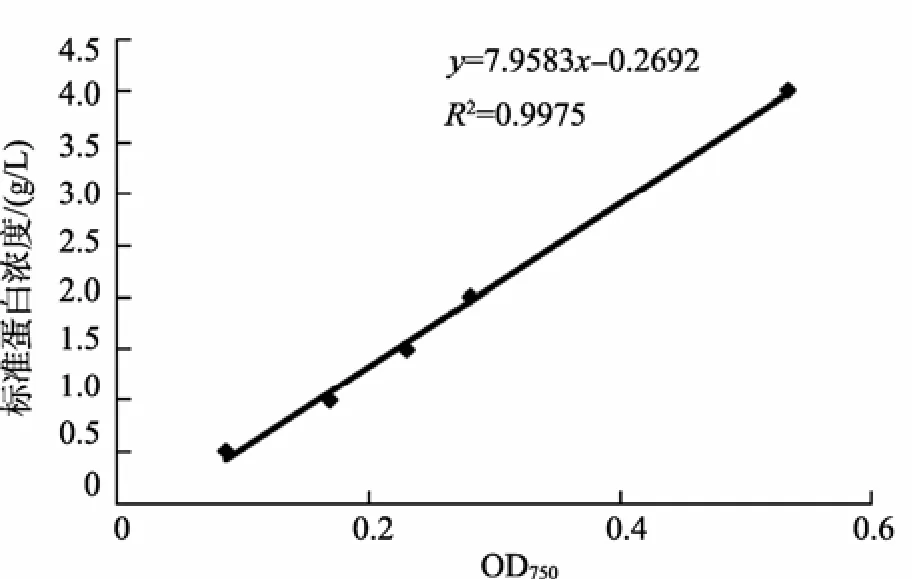
图1 RC DC蛋白定量标准曲线 Fig. 1 Standard curve of RC DC protein quantitative
2.2 不同血淋巴组分的比较
实验中比较了杂交鲍的两种血淋巴组分样品(血浆和血细胞)的电泳结果, 如图2所示。两个样品蛋白组成差异明显, 血浆样品(即去除血细胞后的血淋巴)的蛋白点较多, 分离效果良好, 而血细胞样品的蛋白点较少, 中间偏上位置的蛋白点分离效果有限, 多成串状分布, 可能为经过复杂修饰后的膜蛋白。
2.3 血蓝蛋白的去除
实验发现, 在电泳凝胶上端有大量高分子质量蛋白, 多为血蓝蛋白[16-18]。本研究通过超速离心去除了多数的高分子质量血蓝蛋白, 如图3所示。经过超速离心后, 凝胶顶端聚集的蛋白明显减少, 其他分子质量蛋白变化不明显。
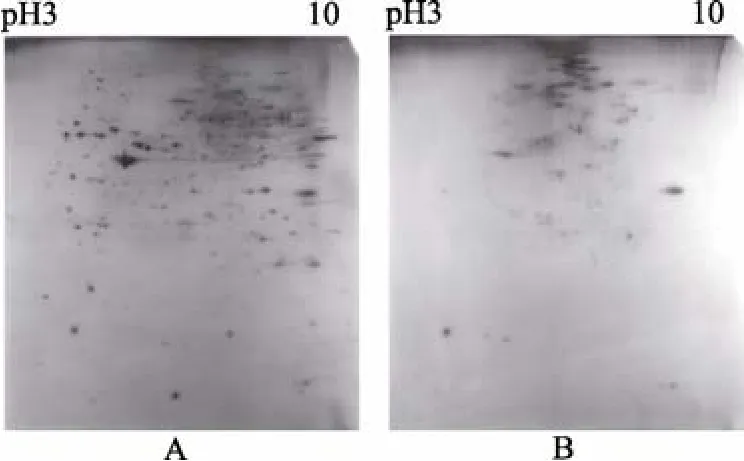
图2 杂交鲍2种不同血淋巴组分的双向电泳图 Fig. 2 2-DE maps of two different hemolymph components of hybrid abalone

图3 超离前后双向电泳凝胶上端比较 Fig. 3 Comparison top parts of 2D-PAGE maps before and after ultracentrifugation
2.4 不同上样量的电泳效果
实验中比较了3种上样量的电泳效果, 如图4所示。3次实验的重复性较好。上样量80 µg时, 凝胶中间偏上部份的分离效果最好, 但总蛋白点数较少, 只有234个; 上样120 µg时, 凝胶中上部的背景加深, 点数增多至264个; 上样150 µg时, 点数增多不明显(276个), 凝胶中上部背景较高, 但其他区域低丰度蛋白点信号有所增强。
2.5 质谱鉴定
所选4个蛋白点二级质谱结果: 1为肌动蛋白, 2为原肌球蛋白, 3为血蓝蛋白1型亚基, 4为胶原蛋白, 图5为所选蛋白点的凝胶位置显示, 图6中A-D为蛋白一级质谱图, 表1为蛋白信息。
4个蛋白点的质谱结果与凝胶图谱比较, 2号点的理论值与图中观测值一致, 1、3、4号点的理论等电点与图中观测值有差异, 3、4号点的理论分子质量与图中观测值有差异。
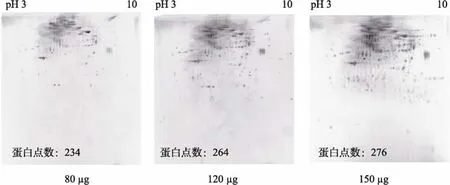
图4 不同上样量的杂色鲍血淋巴总蛋白2-DE图谱(银染) Fig. 4 2-DE maps of Haliotisdiversicolor hemolymphtotal protein with different loading amounts (silver staining)
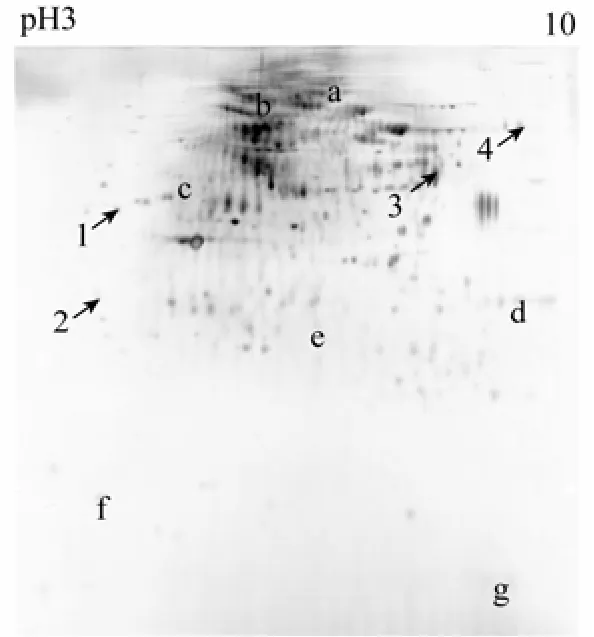
图5 上样量150 µg的杂色鲍血淋巴总蛋白2-DE图谱(银染) Fig. 5 2-DE maps of Haliotis diversicolor hemolymphtotal protein with 150 µg loading amounts (silverstaining)
3 讨论
3.1 研究材料的选择与前处理
节肢动物及大多数的软体动物都为开放式循环系统, 它们的血淋巴(体液)从心脏流出后被直接输送到体内各组织中, 在它们回到心脏之前, 会与机体的多数组织液充分混合并产生交换。因此, 这些动物的血淋巴组成非常复杂, 携带各种功能蛋白、小分子多肽以及生化代谢物, 机体的任何一种生理变化都可能在血淋巴成分变化中反应出来[19-20]。例如: 对缢蛏血淋巴蛋白组的研究发现, 高温应激下血淋巴中多种蛋白发生了变化, 最终鉴定出锌指蛋白和chelonianin蛋白[14]; 对牡蛎血淋巴蛋白的合成、诱导、上调和下调的研究将有助于理解免疫机制和抑制病害感染[8]。
本研究以腹足纲的鲍为材料, 其肌肉裸露, 只需划开腹足即可方便地采集血淋巴样品。考虑到血淋巴组分过于复杂, 为了降低背景、简化问题, 研究中还对鲍血淋巴样品进行了分级处理。首先, 通过低速离心有效分开了血细胞与血浆组分(图2), 减少了血细胞蛋白与血浆蛋白的相互干扰; 其次, 通过超速离心方法[17,21]有效降低了高分子质量血蓝蛋白的干扰(图3), 一定程度上降低了背景, 增加了低丰度蛋白的检出概率。虽然之前Zhou等[7]以杂色鲍肝胰腺为材料进行了双向电泳研究, 但以鲍血淋巴为材料的蛋白质组学相关研究尚未见报道。该技术方法的建立不仅为鲍免疫抗病研究提供保障, 还将为鲍机体内营养物质代谢、生长信号调控和物质运输等方面的研究打下良好基础。
3.2 总蛋白制备及上样量的选择
总蛋白的制备与准确的上样量是影响双向电泳结果的重要因素。本研究综合考虑了三种蛋白制备方法。直接裂解液处理和冻干法操作简单且蛋白损失少, 但由于溶解或定量过程中出现大量纤维蛋白沉淀, 干扰后续实验进行, 因此放弃。虽然丙酮沉淀法步骤繁琐, 过程中会损失一些蛋白, 但为保证实 验的重复性和电泳效果, 最终以获得蛋白纯度最高、定量最准确的丙酮沉淀法作为总蛋白制备方法。实践证明, 该方法所得蛋白点总数依然达到了276(图4), 能够满足研究需要。
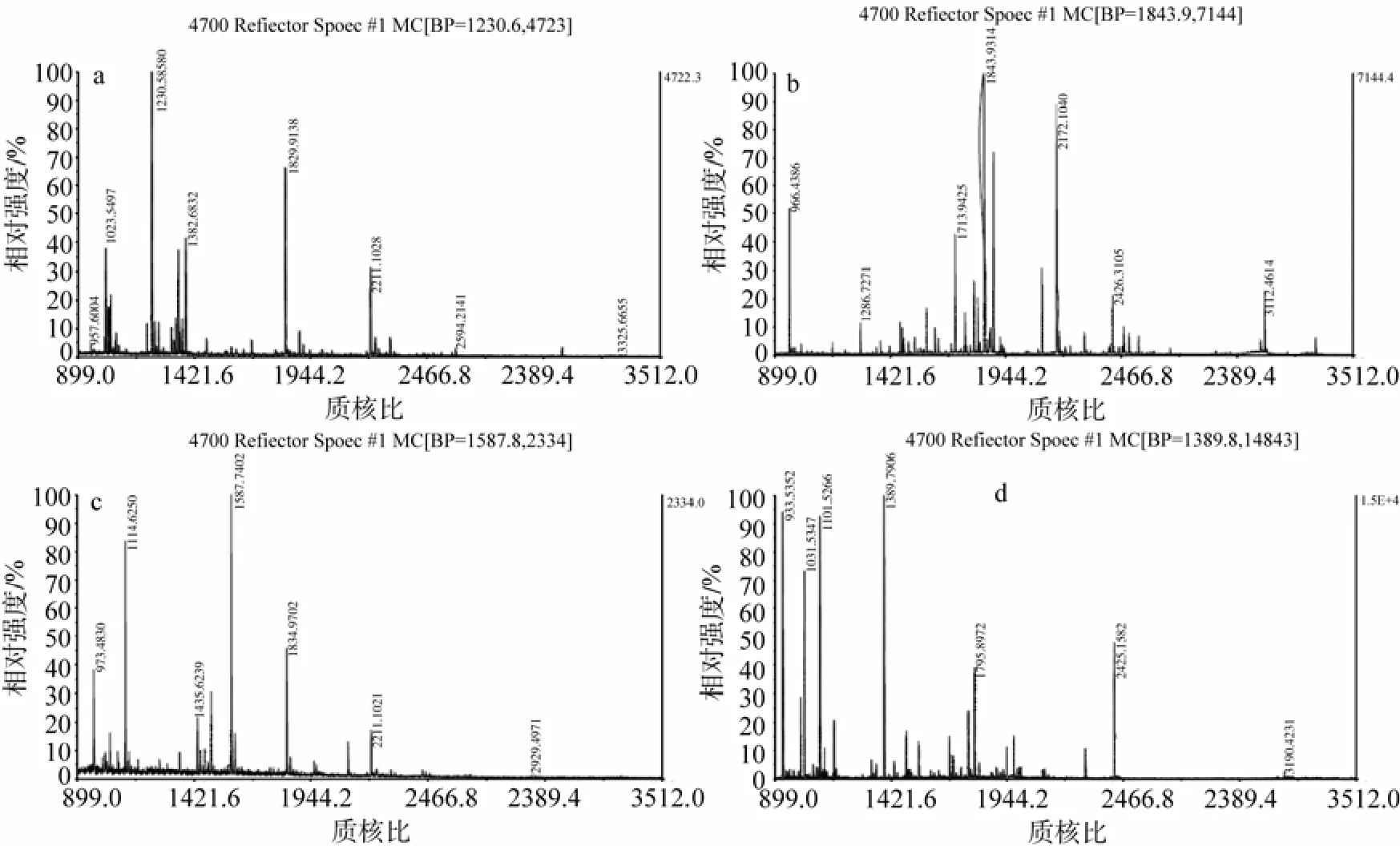
图6 4个蛋白点的MALDI-TOF/MS 肽质量指纹图谱 Fig. 6 MALDI-TOF/MS peptide mass fingerprint (PMF) spectra in geltryptic digest of four protein spots
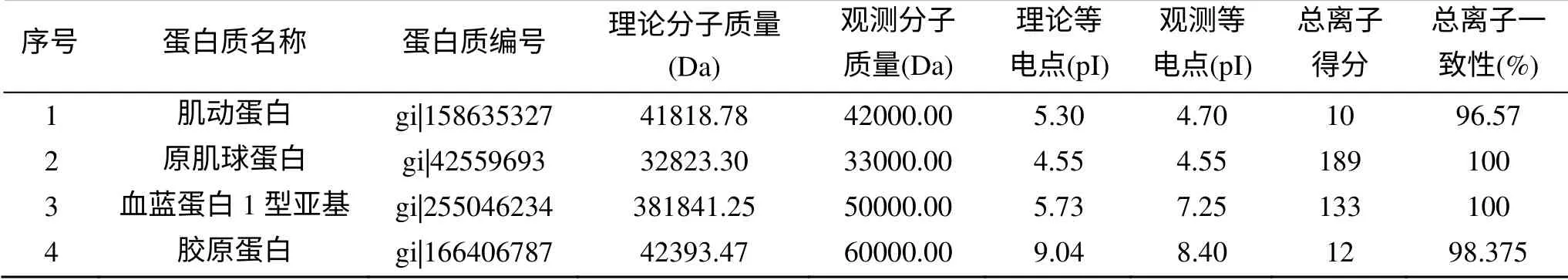
表1 4个蛋白点的质谱鉴定结果 Table. 1 The identification results of four protein spots
文中还对3种不同上样量血淋巴总蛋白进行了比较。发现上样120 µg时图像最清晰, 背景较浅, 适合图像分析及高丰度蛋白点的鉴定; 而150 µg的背景相对较深, 不适用于图像分析, 但有利于低分子质量蛋白的研究。由此可知, 上样量的选择应该依研究需要而定, 不同的血淋巴组分还需依实际情况而定。
3.3 质谱分析与蛋白鉴定
一些低丰度蛋白可能具有很重要的功能, 而考染的分辨率较低, 因此, 本实验凝胶染色方法使用银染。但是传统银染与目前的MALDI-TOF/TOF质谱技术不兼容, 预实验使用传统银染时选取3个蛋白点均未鉴定成功, 后续实验对银染方法进行改进, 在敏化液中不加戊二醛、银染液中不加甲醛, 蛋白点数(276)能满足实验需要, 之后选取4个蛋白点均鉴定成功, 说明兼容性好, 改进的银染方法可行。
蛋白点的质谱结果与凝胶图谱比较, 其中2号点的理论值和图中观测值基本一致, 且总离子得分值与总离子一致性都很高, 说明该蛋白点与数据库中蛋白完全吻合, 并进一步证明本研究所建立的双向电泳和质谱方法是可靠的; 1、4号两个点的总离子得分分别只有10、12, 说明这两个蛋白与数据库中已知蛋白只有小段序列匹配, 但两个质谱结果的总离子一致性(即可靠性)均大于95%, 说明结果是可靠的, 进一步考虑到1、4号两点的等电点或分子质量与数据库中数据并不一致, 说明它们可能是不同于数据库中蛋白的同源或相似蛋白; 3号点的等电点的两个值有差异而且图中观测分子质量远远小于理论值, 但是总离子得分值很高, 即匹配肽段较多, 由此可推测该蛋白是血蓝蛋白在裂解液中裂解成的片段或者本身分解的功能肽段。
文中所鉴定的肌动蛋白是贝类肌肉中的肌原纤维蛋白的重要组成部分, 是重要的结构蛋白之一, 可影响并调控肌动球蛋白之间的相互作用[13]。原肌球蛋白是细肌丝中与肌动蛋白的结合蛋白, 主要作用是加强和稳定肌动蛋白丝, 并在肌肉收缩的调节中起重要作用[22]。胶原蛋白是细胞外基质中最重要的组成部分, 功能是维持皮肤和组织器官的形态和结构, 也是修复各损伤组织的重要原料物质[23]。上述三种蛋白均为结构蛋白。血蓝蛋白是节肢动物和软体动物血淋巴中的一种多功能蛋白, 它在以完整蛋白发挥功能的同时, 其多样的降解肽段也在发挥着重要的生物功能[24-25]。本实验鉴定的3号蛋白点是血蓝蛋白中未见报道的新肽段, 对血蓝蛋白的研究具有一定意义。
4 结论
以鲍血淋巴为研究材料, 通过对样品前处理、总蛋白制备与定量、双向电泳条件、显色方法、数据处理与分析方法的摸索, 最终成功建立了以双向电泳为基础的鲍血浆蛋白质组学研究方法。该方法的建立将为鲍免疫防御机理研究等提供技术保障。
[1] Wang J Y, Guo Z X, Feng J, et al. Virus infection in cultured abalone,HaliotisdiversicolorReeve in Guangdong province, China[J]. Journal of Shellfish Research, 2004, 23: 1163-1168.
[2] 王江勇, 孙秀秀, 王瑞旋, 等. 杂色鲍肌肉萎缩症病原菌的分离鉴定及系统发育分析[J]. 南方水产, 2010, 6(5): 21-26.
[3] 姜敬哲, 张微, 王江勇, 等. 哈维氏弧菌感染的杂色鲍全组织均一化cDNA文库的构建[J]. 南方水产, 2010, 6(5): 37-42.
[4] O’Farrell P H. High resolution two-dimensional electrophoresis of proteins[J]. Thejournal of biologicalchemistry, 1975, 250: 4007-4021.
[5] Dondero F, Negri A, Boatti L, et al.Transcriptomic and proteomic effects of a neonicotinoid insecticide mixture in the marine mussel(Mytilusgalloprovincialis, Lam.)[J]. Science of the Total Environment, 2010, 15: 3775-3786.
[6] 詹怿婕. 三种软体动物大脑神经节的蛋白质组学的研究[D]. 厦门: 厦门大学硕士论文, 2007: 10.
[7] Zhou J, Cai Z H, Li L, et al. A proteomics based approach to assessing the toxicity of bisphenol A and diallyl phthalate to the abalone (Haliotisdiversicolorsupertexta)[J]. Chemosphere, 2010, 79:595-604.
[8] CaoA, Fuentes J, Comesaña P, et al. A proteomic approach envisaged to analyse the bases of oyster tolerance/resistance to bonamiosis[J].Aquaculture, 2009, 295:149-156.
[9] Smith R W, Wood C M,Cash P, et al. Apolipoprotein AI could be a significant determinant of epithelial integrity in rainbow trout gill cell cultures:A study in functional proteomics[J]. Biochimicaet Biophysica Acta, 2005, 1749:81-93.
[10] Somiari R I, Sullivan A, Russell S, et al. High-throughput analysis of human infiltrating ductal carcinoma of the proteome breast[J]. Proteomics, 2003, 3: 1863-1873.
[11] He Q Y, Chen J, Kung H E, et al. Identification of tumor-associated proteins in oral tongue squamous cell carcinoma by proteomics[J]. Proteomics, 2004, 4: 271-278.
[12] 田美, 申欣, 程汉良, 等. 西施舌外套膜蛋白质组双向电泳体系的构建[J]. 海洋科学, 2009, 33(11): 32-36.
[13] 李太武, 詹垄, 苏秀榕. 泥蚶(Tegillarcagranosa)肉质的蛋白组学研究[J]. 海洋与湖沼, 2008, 39(6): 678-682.
[14] 张鹭, 陈寅山, 彭宣宪. 温度应激下缢蛏血淋巴蛋白质组的比较研究[J]. 畜牧与兽医, 2004, 36(6): 1-3.
[15] Chongsatja P, BourchookarnA, Lo C F, et al. Proteomic analysis of differentially expressed proteins inPenaeus vannameihemocytes upon Taura syndrome virus infection[J]. Proteomics, 2007,7: 3592-3601.
[16] 黄冰心. 基于凝胶电泳的中国明对虾血浆蛋白质组学研究[D]. 北京: 中国科学院研究生院, 2008.
[17] 彭文, 王江勇, 丁雪娟. 杂色鲍血蓝蛋白的分离纯化及其酚氧化酶活性研究[J]. 中国水产科学, 2010, 17(1): 52-57.
[18] 彭文, 姜敬哲, 王江勇, 等. 理化因子对杂色鲍血蓝蛋白酚氧化酶活性影响的研究[J]. 南方水产, 2005, 6 (2): 1-6.
[19] 姚翠莺. 免疫刺激后中国明对虾血液抗菌力应答及两种免疫相关因子LYZ和AK的研究[D]. 北京: 中国科学院研究生院, 2005.
[20] 郭志勋, 冯娟, 王江勇. 斑节对虾血淋巴细胞对鳗弧菌的清除作用[J]. 中国水产科学, 2006, 13(1): 28-31.
[21] 王宝杰, 刘梅, 蒋克勇, 等. 中国明对虾血浆蛋白质组学研究中高丰度蛋白的超速离心去除技术[J]. 中国水产科学, 2010, 17(4): 695-700.
[22] 杨静娴. 原肌球蛋白的分子生物学研究进展[J].大连医科大学学报, 2004, 26(2): 144-147.
[23] 张锐, 许永安.水产胶原蛋白的特性及应用研究进展[J]. 福建水产, 33(2): 79-83.
[24] Destoumieux-Garzón D, Saulnier D, Garnier J, et al. Crustacean immunity: Antifungal peptides are generated from the C terminus of shrimp hemocyanin in response to microbial challenge[J]. The journal of biological chemistry, 2001, 276: 47070-47077.
[25] 章跃陵, 叶向群, 陈洁辉, 等. 凡纳滨对虾28.5kD血蓝蛋白的降解新片段[J].中国水产科学, 2008, 15: 425-430.
