血水草根蛋白质组学研究
2016-12-10刘铭彭玲杨盛清田大伦
刘铭+彭玲+杨盛清+田大伦
摘 要 为用蛋白质组学方法初步分析血水草根蛋白质的表达,提取血水草根的蛋白质,经双向凝胶电泳分离、考马斯亮蓝染色后,切取分离较好的蛋白质点,经基质辅助激光解吸/电离飞行时间串联质谱(MALDI-TOF-TOF)分析和数据库(IPI)检索, 对蛋白质进行鉴定.成功鉴定了28个蛋白质点,其中具有明确功能的蛋白质17种,分别属于DNA复制酶、翻译调控蛋白、代谢酶、细胞结构蛋白;另外11种为未知功能蛋白.
关键词 血水草; 蛋白质组学; 双向电泳; 质谱
中图分类号 Q51 文献标识码 A 文章编号 1000-2537(2016)05-0022-05
Abstract To analyze the protein expression in Eomecon chionantha Hance roots with the proteomics approach, all proteins were extracted and separated by two-dimensional gel electrophoresis(2-DE), and stained with coomassie brilliant blue G250 to produce a high resolution and reproducible 2-DE image. Protein spots selected from this image were identified by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry and tandem mass spectrometry (MALDI-TOF-TOF). The mass spectrometric data were used to identify the proteins through searches of the IPI protein sequence database. A total of 28 protein spots were successfully identified, 17 of which were classified with various functional characteristics such as DNA replicase, translation regulating proteins, metabolism enzymes, and cytoskeleton proteins. Eleven unknown proteins were identified as well.
Key words Eomecon chionantha Hance; proteomics; 2-DE; mass spectrometry
近年来,随着植物基因组学以及高通量的蛋白质分析鉴定技术的发展,使得植物蛋白质组学的研究成为植物生物学研究重要内容[1-2].大部分植物蛋白质组学的研究集中在拟南芥、水稻等植物[3-6],其他植物不同组织器官如种子、叶、根等蛋白质组学研究也有较多报道 [7-9].血水草(Eomecon chionantha Hance,1884)是我国独属、独种的特有物种[10],系罂粟科白屈菜族血水草属植物,广泛分布在我国长江流域、西南、华南、华东地区.血水草包含多种生物碱,主要分布在根及根茎中,生物碱是其重要有效成分 [11].本研究利用蛋白质组学技术首次对血水草根的蛋白质组学进行探讨,为血水草的开发应用提供理论基础.
1 材料
血水草采自湖南省益阳市桃江县飞山崖,采摘时间为秋季,经湖南中医药大学周天达教授鉴定为罂粟科(Papaveraceae)白屈菜族(Chelidonium)血水草属(Eomecon)植物血水草(Eomecon chionantha Hance).取血水草成熟根,清水洗净后,晾干,-20 ℃储存.
2 主要仪器与试剂
2.1 仪器
Protein Ⅱ垂直电泳槽为Bio-Rad 公司产品;Multistemp Ⅲ图像扫描仪、恒温制冷循环水浴箱、图像分析软件Imagemaster 2-D Platinum Software 5.0和IPG等电聚焦仪均为 Amersham Biosciences 产品; BP211D电子天平为德国Sartorius 公司产品; 质谱仪Ultraflex MALDI-TOF-TOF 为德国Bruker Daltonics 产品;GelDoc 2000 凝胶成像仪为Bio-Rad公司产品;Savant冷冻干燥机为美国Thermo Electron公司产品.
2.2 试剂
线性固相pH梯度预制胶条 (IPG strip pH 3~10,17 cm),两性电解质,2D Quant Kit 定量试剂盒,IPG 缓冲液,蛋白质裂解液(7 mol/L尿素,2 mol/L硫脲,4%CHAPS,0.2%Tris, 使用前加入75 mmol/L DTT和2 mmol/L PMSF),DeStreak Rehydration Solution均为Amersham Biosciences 产品;四甲基乙烯基二胺(TEMD),过硫酸胺(APS),二硫苏糖醇(DTT),碘乙酰胺(IAA),硫酸铵,甲叉双丙烯酰胺,三氯乙酸(TCA),丙烯酰胺,三羟甲基氨基甲烷(Tris),胰蛋白酶和考马斯亮蓝G250均为Sigma 产品; CCA为Bruker Daltonics产品.
3 方法
3.1 血水草根总蛋白的提取及定量
将血水草根用清水彻底洗干净,剪碎,TCA-丙酮悬浮后,超声,再加入裂解液(7 mol/L尿素,2 mol/L硫脲,75 mmol/L DTT,2 mmol/L PMSF,4%CHAPS,0.2%Tris),充分研磨后,在冰上超声裂解,静置10 min离心,收集上清.在上清液中加入提取液(含0.07%β-巯基乙醇和10%TCA的丙酮),-20 ℃过夜,离心,弃上清.沉淀中加入预冷丙酮,沉淀8 h,离心弃上清,裂解液重新溶解沉淀.用2-D Quant kit试剂盒测定总蛋白浓度.样品置-80 ℃ 保存备用.
3.2 双向凝胶电泳及凝胶图像分析
样品蛋白质通过双向凝胶电泳进行分离.第一向上样量为600 μg,等电聚焦电泳采用17 cm, pH 3~10的IPG胶条;第二向采用12% SDS-PAGE的分离胶分离.将电泳后的凝胶先置于固定液(40%甲醇,10%乙酸)中固定30 min,再置于考马斯亮蓝染液(25%甲醇,10%磷酸,10%硫酸铵,0.1%考马斯亮蓝G250)中染色过夜.用双蒸水清洗凝胶,直至背景清晰,凝胶经图像扫描仪扫描,用图像分析软件对蛋白质点进行检测分析.
3.3 质谱鉴定
切取蛋白质点放置在EP管中,加入50 μL脱色液(50%乙腈,25 mmoL碳酸氢铵),脱色后加入乙腈干胶,再置于真空干燥仪中干燥.干燥后的胶块中加入胰酶溶液,冰水浴1 h,37 ℃消化18~24 h,离心,弃上清.加入萃取液(50%乙腈,5%三氟乙酸)覆盖胶块,37 ℃保温1 h,离心,收集萃取液,冻干至样品体积约为5 μL,再将样品与CCA基质液以体积比1∶1混匀,点样于AnchorChip板上,进行MALDI-TOF-TOF质谱分析.质谱参数如下:激光源为337 nm的氮气激光,发射模式离子源1电压25 kV,离子源2电压21.8 kV,均在正离子模式下检测.用BioTools 2.2软件整合PMF和LIFT质谱结果,对IPI数据库搜索.查询条件:切割酶为胰蛋白酶,允许最大末酶切位点数为1,PMF误差为5×10-5,MS/MS 误差0.6,考虑甲硫氨酸残基的氧化.
4 结果
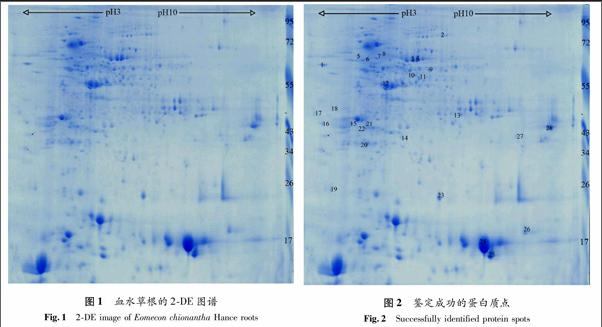
4.1 血水草根的2-DE图谱
在相同条件下对血水草根蛋白样品进行双向电泳,得到了一致性较好的电泳图谱(见图1).从图1中可以看出,2-DE图谱背景较浅,蛋白点的分布均匀,大小蛋白质组分斑点均清晰可见,达到预期分离效果.图谱通过Imagemaster 2-D软件分析,结果显示平均检测到(464±10)个蛋白质点(n=3) 匹配率为84.5%,经蛋白质斑点回顾性分析,选取237个蛋白质点,进行质谱分析.
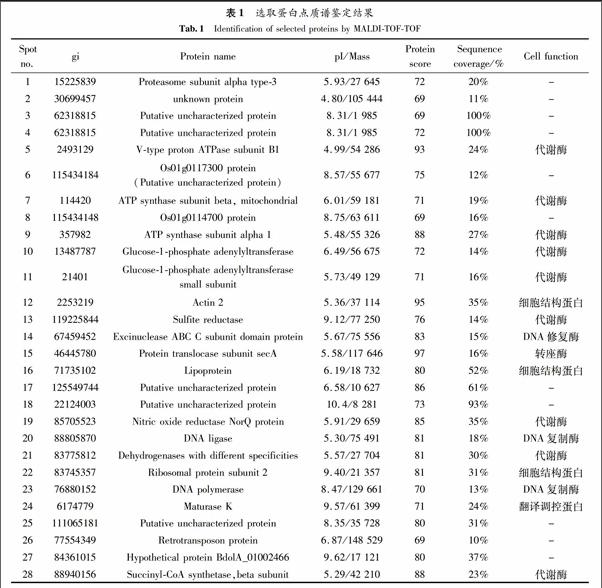
4.2 蛋白质点的质谱分析
选取蛋白质点237个,通过MALDI-TOF-TOF成功鉴定28个蛋白质(图2,表1).其中具有明确功能的蛋白质有17种,按照蛋白质动能分类分别属于DNA复制酶、翻译调控蛋白、代谢酶、细胞结构蛋白;另外11种为未知功能蛋白.
5 讨论
血水草,各地俗称较多,例如水黄莲、捆仙绳、黄水草、广扁线、马蹄草等 [12],生长在山野、路旁、溪边、林边等较潮湿的泥土内,取材容易.从血水草的根及根茎中提取的生物碱(Eomecon Chionantha Alkaloids,简称ECA),包括血根碱、白屈菜红碱、白屈菜红默碱、原阿片碱和α-别隐品碱等,分属苯骈菲啶或阿片型生物碱[13].这些生物碱具有抗菌、增强免疫、抗癌、松弛平滑肌、镇痛与镇静的作用等[14-16].近几年发现生物碱具有杀灭日本血吸虫尾蚴及中间宿主钉螺的作用[17-19].血水草的应用价值得到越来越多的关注.作者对血水草的根进行蛋白质组学研究,经双向电泳分离和考马斯亮蓝染色后,选取了表达量丰富的237个蛋白质点进行质谱鉴定,成功鉴定了28个蛋白质点,大致可分为DNA复制酶、翻译调控蛋白、代谢酶和细胞结构蛋白.
(1)参与DNA 复制、翻译、转录过程蛋白:在生物体内,核酸酶在维持基因组完整性和DNA的损伤修复过程中至关重要,核酸酶结构、表达量或功能的改变,会影响到基因组完整性以及DNA 的损伤修复[20].DNA 连接酶是生物体内极为重要的酶,可以分为两种:一是利用ATP的能量催化两个核苷酸链之间形成磷酸二酯键的依赖ATP 的DNA 连接酶;二是利用NAD+的能量催化两个核苷酸链之间形成磷酸二酯键的依赖NAD+的DNA 连接酶[21].DNA聚合酶是细胞复制DNA的重要作用酶,在具备模板、引物和dNTP等的情况下它能将4种脱氧核苷三磷酸聚合成一条DNA 链.转座酶能特异地识别转座子两端的DNA 序列.在转座酶作用下,转座因子在同一细胞内从一个DNA 位置转移到另一个位置.成熟酶K与内含子RNA结合,使之折叠成有催化活性的结构,从而促进前体RNA剪接, 直接在翻译水平影响基因的表达[22].有研究结果发现,烟草打顶后成熟酶K表达上调, 表明烟草打顶处理能通过增加成熟酶K的表达,增强对RNA内含子的剪切,从而影响6-磷酸山梨醇脱氢酶、氨甲酰磷酸转移酶、精胺/亚精胺合成酶等调控碳氮代谢的酶基因的表达水平, 进而影响烟碱合成的相关生理过程[23].
(2)代谢酶:此次鉴定成功的代谢酶有ATP合酶、葡萄糖-1-磷酸腺苷酰转移酶、亚硫酸盐还原酶、多属性脱氢酶、一氧化氮还原酶、琥珀酰辅酶A合成酶.生物有机体中,ATP的合成是最主要的化学反应之一.ATP合酶广泛分布于叶绿体类囊体、线粒体内膜、异养菌和光合菌的质膜上,参与氧化磷酸化和光合磷酸化,在跨膜质子动力势的推动下合成ATP.ATP合酶的β亚基与核苷酸结合后,具有催化 ATP 合成或水解的活性 [24].腺苷二磷酸葡萄糖(ADPG)是葡萄糖合成的供体,葡萄糖-1-磷酸腺苷酰转移酶主要催化葡萄糖-1-磷酸与ATP合成 ADPG,这在植物淀粉合成中是主要的调节步骤,是植物光合和非光合组织中淀粉合成的起始步骤[25].亚硫酸盐还原酶是催化亚硫酸盐还原为硫化物的酶, 在植物生命活动中具有关键作用 [26].脱氢酶是一种氧化还原酶, 在生物细胞内催化有机物氧化脱氢, 并将其传递给最终受氢体.脱氢酶参与的生物反应包括光合作用、氨基酸合成和降解、脂肪的氧化和合成、丙酮酸的氧化、戊糖磷酸途径等, 为生物体提供必不可少的能量[27].一氧化氮在一氧化氮还原酶的作用下,被还原成N2O.琥珀酰辅酶A合成酶(SCS)由α和β两种亚基构成,是柠檬酸循环的重要组成成分,催化该循环中底物磷酸化的步骤[28].
(3)细胞结构蛋白:脂蛋白是蛋白质与脂肪或类脂结合而成的一类复杂蛋白.脂质通常以非共价键与蛋白质结合,广泛存在于生物膜以及动物的血浆和乳汁中,在生物膜的功能中起十分重要的作用.除成熟红细胞外,所有细胞中都有核糖体存在.核糖体是细胞的重要结构之一,是合成蛋白质的细胞器,其唯一的功能是将氨基酸装配成肽链.肌动蛋白是一种高度保守的蛋白质,是细胞骨架的主要组成成分,它不仅参与维持细胞形态和结构,而且在细胞分裂与分化、信号转导、细胞运动等诸多方面具有重要功能[29].
(4)未知功能蛋白:此次实验还鉴定了几种未知功能蛋白,如蛋白酶3型、逆转录转座子蛋白、未知蛋白等.这些蛋白是根据其核苷酸序列确定的,可能是血水草特有的蛋白质或者是其他生物的蛋白质,目前尚未进行研究.
本研究初步建立了血水草根2-DE参考图谱,为建立血水草蛋白质组数据库提供了必要的资料.血水草的蛋白质构成研究,为血水草开发应用提供理论基础,特别是为血水草作为植物杀螺、灭蚴剂得以在流行区广泛种植及开发成转基因植物提供理论基础.
参考文献:
[1]PARK E, DRAKAKAKI G. Proteomics of endosomal compartments from plants case study: isolation of trans-Golgi network vesicles[J]. Methods Mol Biol, 2014,1209:179-187.
[2]KOMATSU S, KONISHI H, HASHIMOTO M. The proteomics of plant cell membranes[J]. J Exp Bot, 2007,58(1):103-112.
[3]NGARA R, NDIMBA B K. Model plant systems in salinity and drought stress proteomics studies: a perspective on Arabidopsis and Sorghum[J]. Plant Biol, 2014,16(6). doi: 10.1111/plb.12247.
[4]KRISHNAMURTHY P, TAN X F, LIM T K, et al. Proteomic analysis of plasma membrane and tonoplast from the leaves of a mangrove plant Avicennia officinalis[J]. Proteomics, 2014,14(21/22). doi: 10.1002/pmic.201300527.
[5]KOMATSU S, TANAKA N. Rice proteome analysis: a step toward functional analysis of the rice genome[J]. Proteomics, 2005,5(4):938-949.
[6]KOMATSU S. Rice proteome database: a step toward functional analysis of the rice genome[J]. Plant Mol Biol, 2005,59(1):179-190.
[7]PORUBLEVA L, VANDER V K, KOTHARI S, et al. The proteome of maize leaves: use of gene sequences and expressed sequence tag data for identification of proteins with peptide mass fingerprints[J]. Electrophoresis, 2001,22(9):1724-1738.
[8]GALLARDO K, JOB C, GROOT S P, et al. Proteomic analysis of arabidopsis seed germination and priming[J]. Plant Physiol, 2001,126(2):835-848.
[9]CHANG WW, HUANG L, SHEN M, et al. Patterns of protein synthesis and tolerance of anoxia in root tips of maize seedlings acclinated to a low-oxygen environment, and identification of proteins by mass spectrometry[J]. Plant Physiol, 2000,122(2):95-138.
[10]陈 香,胡雪华,陆耀东,等.中国特有植物血水草开花物候与生殖特性[J].生态学杂志, 2011,30(9):1915-1920.
[11]刘 铭,彭 玲.血水草生物碱的药理作用[J].湖南中医杂志, 2009,25(3):128-130.
[12]吴征镒. 中国植物志:第三十二卷[M]. 北京: 科学技术出版社,1999.
[13]左雄军,李 静. 血水草生物碱的HPLC分离[J]. 分析测试学报, 1999,18(6):50-52.
[14]KAMINSKYY V, LIN K W, FILYAK Y, et al. Differential effect of sanguinarine, chelerythrine and chelidonine on DNA damage and cell viability in primary mouse spleen cells and mouse leukemic cells[J]. Cell Biol Int, 2008,32(2):271-277.
[15]ZDARILOVA A, MALIKOVA J, DVORAK Z, et al. Quaternary isoquinoline alkaloids sanguinarine and chelerythrine in vitro and in vivo effects[J]. Chem Listy, 2006,100(1):30-41.
[16]XIAO X, LIU J, HU J, et al. Protective effect of protopine on the focal cerebral ischaemic injury in rats[J].Basic Clin Pharmacol Toxicol, 2007,101(2):85-89.
[17]彭 玲,黄琼瑶,刘建军,等.血水草生物碱致钉螺肝脏蛋白质差异表达分析[J].中草药, 2010,41(3):431-435.
[18]彭 玲,袁仕善,杨盛清,等. 血水草生物碱对钉螺肝脏损伤机理的研究[J]. 中草药, 2011,42(1):127-129.
[19]黄琼瑶,彭 飞,刘年猛,等.血水草生物碱杀灭钉螺的研究[J].中国血吸虫病防治杂志, 2004,16(1):55-57.
[20]陈 雳,张国元,赵明才. 核酸酶与自身免疫性疾病[J].免疫学杂志, 2011,27(3):267-270.
[21]张 波,孟紫强. DNA连接酶同工酶的研究进展[J].生物化学与生物物理进展, 2001,28(5):639-641.
[22]VO GEL J, HUBSEHMAN T, BO RNER T, et al. Splicing and intron-internal RNA editing of trnk-matk transcripts in barley plastids:support for MatK as an essential splice factor[J]. J Mol Biol, 1997,270(2):179-187.
[23]刘卫群,李 浩,郭红祥,等. 烤烟打顶前后差异表达蛋白分析[J]. 烟草农业科学, 2008,4(1):30- 35.
[24]林茂兹,张志兴,林争春,等.太子参连作障碍蛋白差异表达分析[J].草业学报, 2010,19(6):199-209.
[25]刘红星,王蕴波,年 海,等.超甜玉米ADPG-PPase 活性与糖份含量的相关分析及评价[J]. 佛山科学技术学院学报(自然科学版), 2009,27(3):1-4.
[26]刘晓华,万海清.亚硫酸盐还原酶的分离纯化和酶学性质的研究[J]. 酿酒科技, 2006,6(1):28-31.
[27]解 军,祁 峰,裴海燕,等.脱氢酶活性检测方法及其在环境监测中的应用[J]. 中国环境监, 2006,22(5):13-18.
[28]王钦岩,朱圣庚,徐长法.生物化学[M].3版.北京:高等教育出版社, 2002.
[29]RODRIGUEZ-ORTEGA M J, GROSVIK B E, RODRIGUEZ-ARIZA A, et al. Changes in protein expression profiles in bivalve molluscs (Chamaelea gallina) exposed to four model environmental pollutants[J]. Proteomics, 2003,3(8):1535-1543.
(编辑 WJ)
