脊尾白虾精子体外保存的研究
2013-12-23浦蕴惠许星鸿刘兆普阎斌伦
浦蕴惠 , 许星鸿, 高 焕, 刘兆普 阎斌伦
(1. 南京农业大学 资源与环境科学学院 江苏省海洋生物学重点实验室, 江苏 南京 210095; 2.淮海工学院 江苏省海洋生物技术重点建设实验室, 江苏 连云港 222005)
脊尾白虾(Exopalaemon carinicauda)又名白虾、迎春虾, 隶属甲壳动物亚门(Crustacea), 软甲纲(Malacostraca), 真软甲亚纲(Eumalacostraca), 十足目(Decapoda), 长臂虾科(Palaemonidae), 为热温带海区底栖虾类, 是中国3种重要的经济虾类之一, 尤以黄海和渤海产量较多。脊尾白虾肉质细嫩、味道鲜美、营养丰富, 还可加工制成海米, 故有“金钩虾米”之称, 其卵也可制成虾籽, 是深受人们喜爱的海味佳肴。近年来, 随着中国明对虾(Fenneropenaeus chinensis)、日本囊对虾(Penaeus japonicus)等传统虾类养殖难度的加大, 脊尾白虾养殖面积迅速扩大, 成为池塘单养及与其他种类混养的重要品种。目前在脊尾白虾的行为[1]、盐度[2-3]、温度[3]、营养[4-6]、生长[5-6]及育苗生产技术[7]等方面都已有研究, 但脊尾白虾精子的体外保存迄今未见报道。在育种上, 精子的体外保存可避免近亲交配, 增加遗传优势, 解决雌、雄不同步成熟等问题, 对脊尾白虾种质优选、雌核发育、建立优良种质库有重要意义。作者采用精子存活率与顶体酶活力两种评价精子质量的指标, 研究了脊尾白虾精子体外保存中稀释剂、抗冻剂对保存效果的影响, 试图寻找脊尾白虾精子体外保存的最佳条件, 以期为其精子代谢及生理研究提供参考。
1 材料与方法
1.1 脊尾白虾来源及精子的采集
脊尾白虾于2011年10月取自连云港赣榆县养殖场, 挑选雄性个体, 体长(5.90±0.57)cm, 体质量(2.76±0.78)g。解剖后, 取出精巢置于研钵中, 加入少量无钙离子人工海水(海水配方: NaCl 21.63 g, NaOH 0.19 g, KCl 1.12 g, MgSO4·7H2O 4.93 g, H3BO30.53 g, 加蒸馏水定容至1 000 mL), 研磨后, 用200目筛绢网过滤去除组织碎片, 1 000 r/min离心5 min, 取得白色精子沉淀, 4℃保存备用。
1.2 主要试剂
Ficoll液: 以 0.12 mol/L NaCl, 0.025 mol N-2羟乙基哌嗪-N-2-乙磺酸(Hepes)缓冲液配制11%400型聚蔗糖(Ficoll)溶液, 调节pH 至7.5。加入0.1%叠氮钠延长Ficoll液的保存时间。
去污缓冲液: 以0.055 mol/L NaCl, 0.055 mol/L Hepes 缓冲液配制0.01%Triton X-100溶液, 调节 pH为8.0, 加入0.1%叠氮钠以延长保存期。
500 mmol的盐酸苯甲脒水溶液在冰箱中最长可贮存2 周。
底物: 23 mmol/L Nα-苯甲酰-DL-精氨酸-P-硝酰基苯胺(BAPNA), 使用二甲基亚砜(DMSO)配制, 当天使用。
底物和去污剂混合物: 去污剂缓冲液和BAPNA/DMSO底物按9: 1的体积混合。
稀释剂成分:见表1。
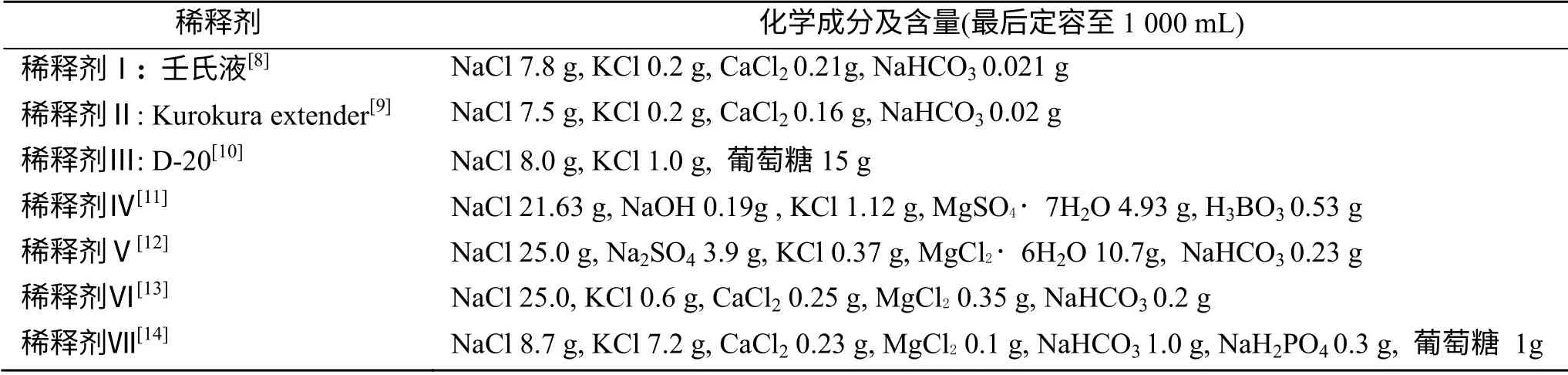
表1 稀释剂成分 Tab. 1 The composition of diluting solutions
1.3 方法
1.3.1 不同稀释剂对精子低温保存的影响
将1.1取得的白色精子沉淀置于离心管中, 分别用7种稀释剂制备成106个/mL的精子悬浮液, 4℃下保存, 分别于0、1、2、3、4 d测定精子存活率及顶体酶活力。
1.3.2 不同稀释剂对精子超低温保存的影响
实验组设置与 1.3.1相同, 并每组添加10%DMSO作为抗冻剂, 对照组不加抗冻剂, 且以低温保存下最佳稀释剂为对照组的稀释剂, 分别于0、1、2 d测定精子存活率以及顶体酶活力。
1.3.3 不同抗冻剂对精子超低温保存的影响
采用上述所筛选出的最适稀释剂, 以DMSO和甘油作为抗冻剂, 设置10个组合: 实验Ⅰ~Ⅳ组分别含甘油(V/ V) 5%、10%、15%、20%; 实验Ⅴ~Ⅷ组分别含二甲基亚砜(Dimethyl sulfoxide, DMSO) (V / V) 5%、10%、15%、20%; 实验Ⅸ组分别含DMSO和甘油各10%; 实验Ⅹ组分别含DMSO和甘油各20%。
对照组不加抗冻剂, 各组精子与稀释剂的混合液于冰箱4℃降温平衡30 min后, 然后将样品投入液氮中保存。
解冻方法: 打开液氮罐, 取出样品迅速放入40℃水浴中解冻, 用以检测各组精子存活率和顶体酶活力。
1.3.4 精子存活率的检测方法
分别从各实验组取1滴精子悬液于干净载玻片上, 涂片, 用2%曙红B染色液(天然海水配制)染色3~4 min, 显微镜观察, 死精子染成红色, 活精子不着色或者部分轻微着色。每次随机计数200个精子, 分4个随机计数点, 每个点约计50个精子, 统计精子存活率。
1.3.5 精子顶体酶活力的测定方法
作者参考Kennedy[15]的方法, 并进行了适当的调整。
(1) 1.5 mL离心管中加入精子悬液, 每管体积不多于 250μL; (2) 同时做对照实验, 0.5 m L Ficoll液注入1.5 mL离心管, 精液必须悬在Ficoll上; (3) 室温条件下, 3 400 r/min离心30 min; (4)去除精浆和 Ficoll 悬浮液, 大约有100μL 的精子沉淀和少量 Ficoll留在管中; (5)加入100μL盐酸苯甲脒溶液到对照组, 并搅匀; (6)每组试管(包括对照组)各添加 1 mL底物和去污剂混合液, 混匀; (7) 25 ℃恒温培养箱中孵化3 h, 每小时混合一下; (8)孵化3 h后, 添加100 μL盐酸苯甲脒溶液到所有实验组(对照组除外); (9) 3 400 r/min离心30 min, 分别收集悬浮溶液; (10)用酶标仪在410 nm处测量吸光值; (11)酶活力计算: 顶体酶的国际单位, 可以用在 25℃降解1μmol Nα-苯甲酰-DL-精氨酸-P-硝酰基苯胺(Nα-Benzoyl- DL-arginine-P-nitroanilide hydrochloride, BAPNA) /min来表示。

1.4 数据处理
各实验均重复3次, 实验数据采用“平均数±标准差”表示, 并采用SPSS16.0软件对数据进行处理, 进行单因子方差分析(One-way ANOVA), LSD(Least Significant Difference)多重比较、Duncan检验。
2 结果
2.1 不同稀释剂对精子低温保存的影响
脊尾白虾精子在各稀释剂中保存的时间均为4 d, 不同稀释剂对低温保存后精子存活率的影响见表2。精子初始存活率为93.18%, 随着处理时间延长, 各组精子存活率与顶体酶活力均出现差异。4℃下保存30 min后, 除稀释剂Ⅱ、稀释剂Ⅶ外, 其余稀释剂的精子存活率均在85%以上, 其中稀释剂Ⅰ的存活率最高, 达到89.63%, 稀释剂Ⅶ最低, 为76.86%, 1、2 d后各组存活率持续下降, 趋势大体相同, 稀释剂Ⅰ均为最高, 其次为稀释剂Ⅴ、Ⅵ, 稀释剂Ⅶ最低。4 d后稀释剂Ⅰ下存活率最高, 达到71.50%。从降幅来看, 以稀释剂Ⅰ最小, 其次为稀释剂Ⅴ、Ⅵ, 稀释剂Ⅶ降幅达到最大, 高达41.71%。
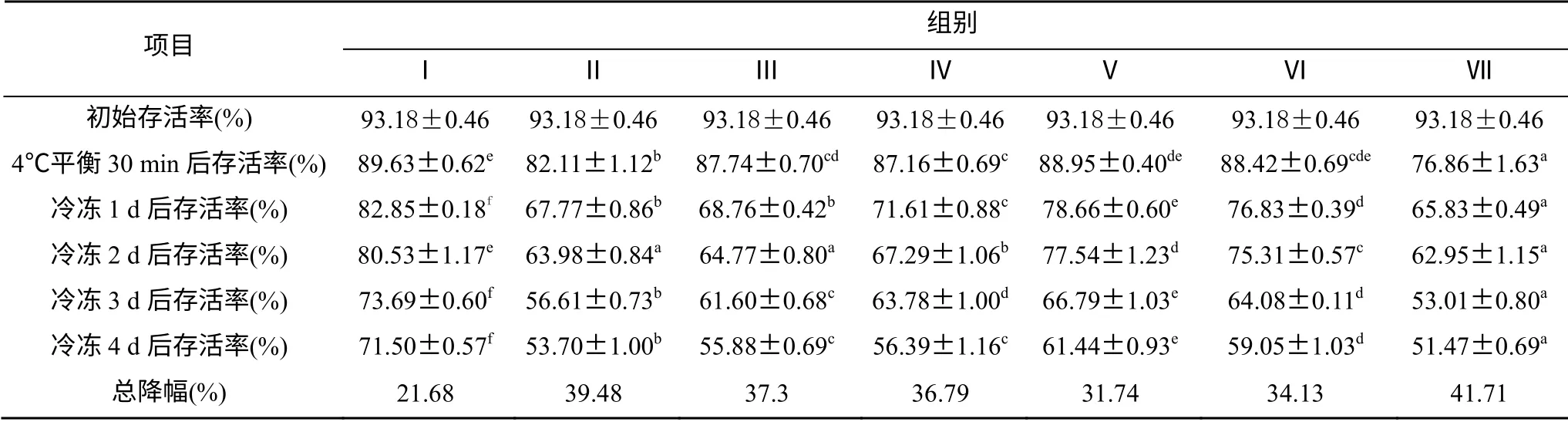
表2 不同稀释剂对低温保存的脊尾白虾精子存活率的影响 Tab. 2 Survival rate of spermatozoa of Exopalaemon carinicauda under hypothermic preservation with different diluting solutions

图1 不同稀释剂对低温保存的脊尾白虾精子顶体酶活力的影响 Fig.1 Acrosin activities of spermatozoa of Exopalaemon carinicauda under hypothermic preservation with different diluting solutions
不同稀释剂对低温保存后精子顶体酶活力的影响见图1, 随着处理时间延长, 低温保存后的精子顶体酶活力逐渐下降。4℃平衡30 min后, 稀释剂Ⅰ保 存下的精子顶体活力最高, 其次为稀释剂Ⅴ、 , Ⅵ 稀释剂Ⅶ保存下的精子顶体酶活力最低。低温保存4 d后, 稀释剂Ⅰ保存下的活力最高, 为1.803 μIU/106, 对照组最低。
由表2、图1比较分析得出, 两种评价精子活力的方法得出的结果基本一致, 变化趋势相同, 壬氏液为脊尾白虾精子低温保存的最佳稀释剂, 其次是稀释剂 , Ⅴ 稀释剂Ⅶ的保存效果最差。4 d后, 各组稀释剂精子存活率与顶体酶活力之间相关性显著,γ=0.846 (P<0.05)。
2.2 稀释剂对精子超低温保存的影响
不同稀释剂对精子超低温保存后存活率的影响见表3。精子初始存活率为92.54%, 随处理时间延长, 各组精子存活率出现差异。4℃平衡后, 除对照组外, 其余各组稀释剂的精子存活率均在85%以上, 其中稀释剂Ⅰ的存活率最高, 达到90.23%, 稀释剂Ⅶ最低, 为86.53%, 1 d后各组存活率持续下降, 稀释剂Ⅰ下的存活率仍为最高。2 d后, 稀释剂Ⅰ下存活率最高, 达到83.50%, 对照组最低, 降至55.66%。从降幅来看, 以稀释剂Ⅰ最小, 其次为稀释剂Ⅵ、Ⅴ, 稀释剂Ⅶ降幅达到最大, 达18.63%。各组的保存效果均比4℃下的保存效果好。
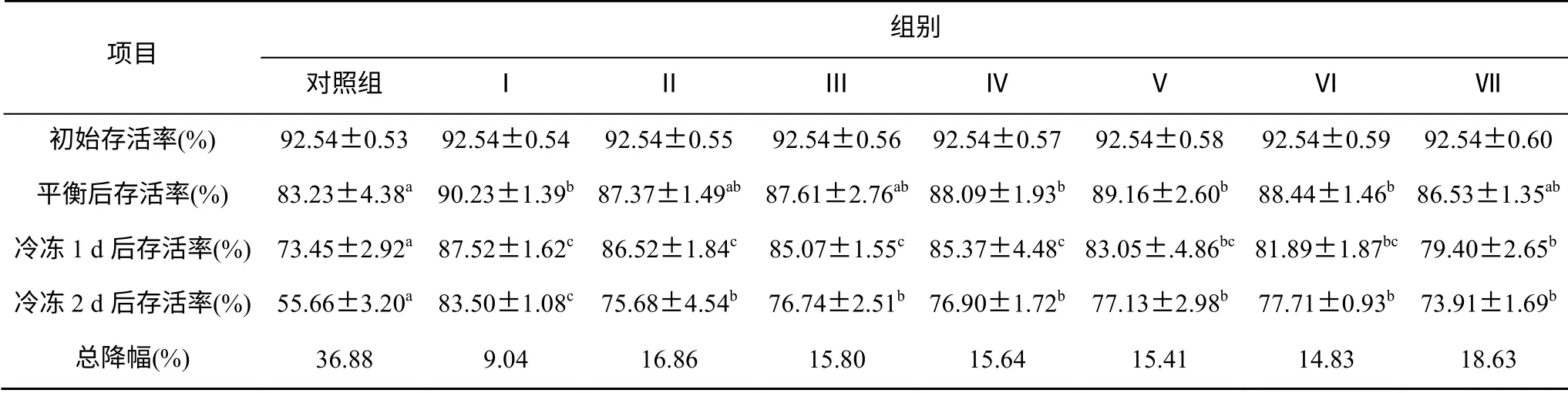
表3 不同稀释剂对超低温保存的脊尾白虾精子存活率的影响 Tab. 3 Survival rate of spermatozoa of Exopalaemon carinicauda under cryopreservation with different diluting solutions
不同稀释剂对精子超低温保存顶体酶活力的影响见图2, 随着处理时间延长, 精子的顶体酶活力逐渐下降。4℃平衡30 min后, 稀释剂Ⅰ保存下的精子顶体活力最高, 为3.760μIU/106, 其次为稀释剂Ⅴ、Ⅵ, 除对照组外稀释剂Ⅶ保存下的精子顶体酶活力最低。保存2 d后, 稀释剂Ⅰ保存下的活力仍然最高, 为2.507μIU/106, 对照组最低, 仅为0.919μIU/106。
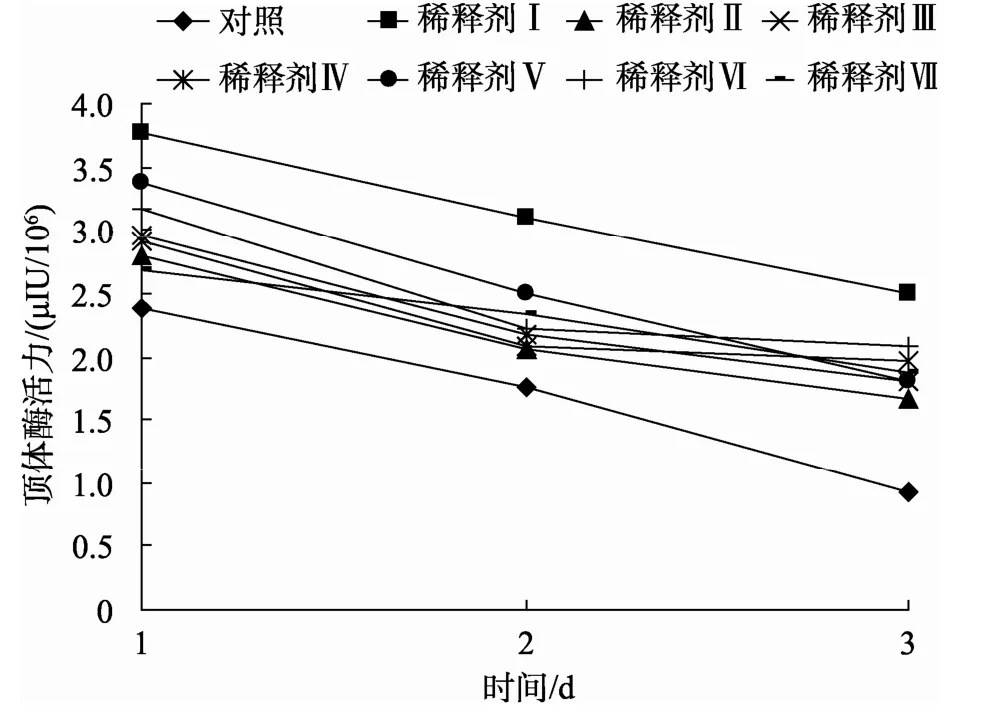
图2 不同稀释剂对超低温保存的脊尾白虾精子顶体酶活力的影响 Fig. 2 Acrosin activities of spermatozoa of Exopalaemon carinicauda under cryopreservation with different dilution solutions
由表3、图2比较分析得出, 两种评价精子活力的方法得出的结果相似, 壬氏液为脊尾白虾精子超低温保存的最佳稀释剂, 稀释剂Ⅶ的保存效果最差, 且此结果与4℃下低温保存的结果相似。各组稀释剂精子存活率与顶体酶活力之间相关性极显著,γ=0.862 (P<0.01)。
2.3 抗冻剂对精子超低温保存的影响
不同抗冻剂对精子超低温保存后精子存活率的影响见表4。精子初始存活率为92.36%, 平衡后各组的存活率均有不同幅度的降低, 对照组下降最明显。超低温保存1 d后, 对照组存活率最低, 实验组Ⅶ的精子存活率最高, 达到85.11%, 其次为实验组Ⅵ、Ⅴ。保存2 d后, 精子存活率明显下降, 但仍是实验组Ⅶ的存活率最高, 高达81.32%, 其次为实验组Ⅵ、Ⅴ, 对照组仅为42.84%。
从表4分析得出, 随着甘油体积分数的增加, 精子存活率也逐渐增加, 但达到20%时, 存活率却有所下降。同样随着DMSO的体积分数从5%到15%, 存活率也随之升高, 15%时达到最高, 而20%时存活率下降。10%甘油和10%DMSO的实验组Ⅹ的存活率较其他实验组都要低。
不同抗冻剂对超低温保存后精子顶体酶活力的影响结果见图3。平衡30 min后, 各组精子顶体酶活力即出现了明显差异, 实验组Ⅶ的顶体酶活力最高, 其次是实验组Ⅲ、Ⅵ。1 d后, 各组顶体酶活力均下降, 实验组Ⅶ的顶体酶活力在各实验组中仍然最高, 其次是实验组Ⅵ、Ⅴ, 对照组精子顶体酶活力最低。2 d后趋势与1 d后相同, 实验组Ⅶ的顶体酶活力降为1.385μIU/106。
由表4、图3比较分析得出, 两种评价分析精子活力的方法得出结果大体相同, DMSO比甘油的保存效果好, 且实验组Ⅶ保存效果在所有实验组中最好, 其次是实验组Ⅵ, 对照组两种指标值均最低。各实验组精子存活率与顶体酶活力之间相关性极显著, 相关系数γ=0.864(P<0.01)。

表4 不同抗冻剂对低温保存的脊尾白虾精子存活率的影响 Tab. 4 Survival rate of spermatozoa of Exopalaemon carinicauda under cryopreservation with different cryoprotectants
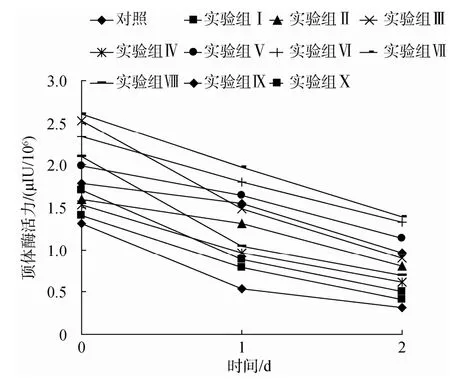
图3 不同抗冻剂对超低温保存的脊尾白虾精子顶体酶活力的影响 Fig. 3 Acrosin activities of spermatozoa of Exopalaemon carinicauda under cryopreservation with different cryoprotectants
3 讨论
3.1 精子保存质量的评价方法
观察精子运动性是评价无脊椎动物精子活力的方法。十足目甲壳动物精子没有鞭毛[16], 精子不能运动, 所以运动能力不能用于其精子的评价。这是评价冷冻保存对脊尾白虾精子活力影响的最大难点所在。已有的精子活力评价方法有生物染色、低渗外吐实验、精卵相互作用、生化分析及精子顶体反应的诱导[17-19]。
本实验采用染色法和顶体酶活力两种方法来评价精子体外保存的效果。染色法要是依靠生物体的代谢作用, 将色素迅速排到胞外, 本实验采用2%曙红B染色液, 死精子染成红色, 活精子不着色或者部分轻微着色。精子顶体酶是精子顶体部特有的胰蛋白酶, 在顶体反应、精子和卵子透明带的结合及穿透中起重要作用。采用顶体酶活力作为指标有利于甲壳动物精子冷冻保存的研究。通常在此类研究中较常用的是染色法, 本实验采用两种方法来评价, 为验证顶体酶活力是评价精子活力有效方法提供依据。染色法的成本低, 但计数工作量大, 主观性强, 顶体酶活力的测定操作简便, 实验结果更为客观, 但成本较高。
3.2 稀释剂对精子保存效果的影响
稀释的天然或人工海水已被广泛地用于十足目甲壳动物精子冷冻的研究中[17,19-21]。本实验参考鱼类、虾类、贝类等精子稀释方法, 根据脊尾白虾生物学特性筛选出7种稀释剂, 再根据预实验得出的适宜pH和渗透压修改而成。Na+、K+、Ca2+、Mg2+是精浆的重要组分, 也是构成精浆渗透压的主要离子。K+、Na+离子在无脊椎动物精子活动中具有重要作 用[22]。适量的K+有延长精子寿命的作用。Ca2+对精子活动的影响与K+、Na+和葡萄糖完全不同, Ca2+浓度过高会对精子活力产生抑制作用[23-24]。
陈东华等[25]研究发现稀释剂Ⅴ是中华绒螯蟹精子短期体外保存的理想保存液。本实验中7种稀释剂中保存效果以壬氏液(稀释剂Ⅰ)的效果最佳, 其次为稀释剂Ⅴ、稀释剂Ⅵ, 这3组的稀释剂中都含NaCl、KCl、NaHCO3这3种组分, 但各组含量不同, 可能导致保存效果的差异性。稀释剂Ⅶ的保存效果最差, 可能是K+的浓度过高, 抑制了精子的活力。哺乳动物和鱼类精子保存的研究发现, 适量添加葡萄糖等糖类物质, 能有效维持低水平的精子代谢, 增强精子活力, 以延长精子寿命[23-24]。但本实验中添加了葡萄糖的稀释剂Ⅶ、D-20(稀释剂Ⅲ)保存效果并不理想, 可能因为脊尾白虾为十足目甲壳动物, 精子无鞭毛, 不能运动, 对葡萄糖这类能源物质的需求不高, 所以添加了葡萄糖对保存效果并没有帮助。D-20(稀释剂Ⅲ)的保存效果差的原因可能还因为成分过于单一。
3.3 抗冻保护剂对精子保存效果的影响
Chow等[26]研究发现10%的甘油对罗氏沼虾精荚的冷冻保存效果最佳, 解冻后能成功授精。陈松林等[27]用6%DMSO作为抗冻剂低温保存鲢、鲤等鲤科鱼类的精子时效果最佳低温保存。柯亚夫等[20]采用含有10%DMSO和5%~10%甘油的稀释液冷冻保存中国对虾的精子, 存活率在60%以上, 解冻后人工授精, 受精率达到59%。不同甲壳动物的抗冻剂是不一样的, DMSO、甘油是最常用的两种抗冻剂。甘油、DMSO通过渗入精子细胞中, 增加细胞质的黏滞度和降低冰点等作用起到对精子的低温保护。一方面, 随着抗冻剂浓度的增加, 精子的保护作用加强; 另一方面, 抗冻剂本身所具有的毒性又是其使用量的限制因子。章龙珍等[28]研究发现DMSO对淡水鱼类精子渗透压有调节作用, DMSO能渗透到精子里面提高精子渗透压, 精子渗透压随DMSO平衡时间和DMSO浓度增加而提高因提高渗透压而降低冰点使精子在结冰前得以快速通过(0~60℃)危险温区[29]。陈松林等[30]研究也发现DMSO是通过渗入到细胞内、提高胞内渗透压而起到抗冻保护作用。从本实验的结果也得出DMSO的保存效果优于甘油。虽然甘油渗透力弱, 能降低原生质冰点到-35℃左右。但与甘油相比, DMSO渗透力强, 亲水性好, 能与电解质鳌合从而降低细胞内电解质的浓度, 进而使细胞内保持水分, 使原生质冰点降低到-40℃, 所以保存效果优于甘油。且本实验中随着DMSO、甘油体积分数的增加, 保存效果也越来越好, 保存效果最佳的是15%DMSO, 但当体积分数达到20%, 保存效果下降。因为体积分数达到一定数值时, 抗冻剂浓度过高, 抗冻剂产生了毒副作用, 因此在添加抗冻剂时应当注意浓度的选择。
[1] 沈辉, 万夕和, 许璞, 等. 脊尾白虾的行为学观察研究[J]. 海洋科学, 2010, 34 (10): 53-56.
[2] 顾军, 李国峰, 张振华, 等. 脊尾白虾对水体盐度的适应性试验[J]. 水产养殖, 2004, 25(2): 39-40.
[3] 陈卫平. 不同温度、盐度下脊尾白虾Exopalaemon carinicauda(Holthuis)早期胚胎和幼体发育的观察研究[J]. 现代渔业信息, 2005, 20(5): 23-26.
[4] 邵银文, 王春琳, 励迪平, 等. 脊尾白虾自然群体与养殖群体的营养差异[J]. 水利渔业, 2008, 28(4): 34-37.
[5] 曹梅, 王兴强, 阎斌伦. 盐度波动和中草药制剂对脊尾白虾存活、生长和免疫的影响[J]. 安徽农业科学, 2010, 38(7): 3512- 3515, 3544.
[6] 王兴强, 曹梅, 阎斌伦. 盐生杜氏藻粉对脊尾白虾存活和生长的影响[J]. 水产养殖, 2006, 27(3): 17-19.
[7] 徐国成, 徐加涛, 于斌, 等. 脊尾白虾工厂化育苗生产技术研究[J]. 齐鲁渔业, 2008, 25(5): 1-3.
[8] Chen S L, Ji X S, Yu G C, et al. Cryopreservation of spermatozoa from turbot (Scophthalmus maximus) and application to large-scale fertilization[J]. Aquaculture , 2004, 236: 547-556.
[9] Routray P, Choudhary A K, Dash S N, et al. Cryopreservation of dead fish spermatozoa several hours after death of Indian major carp ,Labeo rohitaand its successful utilization in fish production[J]. Aquaculture, 2006, 261: 1204-1211.
[10] Maria A N, Viveiros A T M, Freitas R T F, et al. Extenders and cryoprotectants for cooling and freezing of piracanjuba (Bryconor bignyamus)semen,an endangered Brazilian teleost fish[J]. Aquaculture, 2006, 260: 298-306.
[11] Leung T J R, Lawrence A L. Observation on the decline in sperm quality ofPenaeus setiferusunder laboratory conditions[J]. Aquaculture, 1987 , 65 : 363-370.
[12] Tereza G C V, Halccrow K. Influence of some external factors on the acrosome reation in the spermatozoa ofHomarus americanusMilne Edwards 1837[J]. Journal of Crustacean Biology, 1988, 8(3): 317-321.
[13] Chao N H. Cryopreservation of finfish and shellfish sperms[J]. Taiwan Fisheries Research, 1996, 4(2): 157-170.
[14] 邓岳松. 鱼类精液的低温保存[J]. 水利渔业, 1999, 19(4) : 7-10.
[15] Kennedy W P, Kaminski J M, Van der Ven H H, et al. A simple, clinical assay to evaluate the acrosine activity of human spermatozoa[J]. Journal of Andrology, 1989, 10: 221-231.
[16] 席贻龙, 谈奇坤. 日本沼虾精子的形态和超微结构研究[J]. 水生生物学报, 1997, 21(1): 59-63.
[17] Anchordoguy T J, Crogwe J H, Griffin F J, et al. Cryopreservation of sperm from the marine shrimpSicyonia ingentis[J].Cryobiology, 1988, 25: 238-243.
[18] Wang Q Y, Misamore M, Jiang C Q,et al. Egg water induced reaction and biostain assay of spermfrom marine shrimpPenaeus vannamer :dietary effects on sperm quality[J]. Journal of the World Aquaculture Society, 1995, 26: 261-271.
[19] Bhavanishankar S, Subramoniam T. Cryopreservation of spermatozoa of the edible mud crabScylla serrata(Forskal)[J]. Journal of Experimental Zoology, 1997, 277: 326-336.
[20] 柯亚夫, 蔡难儿. 中国对虾精子超低温保存的研究[J]. 海洋与湖沼, 1996, 27(2): 187-193.
[21] Bray W A, Lawrence A L. Male viability determinations inPenaeusvannamei: evaluation of short-term storage of spermatophores up to 36h and comparison of Ca2+-free saline and seawater as sperm homogenate media[J]. Aquaculture, 1998, 160: 63-67.
[22] 鲁大椿, 刘宪亭, 方建萍, 等. 我国主要淡水养殖鱼类精浆的元素组成[J]. 淡水渔业, 1992, 2: 10-12.
[23] 苏德学, 严安生, 田永胜.钠、钾、钙和葡萄糖对白斑狗鱼精子活力的影响[J]. 动物学杂志, 2004, 39(1): 16-20.
[24] 苏德学, 严安生, 田永胜, 等. 阳离子、葡萄糖及渗透压对丁鱥精子活力的影响[J]. 水利渔业, 2004, 24(1): 7-8.
[25] 陈东华, 周忠良, 范丽君, 等. 保存液及保存条件对中华绒螯蟹精子存活率的影响[J]. 华东师范大学学报(自然科学版), 2007, 4: 86-94.
[26] Chow S, Tam Y, Ogasawara Y. Cryopreservation of spermatophore of the fresh water shrimp,Macrobrachium rosenbergii[J]. Biol Bul, 1985, 168: 471-475.
[27] 陈松林, 刘宪亭, 鲁大椿, 等. 鲤、鲢、鳙精子低温短期保存研究[J]. 淡水渔业, 1992, 92: 3-7.
[28] 章龙珍, 刘宪亭, 陈松林, 等. 二甲基亚砜对几淡水鱼精子渗透压及成活率影响的研究[J]. 水生生物学报, 1994, 18(4): 297-302.
[29] 华泽钊. 生物材料的低温保存[J]. 科学, 1987, 39(1): 35-41.
[30] 陈松林, 章龙珍, 郭锋. 抗冻剂二甲亚砜对家鱼精子生理特性影响的初步研究[J]. 淡水渔业研究, 1987, 5: 17-20.
