赤点石斑鱼精子的超低温冷冻及短期保存
2013-12-23郑乐云黄种持危林丹黄长江董巧香
郑乐云, 黄种持, 危林丹, 黄长江, 董巧香
(1. 福建省水产研究所, 福建 厦门 361012; 2. 温州医学院 水域生态与环境科学研究所, 浙江 温州 325035)
赤点石斑鱼(Epinephelus akaara)俗称红斑, 分布于北太平洋西部、中国东海南部以及南海。其色泽鲜艳、肉质细嫩, 属高档经济鱼类, 因其售价高昂、便于活体运输、经济效益极高, 近年来, 受到越来越多的养殖户青睐。目前, 赤点石斑鱼苗来源包括从海域捕捞的野生苗以及通过人工繁殖培育的人工苗。由于多年的过度捕捞, 野生赤点石斑鱼数量大幅度减少, 已被《世界自然保护联盟濒危物种红色名录》收录[1], 其野生苗的捕捞量也呈逐年减少的态势。因此, 增加人工苗的培育和养殖, 更符合海洋渔业资源可持续利用的发展趋势。
赤点石斑鱼人工鱼苗的繁殖虽已获得成功, 但其规模仍受到一定程度的限制[2-3]。究其原因, 在于其独特的性别分化模式, 赤点石斑鱼为雌雄同体, 雌性先熟, 到一定年龄再由雌性转变为雄性。在自然海区性转化的年龄约为6龄以上, 人工养殖条件下亦需3a以上才开始从雌鱼转化为雄鱼[4-6]。因此, 不管是在自然海区捕捞还是人工养殖的赤点石斑鱼, 成熟雄鱼所占的比例均较少, 仅少量可作为人工繁殖的雄性亲鱼, 育苗过程中经常出现精子稀缺的情况。所以, 将赤点石斑鱼的精子予以适当的保存, 可有效地缓解育苗过程中雄鱼精子不足的问题, 为人工育苗提供更多的优质受精卵。根据实际需要, 赤点石斑鱼精子的保存可以从长期保存和短期保存两个方面入手。超低温冷冻技术可以实现赤点石斑鱼精子的长期保存, He等[7]通过在原有石斑鱼精子冻存液中加入环糊精胆固醇复合物, 成功地提高了冻精质量, 但其研究中未针对赤点石斑鱼冻精受精能力予以报道, 而赤点石斑鱼精子的短期保存, 仍未见报道。本研究从贴近应用的角度, 对赤点石斑鱼精子的激活特点、超低温冷冻方案筛选、受精实验、短期保存等方面进行了详细的探索, 从而为野生赤点石斑鱼种质资源的保护、规模人工育苗提供有力的技术支持。
1 材料与方法
1.1 亲鱼
2012年5月13日购于广东省饶平县, 共190尾, 亲鱼体质量600~750 g/尾, 当日运至福建厦门小嶝岛石斑鱼研究基地, 于室内鱼池暂养。每日投喂蓝圆鲹(Decapterus maruadsi)、刷池底、换水100%, 并进行常规的消毒防病处理, 从中选取雄鱼19尾, 雌鱼10尾用于该项研究。
1.2 精子的获取
亲鱼于室内暂养一周后, 陆续对雄鱼采集精子。采集精子时, 首先将雄鱼置于含丁香酚10~20 g/m3的水体中麻醉; 待雄鱼不再挣扎时, 将之捞起, 用纯净水清洗生殖孔及其附近的鱼体表面, 之后, 用吸水纸将生殖孔周围的水份吸干; 轻挤雄鱼腹部, 待精液流出泄殖孔后用移液器将其吸取并移入离心管中备用。取精过程中应避免尿液以及粪便污染; 取精之后的雄鱼立即放入新鲜海水中予以复苏; 获取的精液立刻置于4℃的冰箱中备用。各雄鱼精液的基本参数见表1。
1.3 海水比重对于精子激活的影响
以新鲜海水(温度25℃, 比重1.022)作为初始溶液向其中添加粗盐, 获得比重分别为1.024、1.026、1.028等3种不同的海水, 通过加入纯净水来获得1.020、1.018、1.016、1.014、1.012、1.010 6种不同比重的海水。10个不同比重梯度的海水, 以10: 1(体积比, 海水体积: 鲜精体积, 鲜精用量1 μL)的比例激活随机抽取的6条雄鱼的鲜精, 混匀后取10 μL于干净的载玻片上涂开, 并在100倍放大的暗视野下观察, 以前向运动的精子所占百分比记录为精子的活力。通过盐度计以及渗透压仪(德国GONOTEC公司 OSMOMAT-30-M型)测定不同比重海水相应的盐度和渗透压(表2)。本实验包含6个生物重复, 无技术重复。
1.4 冷冻速率(高度)的筛选
冷冻装置: 泡沫盒厚度为5 cm,内部空间长21 cm,宽18 cm,高22 cm。冷冻时, 先在泡沫盒内加入4 cm高的液氮, 再将样品放置在漂浮于液氮上的泡沫船上(泡沫船长15 cm,宽10 cm,根据需要选择高度)。
冻存过程: 选择6份活力均为85%的雄鱼鲜精, 各取5 μL, 用含1%NaCl、10%DMSO、10 g/L BSA(牛血清白蛋白)的冻存液按10: 1的比例予以稀释, 混匀后装入麦管并做好标记(麦管体积250 μL, 装管体积50 μL, 麦管再装入直径为1 cm的塑料套管中)。之后, 于4℃冰箱中平衡10 min。接下来将装有麦管的塑料套管置于液氮面上方1 cm处熏蒸10 min, 之后将塑料套管取出, 迅速安装到铝制支架上并投入液氮中保存。余下3个高度(3、7、15 cm)操作均与1 cm高度的处理组相同。本实验包含6个生物重复, 无技术重复。
精子解冻以及活力观察: 精子在液氮中保存过夜后取出, 迅速转入40℃温水中解冻7 s。精子解冻后立刻取出1 μL与10 μL比重为1.018的海水混匀激活, 观察精子活力。
1.5 冷冻保存液的比较
冻存液的配制: 冻存液A由生理盐水与DMSO按9: 1(体积比)的比例配制而成; 冻存液B则是在冻存液A的基础上加入海藻糖(阿拉丁试剂), 使得海藻糖的终质量浓度为30 g/L; 冻存液C由1%NaCl溶液与DMSO按9: 1(体积比)比例混匀, 并加入牛血清白蛋白(Bovine serum albumin, BSA, 阿拉丁试剂)使得BSA的终质量浓度为10 g/L。
冻存过程: 选择6份活力均为85%的雄鱼鲜精, 各取30 μL, 每份鲜精平均分成3份, 分别用A、B、C 3种稀释液以10: 1的体积比予以稀释, 再将每份稀释后的精子样品分装入两支250 μL容量的麦管中(装管体积 50μL), 从而获得两个亚样, 并装入塑料套管。4℃平衡10 min后, 于液氮上方7 cm处熏蒸10 min, 之后将塑料套管取出, 迅速安装到铝制支架上并投入液氮中保存。本实验包含6个生物重复, 2个技术重复。
精子解冻以及活力观察: 同1.4。
1.6 受精实验
卵子获取: 选择腹部膨大的雌鱼10条, 予以催产(HCG 100 IU/kg, LHRH-A3 1 μg/kg, 杭州动物药品厂)。催产24 h后观察卵子是否成熟。通过挤压雌鱼腹部获取部分卵子置于比重为1.022的海水中观察, 选择浮卵率70%以上的卵子进行受精实验。
受精: 选取3条雄鱼的鲜精以及冻精(冻存液B,7 cm高度), 分别与3条雌鱼的卵子在烧杯中混合(每个处理约使用卵子400个, 控制精子卵子的比例约为200000: 1), 然后使用100 mL比重为1.018的海水予以激活, 10 min后再加入比重为1.022的海水900 mL并计数各烧杯中浮卵的数量。1.5 h后, 观察到卵裂作为受精成功的标志。受精率=(卵裂数/浮卵数)×100%。本实验包含3个生物重复, 3个技术重复。
1.7 赤点石斑精子的短期保存
选择3份活力为85%的雄鱼精子, 每份样本中取出40 μL, 并均分成两份, 其中1份用等体积的Hank’s溶液稀释, 剩下一份不做处理作为对照, 并置于4℃冰箱中保存。每隔两天从各个处理组取精子悬液1 μL检查精子活力, 直至精子活力均为0。本实验包含3个生物重复, 3个技术重复。
1.8 数据处理
使用统计软件SPSS 17.0对数据进行统计处理。结果均以均数±标准差的形式表示; 对各组间的精子活力进行方差分析; 鲜精、冻精受精率采用配对t检验分析;P<0.05有显著性差异。
2 结果
2.1 鲜精参数
从19条赤点石斑雄鱼获取的精液, 体积、精子浓度、活力分别为: (0.17±0.15) mL 、(9.94±3.01)×109个/mL和(79.21±7.31)%, 三者变异系数分别为86.55%、30.33%和9.23%。可见, 从不同雄鱼所采集到的精液量差异较大、精子浓度差异次之, 活力的差异最小。其中13条雄鱼的精子活力≥80%, 合计2.83 mL, 可满足实验需求(表1)。
2.2 海水比重对于精子激活的影响
海水的比重对于精子激活的影响, 总体呈现先迅速升高然后缓慢下降的趋势。在水温为25℃的条件下, 比重为1.010和1.012的海水并不能使得赤点石斑的精子发生激活; 当海水比重升高到1.014时, 精子被激活, 其活力为(47.50±10.84)%; 随着海水比重的进一步增加, 精子活力迅速提高; 海水比重升至1.018时, 精子活力最高, 为(82.50±4.18)%, 相对于比重为1.016(活力为(80.00±3.16)%,P=0.433)和1.020(活力为(78.33±4.08)%,P=0.194)的处理组无显著性差异, 但显著高于其余的处理组(P<0.05); 之后, 随着海水比重的继续增加, 精子的活力逐渐降低(图1)。可见, 比重为1.018的海水对于赤点石斑鱼精子具有最佳的激活效果, 相应的盐度为25.7‰, 渗透压为821 mOsm/kg。因此, 本研究其他部分所获取的精子活力数据均为使用比重为1.018的海水激活所得。
2.3 冷冻速率(高度)的筛选
通过控制精子样品距离液氮面的高度, 来改变冷冻过程的降温速率。发现经1、3、7和15 cm等4个不同高度的处理, 所得冻精的活力分别为: (43.33±4.08)%、(48.33±2.58)%、(65.83±3.76)%和(55.83±3.76)%, 明显低于鲜精85%的活力(P<0.0001,极具显著性)。不同高度(冷冻速率)之间均表现出显著性差异(P<0.05), 其中以7 cm高度冻存的精子具有最好的冻后活力, 显著高于其他各组(P<0.0001)(图2)。因此, 在后续的实验中, 选择距离液氮面7 cm的高度对赤点石斑鱼精子进行冷冻。
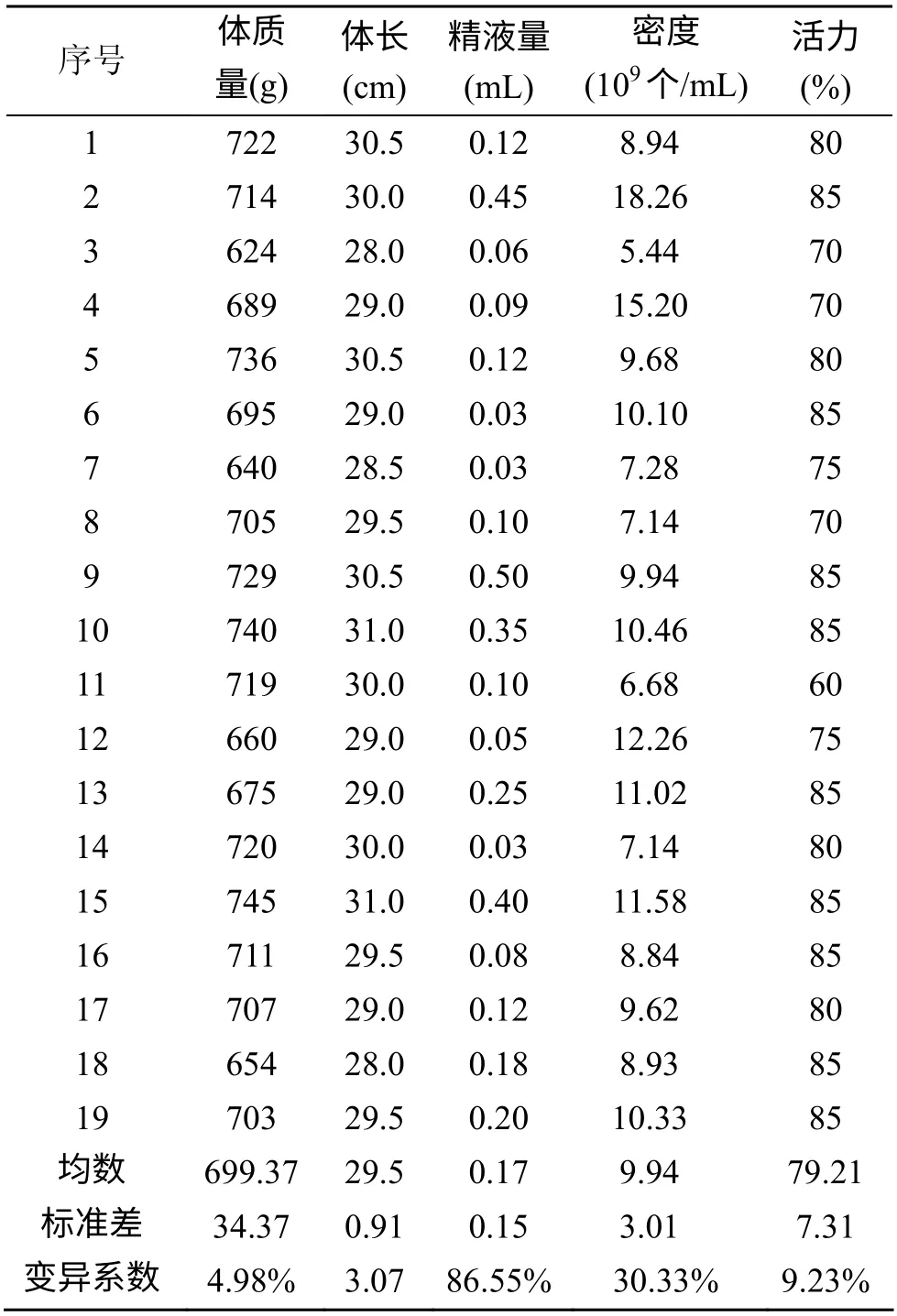
表1 赤点石斑鱼基本参数 Tab. 1 Basic parameters of red spotted groupers

表2 不同比重海水的盐度及其渗透压(水温25℃) Tab. 2 The corresponding salinity and osmolality of seawater with various specific gravity (water temperature was 25℃)

图1 不同比重海水对赤点石斑鱼精子的激活效果 Fig. 1 Activation effect of the seawater with different gravity on red spot grouper sperm
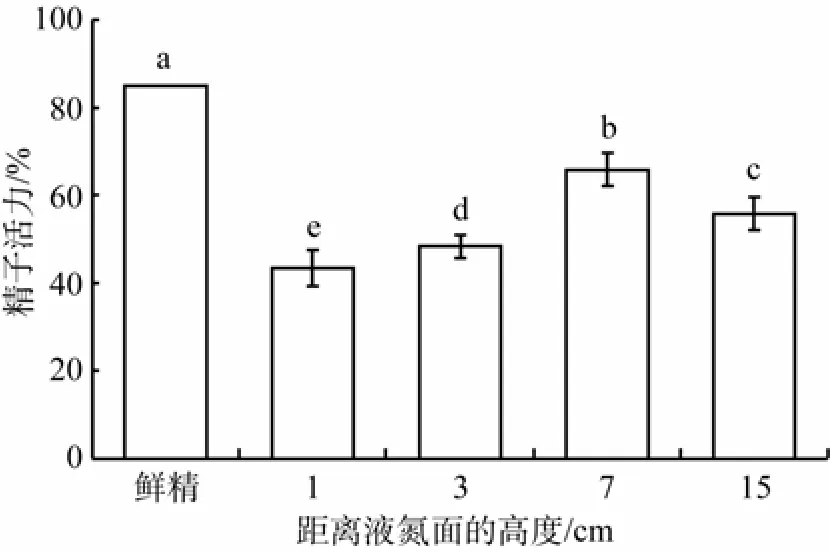
图2 冷却速率对冻精活力的影响 Fig. 2 Effect of cooling rate on post-thaw sperm motility
2.4 冷冻保存液的比较
采用不同的冷冻保存液A、B、C来冻存赤点石斑鱼的精子, 各处理组的冻精活力均显著低于鲜精活力(鲜精活力85%,P<0.0001)。其中, 冷冻保存液B的冻精效果最好, 活力为(67.92±3.96)%, 显著高于冻存液A(冻精活力(59.17±6.34)%,P=0.001)以及冻存液C(冻精活力(62.92±6.89)%,P=0.045), 冻存液A和C之间无显著性差异(P=0.127)(图3)。
图3 冻存液对冻精活力的影响 Fig. 3 Effect of cryopreservation solutions on post-thaw sperm motility
2.5 受精实验
比较通过优化的冻存方案(冻存液B, 7 cm)获得冻精与鲜精的受精效果, 发现在控制精卵比约为 200 000: 1的条件下, 均可获得较好的受精率。其中, 鲜精受精率为(87.42±4.63)%, 冻精的受精率则为(74.55±4.31)%, 二者间的差异具有显著性(P=0.017) (图4)。

图4 受精实验 Fig. 4 Fertilization experiment
2.6 赤点石斑精子的短期保存
总体来看, 赤点石斑鱼的精子在4℃的环境中, 其活力随着保存时间的延长, 逐渐降低, 降低速率先慢后快, 约两周后降低为0。总体上, 通过Hank’s稀释的精子保存效果与未稀释的精子基本一致, 在各个时间点, 两者之间无显著性差异(图5)。
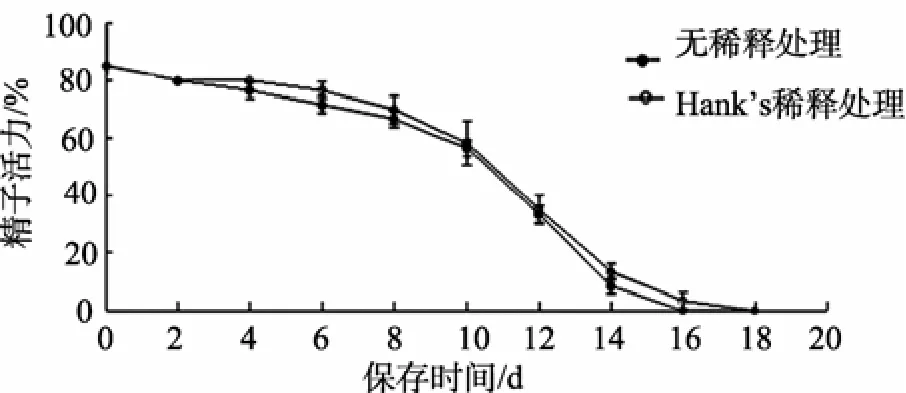
图5 赤点石斑鱼精子的短期保存 Fig. 5 Short-term storage of red spot grouper sperm
3 讨论
3.1 海水比重对于精子激活的影响
除少数卵胎生的鱼类, 如胎鳉科(Poeciliidae)的剑尾鱼(Xiphophorus hellerii)、孔雀鱼(Poecilia reticulata)等, 绝大多数的卵生鱼类其精子排出体外之前均处于静止状态, 只有在受精时, 被排入水体中受到相应的刺激, 才转变成快速运动的精子, 这一过程称之为精子的激活。溶液渗透压对于鱼类精子的激活至关重要[8], 淡水鱼类的精子对于低渗敏感, 因此, 渗透压较低的淡水可激活其精子; 海水鱼类精子则相反, 对高渗敏感, 在渗透压较高的海水中才被激活[9]。海水渗透压与其盐度密切相关, 盐度越高则渗透压越高, 而在温度一定的情况下, 海水的比重可随着盐度的增高而增高, 二者成正比关系, 并且海水比重也是最方便测量得到的数据。因此, 研究海水比重对精子激活的影响, 其本质是研究不同渗透压的海水对精子的激活效果。实验结果表明, 在25℃的条件下, 能引起赤点石斑鱼精子激活的最低海水比重介于1.012与1.014之间, 相应的渗透压则是571~655 mOsm/kg, 高于赤点石斑的精浆渗透压353 mOsm/kg[7]。比重为1.018的海水表现出最佳的激活效果, 虽然相对于比重为1.016以及1.020的海水激活效果无显著差异, 但显著高于其余比重的海水, 与之对应的渗透压为821 mOsm/kg。随着海水比重进一步的增高, 其激活的效果逐渐呈现下降的趋势, 这意味着虽然高渗有利于赤点石斑精子的激活, 但过高的渗透压反而会对降低精子激活的效果。值得注意的是, 实验期间的海水比重稳定在1.022~1.023, 介于此比重范围的海水却并不能对赤点石斑精子起到最佳的激活效果; 而比重为1.018的海水虽具备最佳的激活效果, 但是赤点石斑鱼受精卵在该比重的海水中却不能很好的上浮。从充分利用精子的角度考虑, 之后的受精实验部分, 首先使用少量比重为1.018的海水予以激活, 再加入比重较大的海水, 提高水体比重, 使受精卵上浮。
3.2 赤点石斑鱼精子的超低温冷冻
超低温冷冻保存技术是长期保存精子等生物材质的有效手段。在液氮-196℃的低温状态下, 精子的新陈代谢几乎完全停止, 可历经数年仍保持冻存时的生理生化状态, 只有将其解冻, 才可恢复精子的生理功能[10]。针对鱼类精子超低温冷冻研究多通过简易冷冻装置进行, 以泡沫箱最为常见。通过调节泡沫箱内精子样品距离液氮面的高度, 来获得最适宜该种精子冷冻的降温速率。
本实验中, 首先通过借鉴Cabrita等[11]冻存灰石斑鱼(Epinephelus marginatus)的方案, 使用含10%DMSO、1%NaCl、10 g/L BSA的冻存液, 来摸索简易冷冻装置中最适合冻存赤 点石斑精子的降温速率。实验中, 设计了4个不同的高度, 1、3、7、15 cm,代表了4个依次降低的降温速率。其中以7 cm高度最适宜赤点石斑精子的冷冻, 表明赤点石斑的精子适合以一个适中的降温速率进行冷冻。
在确立降温速率之后, 进一步对冻存液进行了筛选。由于生理盐水与1%的NaCl差别很小、且生理盐水具有低价易得、无菌无污染等特点, 实验中以生理盐水为基础溶液设计了冻存液 A(生理盐水+10%DMSO), 并添加非渗透型抗冻剂海藻糖(冻存液B,在冻存液A的基础上加入30 g/L的海藻糖)以评价海藻糖是否可提高赤点石斑鱼精子的冻存效果。同时将Cabrita等[11]用于灰石斑鱼精子冷冻的冻存液(冻存液C)作为对比。结果表明生理盐水完全可以代替1%的NaCl溶液来作为冻存液的基础溶液。添加了BSA的冻存液C相比于成份简单的冻存液A, 并未表现出显著的优势。而含有海藻糖的冻存液B, 其冻存效果显著高于其他两种冻存液。也说明了海藻糖对于赤点石斑鱼精子冻存的积极作用。此外, 从价格和耐储存的角度考虑, 海藻糖也较BSA更具优势。
受精率则是评价冻存精子的质量更为敏感的指标。有研究指出[7], 精卵比低于200 000: 1时, 受精率将会明显下降。因此, 实验中控制了精子卵子的比例接近该比例, 从而让受精率更为准确地反应冻精的质量。从结果可知, 经优化方案冻存的赤点石斑鱼精子受精率为(74.55±4.31)%, 低于相应的鲜精受精率(87.42±4.63)%,P=0.017, 具有显著性。说明优化后的冻存方案, 在活力降低的同时, 其受精能力也一定程度的下降, 但仍具有较高的应用价值。
石斑鱼具有雌雄同体、雌性先熟的特点, 很难获得足够的雄鱼,所以对石斑精子进行冻存, 才更有价值。通过冻存, 增加雄鱼精子的储备, 有利于石斑鱼人工繁殖规模的扩大, 亦使得成熟季节不同的异种石斑鱼之间的杂交成为可能, 如Kiriyakit等[12]利用冷冻的龙胆石斑鱼(Epinephelus lanceolatus)的精子与斜带石斑鱼(Epinephelus coioides)杂交, 并成功培育出杂交鱼苗。从濒危物种保护和海洋渔业资源可持续利用的角度来看, 也极具意义。
3.3 赤点石斑鱼精子的短期保存
赤点石斑鱼精子经海水激活后可持续运动长达半小时之久[7], 同为海水鱼类的黄姑鱼(Nibea albiflora), 其精子激活后的运动时间不超过10 min[13]。若不将之激活, 而是保存在4℃的环境之中, 可存活两周左右, 而黄姑鱼的精子仅能存活3 d[14]。未作稀释处理的鲜精在短期保存的初期, 活力下降很慢, 至第四天精子活力由最初的85%降至75%~80%, 至第八天仍具有65%~70%的活力, 之后, 随着保存时间的延长, 精子活力迅速降低, 至第十八天活力均降低为0。通过Hank’s平衡溶液稀释, 并未取得明显的保存效果提高。但考虑实际操作中极难完全避免尿液、粪便对精液带来的污染, 因此, 仍有必要对轻微污染的鲜精及时添加Hank’s溶液以消除尿液、粪便带来的渗透压、pH等方面的影响。
实验过程中发现, 取过精子的赤点石斑鱼经过一周的休养, 可再次采集到精液。由于该鱼自身生命力顽强, 可耐受多次的麻醉取精操作, 合理地将精子短期保存与重复取精相结合, 亦可有效地缓解精子不足的问题。同时, 由于赤点石斑鱼精子在4℃条件下可保存较长的时间, 合理地短期保存使得在不运输雄鱼、不进行精子冷冻的情况下跨地域的精子传递成为可能。
[1] Cornish, A. Epinephelus akaara.IUCN Red List of Threatened Species. Version[EB/OL]. http: www. iucnredlist.org, 2003-11-18.
[2] 周根常. 赤点石斑鱼人工繁殖试验[J]. 水产科技. 2008, 1: 21-24.
[3] 毛国民, 史会来, 楼宝, 等. 赤点石斑鱼人工繁育试验[J]. 水产养殖. 2010, 4: 1-3.
[4] 洪万树, 张其永. 赤点石斑鱼繁殖生物学和种苗培育研究概况[J]. 海洋科学, 1994, 18(5): 17-19.
[5] 王涵生. 赤点石斑鱼人工繁殖的研究Ⅰ.亲鱼的室内自然产卵[J]. 海洋科学, 1996, 20(6): 4-8.
[6] 邢晨光, 金珊, 袁思平. 石斑鱼性逆转研究现状[J].水产科学, 2006, 4: 214-215.
[7] He Q T, Lu G, Che K, et al. Sperm cryopreservation of the endangered red spotted grouper, Epinephelus akaara, with a special emphasis on membrane lipids[J]. Aquaculture, 2011, 318:185-190.
[8] Mark C, Bates K, William R. Effect of osmotic pressure on the act ivation and storage of channel catf ish sperm[J]. American Fisheries Society, 1996, 125: 798-802.
[9] 苏天凤, 艾红. 鱼类精子活力及其超低温保存研究综述[J]. 上海水产大学学报, 2004, 4: 343-347.
[10] 李广武, 郑从义, 唐兵. 低温生物学[M]. 长沙: 湖南科学技术出版社, 1998:41-42.
[11] Cabrita E, Engrola S, Conceição L E C, etal. Successful cryopreservation of sperm from sex-reversed dusky grouper,Epinephelus marginatus[J].Aquaculture, 2009, 287: 152-157.
[12] Kiriyakit A, Bart A N, Gallardo W G, et al.Successful hybridization of groupers (Epinephelus coioides×Epinephelus lanceolatus) using cryopreserved sperm[J]. Aquaculture, 2011, 320:106-112.
[13] He Q T, Zhao E H, Lu Y L, et al. Evaluation of activation and storage conditions for sperm of yellow drumNibea albiflora[J]. Aquaculture., 2012, 324-325: 106-112.
[14] 闫文罡, 章龙珍, 庄平, 等. 日本黄姑鱼精子生理特性及超低温冷冻保存研究[J]. 海洋渔业, 2008, 2: 146-151.
