马鞍列岛岩礁生境鱼类群落结构时空格局
2013-12-09汪振华章守宇
汪振华, 赵 静, 王 凯, 章守宇
(上海海洋大学海洋科学学院, 上海 201306)
马鞍列岛岩礁生境鱼类群落结构时空格局
汪振华, 赵 静, 王 凯, 章守宇*
(上海海洋大学海洋科学学院, 上海 201306)
基于2009年马鞍列岛潮下带岩礁生境的多网目三层组合刺网逐月调查数据,对鱼类群落月相和季度间的变化、区域尺度上的空间差异和群落的稳态进行了探讨,应用优势种相对丰度和生物量、定居性鱼类和洄游种的季节动态、非度量多维标度(nMDS)和生物量丰度曲线(ABC)分析方法对群落时空格局进行了分析。结果显示:季节性洄游种集中出现在夏秋季,但对岩礁生境的利用表现出不同区域的强度差异;小黄鱼Larimichthyspolyactis和黄姑鱼Nibeaalbiflora周年利用岩礁生境,但强度有别,尤其在冬季;定居性鱼类褐菖鲉Sebastiscusmarmoratus、斑头鱼Agrammusagrammus和大泷六线鱼Hexagrammosotakii在春末夏初的种群密度最高,同样表现出某些或大部分月份的区域差异;而河口种中国花鲈Lateolabraxmaculatus则更多地选择秋冬季出现在岩礁生境。多元分析结果揭示了当地岩礁生境鱼类群落格局上显著的季节和区域差异,这是定居性鱼类对岩礁生境利用的阶段性变化和区域差异、结合洄游种季节迁移和选择性分布等因素作用下共同形成的格局。ABC分析进一步发现,丰富的鱼类生态类型形成了夏季岩礁生境更为稳定的群落状态,而冬季相反;同时各季度A区的群落干扰明显强过B区。研究表明,产卵季节海域西北部的岩礁生境很可能起着主要的产卵场功能,而东南部区域各季度皆侧重于幼鱼育肥场的功能表达。丰富的种类区系加之优势种的季节性交替出现,共同塑造了岩礁生境极具动态的鱼类群落格局,对维持岛礁海域鱼类多样性以及局部区域生态系统的稳定性起着非常重要的作用。
岩礁生境; 鱼类群落; 时空格局; 马鞍列岛
鱼类组成在不同时间尺度上的变化及不同空间尺度上的差异共同形成了其在特定生境或区域的群落格局。探索这种格局形成的过程和机制是生态学研究的重要内容[1- 2]。20世纪80年代以后,随着生态学尺度研究的深入,对岩礁生境鱼类群落不同时空格局的成因探讨得到进一步的拓展和深入[3- 4]。在站点尺度或小尺度上研究格局,研究者认为需重点考虑种类的竞争、捕食和避敌等问题[5],同时不能忽略人类捕捞的影响[6]。在区域尺度上探讨群落格局则需把握研究区域的底质、水文水质和物理空间异质性等信息[7- 9]。但在景观或更大的尺度上探讨这种格局时,认为温度、盐度、深度和流系等是群落差异形成的主导因子[5,10- 12]。在特定生境中,鱼类群落格局在昼夜[13]、月相和季度[7,14]以及年际间[15]都会发生变化。这些变化的产生除了各种环境的影响之外,群落的特征种或优势种随着生活史的变化而迁入迁出亦成为格局变化的关键原因[2,15]。如能充分了解一种栖息地的鱼类时空格局,则可为特定资源群体的保护和管理提供积极参考[16]。
马鞍列岛海域是鱼类优良的产卵和育肥场,但该海域所有栖息地是否皆起到上述功能?其空间差异是否存在?区域功能是否有侧重?……这些问题一直不得而知。对于保护区而言,应该突出对产卵场的持续保护和育幼所的阶段性封闭管理,而前提是必须查清海域资源的栖息地利用格局。本文目的即在前期阐述马鞍列岛岩礁生境鱼类组成和多样性特征[14]的基础上,进一步探究其群落结构的季节变化和空间差异,丰富当地岩礁生境鱼类群落特征基础数据,为海洋特别保护区鱼类资源的利用和管理提供参考。研究区域地处亚热带海区,水温和透明度等水文因子具有明显的季节差异,同时受长江和钱塘江冲淡水的周期性影响,这些环境因子亦呈现出空间上的梯度变化特征。基于此,研究区域的鱼类群落不仅仅会呈现季节上的变化,而且会表现出海域环境梯度方向上的空间差异。本文将从优势种的数量变化、群落组成时空格局和群落稳定性的变化3个方面来验证上述假设。
1 材料与方法
1.1 研究区域和站点布设
研究区域在浙江省舟山群岛北部马鞍列岛海洋特别保护区。在列岛的西北部岩礁以外的区域,其底质以粉砂质软泥为主;在东南部岩礁以外区域以硬相沙石泥底质为主。相应的,两个区域的年平均透明度和盐度分别为(1.11±0.67) m和(29.04±1.52)以及(2.43±1.29) m和(30.11±1.58),存在较大差别。根据所有采样站点的分布情况结合当地冲淡水和潮汐共同影响下的环境梯度分布特征,将S01—S11共11个站点所在区域划为A区,而S12—S21共计10个站点所在区域划为B区(图1)。本文研究区域21个站点的具体采样信息参见文献[14]。
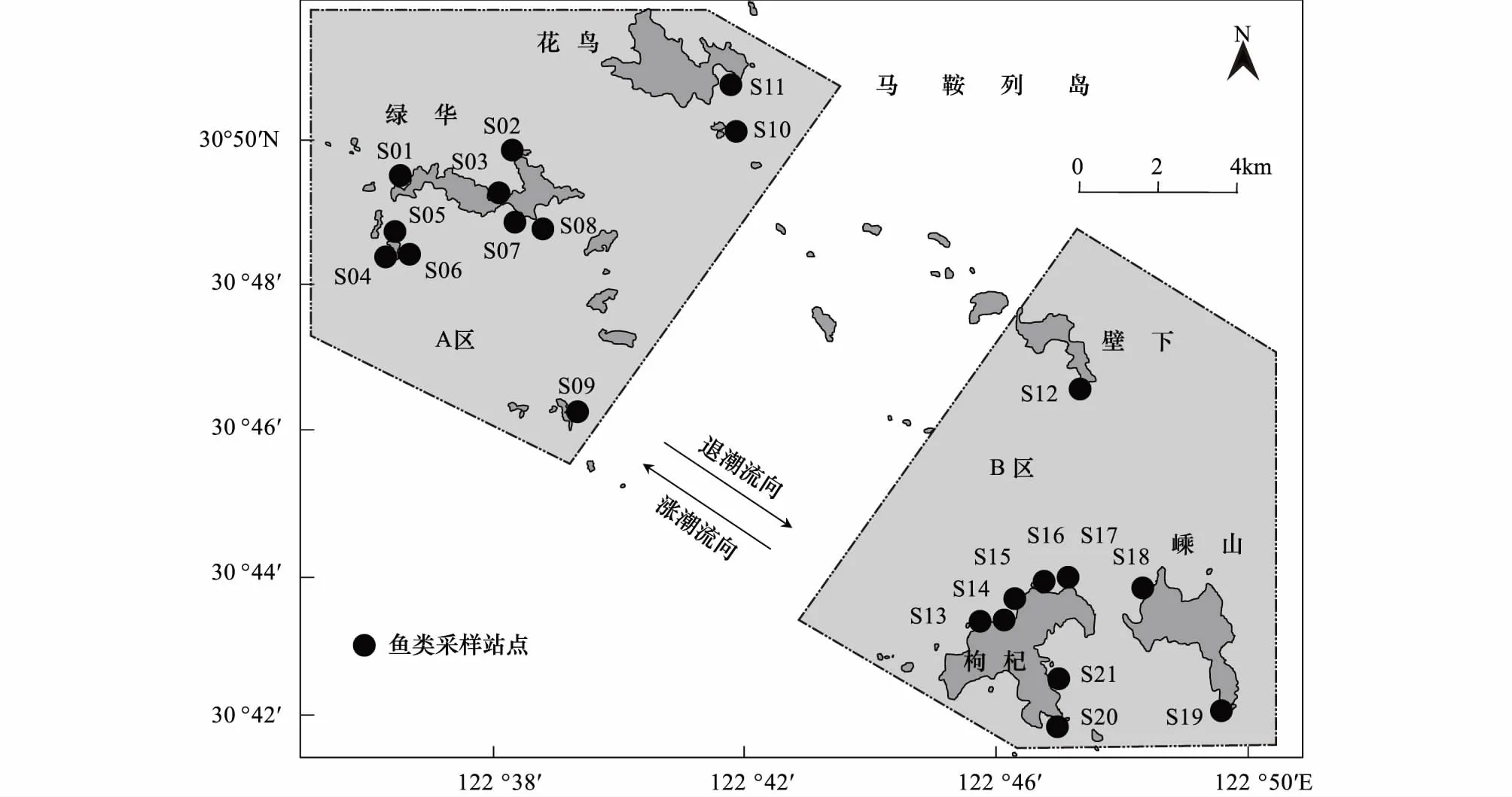
图1 采样区域和站点分布Fig.1 Location of study area and distribution of sampling sites
1.2 采样方法和样品处理
本文采样方法和样品处理同[14]。蟹笼渔获星康吉鳗Congermyriaster仅在丰度和生物量曲线分析中出现。
1.3 数据处理和统计分析
以丰度CPUE (Catch Per Unit Effort,个/d)表示各采样站点鱼类的相对密度。优势种相对丰度和群落组成排序时,不包含蟹笼渔获。采用单因素方差分析(One-Way ANOVA)检验相同月份不同区域间优势种的丰度CPUE差异。显著性水平为α=0.05。
利用非度量多维标度(Nonmetric Multidimensional Scaling, nMDS)对不同区域和不同季节间的鱼类群落结构进行排序,同时结合ABC (Abundance-Biomass Curve)曲线进行群落扰动和变化分析。首先对所有站点的渔获丰度和生物量进行标准化,即将渔获尾数和重量转化为24 h对应的丰度和生物量,以此建立丰度和生物量矩阵,计算任意两站点间的Bray-curtis 相似性系数值,以此形成相似性矩阵,进行进一步的排序分析。MDS图的可解释程度根据其压力系数(stress)来确定,通常当stresslt;0.2时,该图具有一定的可信度。利用相似性百分比(Similarity Percentage, SIMPER)分析来确定群落差异形成的主要贡献物种。利用相似性分析(Analysis of Similarities, ANOSIM)检验不同季节和区域群落组成的差异性[17],置换数皆为1000。在做nMDS分析时将出现率小于5%的种类剔除[18]。以上分析皆使用PRIMER5.0完成。
2 结果
2.1 优势种丰度CPUE时空变化
分别对赤鼻棱鳀Thrissamystax,丝背细鳞鲀Stephanolepiscirrhifer,小黄鱼Larimichthyspolyactis,黄姑鱼Nibeaalbiflora,褐菖鲉Sebastiscusmarmoratus,斑头鱼Agrammusagrammus,大泷六线鱼Hexagrammosotakii和中国花鲈Lateolabraxmaculatus等共8种主要优势种类的丰度CPUE进行统计(上述优势种占全年总渔获尾数的67.8%和渔获重量的53.5%),由图2可以看出,上述优势种在相同时间尺度上对马鞍列岛岩礁生境的空间利用存在不同程度的差异。

图2 岩礁水域AB两区岩礁生境主要优势鱼类的丰度渔获率月变化Fig.2 Monthly variation of abundance catch per unit effort for dominant fishes in two rocky reef areas*Plt;0.05, **Plt;0.01
季节性洄游种方面(图2):赤鼻棱鳀在B区停留的月份多于A区,进入8和9月后两区域表现出类似的变化趋势。虽然AB两区8、9月的丰度CPUE月均值并不相同,但之间尚无显著差异(F8,AB=1.037;F9,AB=1.633,Pgt;0.05)。丝背细鳞鲀大量出现的月份在AB两区基本吻合,差别在于5、6月它首先在B区出现,直到7月才出现在A区。10月份开始,赤鼻棱鳀逐渐消失于B区,而A区一直持续到11月,且捕获的量也明显大于B区。
近海洄游种方面(图2):小黄鱼在B区岩礁生境出现的月份数明显多于A区。除1、3月份小黄鱼在A区的丰度CPUE显著高于B区外,其他月份两区间的差异并不明显。在时间尺度上,全年12个月在B区皆采捕到黄姑鱼,而2月份和8月份的A区未能捕获。AB两区域的黄姑鱼丰度CPUE在冬、春和夏季的多数月份皆无显著差异。进入夏末和秋季,两区的丰度CPUE逐渐从相似转变为A区小于B区,到了12月份则显著低于B区。
定居性鱼类方面(图2):褐菖鲉表现出AB两区岩礁生境较大的数量差异。全年B区的丰度CPUE除了9月略大于、10月略小于A区外,其他月份皆显著高于A区,1月份则达到了A区的12.9倍。除9、10月份外,其他月份B区的丰度CPUE是A区的4.4倍。斑头鱼在A区只有少数月份被少量捕获,而B区不仅各月均有较多数量的出现,且量上皆显著高于相同月份的A区。斑头鱼在B区的丰度CPUE变化并未表现出上述其他种类的波浪形特征,进入夏秋季节,多数月份都有着较高的丰度CPUE。大泷六线鱼在岩礁生境的AB两区出现模式类似于褐菖鲉,但B区出现的月份数显然多于A区。3、5和11月份,大泷六线鱼在A区的渔获率显著低于B区,而到了9月份,则显著高于B区。
河口性鱼类方面(图2):中国花鲈对岩礁生境时间尺度上的利用呈现了秋冬季高、春夏季低的特征。同样该鱼在B区出现的月份要多于A区,8月份在两区皆未采获该鱼种。1、4、9和11月份仅在B区采获一定量的中国花鲈。除了3月份A区的中国花鲈丰度CPUE显著高于B区外,其他共同出现的月份或季节的差异并不显著。
2.2 鱼类群落组成时空变化

图3 基于丰度数据的岩礁生境全年鱼类群落组成的多维排序分析Fig.3 The multidimensional scaling analysis of fish community composition based on abundance data in rocky reef habitat throughout the year
nMDS分析显示(图3),鱼类群落组成的季节变化夏季和冬季皆明显区别于春秋2季,而春秋两季间的交叠较为强烈。进一步的SIMPER分析揭示,春夏、春秋、春冬、夏秋、夏冬和秋冬间的群落组成平均相异性百分比分别为81.38%、67.4%、76.84%、80.41%、88.69%和73.62%。结合表1可以看出,夏季中上层鱼类赤鼻棱鳀和蓝圆鲹Decapterusmaruadsi以及石首鱼科小黄鱼和皮氏叫姑鱼Johniusbelengerii幼鱼的加入,使得该季节的群落组成明显区别于其他季节。其他季节间的差异主要是由于定居性鱼类褐菖鲉、斑头鱼以及河口性鱼类中国花鲈和黄姑鱼的密度变化而引起(表1)。ANOSIM分析表明,岩礁生境鱼类群落组成的季节差异极为显著(Global Test,R=0.305,Plt;0.001),各季节间除了春季-秋季间的群落差异达到显著水平外(Pairwise Test,R=0.073,P=0.002gt;0.001),其他两两季节间的差异皆达到了极为显著的水平(成对检验Pairwise Tests:R冬季-春季=0.304,Plt;0.0001;R冬季-夏季=0.57,Plt;0.0001;R冬季-秋季=0.195,Plt;0.0001;R春季-夏季=0.376,Plt;0.0001;R夏季-秋季=0.333,Plt;0.0001),其中冬季和夏季间的群落差异是最大的。
对岩礁生境的鱼类群落组成进行4个季节间的AB区域比较,也表现出区域间的明显差别。nMDS分析显示(图4)4个季度两个区域的鱼类群落格局皆有着不同程度的明显差异。结合SIMPER分析,AB两区春、夏、秋和冬季的群落组成平均相异性百分比分别为70.23%、76.74%、69.97%和74.84%。进一步结合表1,春季A区是以底层褐菖鲉和近底层黄姑鱼占绝对优势的群落格局,而B区是以底层恋礁鱼类褐菖鲉、斑头鱼和大泷六线鱼为优势群体的群落格局;夏季优势鱼类小黄鱼和皮氏叫姑鱼更多地出现在A区,而蓝圆鲹和丝背细鳞鲀则更多地出现在B区;秋季在B区出现了更多的斑头鱼和黄姑鱼;而冬季的B区除了继续保持斑头鱼群体的优势度外,该区域的黑鲷群体却没有A区那样密集。ANOSIM分析表明:AB两区的鱼类群落在4个季度间皆存在显著的差异(Global Tests:R春季=0.351,Plt;0.0001;R夏季=0.183,P=0.002lt;0.01;R秋季=0.311,Plt;0.0001;R冬季=0.263,P=0.004lt;0.01)。
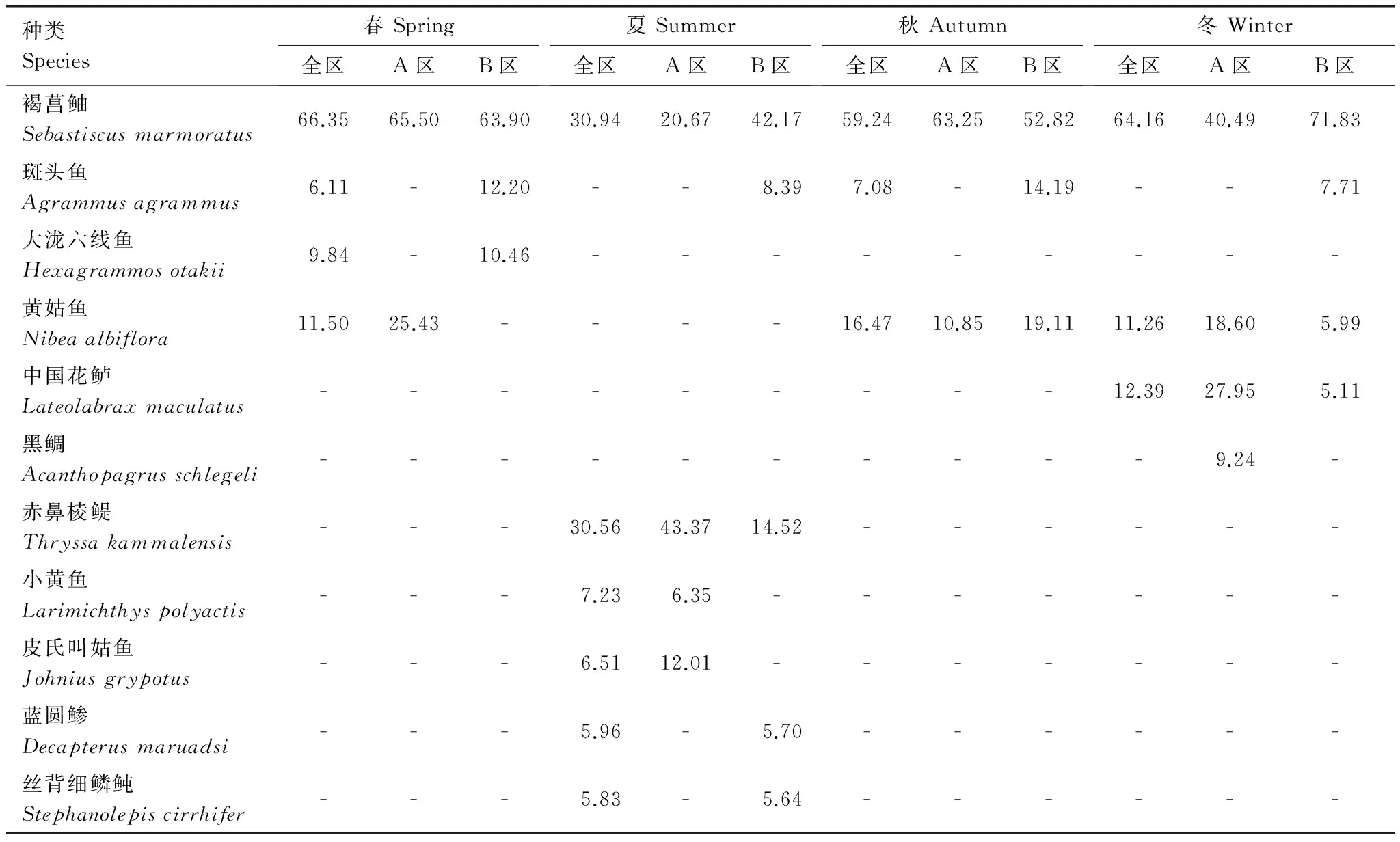
表1 不同季节和区域中岩礁生境鱼类群落主要鱼种的相似性贡献度(%)
表中仅罗列各群落中贡献值大于5%的种类
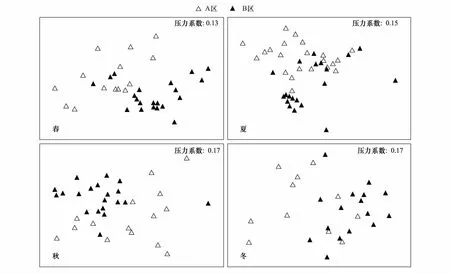
图4 基于丰度数据的岩礁生境AB两区鱼类群落组成四个季度的多维排序分析Fig.4 Seasonal multidimensional scaling of fish community composition comparisons between area A and area B based on abundance data
2.3 鱼类群落稳态变化
ABC曲线的季节变化方面:春秋两季的曲线模式类似,夏季的丰度曲线在更高位上变化,而到了冬季,丰度和生物量曲线出现了交叉,最终形成了生物量曲线在上、丰度曲线在下的变化模式(图5)。褐菖鲉、鳀和斑头鱼主导了春季岩礁生境丰度曲线70.1%的累积优势度,褐菖鲉、黄姑鱼和大泷六线鱼则占据了生物量曲线累积优势度的52%(表2)。到了夏季,无论是丰度线还是生物量线,赤鼻棱鳀都占据了绝对优势地位,成为累积优势度曲线的最大主导者,而褐菖鲉、蓝圆鲹和皮氏叫姑鱼所占比例相应要小得多,因此形成了丰度线高位发展、生物量线低位延伸的ABC模式。秋季的丰度和生物量曲线前三位皆由趋礁性鱼类所控制,虽然褐菖鲉的数量优势处在第1位,但生物量累积率的第1位由黄姑鱼所替代,斑头鱼和中国花鲈紧随其后,共同形成了秋季底层和近底层鱼类主导的鱼类群落。褐菖鲉占据了冬季丰度线累积值的40.5%,在数量上是绝对的优势种,其次是中国花鲈和黄姑鱼,体型较大的中国花鲈,黄姑鱼和黄鮟鱇Lophiuslitulon依次成为冬季生物量曲线的前3位累积率贡献者(表2)。ABC曲线的季节变化上,同样表现出了和月份变化模式类似的特点,即有中上层鱼类成为优势种的季节,A线和B线的变化更加平缓,而缺乏该类型鱼类时,两曲线表现出突然收紧或交叉的不稳定变化(图5)。可以看出,研究区域的鱼类群落总体上以幼小鱼类个体为主,仅在冬季有相对较多的大型成鱼出现。
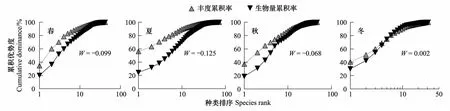
图5 岩礁生境4个季度的丰度生物量曲线Fig.5 The seasonal abundance and biomass curves in rocky reef habitat
对AB两区的ABC曲线进行比较,可以发现,除夏季外,其他季节的曲线变化模式都有着明显的差异。春季A区的生物量曲线从第3个种类开始,就基本和丰度曲线在一个累积率上变化,并在近末尾发生了明显交叉,而B区的生物量和丰度曲线呈现始终分开、最后重合的变化特点(图6)。秋季的A区生物量丰度比较曲线发生了明显的交叉,而B区几乎是一个重合的渐近变化。到了冬季A区的生物量曲线完全在丰度曲线之上,而B区优势种丰度累积率依旧在生物量累积率之上,在优势种之后呈现一个重合和微弱的交叉变化过程。导致这些明显差异的一个重要原因是AB两区生物量百分比占优势的种类组成有着显著不同,尤其是春季和秋季,第1生物量优势种种类不同,而且体型较大的趋礁鱼类中国花鲈、黑鲷Acanthopagrusschlegeli和黄姑鱼,以及底层鱼类黄鮟鱇更多地出现在A区。虽然两个区域的群落皆以幼小鱼类为主导,但AB两区的幼-成鱼比例并不相同,因此B区的群落相对比较稳定,而A区相对要剧烈一些。
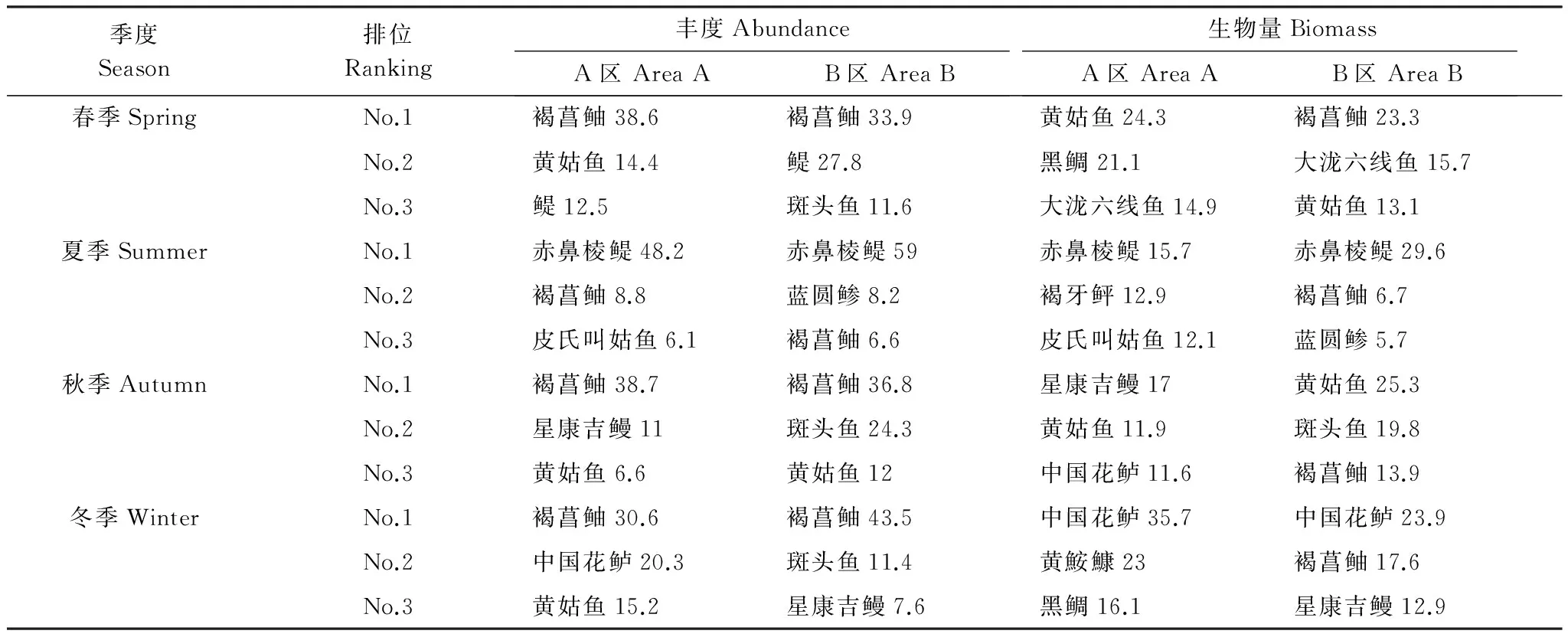
表2 岩礁生境AB两区域四个季度丰度和生物量百分比位于前3位的种类
种类后面数字表示其对应的丰度或生物量百分比
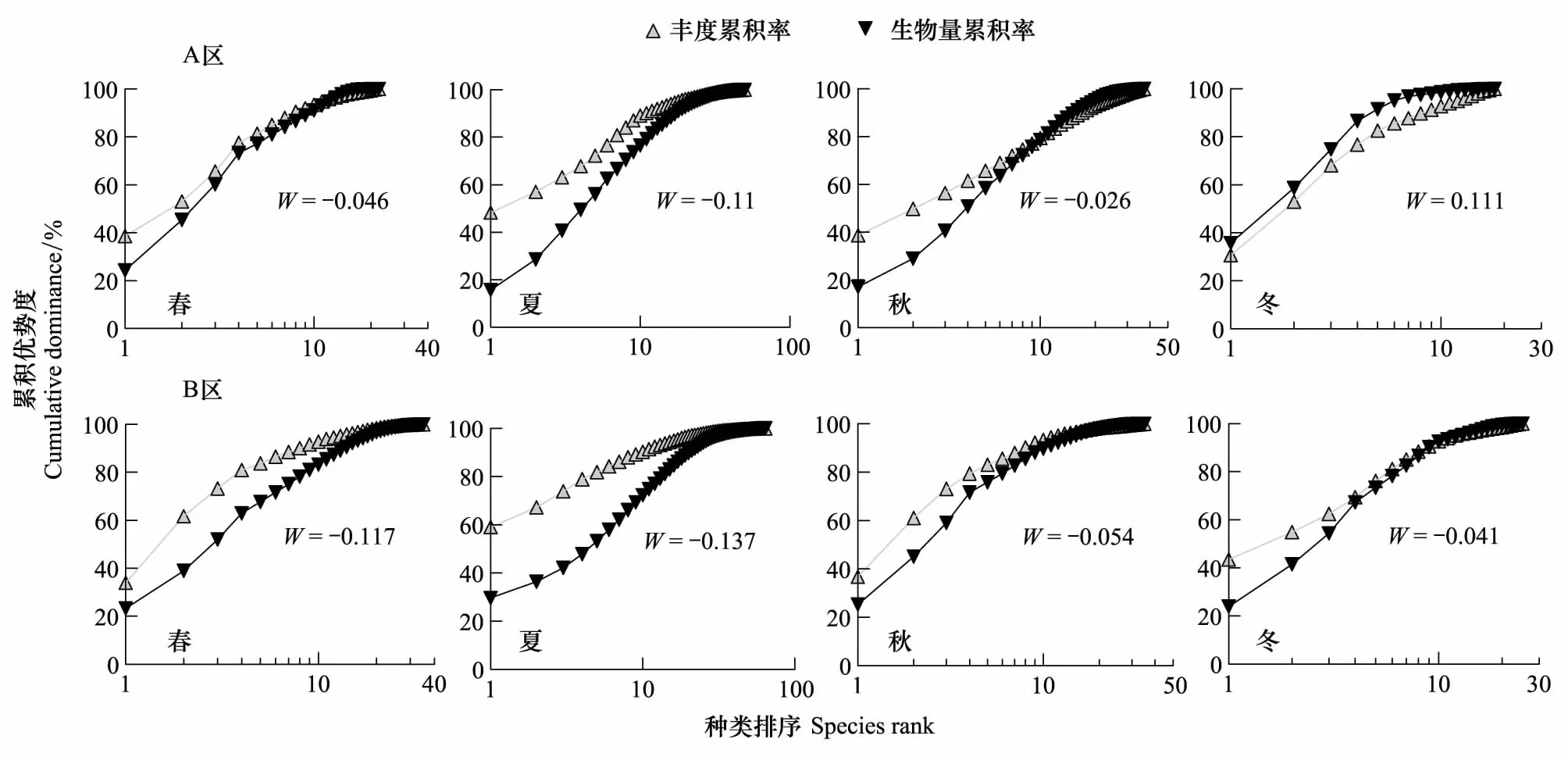
图6 AB两区岩礁生境4个季度的丰度生物量曲线 Fig.6 The seasonal abundance and biomass curves of fish community composition in area A and area B
3 结论和讨论
3.1 优势种利用岩礁生境的时空动态
研究表明鱼类利用岩礁生境的时间跨度及区域差异随生态类型的不同而不同。
对于季节性洄游种在岩礁生境出现,其主导因子很可能是水温及耦合的暖流[5,14]。而造成它们在AB区间的差异,则与环境因子在区域尺度上的梯度分布有关[8],如食物竞争和躲避敌害等[5]。通过同步的环境和栖息地特征调查,发现马鞍列岛海藻的丰度、密度及规模在A区皆要低于B区,这很可能在B区形成了更多适宜饵料生物生存的条件,从而吸引更多的洄游种类趋向出现在B区。
以小黄鱼和黄姑鱼为代表的石首鱼科鱼类在研究区域都能被周年采集到,这说明这些近海洄游性鱼类不同阶段都有利用岩礁生境的需求,而随着生命史的变化其需求强度发生变化[2,15],从而共同形成秋季集群最高而其他季节群体密度较低的特征。
对于定居性种类而言,这种时间尺度上的波动和空间上的差异,可以用集合种群和集合群落的相关概念进行解释[2,19]。在马鞍列岛跨度约30 km的区域尺度上,褐菖鲉等的繁殖和补充往往因为温度、盐度和饵料条件的梯度性而不能同步进行;另一方面很可能出于种群繁殖的需要,不同区域在作为繁殖场所和育幼场所的功能被区分化[15]。
对于河口性鱼类而言,由于其本身对温盐的适应性较强,该类型鱼类的时空格局则主要受栖息地在提供其生长、摄食和繁殖等需求方面的功能所影响。
当然,形成上述种类时间变化和空间差异的另一个原因很可能是捕捞[6]。本文研究选择的21个站点,除了在A区的4个数站位,其他大部分站点周年受捕捞的干扰都比较小,而且某些种类并非经济种(如赤鼻棱鳀和丝背细鳞鲀),所以人为捕捞对这些种类时空格局的形成,其影响相对其他自然环境而言是比较小的。
3.2 鱼类群落组成的时空变化
本研究揭示了当地岩礁生境鱼类群落组成不仅存在显著的季节变化特征,而且在相同季节有着明显的区域差异。一定程度上表明鱼类利用不同区域中相同生境的机制是有差别的。
从时间变化上来看,这种显著差异的贡献主要来源于春季的恋礁鱼类、夏季近底层石首鱼科鱼类和中上层鳀科鲹科鱼类、秋季除了大泷六线鱼之外的恋礁鱼类以及冬季恋礁和近礁鱼类(中国花鲈和黑鲷集群出现)。由于这些主要鱼类对岩礁生境的季节性利用模式存在差异,过程中形成了种类的迁移和群体密度的波动状态,从而主导了该生境鱼类群落显著的季节动态[7]。
从空间差异上来看,各季度两个区域的群落格局皆有着显著的不同。这种差异的贡献源主要来自除褐菖鲉之外的其他恋礁性鱼类(如斑头鱼和大泷六线鱼)、趋礁性鱼类(黑鲷、中国花鲈和黄姑鱼)、部分石首鱼科鱼类(小黄鱼和皮氏叫姑鱼)以及中上层鳀科和鲹科鱼类。它们在不同区域岩礁生境的相对丰度往往有着显著差异,这一方面与栖息环境本身的差异有关,另一方面某些洄游性种类利用两个区域岩礁生境存在明显的时差。
空间上的差异实际上反映的是岛礁水域的集合群落状态。有研究指出,可以通过生物的个体大小和扩散模式来确定集合群落状态[2]。比较两个区域主要贡献鱼种的个体大小差异,并结合前期报道[14],发现在近河口一侧的A区捕获的黑鲷和黄姑鱼通常都是个体较大的成体,很多都在产卵阶段;而外侧B区的个体相应要小,且大多数为幼鱼[14]。这和可能与这些种类对产卵场和育幼场的选择性利用有关。
对上述鱼类而言,本研究可以初步揭示A区更侧重于产卵场功能的体现,而B区作为育幼场所的功能则更为突出。这与两区域该生境的水文条件和饵料基础密切相关[5]。
3.3 岩礁生境鱼类群落稳态特征
马鞍列岛岩礁生境鱼类群落总体上以幼小鱼类为主导,波动性较大,且不同区域和季节间有着明显差别。其抵抗捕捞干扰、污染和栖息地破坏的能力很可能较差,群落较脆弱。
当特定区域的鱼类群落以数量优势为主导时,往往能反映出该栖息空间内的幼小鱼类数量比较多[20]。对于岩礁生境而言,高密度幼小鱼类的存在是其庇护和育幼功能的最好体现。从ABC曲线的分析结果可以看出,马鞍列岛岩礁生境的春、夏和秋季的主要功能在于对幼小鱼类的养护。这些鱼类不局限于当地趋礁种类,还包括季节性洄游的鳀科、鲹科和石首鱼科鱼类[14]。另一方面,更多的幼鱼预示着补充群体的基础状况较好,因此对该生境而言,其鱼类群落的年龄结构就更为稳定[20]。
但这种群落稳态在AB区域又有差异。在阐述群落组成格局的基础上,结合本分析结果,可以进一步揭示两个区域在幼鱼、成鱼比例上的一个显著差异。在不考虑捕捞干扰在情况下,两个区域的不同ABC模式并不能得出A区群落稳态比B区差的结论,因为两个区域本身的功能可能明显不同。但更多的成鱼出现在A区(如黄姑鱼和黑鲷等)对其种群本身而言会非常不利。调查期间,春秋季整个马鞍列岛大部分的刺网生产船都集中在河口侧的A区,尤其在春季,可以捕获大量性成熟的黄姑鱼和鮸鱼个体。强烈的捕捞干扰,必然降低了该区域岩礁生境同期的鱼类群落稳定状态,从而不利于资源的持续利用和多样性的维持。
[1] Lekve K, Boulinier T, Stenseth N C, Giøster J, Fromentin J M, Hines J E, Nichols J D. Spatio-temporal dynamics of species richness in coastal fish communities. Proceedings of the Royal Society B: Biological Sciences, 2002, 269(1502): 1781- 1789.
[2] De Bie T, De Meester L, Brendonck L, Martens K, Goddeeris B, Ercken D, Hampel H, Denys L, Vanhecke L, Van der Gucht K, Van Wichelen J, Vyverman W, Declerck S A J. Body size and dispersal mode as key traits determining metacommunity structure of aquatic organisms. Ecology Letters, 2012, 15(7): 740- 747.
[3] Sale P F. Appropriate spatial scales for studies of reef-fish ecology. Australian Journal of Ecology, 1998, 23(3): 202- 208.
[4] Chesson P. Spatial scales in the study of reef fishes: A theoretical perspective. Australian Journal of Ecology, 1998, 23(3): 209- 215.
[5] Martino E J, Able K W. Fish assemblages across the marine to low salinity transition zone of a temperate estuary. Estuarine, Coastal and Shelf Science, 2003, 56(5/6): 969- 987.
[6] Ordines F, Moranta J, Palmer M, Lerycke A, Suau A, Morales-Nin B, Grau A M. Variations in a shallow rocky reef fish community at different spatial scales in the western Mediterranean Sea. Marine Ecology Progress Series, 2005, 304: 221- 233.
[7] Gelwick F P, Matthews W J. Temporal and spatial patterns in littoral-zone fish assemblages of a reservoir (Lake Texoma, Oklahoma-Texas, U. S. A.). Environmental Biology of Fishes, 1990, 27(2): 107- 120.
[8] Roeda M, Defeo O. Spatial structure of fish assemblages in a tropical estuarine lagoon: combining multivariate and geostatistical techniques. Journal of Experimental Marine Biology and Ecology, 2003, 296(1): 93- 112.
[9] Wang Z S, Chen M H, Lü K, Xu C R, Lei G C. Species diversity and spatio-temporal distribution patterns of icefishes (Salangidae) in Poyang Lake. Acta Ecologica Sinica, 2006, 26(5): 1337- 1344.
[10] Jaureguizar A J, Menni R, Lasta C, Guerrero R. Fish assemblages of the northern Argentine coastal system: spatial patterns and their temporal variations. Fisheries Oceanography, 2006, 15(4): 326- 344.
[11] Li S F, Cheng J H, Yan L P. Spatial structures of fish communities on the continental shelf of the East China Sea. Acta Ecologica Sinica, 2007, 27(11): 4377- 4386.
[12] Valle C, Bayle-Sempere J T. Effects of a marine protected area on fish assemblage associated withPosidoniaoceanicaseagrass beds: temporal and depth variations. Journal of Applied Ichthyology, 2009, 25(5): 537- 544.
[13] Wang Z H, Wang K, Zhang S Y. Diel variations of fish assemblages in multiple habitats of Ma′an archipelago, Shengsi, China. Acta Ecologica Sinica, 2011, 31(22): 6912- 6925.
[14] Wang Z H, Zhang S Y, Chen Q M, Xu Q, Wang K. Fish community ecology in rocky reef habitat of Ma′an Archipelago Ⅰ. Species composition and diversity. Biodiversity Science, 2012, 20(1): 41- 50.
[15] Holbrook S J, Kingsford M J, Schmitt R J, Stephens J S Jr. Spatial and temporal patterns in assemblages of temperate reef fish. American Zoologist, 1994, 34(3): 463- 475.
[16] Denny C M, Babcock R C. Do partial marine reserves protect reef fish assemblages?. Biological Conservation, 2004, 116(1): 119- 129.
[17] Clarke K R, Clarke R K, Gorley R N. PRIMER v6: User Manual-Tutorial. Plymouth: Plymouth Marine Laboratory, 2006.
[18] McCune B, Grace J. Analysis of Ecological Communities. Gleneden Beach: Mjm Software Design, 2002.
[19] Hanski I. Metapopulation Ecology. New York: Oxford University Press, 1999.
[20] Wang Z H, Wang K, Zhao J, Zhang S Y. Fish community structure and its seasonal change in subtidal sandy beach habitat off southern Gouqi Island. Chinese Journal of Applied Ecology, 2011, 22(5): 1332- 1342.
参考文献:
[9] 王忠锁, 陈明华, 吕偲, 许崇任, 雷光春. 鄱阳湖银鱼多样性及其时空格局. 生态学报, 2006, 26(5): 1337- 1344.
[11] 李圣法, 程家骅, 严利平. 东海大陆架鱼类群落的空间结构. 生态学报, 2007, 27(11): 4377- 4386.
[13] 汪振华, 王凯, 章守宇. 马鞍列岛多种生境中鱼类群聚的昼夜变化. 生态学报, 2011, 31(22): 6912- 6925.
[14] 汪振华, 章守宇, 陈清满, 许强, 王凯. 马鞍列岛岩礁生境鱼类群落生态学 Ⅰ. 种类组成和多样性. 生物多样性, 2012, 20(1): 41- 50.
[20] 汪振华, 王凯, 赵静, 章守宇. 枸杞岛潮下带沙地生境鱼类群落结构和季节变化. 应用生态学报, 2011, 22(5): 1332- 1342.
FishcommunityecologyinrockyreefhabitatofMa′anArchipelagoⅡ.Spatio-temporalpatternsofcommunitystructure
WANG Zhenhua, ZHAO Jing, WANG Kai, ZHANG Shouyu*
CollegeofMarineSciences,ShanghaiOceanUniversity,Shanghai201306,China
Spatio-temporal pattern in fish community structure is an important topic for fish community ecologists. In order to better understand fish community characteristics in rocky reef habitats (RR) of the Ma′an Archipelago, we analyzed monthly data from 21 randomly selected sites sampled with multi-mesh trammel nets in 2009. This study reveals spatial and temporal variation in fish community composition, and specifically focuses on seasonal variation in the relative population density of dominant fishes, species richness and diversity, fish community composition, disturbance-related fish community dynamics, and regional differences in fish community patterns based on these indices. Regional differences can be explained by gradients in water turbidity and salinity along tidal currents, so sites set in the southeast were allocated to area A, and sites set in the northwest were allocated to area B. We test the assumption that fish communities in RR habitat within the study area are a function not only of seasonal variations, but also of spatial differences between areas A and B. We use indices of abundance catch per unit effort (A-CPUE) to specify relative population density and community abundance density. Multivariate analysis such as multidimensional scaling (MDS), similarity percentage (SIMPER), analysis of similarity (ANOSIM) and abundance biomass curves (ABC) were introduced to explain spatial differences and temporal variation in fish community composition. Seasonaly migrating species such asThrissamystaxandStephanolepiscirrhiferwere collected only in summer and autumn, and habitat use by both differs between areas A and B.LarimichthyspolyactisandNibeaalbifloracan be found in RR habitat all year, but they choose different microhabitats in different seasons.Sebastiscusmarmoratus,AgrammusagrammusandHexagrammosotakiireach their highest population density during late spring and early summer, but they can be found most months in areas A and B, though their densities are time- and space-dependent. The estuarine fishLateolabraxmaculatusappears frequently during autumn and winter but is less abundant in other seasons. SIMPER, ANOSIM and MDS analyses reveal obvious seasonal variations in fish community composition and significant spatial differences between areas A and B (Plt;0.001). The population rise and fall of the local species mixed with the immigration and emigration of migrating species both contribute to this pattern. The ABC analysis further indicates that the most stable communities can be found in summer, while the opposite is true in winter. Much more disturbance exists in area A compared to area B during each of the four seasons. We conclude that abundant eco-types and obvious seasonal variations in population density of dominant fishes, which relates to habitat use tendency, contribute together to the spatio-temporal patterns of fish communities in the RR habitat of the Ma′an archipelago. A comprehensive understanding of this is vital to the protection and sustainable use of living resources in the study area.
rocky reef habitat; fish community; spatio-temporal pattern; Ma′an Archipelago
国家重点基础研究发展计划资助项目 (2011CB111608);国家自然科学基金资助项目 (41176110)
2013- 06- 08;
2013- 08- 26
*通讯作者Corresponding author.E-mail: syzhang@shou.edu.cn
10.5846/stxb201306081445
汪振华, 赵静, 王凯, 章守宇.马鞍列岛岩礁生境鱼类群落结构时空格局.生态学报,2013,33(19):6218- 6226.
Wang Z H, Zhao J, Wang K, Zhang S Y.Fish community ecology in rocky reef habitat of Ma′an Archipelago Ⅱ. Spatio-temporal patterns of community structure.Acta Ecologica Sinica,2013,33(19):6218- 6226.
