非人灵长类性打搅行为研究进展
2013-12-09王程亮纪维红赵海涛王开锋郭松涛齐晓光李保国
杨 斌,王程亮,纪维红,赵海涛,王开锋,郭松涛,齐晓光,李保国,,*
(1. 陕西省动物研究所,西安 710032; 2. 西北大学生命科学学院,西安 710069;3. 梅西大学自然科学及数学学院,新西兰)
非人灵长类性打搅行为研究进展
杨 斌1,王程亮1,纪维红3,赵海涛1,王开锋1,郭松涛2,齐晓光2,李保国1,2,*
(1. 陕西省动物研究所,西安 710032; 2. 西北大学生命科学学院,西安 710069;3. 梅西大学自然科学及数学学院,新西兰)
性打搅行为是指非人灵长类社群内非交配个体对正在发生性行为个体的干扰行为,该行为在非人灵长类中普遍存在,通过综述目前已知的36种非灵长类的性打搅行为的报道,探讨性打搅行为的功能和意义。性打搅行为具有更高度的种间和种内差异,种间的性打搅的方式不同、同时受到社会结构和婚配制度的影响;在种内受到性别、年龄、等级等因素的影响。结合川金丝猴性打搅的研究结果,从性打搅的类型、被打搅的反应、性打搅的功能以及相关假说等方面入手,对非人灵长类性打搅行为进行系统总结,旨在为我国相关领域的研究提供参考,为生殖行为学研究者启发思路,推动本领域的发展。
非人灵长类;性打搅行为;性竞争假说
性打搅行为是指动物在交配时受到同种其它个体的干扰或攻击等影响,这些影响方式包括化学信息素、面部表情、声音行为以及直接的身体攻击等行为[1];性打搅行为在无脊椎动物(如昆虫等)和脊椎动物(如鱼类、鸟等)中都普遍存在[2],并且在36灵长类物种中得到了较深入的研究[3- 6]。关于非人灵长类的性打搅行为研究,国外始于20世纪60年代,70和80年代、甚至90年代一直是灵长类性行为的研究的热点[6- 9]。国内关于非人灵长类性打搅行为的研究,在藏酋猴(Macacathibetana)和川金丝猴(Rhinopithecusroxellana)中展开,特别是在川金丝猴中得到深入的研究[10- 11]。非人灵长类的性打搅行为早期研究仅停留在描述这一行为的存在,没有足够的量化数据予以支持,研究者依据观察提出一些假说对这一行为进行解释[12]。随着研究的深入,性打搅行为在更多的物种中得到深入的研究,通过量化数据,现有的假说得到验证,同时新的假说也得以提出。
性打搅行为在灵长类中普遍存在,是生殖行为学重要的研究热点[6, 12]。由于用来解释性打搅的理论和假说众说纷纭,不成体系,阻碍了这一领域的研究[12]。鉴于此,本文总结已知的36种灵长类性打搅的研究进展[3, 12, 13- 18],结合川金丝猴性打搅的研究结果,从性打搅的类型、被打搅的反应、性打搅的功能以及相关假说等方面入手,对非人灵长类性打搅行为进行系统总结,希望能藉此为我国相关领域的研究提供参考,为生殖行为学研究者启发思路,推动本领域的发展。
1 灵长类性打搅行为的定义及分类
性打搅行为是灵长类社群内非交配个体对正在发生性行为个体的干扰行为[19]。依据被打搅的性行为类型,以及性打搅行为的方式和强度,性打搅行为可以分为以下几种类型。
1.1 异性性打搅和同性性打搅
依据性行为所涉及个体的不同性别,可分为异性性行为和同性性行为[20]。异性性行为是发生性行为的两个体性别不同,而同性性行为是发生性行为的两个体性别相同,同样包括邀配、爬背等行为[20]。同性性行为(雌性和雌性、雄性和雄性)发生在类人猿、旧大陆猴,尤其是叶猴类(Langurs)等物种中[6],涉及的年龄组不仅包括成年个体[21- 22],也包括青年个体[23]。依据性行为类型的不同,性打搅行为可分为异性性打搅和同性性打搅[8]。通常意义上的性打搅行为是指成年雄性和成年雌性的交配所受到的性打搅行为[6]。随着生殖行为学领域的不断发展,研究者也在日本猕猴(Macacafuscata)中发现同性性行为的受到打搅,一般是由成年雄性发出,是雄性打断雌性同性恋而获得雌性的竞争策略[22],但在其它物种中的同性性打搅其功能和意义目前仍不清楚[8]。因此,现阶段关于性打搅行为的研究,主要集中在解释异性性打搅行为的机理以及对其功能的验证[6]。
1.2 性干扰和性打断
依据性打搅行为的强度,性打搅行为可分为:性干扰和性打断[6, 24]。
1.2.1性干扰 是指性打搅行为的方式和强度相对比较温和轻微,例如:趋近交配对、接触或轻拍交配个体[6]。由于这种性打搅的强度比较低,因此一般不会导致交配个体的行为的中断或停止,即使在有性打搅的情况下,雄性通常仍然会继续骨盆推动和射精。性干扰者一般是成年雌性和未成年个体(青年猴和婴幼猴)。例如,川金丝猴单元内的干扰者通常为成年雌性、青年猴和幼猴,干扰方式有威胁声音、威胁性的注视、尖叫和轻拍等,通常不会直接导致交配终止。类似的打搅方式在叶猴(Presbytisentellus)、普通狨(Calltithrixjacchus)、赤猴(Erythrocebuspatas)和猕猴(Macacamulatta)等物种中存在[7, 10, 24- 25](表1)。
1.2.2性打断 指打搅强度相对激烈,具有比较强的分裂性和攻击性的打搅方式,具体的行为有打斗、撕咬和用力拉扯等方式,通常会导致交配行为的中断或停止。这种方式的性打搅一般由成年雄性发出,尤其是高等级雄性。例如,川金丝猴单元外交配时成年雄性通常采用这种方式打搅,成年雄性(通常是单元外交配雌性所属家庭单元的雄性)会直接攻击、打斗、驱赶发生
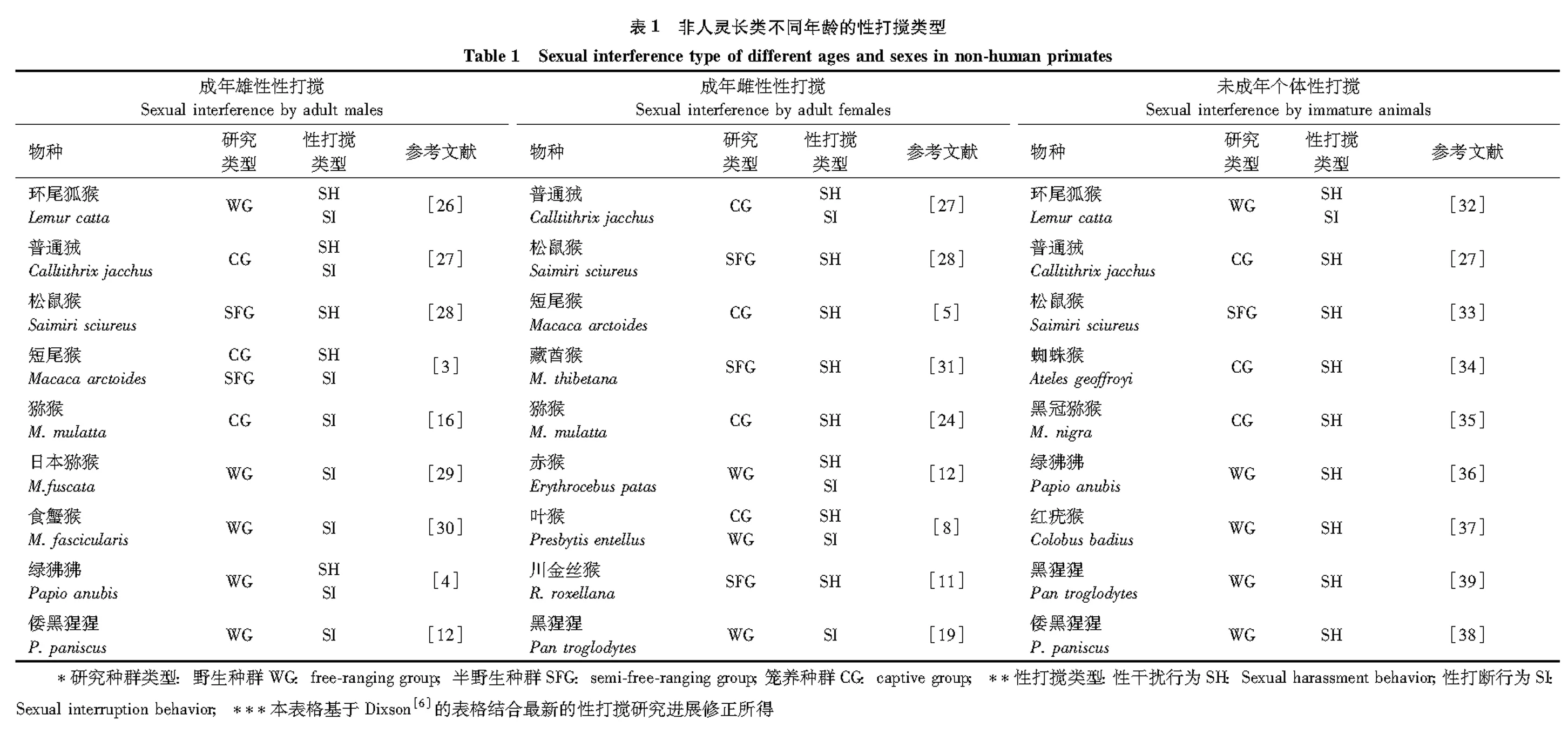
2 被性打搅的个体回应类型
交配个体受到其他个体的打搅后的反应,在不同物种或者同一物种(不同年龄、不同社会等级和不同社会情境)都有差异,大致有4种:
(1)无反应和继续 前者指被打搅者受到轻微的打搅而继续性行为;通常是受到比较温和的性干扰方式的打搅所作出的反应。例如,川金丝猴的成年雌性发生交配时,家庭单元(OMU)内其它非交配的成年雌性向交配的成年雄性发出威胁声音、报警声音或邀配等打搅方式,类似的反应在狐猴、狨类等物种存在[7]。由于打搅方式多是非接触类型的干扰(89.3%, 100/112),川金丝猴的成年雌性对打搅者的回应,大部分是忽略打搅继续交配 (71.4%, 80/112)[11]。
(2)停止 是指被打搅的个体终止性行为而取食或者理毛;被打搅个体通常受到激烈的打搅所作出相应的反应。例如,在川金丝猴中发生单元外交配的成年雄性,受到其它成年雄性(通常是发生单元外交配的成年雌性所在家庭单元的成年雄性)的攻击、驱赶等而停止交配,迅速逃跑(62.9%, 17/27)[11]。再如短尾猴(Macacaarctoides)的低等级的成年雄性交配时,受到高等级的成年雄性的打搅而中断交配[7, 24]。长尾猴(Presbytisentellus)、日本猕猴等物种被打搅个体会做出这样的反应[8,40]。
(3)攻击 是指被打搅的雌性或者雄性攻击打搅者[41]。川金丝猴的青年猴或婴猴发起打搅行为时,偶尔会受到被打搅成年雌性的攻击。川金丝猴的112次的成年雌性性打搅,仅3次被打搅的雌性攻击打搅者,且都是被打搅者的个体等级高于打搅者的等级。类似的结果在短尾猴发现,的高等级成年雄性会攻击低等级雄性的打搅[7]。
(4)改变交配伙伴 是指被打搅者改变原来的交配对象,选择与打搅者交配,通常也是受到比较温和的性干扰方式的打搅所作出的反应。例如,在川金丝猴中,成年雌性主动邀配成年雄性时,单元内的另外一个成年雌性也发出邀配方式的打搅,该成年雄性选择与打搅者交配(5.4%, 6/112)。这种行为回应发生的比较少,目前明确给出一定量化数据的是川金丝猴和黑猩猩。Nishida观察到黑猩猩的383次的交配,受到11次(3%)成年雌性的性打搅,9次导致交配的中断;其中有3次是成年雄性随后与打搅的成年雌性交配[42]。这一行为反应,说明打搅者通过性打搅这种行为方式获得一定的交配机会。
3 影响灵长类性打搅行为的因素
就目前的研究结果来看,非人灵长类的性打搅行为具有更高度的种间和种内差异,受到物种、社会等级、繁殖状况、社会结构等因素的影响[6, 12]。
3.1 物种
性打搅频次、方式、强度在非人灵长类中呈现出高度的种间差异。例如性打搅的频次在不同物种中的差异比较大,长尾猴将近有80%的交配受到性打搅[8],日本猕猴的交配受到68%的性打搅[40],川金丝猴的雌性性打搅是24.23%[10],而在黑猩猩(Pantroglodytes)中的性打搅仅仅只有2%[43]。在一些非人灵长类物种中还仅仅只有性打搅的描述,只有几个事件而已,还有一些种类迄今为止仍然没有发现性打搅行为[6]。造成非人灵长类的性打搅的方式和频次的差异与成年雄性的宽容度水平和社会结构有关[44]。例如,原猴类(Prosimii)多数属于夜间活动和独居的灵长类社会结构,有关原猴类的性打搅行为的报道相对较少[12]。相对的,多雄社会结构的环尾狐猴的性打搅却很常见[45]。群内个体之间的攻击关系对称的灵长类物种(如,日本猕猴),性打搅行为普遍存在,因此性打搅频次较高。而在一些攻击关系不对称的种类中(如,黑猩猩),性打搅很少,或者不存在,因此性打搅频次比较低。日本猕猴等的多雄多雌的社会结构,这是一种单一水平结构的社会体系。其性打搅与交配行为相关,性打搅呈现出单一水平,群内成年雌性和雄性都有性打搅行为,性打搅行为表现为比较对称[6]。而在一雄多雌社会结构的川金丝猴,处于多重社会结构[46]。在此社会结构下,川金丝猴的性打搅表现出多重水平,存在单元内和单元外性打搅的多重水平[11]。在川金丝猴的一雄多雌的家庭单元(OMU)中,单元内的性打搅呈现出偏雌性的,是雌性性竞争的体现[10]。因此,非人灵长类的性打搅与其社会结构、社会关系有相关性。纵览目前性打搅的研究,性打搅的频次和强度与其交配体制的存在直接关系。单配制的物种如普通狨,在交配季节时出现婚外交配行为,但是雄性是不能容忍其它雄性与其所属的雌性交配,因而发生攻击等形式的性打搅(即性打断)[12]。由于婚外交配的频次很低,所以单配制物种的性打搅行为表现为一种低频次高强度的特点。一夫多妻制物种以川金丝猴为例,川金丝猴的性打搅和OMU内的雌性数量呈正相关[11],由于OMU内的雌性数量少于多夫多妻制的雌性数,性竞争强度比较低。因此单元内的性打搅表现为低频次低强度的特点,一般的性打搅方式是干扰。川金丝猴的成年雌性和成年雄性都扩大其生殖价值而发生单元外交配,而雄性是不能容忍家庭单元内的雄性与其它家庭单元的雄性交配,因而发生攻击、驱赶等形式的打搅(即性打断)[11]。但是单元外交配的频次又很低,因此单元外的性打搅表现为低频次高强度的特点。以藏酋猴为例的多夫多妻制物种,存在明显的社会等级,高等级和低等级的个体为争夺交配权而常常产生激烈的竞争,性打搅也就表现出高频次高强度[12]。关于一妻多夫制物种的性打搅研究目前还没有报道。
3.2 季节性
在季节性却表现出“一致性”,性打搅更多的发生在交配季节。例如,野生川金丝猴的研究中,98.65%的性打搅发生在交配季节,仅仅有1.35%的性打搅发生在生殖季节。类似的在半野生环境下的松鼠猴(Saimirisciureus)和蜘蛛猴的成年雌性的性打搅行为在交配季节显然是普遍的,在交配季节成年雌性更多的攻击交配的雄性,经常打搅交配行为[28]。很多非人灵长类的都是严格的季节性繁殖的物种[46],当交配季节大量的成年雄性和成年雌性发生交配,并出现交配高峰,性打搅行为也随之增加。在川金丝猴的研究中,发现当同一家庭单元(OMU)内的几个成年雌性同时进入发情期时,性打搅的频次将明显增加[47]。
3.3 社会等级
性打搅者和被打搅者之间的社会等级,是影响性打搅行为的重要因素[7]。低等级雄性和雌性的性打搅行为很少能中断高等级的个体的交配活动,而高等级的雄性的性打搅却能成功地中断低等级的雄性或雌性的交配活动[7]。这一观点在很多非人灵长类物种中得到支持,例如,日本猕猴和猕猴中统治者或者高等级雄性经常打搅低等级雄性的交配(80%—90%)[16,29],而低等级的雄性却很少打搅高等级雄性的交配,而且通常是无效的[16, 29]。短尾猴的第一顺位的成年雄性的829次的交配尽管受到成年雌性和未成年个体的打搅,但是没有造成交配的中断[24]。而第二顺位的成年雄性却有33%的交配被打断。这也说明,高等级个体能够减少其它个体的性打搅。对川金丝猴的研究发现,高等级的成年雌性在受到低等级雌性的性打搅时,会追逐、驱赶低等级的打搅者,而低等级的雌性却没有发现这一行为[11]。
3.4 亲缘关系
打搅者和被打搅者之间的亲缘关系,也是非常重要的影响因素。例如,Niemeyer关于一群野生短尾猴的成年雌性的性打搅研究,分析了14个成年雌性的450次的性打搅行为,发现成年雌性特别倾向打搅与其有基因关系或者关系密切的雌性的交配[7]。由于非人灵长类的亲缘关系在野外研究中难以完全掌握,而在未成年个体(婴幼猴和青年猴)和其母亲的亲缘关系容易确定,所以未成年的个体的亲缘关系和性打搅行为的研究得到较深入研究[12]。非人灵长类的未成年个体虽然也打搅一些和它没有亲缘关系的成年雌性个体的交配,但是更多的打搅针对它们母亲的交配[12]。研究结果发现,川金丝猴的婴幼猴个体的性打搅有明显的倾向,更多的选择打搅它们母亲的交配[11]。类似的结论在短尾猴、日本猕猴等物种发现,婴幼猴更喜欢打搅它们的母亲或者雌性姐妹的交配[48]。
4 灵长类性打搅假说
回顾非人灵长类的性打搅的研究结果,显示了性打搅的并不是一个简单的现象,存在着种内和种间差异,因此为解释性打搅的功能和意义就不能笼统简单的分析。为了了解性打搅的直接和终极原因,解释这一行为的动机和功能,按照年龄性别组,来进一步分析相关的假说。
4.1 成年雄性的性打搅
4.1.1雄性竞争假说 是指成年雄性的性打搅反映了雄性减少其它个体的交配成功率,或者试图得到被打搅的雌性未来的交配机会,为得到能够生育的成年雌性而展开的竞争[12]。秦岭金丝猴是同其它一雄多雌制叶猴类一样,都以一雄多雌单元作为社会结构的基本单位,所以单元内交配不存在雄性性打搅[11]。但是同时,秦岭金丝猴类似狮尾狒(Theropithecusgelada)、埃及狒狒(Papiohamadryas)是属于重层社会结构的物种[49]。在交配季节,大量的单元间交配的出现,增加了雄性间的性竞争[11]。发生单元外交配的雌性,所属家庭单元的成年雄性发出攻击性的性打断方式的打搅,家庭单元内的其它成年雄性也会打搅[11]。而在短尾猴等非重层社会结构的物种,性打搅的研究更多的是关注性打搅和雄性的等级的研究。高等级的成年雄性短尾猴能够更有效的打断低等级成年雄性的交配,高等级的雄性的打搅能够缩短低等级个体的射精后的成对挨坐(Pair-sit),从而降低低等级雄性的精子竞争和生殖成功率[24]。低等级的成年雄性单独个体的性打搅很少有效,但是数个低等级雄性的联合行动却能打断或者延迟高等级雄性的交配,合作性打搅作为一种性竞争的策略[50]。尽管成年雌性猕猴和短尾猴的交配被打断以后,发出打搅的成年雄性很少与该雌性交配;但是从长远角度考虑,雄性性打搅能够获得将来的交配机会而达到生殖成功[51]。
4.1.2社会纽带假说 是指打搅者试图通过打搅来与交配个体建立社会关系,实现潜在的联盟关系;或者成年雄性维护与被打搅雌性的亲密关系[44]。该假说的提出是基于社会关系,例如藏酋猴在交配季节,成年雄性试图占有能够生育的成年雌性、并对其进行交配守护,与该雌性建立社会纽带关系(Social-bond);当其它成年雄性与该雌性发生交配时,成年雄性是不能容忍他们关系被打断而发起了性打搅行为[6]。猕猴等低等级的打搅者的打搅方向有时会直接攻击其它打搅者,而不是交配的成年雄性,这种行为或许是低等级的打搅者试图与高等级的交配雄性联合的一种策略[12]。打搅者通过打搅和被打搅者试图维系和建立雄性的生殖策略在整个生活史中随着年龄、社会地位不同等而发生转变,也会从其它个体获得支持,因而,性打搅作为一种生殖策略也会发生转变[50]。
4.2 成年雌性的性打搅
4.2.1雌性竞争假说 这一假说的提出是基于群内高质量的精子数量是有限资源,因此会激起成年雌性对这一资源的竞争,雌性通过打搅交配的方式限制其它雌性的生殖机会[52]。该假说认为,打搅者以降低被打搅者的交配成功率或者以被打搅者未完成交配为代价,从而使自己获得更多的交配机会[12]。这个假说又可以进一步分为直接的性竞争假说[12]和间接的性竞争假说[52],前者指打搅者减少了交配个体的生殖成功率而增加了自身的成功率;后者是指雌性借助性打搅获得交配雄性的注意力,从而使得自己随后有可能与这个雄性交配。在一些研究中发现,发情期的成年雌性表现出更普遍和激烈的性打搅,当几个雌性同时进入发情期时,性竞争激烈而引发性打搅行为更加激烈[12, 53- 55]。川金丝猴的性打搅研究支持这一假说,单元内的成年雌性会为单独的雄性而产生竞争,尤其是单元(OMU)内成年雌性数量多的时候会加剧这一竞争[11]。成年雌性的性打搅与家庭单元(OMU)内的成年雌性和亚成年雌性的数量呈正相关[11]。怀孕的雌性相对没有怀孕的雌性在交配季节发出了更多的性打搅,即成年雌性通过性打搅降低其它雌性生殖成功率而提高了自身的生殖成功率[11]。这无疑支持了雌性竞争假说。因此,川金丝猴的成年雌性性打搅是金丝猴偏性竞争的具体体现[10]。川金丝猴可以通过邀配方式的性打搅,获得被打搅雄性的交配。在猕猴等雌性性打搅之后,也会发生性行为,这些是打搅者通过打搅直接获得了交配机会[19, 48, 56]。
4.2.2社会纽带假说 认为成年雌性的打搅是群内亲和关系的占有欲的一种表现,即为得到联盟或潜在联盟(高等级的个体)而产生的竞争[5]。这一假说是基于短尾猴、长尾叶猴(Semnopithecusentellus)、赤猴和松鼠猴等物种提出,因为在这些灵长类种群中,成年雌性是形成社会群体稳定、有凝聚力的核心[12]。成年雌性之间的社会关系相对成年雌性和成年雄性的关系更强更持久,成年雄性可能是随后迁移进来或者是群内相对比较边缘的角色[42]。因此,当成年雌性交配时,与其关系亲密的成年雌性担心其社会关系被打断而进行打搅[12]。但是,成年雌性性打搅的“占有关系”解释仍然需要进一步研究,成年雌性性打搅并没有在所有以雌性为种群稳定核心的物种报道[57]。
4.2.3资源限制假说 该假说指出对交配打搅的功能是限制对有限资源的竞争[12]。同时,这一假说暗示雌性通过性打搅影响其它个体的后代数量,以减少与自己后代的资源竞争。然而雌性的怀孕却不受打搅,因此雌性通过不同方式的性打搅,影响到对手的雄性后代或者雌性后代的出生性比率[12]。这种行为体现出雌性对其它雌性的自私行为,通过性打搅而在将来的存活率和生殖上得到回报[5]。类似的,Hrdy也认为成年雌性的性打搅或许能够减少将来的环境资源竞争[52]。按照这一假说,性打搅是一种能限制种群的增长的机制[8]。因此,雌性性打搅可能与种群的密度高有关[58],例如,Jay研究的区域有一群种群密度低的叶猴,种群比较稳定、也没有群外的成年雄性;成年的雌性性打搅没有发现。与此相反,在Abu和Dharwar的种群密度高,种群的不稳定性显著增加、群外存在大量的成年雄性;所有年龄和性别都会有性打搅[59- 60]。这一研究结果似乎支持这一假说,要验证这一假说就需要对种群的动态和生育的后代性别做长期监测,但是这在很多研究中仍然是不足的。
4.3 未成年个体的性打搅
4.3.1母婴冲突假说 这一假说是基于母亲和后代为扩大自身的利益而产生的冲突[15],即母亲希望生殖更多的后代,而婴幼猴希望得到更多的母亲照顾。该假说指出婴幼猴为了获得更多的母亲抚育的利益,在其母亲交配时候会发生打搅,这样会减少或推迟下一个同胞后代的出现,因为下一个同胞后代的出现会夺走母亲的注意力和照顾[15]。该假说在笼养的食蟹猴(M.fascicularis)得到量化的验证,婴幼猴的性打搅和它们母亲的交配成正相关,婴幼猴的打搅能够降低母亲在随后的怀孕率;比起其他成年雌性,婴幼猴更喜欢打搅他们母亲的交配[61]。而食蟹猴的成年雌性避免婴幼猴的打搅,会在婴幼猴不在场的情况下交配[61]。这在川金丝猴的婴幼猴性打搅研究结果一致,98%的婴幼猴打搅了它们母亲的交配,并且不存在性别差异[11]。
4.3.2保护性假说 这一假说是在短尾猴中提出,因为雄性短尾猴在与雌性交配时或者刚射精完毕时候会咬他的交配伙伴,因此,Gouzoules提出了打搅者试图通过打搅使雌性个体避免交配雄性的攻击[3]。类似这样的性打搅似乎都是在这种雄性攻击行为的物种中出现,如赤猴[12]。在这些打搅者中,主要是与交配雌性关系密切的个体发出,例如雌性的后代,青年猴和婴幼猴[15]。Gouzoules发现如果短尾猴在交配中有性打搅,雄性很难咬雌性[3];相反,交配中没有性打搅的,雄性经常咬雌性。这一假说目前只局限在短尾猴等物种,因为很多物种类似川金丝猴,并没有发现交配的雄性咬雌性的现象[11]。
4.3.3学习假说 这一假说认为婴幼猴的性打搅行为是婴幼猴学习成熟社会行为的一部分[6]。这个假说源于De Benedictis在他的研究中报道到性打搅的青年食蟹猴通常注意观察交配[62]。他认为,通过这一行为,青年个体欣赏和观察交配,是一种社会性行为的一种学习行为模式。这一观点得到一些灵长类研究结果的支持[63- 65]。然而,并不是所有物种的研究中都有婴幼猴的打搅[15],也没有完整的社会性行为的发展。这一假说没有得到量化的数据的验证,仅仅是描述性的数据,因此,这一假说仍然需要进一步验证。
4.3.4分离焦虑假说 这一假说是建立在心理学的层面而言,婴幼猴的性打搅是对于牵涉与它们社会关系亲密的而形成的亲和纽带联系在一起的伙伴的交配具有强烈情绪的反应[12]。这种情绪表现为痛苦、恐惧、兴奋等行为。Tutin认为婴幼猴的性打搅是婴幼猴断乳缺少安全感的一种表达,而表现出来的一种“分离焦虑”[15]。婴幼猴可能感知交配会引起它们和母亲之间的关系的中断,而表现出焦虑[66]。虽然未成年个体也会打搅不相关的雌性[3, 7, 13, 15],但是在它们的母亲交配时,婴幼猴性打搅反应更加频繁,表现更加痛苦[38]。因此,性打搅似乎是未成年灵长类和交配个体的亲密关系强度的一个标志,尤其是交配的雌性的关系,影响性打搅的频次和强度。婴幼猴打搅的表现出恐惧和矛盾的特点,这是因为成年雄性接近、不熟悉、存在潜在危险的原因[12]。
5 总结与展望
纵观目前性打搅的研究结果,性打搅行为具有更高度的种间和种内差异,种间的性打搅的方式不同、同时受到社会结构和婚配制度的影响;在种内受到性别、年龄、等级等因素的影响[6]。相关假说的提出有两种不同方式:(1)直接因素,动物发出行为的动机是什么;(2)终极因素,行为的适应价值是什么和怎么适应它们的社会结构[9]。
回顾之前的研究,性打搅行为假说提出的直接因素,即性打搅的直接动机是打搅者和交配者之间的亲密纽带关系,具体体现在:(1)占有欲,性打搅是担心打搅者和交配对之一的亲密关系被打断而产生的情绪反应[7]);(2)断奶期的缺乏安全感(性打搅是断奶期的青年个体在它们母亲交配时而产生的一种分离焦虑情绪表达[15])。
直接的因素能够反应性打搅的发生动机,但是随着研究的深入,性打搅行为假说提出的终极因素,即性打搅的最终原因是利益,具体体现在:(1)母婴冲突(未成年个体在其母亲交配时候会发生打搅,以减少或推迟下一个同胞后代的出现,因为下一个同胞后代的出现会夺走母亲的注意力和照顾[15]);(2)性竞争(打搅者降低交配者的交配成功率,提高自己的交配机会或生殖成功率[7])。
由此可以得出,性打搅行为实际上是灵长类的一种自私行为,是为提高自身的利益而产生的冲突,而不是早期研究中认为性打搅是一种报复行为[9]。而被打搅者也会因此而产生一些应对策略,交配叫声[6]或主动规避(例如食蟹猴的成年雌性避免婴幼猴的打搅,会在婴幼猴不在场的情况下交配[61])等行为,这也将成为将来性打搅行为的研究热点。随着性打搅行为在更多非人灵长类物种,以及在亲缘关系、社会等级等明确的物种的得到量化数据的验证,将有助于提高人们对非人灵长类性打搅行为和社会性行为的理解。
致谢:本工作得到西北大学灵长类研究小组赵大鹏、王铭、张剑等人的帮助;陕西省动物所常罡博士对写作给予帮助,周至国家级自然保护区给予支持,特此致谢。
[1] Arnold S J. Sexual behavior, sexual interference and sexual defense in the salamandersAmbystomamaculatum,AmbystomatigrinumandPlethodonjordani. Zeitschrift für Tierpsychologie, 1976, 42(3): 247- 300.
[2] Pocklington R, Dill L M. Predation on females or males: who pays for bright male traits? Animal Behaviour, 1995, 49(4): 1122- 1124.
[3] Gouzoules H. Harassment of sexual behavior in the stumptail macaque,Macacaarctoides. Folia Primatologica, 1974, 22(2/3): 208- 217.
[4] Smuts B B. Sexual competition and mate choice // Smuts B B, Chency D L, Seyfarth R M, Wrangham R W, Struhsaker T T, eds. Primate Societies. Part III. Chicago: University of Chicago Press, 1987: 385- 399.
[5] Brereton A R. Return-benefit spite hypothesis: an explanation for sexual interference in stumptail macaques (Macacaarctoides). Primates, 1994, 35(2): 123- 136.
[6] Dixson A F. Primate Sexuality: Comparative Studies of the Prosimians, Monkeys, Apes, and Human Beings. Oxford: Oxford University Press, 2012.
[7] Niemeyer C L, Chamove A S. Motivation of harassment of matings in stumptailed macaques. Behaviour, 1983, 87(3): 298- 322.
[8] Sommer V. Sexual harassment in langur monkeys (Presbytisentellus): competition for ova, sperm, and nurture?. Ethology, 1989, 80(1/4): 205- 217.
[9] Druckker B, Nieuwenhuijisen K, van der Werff ten Bosch J J, van Hooff J A R A M, Slob A K. Harassment of sexual interactions among stumptail macaques,Macacaarctoides. Animal Behaviour, 1991, 42(2): 171- 182.
[10] Li B G, Zhao D P. Copulation behavior within one-male groups of wildRhinopithecusroxellanain the Qinling Mountains of China. Primates, 2007, 48(3): 190- 196.
[11] Qi X G, Yang B, Garber P A, Ji W H, Watanabe K, Li B G. Sexual interference in the golden snub-nosed monkey (Rhinopithecusroxellana): a test of the sexual competition hypothesis in a polygynous species. American Journal of Primatology, 2011, 73(4): 366- 377.
[12] Niemeyer C L, Anderson J R. Primate harassment of matings. Ethology and Sociobiology, 1983, 4(4): 205- 220.
[13] Hrdy S B. The Langurs of Abu: Female and Male Strategies of Reproduction. Cambridge: Harvard University Press, 1977.
[14] Loy J, Loy K. Sexual harassment among captive patas monkeys (Erythrocebuspatas). Primates, 1977, 18(3): 691- 699.
[15] Tutin C E G. Responses of chimpanzees to copulation, with special reference to interference by immature individuals. Animal Behaviour, 1979, 27: 845- 854.
[16] Wilson M E. Social dominance and female reproductive behaviour in rhesus monkeys (Macacamulatta). Animal Behaviour, 1981, 29(2): 472- 482.
[17] Vervaecke H, Van Elsacker L. Sexual competition in a group of captive bonobos (Panpaniscus). Primates, 2000, 41(1): 109- 115.
[18] Vervaecke H, Stevens J, Van Elsacker L. Interfering with others: female-female reproductive competition inPanPaniscus// Jones C B, ed. Sexual Selection and Reproductive Competition in Primates: New Perspectives and Directions. Norman, OK: American Society of Primatologists, 2003: 231- 253.
[19] Nishida T. Sexual behavior of adult male chimpanzees of the Mahale mountains national park, Tanzania. Primates, 1997, 38(4): 379- 398.
[20] Darwin C. Sexual selection in relation to monkeys. Nature, 1876, 15(366): 18- 19.
[21] Vasey P L. Homosexual behavior in primates: A review of evidence and theory. International Journal of Primatology, 1995, 16(3): 173- 204.
[22] Vasey P L. Sex differences in sexual partner acquisition, retention, and harassment during female homosexual consortships in Japanese macaques. American Journal of Primatology, 2004, 64(4): 397- 409.
[23] Lu J Q, Zhao D P, Li B G. Homosexual mounting within one all-male juvenile unit in wild Sichuan snub-nosed monkeys (Rhinopithecusroxellana). Acta Theriologica Sinica, 2007, 27(1): 14- 17.
[24] Bruce K E, Estep D Q. Interruption of and harassment during copulation by stumptail macaques,Macacaarctoides. Animal Behaviour, 1992, 44(6): 1029- 1044.
[25] Yang X J. Observations on the female sexual behaviors of Golden monkey (Rhinopithecusroxellana) in captive. Journal of Gansu Agricultural University, 1998, 33(3): 228- 233.
[26] Koyama Y, Fujita I, Aou S and Oomura Y. Proceptive presenting elicited by electrical stimulation of the hypothalamus. Brain Res., 1988, 446: 199- 203.
[27] Rothe H. Some aspects of sexuality and reproduction in groups of captive marmosets (Callitbrixjacchus), Zeitschrift fur Tierpsychologic, 1975, 37: 255- 273.
[28] Baldwin J D. The social behavior of adult male squirrel monkeys (Saimirisciureus) in a seminatural environment. Folia Primatologica, 1968, 9(3/4): 281- 314.
[29] Stephenson G R. Social structure of mating activity in Japanese macaques // Kondo S, Kawai M, Ehara A, Kawamura S, eds. Proceedings from the Symposia of the Fifth Congress of the International Primatological. Tokyo: Japan Science Press, 1975: 63- 115.
[30] Wheatley B P, Adult male replacement in Macaca fascicularis of East Kalimantan, Indonesia. International Journal of Primatology, 1982, 3: 203- 219.
[31] Xiong C P, Sexual harassment of copulation in Thibetan monkeys (MacacaThibetana). Acta Theriologica Sinica, 1993, 13: 172- 180.
[32] Jolly A. Lemur Behavior: A Madagascar Field Study. Chicago: University of Chicago Press, 1966.
[33] Du Mond F V. The squirrel monkey in a semi-natural environment // Rosenblum L A, Cooper R W, eds. The Squirrel Monkey. New York: Academic, 1968: 87- 145.
[34] Klein L L. Observations on Copulation and Seasonal Reproduction of Two Species of Spider Monkeys, Ateles belzebuth and A. geoffroyi. Folia Primatologica, 1971, 15: 233- 248.
[35] Dixson A F. Observations on the displays, menstrual cycles and sexual behaviour of the “black ape” of Celebes (Macacanigra). Journal of Zoology, 1977, 182: 63- 84.
[36] DeVore I. Male dominance and mating behavior in baboons // Beach F A, ed. Sex and Behavior. New York: Wiley, 1965: 266- 287.
[37] Struhsaker T T. The Red Colobus Monkeys. Chicago: University of Chicago Press, 1975.
[38] Vollmer H. Jealousy in children // Clanton G, Smith L G, eds. Jealousy. Englewood Cliffs, NJ: Prentice-Hall, 1977.
[39] van Lawick-Goodall J. The behaviour of free-living chimpanzees in the Gombe Stream Reserve // Animal Behaviour Monographs. vol.1, pt. 3. London: Baillieère, Tindall amp; Cassell, 1968: 298- 300. [40] Inoue M, Mitsunaga F, Nozaki M, Ohsawa H, Takenaka A, Sugiyama Y, Shimizu K, Takenaka O. Male dominance rank and reproductive success in an enclosed group of Japanese macaques: with special reference to post-conception mating. Primates, 1993, 34(4): 503- 511.
[41] Robbins M M. Male mating patterns in wild multimale mountain gorilla groups. Animal Behaviour, 1999, 57(5): 1013- 1020.
[42] Nishida T. The social structure of chimpanzees of the Mahale Mountains // Hamburg D A, McCown E R, eds. The Great Apes. Menlo Park: Benjamin/Cummings, 1979: 73- 121.
[43] Hasegawa T, Hiraiwa-Hasegawa M. Sperm competition and mating behavior // Nishida T, ed. The Chimpanzees of the Mahale Mountains: Sexual and Life History Strategies. Tokyo: University of Tokyo Press, 1990: 115- 132.
[44] Thierry B. Affiliative interference in mounts in a group of tonkean macaques (Macacatonkeana). American Journal of Primatology, 1986, 11(1): 89- 97.
[45] Jolly A. Breeding synchrony in wild Lemur cuffa // Altmann S A, ed. Social Communication among Primates. Chicago: University of Chicago Press, 1967: 3- 14.
[46] Zhang P, Watanabe K, Li B G, Tan C L. Social organization of Sichuan snub-nosed monkeys (Rhinopithecusroxellana) in the Qinling Mountains, Central China. Primates, 2006, 47(4): 374- 382.
[47] Qi X G, Zhang P, Li B G, Watanabe K. The diversity of polygynous social systems among multi-level societies in non-human primates. Acta Theriologica Sinica, 2010, 30(3): 322- 338.
[48] Chevalier-Skolnikoff S. Homosexual behavior in a laboratory group of stumptail monkeys (Macacaarctoides): Forms, contexts, and possible social functions. Archives of Sexual Behavior, 1976, 5(6): 511- 527.
[49] Grüter C C, Zinner D. Nested societies: convergent adaptations of baboons and snub-nosed monkeys?. Primate Report, 2004, 70: 1- 98.
[50] Packer C. Reciprocal altruism inPapioanubis. Nature, 1977, 265(5593): 441- 443.
[51] Abbot D H, Hearn J P. Physical, hormonal and behavioural aspects of sexual development in the marmoset monkey,Callithrixjacchus. Journal of Reproduction and Fertility, 1978, 53: 155- 166.
[52] Hrdy S B. The Langurs of Abu: Female and Male Strategies of Reproduction. Cambridge: Harvard University Press, 1977.
[53] Dunbar R I M. Determinants and evolutionary consequences of dominance among female gelada baboons. Behavioral Ecology and Sociobiology, 1980, 7(4): 253- 265.
[54] Rowell T E. Intra-sexual behaviour and female reproductive cycles of baboons (Papioanubis). Animal Behaviour, 1969, 17: 159- 167.
[55] Rowell T E. Baboon menstrual cycles affected by social environment. Journal of Reproduction and Fertility, 1970, 21: 133- 141.
[56] Chevalier-Skolnikoff S. Heterosexual copulatory patterns in stumptail macaques (Macacaarctoides) and in other macaque species. Archives of Sexual Behavior, 1975, 4(2): 199- 220.
[57] Struhsaker T T, Leland L. Socioecology of five sympatric monkey species in the Kibale Forest, Uganda. Advances in the Study of Behavior, 1979, 9: 159- 228.
[58] Young O P. Copulation-interrupting behavior between females within a howler monkey troop. Primates, 1981, 22(1): 135- 136.
[59] Hrdy S B. Male-male competition and infanticide among the langurs (Presbytisentellus) of Abu, Rajasthan. Folia Primatologica, 1974, 22: 19- 58.
[60] Yoshiba K. Local and intergroup variability in ecology and social behavior of common Indian langurs // Jay P C, ed. Primates: Studies in Adaptation and Variability. New York: Academic, 1968: 256- 398.
[61] Gore M A. Mother-offspring conflict and interference at mother′s mating inMacacafascicularis. Primates, 1986, 27(2): 205- 214.
[62] De Benedictis T. The behavior of young primates during adult copulation: Observations of aMacacairuscolony. American Anthropologist, 1973, 75(5): l469- 1484.
[63] Harlow H F, Harlow M K. Social deprivation in monkeys. Scientific American, 1962, 207(5): 136- 146.
[64] Maple T. Unusual sexual behavior of nonhuman primates // Money J, Musaph H, eds. Handbook of Sexology. New York: Elsevier, 1977: 1167- 1186.
[65] Mitchell G. Behavioral Sex Differences in Nonhuman Primates. New York: Van Nostrand Reinhold Company, 1979.
[66] Bowlby J. Attachment and Loss. Vol. 2. Separation: Anxiety and Anger. Harmondsworth: Penguin, 1973.
Sexualinterferenceinnon-humanprimates
YANG Bin1, WANG Chengliang1, JI Weihong3, ZHAO Haitao1, WANG Kaifeng1, GUO Songtao2, QI Xiaoguang2, LI Baoguo1,2,*
1ShaanxiInstituteofZoology,Xi′an, 710032,China2CollegeofLifeSciences,NorthwestUniversity,Xi′an710069,China3InstituteofNaturalandMathematicalSciences,MasseyUniversity,AlbanyPrivateBag102 904NorthShoreMailCentreAuckland,NewZealand
Sexual interference behavior in non-human primate species is defined as the behavior with which non-mating individuals disturb a mating pair. The forms of sexual interference can be further divided into interruption and harassment in primates. The former is more disruptive and leads to termination of the copulatory sequence, and is mostly employed by adult males. The latter is mild interference such as approaching and touching or slapping the recipient, and is shown by immature individuals as well as adult females. Such interference does not necessarily lead to the termination of copulation. Numerous hypotheses have been proposed and examined for the function of sexual interference, but there is no hypothesis that can explain all types of sexual interference. Sexual interference may have multiple functions across species and among different age-sex classes in the same species. For this reason, the hypothesis of sexual interference is not consistent and hinders the research of this field. The aim of this paper is therefore to review the sexual interference behavior in 36 non-human primate species, and discuss the function and significance of this behavior. The proximate factors of sexual interference is related to reassurance of the “affiliative” bond between harasser and harassed which is manifested in: (1) Possessiveness (sexual interference is an emotional response to the threat of a disruption of affiliative bonds existing between the harasser and one or both of the mating pair); (2) Insecurity at weaning (sexual interference is an expression of separation anxiety of a young animal, an insecurity at weaning, during copulation of its mother). Proximate factors can reveal the motives of interference, but further research has demonstrated the ultimate consequences of sexual interferences, which are manifested in: (1) Parent-offspring conflict (Interfering in their mother′s mating results in delaying or a new conception hence reducing the competition for maternal care between siblings.); (2) Sexual competition (the interference stops or delays the mating, resulting in reduced reproductive effectiveness of the copulant and thus increases her or his own breeding effectiveness). It can be concluded that the sexual interference is a selfish behavior to improve the protagonists own interests, rather than revenge behavior suggested by early research. Disturbed individuals also produce counter strategies, such as mating calls or active avoidance behavior. This should be further investigated. Sexual interference is associated with the mating system, and is characterized by low frequency and low intensity in polygyny species, and high frequency and high intensity in multimale-multifemale mating systems. Sexual interference behavior is affected by species, gender, age, rank, genetic, physiological, social structure and social situation and has significant inter- and intra-species differences. In this paper the research results of sexual interference in the Sichuan golden monkey and sexual interference behavior of non-human primate species are summarized systematically from the type of sexual interference, the response of interferers, the function of sexual interference and related hypotheses. The significance of this paper is to provide a reference for related researches in China and ideas for further studies of reproductive behavior, and thus promote the development of study in this field.
non-human primates; sexual interference behavior; sexual-competition hypothesis
国家自然基金的重点项目(31130061);国家自然科学基金项目(30970444, 30900168, 30970379);陕西省科学院基金项目(2009K- 08, 2013K- 34, 2013K- 35);陕西省自然科学基金项目(2010JM3006)
2013- 04- 07;
2013- 07- 29
*通讯作者Corresponding author.E-mail: baoguoli@nwu.edu.cn
10.5846/stxb201304070620
杨斌,王程亮,纪维红,赵海涛,王开锋,郭松涛,齐晓光,李保国.非人灵长类性打搅行为研究进展.生态学报,2013,33(19):5973- 5980.
Yang B, Wang C L, Ji W H, Zhao H T, Wang K F, Guo S T, Qi X G, Li B G.Sexual interference in non-human primates.Acta Ecologica Sinica,2013,33(19):5973- 5980.
