系统性红斑狼疮患者外周血Th1细胞自噬相关标记物的表达①
2013-11-28潘庆军冯永民刘伟敬刘华锋
王 超 潘庆军 冯永民 刘伟敬 刘华锋
(广东医学院附属医院肾脏疾病研究所,湛江524001)
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是以免疫调节失衡为特征的一种自身免疫性疾病,已有大量的研究证实,辅助性T细胞(Th细胞)功能失常在SLE发生发展中起极其重要的作用,其中Th1细胞因子功能亢进导致大量的Th1细胞因子分泌并参与了SLE的发病[1-3]。因此,深入研究SLE患者Th1细胞功能变化,对进一步明确Th1细胞在SLE发病中的作用至关重要。
自噬(Autophagy)是一种广泛存在于真核生物的生命现象,细胞通过自噬降解自身衰老或损伤的细胞器和其他大分子物质,与细胞的生长、分化、功能和存活密切相关。近期陆续有学者研究SLE患者免疫细胞自噬是否存在异常,赵继军[4]和Frédéric[5]等人发现 SLE 患者外周血单个核细胞(PBMC)自噬泡堆积。但PBMC细胞种类繁多,作为在SLE发病中起重要作用的Th1细胞,其自噬情况如何?尚未见相关文献报道。本研究通过检测SLE患者外周血Th1细胞自噬通路几种关键标记物Phospho-mTOR、Beclin-1、LC3和 p62的表达情况,借此探讨SLE患者Th1细胞自噬活性,进而初步探讨自噬异常在SLE发病过程中的作用。
1 资料与方法
1.1 临床资料 选取2011年11月至2012年12月广东医学院附属医院肾病内科住院SLE患者68例(男13例,女55例),诊断均符合1997年美国风湿病协会(ACR)修正的SLE分类标准。收集SLE患者的临床资料及实验室检查数据,并计算患者SLE 活动指数(SLE disease activity index,SLEDAI),根据SLEDAI评分将SLE患者分为活动组(SLEDAI≥10分)46例(包括初诊活动期31例和复发活动期15例)和非活动组(SLEDAI<10分)22例。活动组患者平均年龄为(24.3±7.2)岁,非活动组患者平均年龄为(30.1±9.2)岁,对照组为健康志愿者23例(男5例,女18例),平均年龄(23.7±5.3)岁,三组之间性别、年龄差异无统计学意义(P>0.05)。
1.2 试剂和仪器 PE-anti human IFN-γ、PE-Cy7-anti human CD3、APC-Cy7-anti human CD4 及其同型对照均购自BioLegend公司,anti human Beclin-1及其同型对照购自Abcam公司,anti human PhosphomTOR及其同型对照均购自Cell Signaling Technology公司,anti human LC3抗体及其同型对照购自MBL公司,anti human p62及其同型对照购自BD biosciences公司,FITC-anti mouse/rabbit IgG购自Santa cruz公司。裂解液、固定液、穿透液和染色液购自BioLegend和ebioscience公司。流式细胞仪为BD FACSCantoTMII。
1.3 外周血Th1细胞自噬标记物测定
1.3.1 免疫荧光标记 采集受试者清晨空腹外周静脉血3 ml,EDTA充分抗凝;取18支试管用于制备样本,先将裂解液分别加入上述各试管当中,每管3 ml,再将新鲜外周血标本150 μl分别加入上述试管当中充分裂解;离心后去上清,加入10 mmol/L PBS洗涤,加入固定液充分固定细胞;继之加入穿透液2 ml/管,洗涤穿透2次,1 500 r/min ×6分钟/次。加入穿透液100 μl/管重悬细胞后加羊血清封闭;在试管1~10 加入 0.3 μl的 PBS,11 ~14 分别加入 Beclin-1、Phospho-mTOR、LC3、p62 抗体的同型对照(量与加入相应抗体的量相同),试管15加入Beclin-1抗体 0.3 μl,试管 16 加入 Phospho-mTOR抗体1 μl,试管17 加入 LC3 抗体0.3 μl,试管18 加入p62抗体0.3 μl,充分振荡混匀,室温避光孵育30分钟;加入PBS洗涤2次;加入穿透液100 μl/管重悬细胞后,加入相应适量二抗,避光孵育30分钟;再次洗涤2次;加入染色液100 μl/管重悬细胞,试管1未加入任何抗体,为调节各荧光通道的电压用,试管2~8加入单色抗体为调制荧光补偿用,试管9加入抗体 CD3-PE-Cy7 10 μl、CD4-APC-CY7 10 μl、Mouse IgG1,κ-PE 10 μl,试管 10 ~18 均加入抗体CD3-PE-Cy7 10 μl、CD4-APC-CY7 10 μl、IFN-γ-PE 10 μl,振荡摇匀上述各试管,避光孵育30分钟;洗涤2次后加入200 μl染色液重悬细胞;移液至流式管中,流式上机检测分析。
1.3.2 流式细胞仪检测 设置相应各通道电压和通道之间荧光补偿后,根据前向散射角和侧向散射角,对整个白细胞进行设门,以CD3+CD4+IFN-γ+定义为 Th1细胞[6]。测定 Th1细胞的 Beclin-1、Phospho-mTOR、LC3、p62的表达水平,以平均荧光强度(Mean fluorescence intensity,MFI)表示。
1.4 SLE的其他指标检测方法 补体C3采用免疫速率散射比浊法,anti-dsDNA采用酶联免疫吸附试验(ELISA)检测。
1.5 统计学方法 应用SPSS16.0进行数据的统计分析。根据Kolmogorov-Smimov正态性检验可知该组资料为偏态分布,本文采用非参数检测的方法对数据进行处理。计数资料差异比较采用χ2检验,计量资料采用中位数(四分位间距)[M(P25-P75)]表示,Mann-Whitney Test分析;非参数数据的相关分析采用Spearman秩相关,分别比较自噬相关标记物与SLEDAI评分及免疫学指标的相关性。以健康自愿者外周血Th1细胞Phospho-mTOR的第95百分位数和第5百分位数测量数据的上限和下限为参考值范围。敏感度=SLE活动时该指标的阳性人数/实际SLE活动人数;诊断SLE是否活动的特异度=SLE非活动时该指标的阴性人数/实际SLE非活动人数。
2 结果
2.1 各组Th1细胞自噬相关标记物的比较 SLE活动组和非活动组外周血Th1细胞Phospho-mTOR的平均荧光强度分别为1 366(1 099,1 579.2),1 953.5(1 868.5,2 151.5)]低于对照组 2 247(2 072,2 488),差异均有统计学意义(均 P<0.05);SLE活动组外周血Th1细胞Phospho-mTOR的平均荧光强度低于非活动组(P<0.05),见图1A。
SLE活动组和非活动组的外周血Th1细胞Beclin-1 的平均荧光强度分别为[494(392.75,586.5),529(396,566.5)],低于对照组 655.5(522,973.5),差异有统计学意义(P<0.05)。但SLE活动组与非活动组相比,差异无统计学意义(P>0.05),见图1B。

图1 各组Th1细胞自噬相关标记物的表达情况Fig.1 The expression of autophagy markers of Th1 cells from both SLE patients and health control
SLE活动组的外周血Th1细胞LC3的平均荧光强度为 383.5(314,409),高于非活动组 240(211.25,333.75)和对照组 254(221,299),差异有统计学意义(P<0.05),而非活动组与健康对照组相比差异无统计学意义(P>0.05),见图1C。
SLE活动组和非活动组的外周血Th1细胞p62的平均荧光强度[分别为 172(156,181),168.5(154.75,188.25)]与对照组 169.25(156.25,179.75)相比,差异无统计学意义(P>0.05),见图1D。
2.2 SLE患者Th1细胞自噬相关标记物与补体C3、SLEDAI评分和Anti-dsDNA的相关性 SLE患者组外周血Th1细胞自噬相关标记物PhosphomTOR的平均荧光强度与血清C3水平呈正相关(rs=0.458,P < 0.05),与 SLEDAI评分呈负相关(rs= -0.829,P <0.01),与血清 anti-dsDNA 水平呈负相关(rs= -0.637,P <0.01)。而 SLE 患者组外周血Th1细胞其他自噬相关指标与血清C3水平、SLEDAI评分、血清anti-dsDNA水平均无相关关系(表1)。
2.3 SLE患者外周血Th1细胞自噬相关标记物与SLE活动度 正常人外周血Th1细胞PhosphomTOR的 MFI的中位数为 2 247,95%位数为2 791.2,5%位数为1 899.4。因此SLE患者外周血Th1细胞Phospho-mTOR的MFI低于1 899.4即为疾病活动性阳性;补体C3<0.70 g/L为疾病活动性阳性;血清Anti-dsDNA水平以医院检验科定性指标(阳性/阴性)为准。如表2所示,在判断SLE是否活动时,SLE患者组外周血Th1细胞自噬相关标记物(Phospho-mTOR)和补体C3的敏感性显著高于血清Anti-dsDNA,但特异性相对较差。

表1 SLE患者Th1细胞自噬相关标记物与补体C3、SLEDAI评分和Anti-dsDNA的相关分析Tab.1 Correlation between the expressions of autophagy markers of Th1 cells with anti-dsDNA,C3 and SLEDAI scores

表2 Phospho-mTOR、C3和 Anti-dsDNA的变化评判SLE活动度的比较Tab.2 Comparition of changes of Phospho-mTOR,C3 and anti-dsDNA for activity of SLE
3 讨论
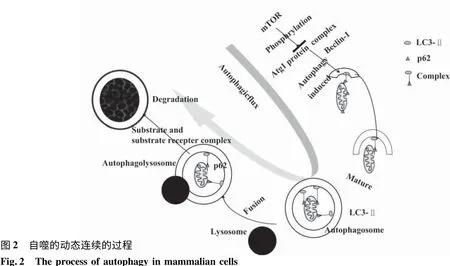
自噬(Autophagy)是胞浆大分子物质和衰老细胞器在膜包囊泡中降解的生物学过程,其主要功能是确保细胞在受到应激性死亡威胁时可以保持存活。目前认为自噬是一个动态连续的过程,包含自噬体的形成,自噬性底物向溶酶体的运送和在溶酶体内降解的整个过程[7]。首先,在自噬诱因(例如饥饿和氧化应激等)作用下,mTOR(mammalian target of rapamycin)磷酸化受抑制,对自噬通路启动抑制减弱,同时自噬调节蛋白Beclin-1表达升高,自噬启动;继之,ULK1复合物和PI3k(classⅢ PtdIns 3-kinase)复合物定位于 phagophore[8],并随着 LC3(微管相关蛋白轻链3)和其他自噬相关蛋白共轭结合,双层分隔膜逐渐延伸[9];需被清除的物质(如异常折叠蛋白质、损坏细胞器等)先与底物受体(Cargo receptor,如p62)结合,然后通过底物受体识别LC3,使底物-底物受体复合物被逐渐延伸的双层膜结构包含而形成自噬体(Autophagosome)[10];自噬泡形成后与溶酶体结合而形成自噬溶酶体(Autolysosome),最后在溶酶体酶的作用下,自噬泡膜和其包含物被溶酶体降解,以上过程构成一条完整的自噬通路(Autophagy pathyway),这条自噬通路必须被精密调控,以保证各环节畅通且不过度。在自噬通路中,Phospho-mTOR和Beclin-1是自噬启动的标记,LC3II是自噬泡形成的标记,p62则是自噬泡降解的标记(图2)。
目前研究表明自噬参与了胞内抗原加工和提呈给MHCⅡ类分子,从而提高细胞的免疫监视效率,增强机体的免疫功能[11,12],同时目前研究也表明多种自身免疫性疾病均存在自噬异常的现象[5,13,14]。然而SLE与自噬的相关研究仍在起步阶段,虽已有学者研究报道SLE患者PBMC自噬泡堆积的现象[4,5],但由于疾病本身的复杂性,以及单个核细胞又包含多种亚型,不同亚群的细胞其自噬的变化方向(如增强、减弱)和变化水平(或幅度)也可能存在差异,仅对单个核细胞自噬泡的观察并不能真正明确SLE中的自噬失调的状况。因此,明确单一免疫细胞亚群的自噬活性显得更为重要。Th1细胞功能紊乱及其细胞因子分泌异常在SLE发病及其免疫炎性损伤中起到重要作用。在本研究中,我们旨在通过对自噬通路中四个关键自噬标记物的检测,分析SLE患者外周血Th1细胞自噬情况。
本研究发现,疾病活动期SLE患者外周血Th1细胞LC3的表达水平显著高于非活动组和正常对照组,提示SLE发病过程中存在外周血Th1细胞自噬泡堆积的现象,诱导自噬泡生成增多或抑制自噬泡的降解均可导致自噬泡的堆积,故自噬泡堆积现象并不能真正反映自噬流量的增强或减弱。而本研究发现各组之间p62的表达水平无显著性差异,提示SLE外周血Th1细胞自噬降解通路通畅。因此我们推测LC3的增多主要由诱导增强所致,即在SLE发病过程中存在外周血Th1细胞自噬流量增强的现象。已有文献证实IFN-γ等Th1细胞因子可以诱导自噬[14],且 Dilip 等[15]研究发现,与正常对照组相比,活动组SLE患者外周血Th1细胞因子IFN-γ表达水平均显著增加,并与SLEDAI评分呈线性相关关系。这或许提示在SLE发病时增多的IFN-γ可能与Th1细胞自噬流量增强有关。
已知Phospho-mTOR活性降低说明自噬活性增强,而Beclin-1活性下降则说明自噬被抑制。本研究结果显示SLE组的Phospho-mTOR和Beclin-1的表达水平均显著低于正常对照组,以Phospho-mTOR降低更为突出,这提示SLE患者外周血Th1细胞自噬流量的增加可能主要因为mTOR磷酸化受抑制,而Beclin-1对SLE患者外周血Th1细胞自噬流量的影响可能较小;同时也提示SLE外周血Th1细胞存在着多种自噬调节蛋白的异常,至于哪些自噬调节蛋白在其中起主要作用,还需进一步探讨。
此外,我们研究结果显示SLE患者组外周血Th1细胞Phospho-mTOR的表达水平与血清补体C3呈正相关,与SLEDAI评分及Anti-dsDNA均呈负相关,这提示Th1细胞Phospho-mTOR水平与SLE疾病活动相关,可能成为评判SLE病情活动的指标之一。
最后,我们通过将Th1细胞Phospho-mTOR变化水平与传统评价指标对SLE的活动度评判上进行敏感度和特异度的初步比较,得出Th1细胞自噬相关标记物(Phospho-mTOR)和补体C3的敏感性显著高于Anti-dsDNA,但特异性相对较差的结果。当然这部分的结果仍然需要更大样本量来进行检验。
综上,本研究发现SLE患者Th1细胞中存在自噬流量增强的现象,其中Th1细胞Phospho-mTOR的表达水平与SLE疾病活动相关,有望成为SLE活动的指标之一。而SLE患者Th1细胞的自噬增强在SLE发病中的作用尚有待进一步研究。
1 Longhi M S,Ma Y,Grant C R et al.T-regs in autoimmune hepatitissystemic lupus erythematosus mixed connective tissue disease overlap syndrome are functionally defective and display a Th1 cytokine profile[J].Autoimmun,2012;16:34-38.
2 Postal M,Pelicari K O,Sinicato N A et al.Th1/Th2 cytokine profile in childhood-onset systemic lupus erythematosus[J].Cytokine,2013;61(3):252-256.
3 Argyrios N T,Stefanos K,Dwight H K et al.The role of IFN-γ in systemic lupus erythematosus:a challage to the Th1/Th2 paradigm in autoimmunity[J].Athritis Res,2001;3(3):136-141.
4 赵继军,李美荣,陆才生et al.活动性系统性红斑狼疮自噬及相关基因研究[J].中华风湿病学杂志,2009;13(3):148-151.
5 Frédéric G,Johan A,Nicolas P et al.Macroautophagy is deregulated in murine and human lupus T lymphocytes[J].Autophagy,2012;8(7):1-11.
6 Susumu N,Yoichiro I,Hajime S et al.Phenotypic differences between Th1 and Th17 cells and negative regulation of Th1 cell differentiation by IL-17[J].J Leurkocyte Biol,2007;8:1258-1268.
7 Kuma A,Mizushima N.Physiological role of autophagy as an intracellular recycling system:With an emphasis on nutrient metabolism[J].Semin Cell Dev Biol,2010;21:683-690.
8 Bai X C,Jiang Y.Key factors in mTOR regulation[J].Cell Mol Life Sci,2010;67(2):239-253.
9 Noda N N,Kumeta H,Nakatogawa H et al.Structural basis of target recognition by A tg8/LC3 during selective autophagy[J].Genes Cells,2008;13:1211-1218.
10 Fengsmd M,Erichsen E S,Berg To et al.Ultrastructural characterization of the delimiting membranes of isolated autophagosomes and amphisomes by freeze-fracture electron microscopy[J].Eur J Cell Biol,2000;79(12):87l-882.
11 Paludan C,Schmid D,Landthaler M et al.Endogenous MHC classⅡ processing of a viral nuclear antigen after autophagy[J].Science,2005;307:593-596.
12 Kubaila P,Huatt A,Rioux J D et al.Impaired autophagy of intracellular pathogen induced by a Crohn’s disease associated ATGl6Ll variant[J].PLoS One,2008;3(10):e3391.
13 Alirezaei M,Fox H S,Flynn C T et al.Elevated ATG5 expression in autoimmune demuelination and hauhiple sclerosis[J].Autophagy,2009;5:152-158.
14 Harris J,De Haro S A,Master S S et al.T helper 2 cytokines inhibit autophagic control of intracellular Mycobacterium tuberculosis[J].Immunity,2007;27:505-517.
15 Dilip S,Ravi K,Ajay W et al.Oxidative stress in systemic lupus erythematosus:Relationship to Th1 cytokine and disease activity[J].Immunology Letters,2010;129:7-12.
