大豆甙元联合TRAIL诱导胃癌SGC-7901细胞凋亡的机制研究①
2013-11-28杜志敏杨静静王天云李齐印徐志强李万里
杜志敏 杨静静 马 倩 王天云 李齐印 徐志强 李万里
(新乡医学院免疫教研室,新乡453003)
肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)是TNF家族的成员之一,是一种Ⅱ型膜蛋白,通过与其特异性死亡受体结合而激活凋亡信号传导途径,从而诱导肿瘤细胞凋亡。大豆甙元(Daidzein,Da)是来源豆类植物和齿状植物的异黄酮类化合物,是大豆异黄酮的主要成分。近年来大量体外实验及流行病学均显示,Da作为一种抗癌剂具有诱导肿瘤细胞凋亡、细胞周期、细胞生长与分化及抗氧化作用。近年来研究表明Da能够抑制乳腺癌、前列腺癌、白血病以及某些肝癌细胞株的生长,增殖以及诱导肿瘤细胞凋亡的作用[1-3]。Da具有抗癌作用,且毒性低,药物作用平缓。Da作为一种天然植物雌激素,已被证实具有抗氧化、抗肿瘤等多种药理作用,因其毒副作用小,抗肿瘤作用日益受到重视。本研究旨在探讨低毒性的Da联合TRAIL作用于胃癌SGC-7901细胞,研究两者联合对SGC-7901细胞增殖的影响和细胞相关凋亡基因的表达影响,以初步探讨Da与TRAIL联合作用于胃癌SGC-7901细胞是否具有协同作用及其作用机制,以期为临床胃癌防治提供一定的实验室依据。
1 材料与方法
1.1 材料 人胃腺癌SGC-7901细胞株(本实验室建立);DYY-8B电泳仪(北京六一仪器厂);流式细胞仪(美国BD公司);CLLNIBI0128酶标仪(奥地利Clibibo公司);UV-250紫外分光光度仪(日本SHIMADZU公司);电泳凝胶成像系统(英国SynDZe公司);FACSCALIBUR流式细胞仪(美国BD公司);电镜(日立H-7500);切片机(leica-uc6);Daidzein(郑州荔诺生物科技有限公司);TRAIL(USA Sigma公司);Annexin V-FITC细胞凋亡检测试剂盒、兔抗鼠Bcl-2、survivin、辣根过氧化物酶(HRP)标记的羊抗兔二抗、Ecl发光液、细胞裂解液、蛋白酶抑制剂、Tris-HCL平衡苯酚(上海碧云天公司);四噻唑蓝(MTT)、二甲基亚砜(DMSO),USA Sigma公司。
1.2 方法
1.2.1 实验分组 Da和 TRAIL分别作用于 SGC-7901细胞 取处于对数生长期的细胞,96孔板中每孔加入1 000个细胞。分组设置:空白对照组(加等量的含0.03%DMSO的 DMEM 培养基)、Da处理组:药物浓度分别为 20 mg/L(Da1)、40 mg/L(Da2)、80 mg/L(Da3)、160 mg/L(Da4),TRAIL 处理组:药物浓度分别为 50 μg/L(T1)、100 μg/L(T2)、200 μg/L(T3)、400 μg/L(T4)分别作用于SGC-7901细胞。Da和 TRAIL联合作用于 SGC-7901细胞:分组设置为:空白对照组(加等量的含0.03%DMSO的DMEM培养基)、20 mg/L大豆甙元组(Da1)、50 μg/L TRAIL组(T1)以及两者联合作用于SGC-7901细胞。
1.2.2 MTT检测 各组细胞经过药物刺激后,置于培养箱中培养 12、24、48、72小时后,每孔加入MTT 溶液(5 mg/ml)20 μl,37℃继续孵育4 小时,小心吸去孔内培养上清液,每孔加入150 μl DMSO溶解甲瓒,溶解后在酶联免疫检测仪上测定490 nm的吸收值。每组设5个复孔,实验重复3次,利用空白对照组调零。计算细胞生长率公式:细胞抑制率=(对照组A值-实验组A值)/对照组A值×100%。
1.2.3 FITC-AnnexinV/PI双染法检测细胞凋亡率
SGC-7901细胞经过药物处理24小时后,收集细胞预冷PBS清洗两遍后,收集细胞,加入500 μl结合缓冲液重悬细胞,加入5 μl AnnexinV-FITC混匀避光反应10分钟后,再加入5 μl PI混匀,室温避光反应10分钟,利用流式细胞仪检测。
1.2.4 PI染色检测细胞周期 SGC-7901细胞经过药物处理24小时后,收集细胞,PBS漂洗后重悬细胞于预冷的70%乙醇中,-20°C固定24小时以上;固定后离心弃上清,PBS洗涤一次,将细胞重悬于含50 μg/ml PI和100 μg/ml RNase A 的 PBS中,室温孵育30分钟后,利用流式细胞仪进行检测细胞周期。
1.2.5 电镜检测 SGC-7901细胞经过药物处理后,离心弃上清,加入4%多聚甲醛,在4℃下固定4小时。0.1 mol/L磷酸缓冲液漂洗3次,加入0.5 ml人的新鲜血浆,用钩针轻轻打散后离心5分钟,沿管壁轻轻滴入2.5%戊二醛2~3 ml,微波中档固定5~10秒后,置4℃下固定1小时,用带钩的解剖针勾出细胞团块,切成1 mm3大小的组织块,放回2.5%戊二醛中低温保存。常规超薄切片样品制作,透射电镜日立H-7500观察。
1.2.6 Western blot检测 SGC-7901 细胞中 Bcl-2、caspase-3、survivin蛋白 SGC-7901细胞经过药物处理后,收集细胞,用RIPA裂解液提取总蛋白,用BCA蛋白定量试剂盒进行定量。蛋白上样量30 ug,Western blot检测蛋白的表达。Bcl-2一抗的稀释浓度1∶1 000,caspase-3一抗的稀释浓度1∶500,survivin一抗的稀释浓度1∶1 000,二抗稀释浓度均为1∶1 000,ECL发光,用胶片捕捉发光条带。所得的胶片结果经扫描后,利用ImageJ软件进行灰度分析。
2 结果
2.1 Da、TRAIL分别对SGC-7901细胞体外增殖的抑制作用 SGC-7901细胞经过不同浓度的 Da、TRAIL处理不同的时间后,用MTT法检测对细胞的抑制情况。与对照组比,Da、TRAIL对SGC-7901细胞体外增殖有一定的抑制作用,不同浓度作用不同,随着浓度的增加作用加强,48小时 Da对SGC-7901细胞体外增殖的抑制作用达到高峰(P<0.01),当TRAIL达到较高浓度时,肿瘤细胞的抑制作用随着浓度的增加而增强(P<0.01),见表1。
2.2 Da联合TRAIL对SGC-7901细胞体外增殖的抑制作用 SGC-7901细胞经过Da或/和TRAIL处理不同的时间后,与对照组相比,Da1(20 mg/L)和T1(50 μg/L)联合时,SGC-7901细胞的增殖抑制率随着联合时间的延长,凋亡作用增强,两种药物联合作用在48小时时抑制率达46.6%,与对照组及单独用药组抑制率相比,差异具有统计学意义(P<0.05或 P <0.01),见表2。
2.3 Da和TRAIL对SGC-7901细胞形态、超微结构的影响 SGC-7901细胞经过Da或/和TRAIL处理24小时后,利用透射电镜观察细胞内部的形态学变化。正常细胞呈球形,细胞核质比大,表面有微绒毛;Da1(20 mg/L)处理后,细胞核体积变小,细胞膜损伤;T1(50 μg/L)处理后,核膜下可见染色质形成斑块状凝聚,造成细胞碎裂。Da1联合T1组胞质空泡化,出现大量空泡,胞膜破裂,细胞表面绒毛脱失,细胞出现崩解,形成了典型的细胞凋亡特征。见图1。
2.4 Da和TRAIL对SGC-7901细胞凋亡率的影响SGC-7901细胞经过Da或/和TRAIL处理后24后,利用流式细胞仪检测各组的凋亡情况。与对照组相比,Da1(20 mg/L)和 T1(50 μg/L)引起 SGC-7901细胞凋亡率显著增加,与对照组及单独用药组抑制率相比,差异具有统计学意义,P<0.01,见图2,表3。
2.5 Da和TRAIL对SGC-7901增殖细胞周期的影响 SGC-7901细胞药物处理24小时后,单独用药和联合用药均能够诱导胃癌SGC-7901细胞凋亡,G1峰前出现凋亡细胞所特有的凋亡峰Sub-G1。与对照组比随着Da与 TRAIL联合作用的增强,使G0/G1和G2/M期细胞数目明显减少,S期细胞数目明显增加(P<0.01),表明两者联合作用使S期受到阻滞,从而抑制细胞增殖,见图3、表4。
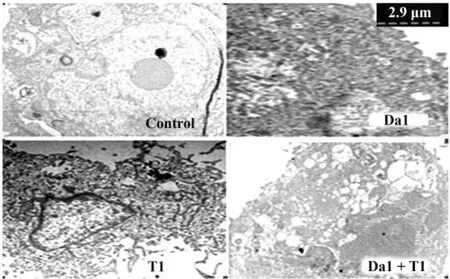
图1 Da和/或TRAIL对SGC-7901细胞超微结构的影响(×5 000)Fig.1 Effect of TRAIL and/or Da treatment on morphological changes of the SGC-7901 cells(×5 000)
表1 Da或TRAIL对SGC-7901细胞增殖抑制率的影响(±s,n=4)Tab.1 Effects of Da or TRAIL on proliferation of SGC-7901 cells(±s,n=4)

表1 Da或TRAIL对SGC-7901细胞增殖抑制率的影响(±s,n=4)Tab.1 Effects of Da or TRAIL on proliferation of SGC-7901 cells(±s,n=4)
Note:Compared with control group,1)P <0.05,2)P <0.01.
Groups 12 h 24 h 48 h 72 h Control 0.00 ±3.800 0.00 ±2.100 0.00 ±6.000 0.00 ±11.500 Da1 9.23 ±6.7101) 7.27 ±3.682 34.84 ±9.8682) 4.82 ±4.000 Da2 7.77 ±6.2401) 13.61 ±12.182 47.24 ±5.2492) 29.52 ±14.7242)Da3 25.86 ±10.0402) 37.21 ±15.5522) 59.18 ±6.4132) 53.41 ±14.3512)Da4 36.81 ±7.7262) 43.85 ±11.1572) 77.45 ±6.1362) 44.63 ±4.9422)T1 2.95 ±3.211 3.27 ±2.910 11.24 ±4.9042) 5.31 ±4.390 T2 11.54 ±11.915 15.84 ±4.8612) 19.74 ±10.0932) 3.84 ±4.640 T3 16.43 ±6.8772) 26.70 ±9.9682) 38.53 ±6.6262) 28.56 ±6.0842)T4 33.72 ±9.3002) 41.92 ±5.3712) 48.61 ±7.1672) 34.47 ±11.3822)
表2 Da1联合TRAIL对SGC-7901细胞增殖抑制率的影响(±s,n=4)Tab.2 Effects of combination of TRAIL and Da1 on proliferation of SGC-7901 cells(±s,n=4)

表2 Da1联合TRAIL对SGC-7901细胞增殖抑制率的影响(±s,n=4)Tab.2 Effects of combination of TRAIL and Da1 on proliferation of SGC-7901 cells(±s,n=4)
Note:Compared with control group,1)P <0.05,2)P <0.01;3)P <0.05,4)P <0.01;Compared with T1,5)P <0.01.
Groups 24 h 48 h Control --- ---Da1(20 mg/L) 9.40 ±5.4011) 22.32 ±11.1122)T1(50 μg/L) 12.40 ±8.5921) 25.33 ±3.1072)Da1+T1 37.70 ±10.3142)4)5) 46.60 ±8.0062)3)5)
表3 Da和/或TRAIL对SGC-7901细胞凋亡的影响 (±s,n=4)Tab.3 Effects of TRAIL and/or Da on apoptosis of SGC-7901 cells(±s,n=4)
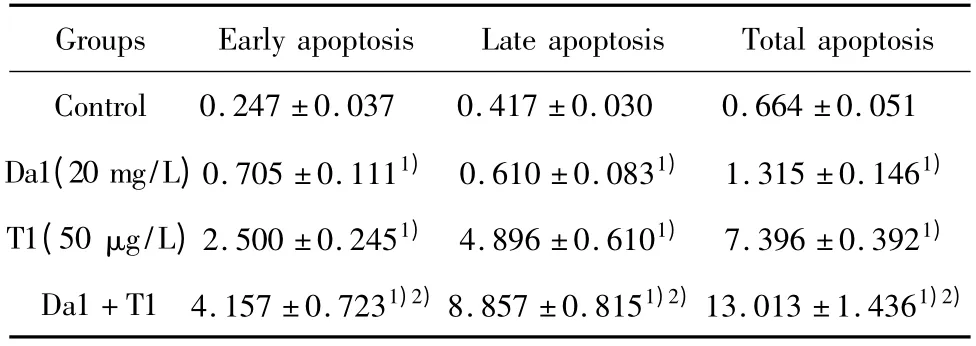
表3 Da和/或TRAIL对SGC-7901细胞凋亡的影响 (±s,n=4)Tab.3 Effects of TRAIL and/or Da on apoptosis of SGC-7901 cells(±s,n=4)
Note:Compared with control group,1)P <0.01;Compared with Da1,2)P <0.01.
051 Da1(20 mg/L)0.705 ±0.1111) 0.610 ±0.0831) 1.315 ±0.1461)T1(50 μg/L)2.500 ±0.2451) 4.896 ±0.6101) 7.396 ±0.3921)Da1+T1 4.157 ±0.7231)2)8.857 ±0.8151)2)13.013 ±1.4361)2)poptosis Control 0.247 ±0.037 0.417 ±0.030 0.664 ±0.Groups Early apoptosis Late apoptosis Total a

图2 Annexin V-FITC/PI双染法检测凋亡Fig.2 Detection of apoptosis using Annexin V-FITC/PI double staining
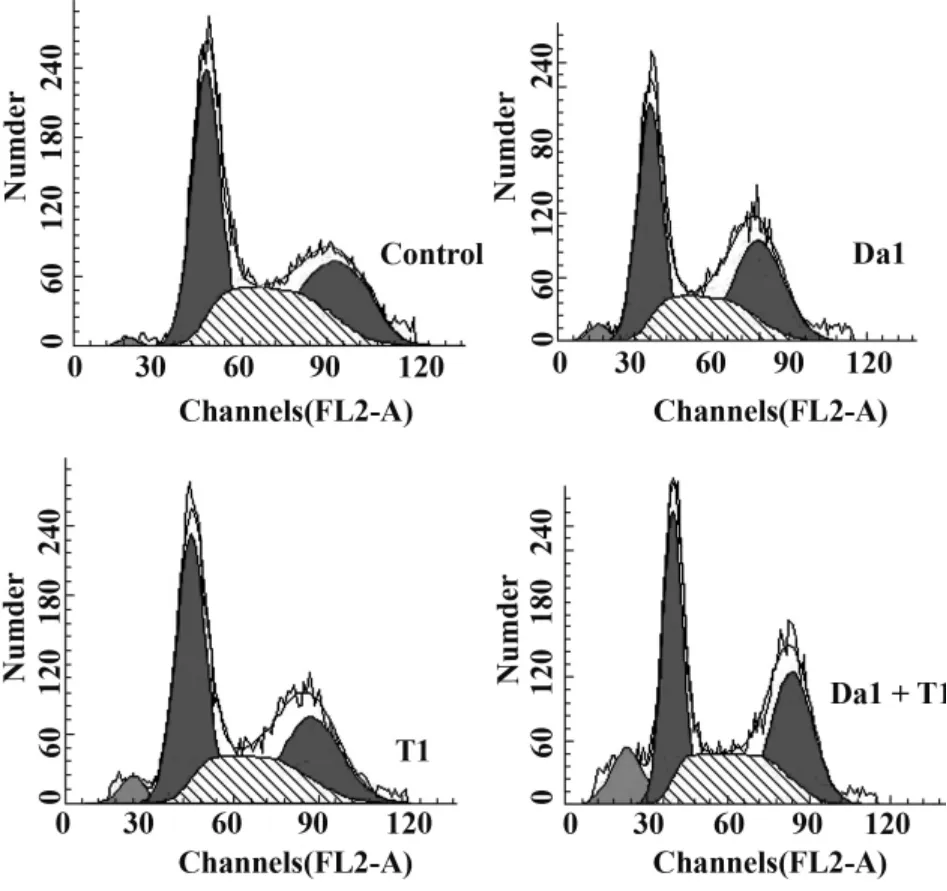
图3 Da和/或TRAIL对SGC-7901增殖细胞周期的作用Fig.3 Effects of TRAIL and/or Da on cell cycle of SGC-7901 cells
2.6 Da和 TRAIL对SGC-7901细胞凋亡中Bcl-2、survivin、caspase-3表达的影响 与对照组比,Da1联合T1能够下调SGC-7901细胞凋亡相关基因Bcl-2、survivin蛋白表达,联合用药组与对照组比较,明显低于对照组,差异具有统计学意义P<0.01,见图4、表5。
表4 Da和/或TRAIL对SGC-7901细胞周期的影响(±s,n=4)Tab.4 Effects of TRAIL and Da on cell cycle of SGC-7901 cells(±s,n=4)
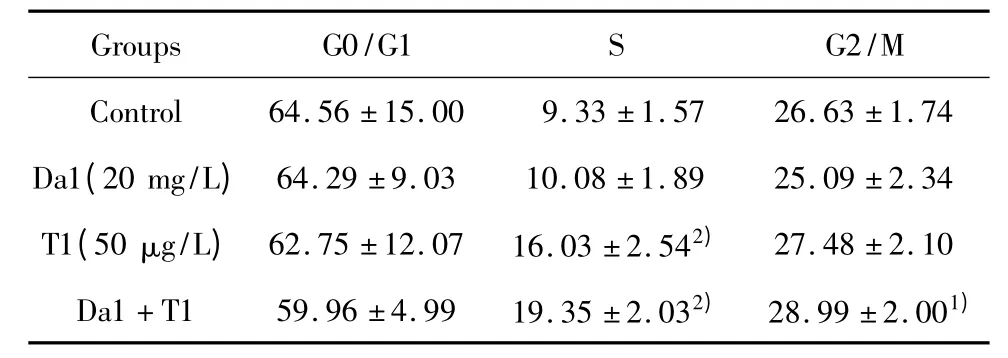
表4 Da和/或TRAIL对SGC-7901细胞周期的影响(±s,n=4)Tab.4 Effects of TRAIL and Da on cell cycle of SGC-7901 cells(±s,n=4)
Note:Compared with control group,1)P <0.05,2)P <0.01.
Groups G0/G1 S G2/M Control 64.56 ±15.00 9.33 ±1.57 26.63 ±1.74 Da1(20 mg/L)64.29 ±9.03 10.08 ±1.89 25.09 ±2.34 T1(50 μg/L)62.75 ±12.07 16.03 ±2.542) 27.48 ±2.10 Da1+T1 59.96 ±4.99 19.35 ±2.032) 28.99 ±2.001)
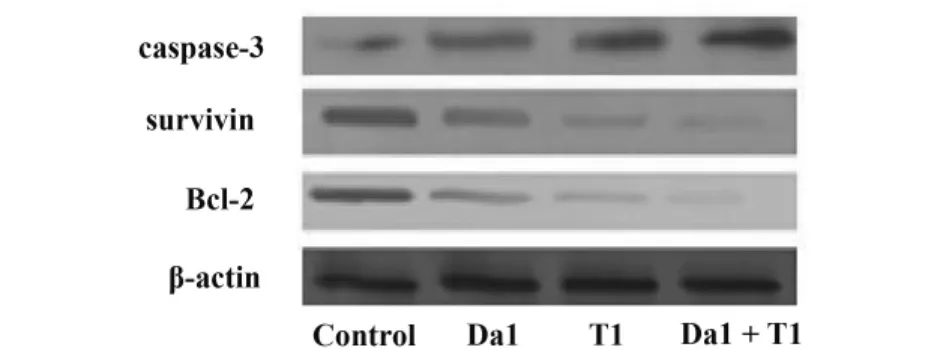
图4 凋亡蛋白caspase-3、survivin、Bcl-2表达变化Fig.4 Expression changes of apoptosis related protein caspase-3,Bcl-2 and survivin
表5 Da和/或 TRAIL对 caspase-3,survivin,Bcl-2表达的影响(±s,n=4)Tab.5 Effect of TRAIL and Da on the expressions of caspase-3,survivin,Bcl-2(±s,n=4)
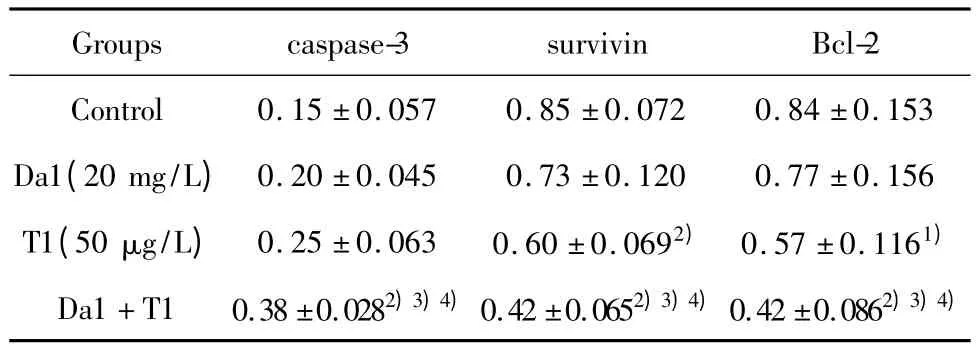
表5 Da和/或 TRAIL对 caspase-3,survivin,Bcl-2表达的影响(±s,n=4)Tab.5 Effect of TRAIL and Da on the expressions of caspase-3,survivin,Bcl-2(±s,n=4)
Note:Compared with control group,1)P <0.05,2)P <0.01;Compared with Da1,3)P <0.01;Compared with T1,4)P <0.01.
Groups caspase-3 survivin Bcl-2 Control 0.15 ±0.057 0.85 ±0.072 0.84 ±0.153 Da1(20 mg/L)0.20 ±0.045 0.73 ±0.120 0.77 ±0.156 T1(50 μg/L) 0.25 ±0.063 0.60 ±0.0692) 0.57 ±0.1161)Da1+T1 0.38 ±0.0282)3)4)0.42 ±0.0652)3)4)0.42 ±0.0862)3)4)
3 讨论
胃癌是我国常见的恶性肿瘤,五年生存率仅为15%~20%,传统化疗是胃癌治疗的一个重要手段,然而大剂量的化疗药物对机体组织可造成相当的毒副作用,如骨髓抑制等,加之常规的化疗效果也不甚理想[4]。有研究表明,增强 caspase-3、Bax基因或抑制survivin、Bcl-2基因的表达能有效抑制肿瘤细胞的增殖,明显增强化疗和放疗对肿瘤细胞的杀伤作用[5,6]。
Da又名黄豆甙元,是存在于大豆中的一类重要的非营养成分,主要来源于大豆和齿状植物等天然的食物中,相关研究认为异黄酮类化合物在预防、治疗恶性肿瘤以及逆转肿瘤耐药等领域将发挥重要作用[7]。Da通过产生活性氧簇(ROS)和线粒体途径来诱导细胞的凋亡,特别是通过诱导Bax/Bcl-2比例的变化和激活 caspases-7和 caspases-9。TRAIL能通过胞内信号传导,能够迅速使表达TRAIL特异性受体通过多种信号传导通路诱导细胞发生凋亡,而对正常的细胞无毒性,被认为是最理想的抗肿瘤新药之一[8,9]。
本实验结合MTT和流式细胞术结果,观察Da和TRAIL单独及联合对SGC-7901细胞增殖抑制率以及诱导细胞凋亡的影响。结果显示,不同浓度的Da和TRAIL均能抑制SGC-7901细胞的增殖,且这种作用呈剂量依赖性,证实了两者联合使用诱导细胞凋亡作用增强并提高TRAIL对SGC-7901细胞敏感性。
本研究通过Western blot检测Da、TRAIL诱导SGC-7901细胞中凋亡相关基因表达的变化。结果显示,Da和TRAIL单独用药能够下调Bcl-2、survivin表达,Da与TRAIL联合作用显著强于单独用药组。说明抑制胃癌细胞 Bcl-2、survivin的表达并增强caspase-3的表达有助于提高胃癌细胞对TRAIL的敏感性。
综上所述,研究发现Da不仅单独应用对胃癌SGC-7901细胞具有抑制增殖作用,而且与TRAIL联合应用可明显提高TRAIL的抗肿瘤活性,对诱导肿瘤细胞凋亡有协同作用。Da联合TRAIL诱导胃癌SGC-7901细胞凋亡,其机制可能与细胞周期S期阻滞、下调Bcl-2、survivin蛋白及增强caspase-3蛋白表达有关,其深层次的作用机制仍需进一步的研究。
1 Cui H B,Na X L,Song D F et al.Blocking effects of genistein on cell proliferation and possible mechanism in human gastric carcinoma[J].World J Gastroenterol,2005;11:69-72.
2 Su S J,Yeh T M,Chuang W J et al.The novel targets for anti-angiogenesis of genistein on human cancer cells[J].Biochem Pharmacol,2005;69:307-318.
3 Yu Z L,Li W J,Liu F Y.Inhibition of proliferation and induction of apoptosis by genistein in colon cancer HT2-29 cells[J].Cancer Lett,2004;2:84-91.
4 Yang X,Takano Y,Zheng H C.The pathobiological features of gastrointestinal cancers[J].Oncol Lett,2012;3(5):961-969.
5 Kaliberov S A.Adenovirus-mediated transfer of BAX driven by the vaseular endothelial growth factor promoter induces apoptosis in lung cancer cells[J].Mol Ther,2002;6:190-198.
6 Waligórska-Stachura J,Jankowska A,Wako R et al.Survivin--prognostic tumor biomarker in human neoplasms--review[J].Ginekol Pol,2012;83(7):537-40.
7 Nagata C,Takatsuka N,Kawakami N et al.A prospective cohort study of soy product intake and stomach cancer death[J].Br J Cancer,2002;87:31-36.
8 杨柳芹,房殿春.硝普钠对TRAIL诱导的胃癌细胞凋亡的影响[J].中华微生物学和免疫学杂志,2006;26(3):246-247.
9 Yang L Q,Fang D C,Wang R Q et al.Effect of NF-kappaB,survivin,Bcl-2 and Caspase-3 on apoptosis of gastric cancer cells induced by tumor necrosis factor related apoptosis inducing ligand[J].World J Gastroenterol,2004;10(1):22-25.