人脐血来源CD34+内皮祖细胞的分离、培养、鉴定及集落形成特性①
2013-11-28李国强刘珍珍孙晟轩安广宇周海斌
李国强 刘珍珍 孙晟轩 安广宇 周海斌
(苏州大学附属第二医院骨外科,苏州215004)
自1997年Asahara等[1]首次在成人外周血中发现循环内皮祖细胞(Endothelial progenitor cells,EPCs),使人们对内皮祖细胞的定义和血管形成的概念有了新的认识。血管发生是一个高度调控的过程,并且在胚胎发育、组织修复与再生中起着重要作用,其中EPCs在这些过程中可能扮演着重要角色[2]。EPCs具有自我增殖、定向分化的特性,可定向分化为血管、内皮细胞,促进血管新生、修复损伤内膜,在血管组织工程、冠心病的诊断治疗上有广阔的临床应用前景[3-5]。
对于EPCs的定义国内外存有争议,现有“两种EPCs”,一种为形态上呈“纺锤样”的 CFU-ECs,另一种则是呈“鹅卵石样”的 ECFCs[6,7]。目前国际上常用的鉴定EPCs的方法是通过流式细胞仪检测细胞表面一些分子抗原的表达,如CD34、CD133和血管内皮细胞生长因子受体(VEGFR-2)[1,8]。但随着细胞的分化,细胞表面抗原也不断发生变化,其中CD34、CD133在细胞体外培养的过程中会逐渐消失[9],而内皮细胞标志物VEGFR-2的表达逐渐增强。因造血干细胞和内皮祖细胞来源于同一前体细胞,即成血管细胞,在其分化过程中可能存在部分相同的细胞表面抗原[10],因此单纯通过细胞表面抗原来鉴定EPCs并不准确。本文通过细胞表面抗原鉴定、细胞增殖能力、集落形态、次级集落形成及体外成血管等方法对两种EPCs进行鉴定,区别 ECFCs和 CFU-ECs,进而对EPCs建立一个正确、统一的认识。
1 材料与方法
1.1 材料
1.1.1 脐血来源 收集6名健康新生产妇脐血,每份约40~100 ml。所有产妇及其家属均知情并同意。
1.1.2 试剂与仪器 Ficoll淋巴细胞分离液购自Cedarlane公司,CD34磁珠分选试剂及仪器购自stem cell公司,流式细胞分析仪、VEGFR-2-PE、CD31-PE、 CD144-PE、 CD133-FITC、 CD34-FITC,CD105-FITC、CD146-FITC、CD14-FITC、CD45-PerCP、Matrigel胶购自BD公司,荧光二抗购自Invitrogen,智能生物图像导航仪FSX100购自OLYMPUS,EBM-2培养基购自MD公司,胎牛血清购自Gibco公司。
1.2 细胞分离培养 从自愿捐献者脐静脉上抽取脐血50 ml左右,肝素抗凝,用等量的PBS稀释,按2∶1比例加在Ficoll淋巴细胞分离液上,2 600 r/min离心30分钟,取中间白膜层,用PBS洗涤2遍,计数。用Easysep免疫磁珠(MACS)人CD34细胞正选试剂筛选CD34+的细胞接种于用纤粘连蛋白(FN)包被的培养皿中,含10%FBS的EGM-2培养基培养。48小时后将未贴壁细胞及细胞碎片移出到新包被培养皿中,48小时后细胞贴壁并换液。原培养皿中贴壁细胞前7天每天更换新鲜培养基,以后隔天换液。见图1。
1.3 EPCs的鉴定
1.3.1 流式分析 1×105个生长状态良好的5代以内细胞与1%BSA稀释的抗体 VEGFR2-PE、CD31-PE、 CD144-PE、 CD133-FITC、 CD34-FITC、CD105-FITC、CD146-FITC、CD14-FITC、CD45-PerCP(100 μl/管),在冰上避光孵育40分钟,继而加1 ml的PBS洗2次,混匀后1 500 r/min离心5分钟。弃上清,加500 μl PBS重悬细胞。流式细胞仪分析,每个样本收集分析10 000个细胞。
1.3.2 细胞免疫荧光 接种细胞与干净的盖玻片上,过夜贴壁后,用4%多聚甲醛固定10分钟;冷PBS洗一遍,100 μl 1%BSA封闭1小时,分别加抗人CD31、vWF、CD144的鼠单克隆抗体,孵育45分钟,PBS洗一遍,再加上Alexa 488羊抗鼠二抗,4℃避光孵育20分钟;PBS洗2次,蒸馏水洗1次,用含DAPI染色剂的封片剂封片后共聚焦显微镜下观察。
1.4 吞噬DiI-Ac-LDL能力 取生长状态良好的5代以内细胞,将细胞与 DiI-AC-LDL(10 μg/ml)在37℃孵育1小时,4%的多聚甲醛固定,37℃孵育1小时,PBS冲洗3次,蒸馏水洗1次,向已染色的标本上滴加DAPI,然后再滴加50%缓冲甘油封片,荧光显微镜下观察结果。
1.5 Matrigel的体外血管形成 提前将Matrigel及48孔板放于4℃冰箱过夜,48孔板中每孔加入150 μl Matrigel,放到37℃培养箱中30分钟。每孔接种4×104个细胞,静置5分钟后放到细胞培养箱中。每隔3小时于倒置显微镜下观察血管形成情况。
2 结果
2.1 EPCs形态特征和集落形成 我们发现经过CD34+免疫磁珠筛选获得的EPCs分为贴壁细胞和未贴壁细胞,其形态完全不同。进一步研究发现两种细胞,在细胞大小、增殖能力、集落形态和集落形成时间等方面存在很大差异,根据其上述特性将贴壁细胞命名 ECFCs,未贴壁细胞命名为 CFU-ECs。ECFCs在分离培养5~14天时形成少量形态为典型“铺路石”样的细胞集落。通过每隔3天用倒置相差显微镜观察细胞的集落形成及增殖过程,发现14~21天有多个集落形成,ECFCs在传到25代时仍具有很强的增殖能力。CFU-ECs在4~10天左右出现少量细胞,呈“纺锤体样”或“梭形”,贴壁梭形细胞从中央向周围呈放射状生长,且有梭形细胞排列呈线状,分别在4、11、18天观察,未见集落生成,10代左右CFU-ECs生长增殖能力明显下降。以往研究认为,ECFCs与CFU-ECs在体内或者体外能否形成次级内皮集落形成是判定细胞增殖能力及是否为EPCs的重要指标[12]。我们研究发现,ECFCs在体外可以形成次级内皮克隆集落,而CFU-ECs不能,这一点也证明 CFU-ECs并非真正的 EPCs,见图2。
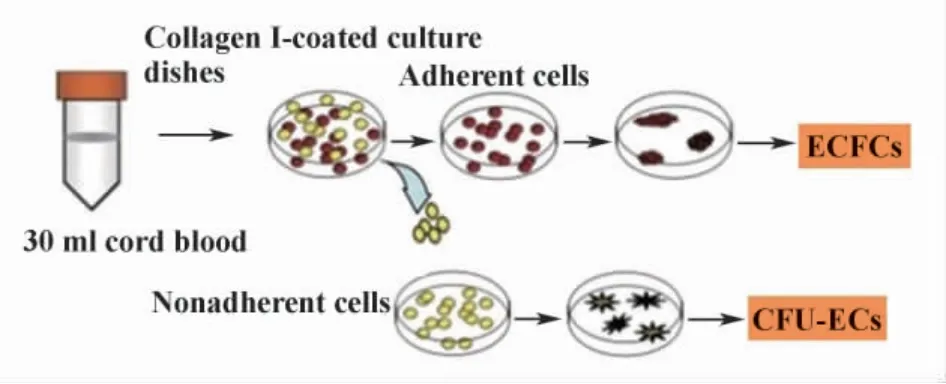
图1 ECFCs和CFU-ECs的分离和培养Fig.1 Endothelial cells isolated and cultured
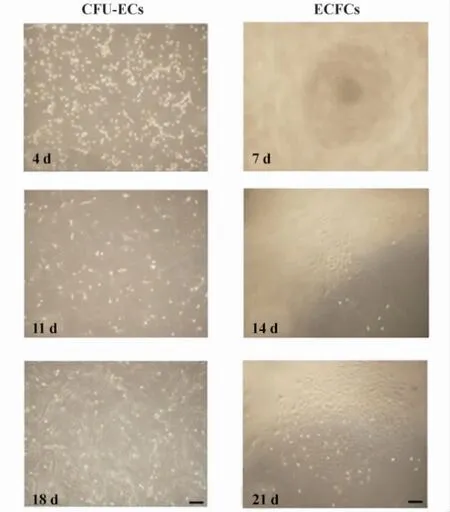
图2 CFU-ECs和ECFCs的细胞集落形成能力Fig.2 The ability of colony formation in two cells
2.2 流式及细胞免疫荧光及 RT-PCR 流式结果发现ECFCs和CFU-ECs共同表达部分内皮细胞表面标志,如 CD31、CD105、CD146和 VEGFR-2等内皮标志,结果见图3A。但CFU-ECs表面造血干细胞标志 CD45和吞噬细胞标志CD14高表达,而ECFCs CD34阳性率达75%,CD14及CD45阳性率较低,分别为5%和9%(图3B)。
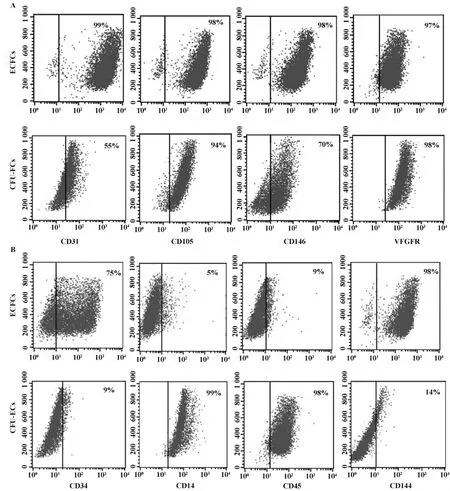
图3 第4代的ECFCs和CFU-ECs的流式检测结果Fig.3 The expression of different molecular in two cells
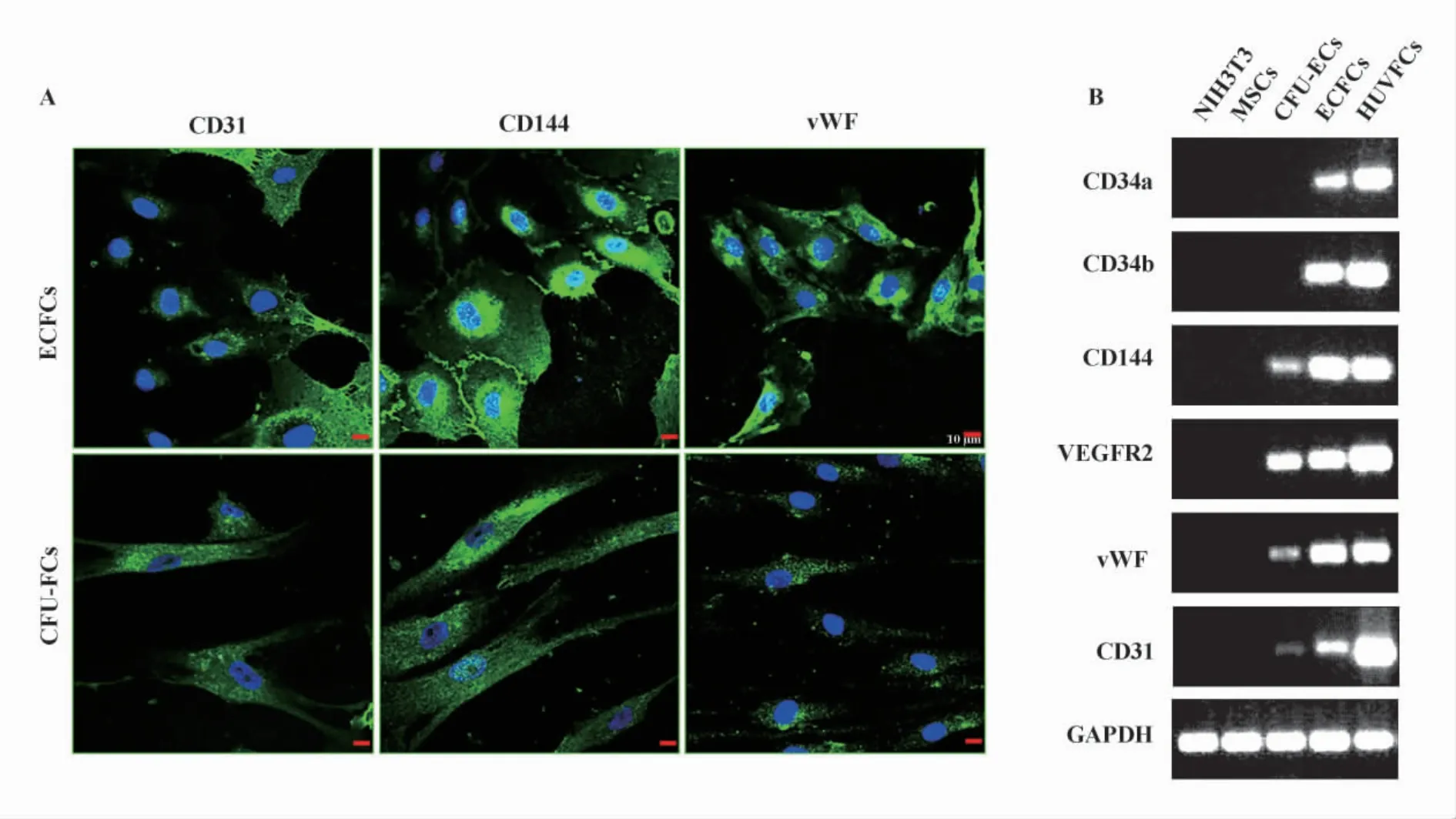
图4 免疫荧光检测及RT-PCR测定ECFCs和CFU-ECs CD31、CD144和vWF的表达Fig.4 The expression of different molecules in immunofluorescence and RT-PCR

图5 ECFCs和CFU-ECs摄取DiL-Ac-LDL能力Fig.5 The ability of ECFCs and CFU-ECs intake DiLAc-LDL

图6 ECFCs和CFU-ECs成血管能力对照Fig.6 The ability of ECFCs and CFU-ECs into vascular
细胞免疫荧光证实两种细胞表面均有CD31、CD144、vWF的阳性表达,与流式检测结果相符,见图4A。RT-PCR检测两种细胞 CD34a、CD34b、CD144、VEGFR-2、vWF、CD31 在 mRNA 水平的表达,结果与上述流式及免疫荧光结果相一致,见图4B。上述结果说明ECFCs和CFU-ECs许多细胞表面标志相同,鉴定细胞标志物并非是鉴定EPCs的金标准。
2.3 DiI-Ac-LDL摄取实验 图5为ECFCs和CFUECs摄取Dil-Ac-LDL能力的比较,可以看出两种细胞都有一定的摄取能力,但ECFCs摄取能力明显强于CFU-ECs,90%以上 ECFCs可以摄取 DiL-Ac-LDL。由于 CFU-ECs表面作为吞噬细胞标志的CD14阳性率约99%,所以其摄取能力可能为吞噬细胞对Dil-Ac-LDL的吞噬作用。
2.4 血管形成 图6为两种细胞成血管情况,发现ECFCs在3小时时已见明显血管网状结构形成,而CFU-ECs在9小时时仍未见血管网状结构,说明CFU-ECs无血管生成能力。
3 讨论
临床研究结果普遍支持自体EPCs在组织缺血以及损伤血管修复的治疗方面具有极大的潜力[11],但外周血中EPCs的数量极少,没有足够细胞量来满足临床应用。而脐血具有取材无创伤、资源丰富、富含早期干细胞等诸多优点。Asahara首次在成人外周血中发现循环EPCs,但关于ECFCs和CFU-ECs哪一种为真正的EPCs及EPCs的标准鉴定方法一直存在争议[12]。本研究选择从脐血中分离扩增EPCs,通过多种方法鉴定ECFCs和CFU-ECs。这两种细胞来源于不同的祖细胞,CFU-ECs可能来源于造血干细胞。ECFCs的分子表面标记、增殖能力、次级集落形成、摄食Dil-Ac-LDL及成血管能力,推断其可能为真正的EPCs。
EPCs与心血管疾病相关,已成为一种新型的评估心血管疾病风险的细胞生物标记[13,14]。研究表明,随着冠心病的Framinghan危险因素评分的增加,血管中循环EPCs的数量逐渐减少,相反在缺血和动脉粥样硬化后的恢复过程中EPCs数量增加。国外学者认为EPCs数量的减少是影响心血管功能和促进心血管疾病发生的重要因素。
在骨折修复与再生方面,Matsumoto等[15]认为CD34+的EPCs和造血干细胞都是细胞系的不同分化阶段,如MSCs一样,CD34+的EPCs和造血干细胞在体内都可以向成骨方向分化[16,17]。骨折的不愈合或延迟愈合很大程度上与骨膜或者骨折附近血供被破坏有关,由于EPCs具有很强的成血管的能力,同时还可以通过旁分泌VEGF促进毛细血管形成,EPCs若能向成骨方向分化,对骨折的治疗将会有非常好的应用前景。
1 Asahara T,Murohara T,Sullivan A et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997;275:964-967.
2 Hisamichi Naito,Hiroyasu Kidoya.Identification and characterization of a resident vascular stem/progenitor cell population in preexisting blood vessels[J].EMBO J,2012;31:842-855.
3 Fadini G P,Agostini C,Avogaro A.Autologous stem cell therapy for peripheral arterial disease meta-analysis and systematic review of the literature[J].Atherosclerosis,2010;209:10-17.
4 Lipinski M J,Biondi-Zoccai G G,Abbate A et al.Impact of intracoronary cell therapy on left ventricular function in the setting of acute myocardial infarction:a collaborative systematic review and meta-analysis of controlled clinical trials[J].J Am Coll Cardiol,2007;50:1761-1767.
5 Dimmeler S,Burchfield J,Zeiher A M.Cell-based therapy of myocardial infarction[J].Arterioscler Thromb Vasc Biol,2008;28:208-216.
6 Ingram D,Mead L,Tanaka H et al.Identification of a novel hierarchy of endothelial progenitor cells utilizing human peripheral and umbilical cord blood[J].Blood,2004;104:2752-2760.
7 Yoder M C,Mead L E,Prater et al.Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals[J].Blood,2007;109:1801-1809.
8 Peichev M,Maiyer A,Pereira D et al.Expression of VEGFR-2 and AC133 be circulating human CD34(+)cells identifies a population of functional endothelial precursors[J].Blood,2000;95:952-958.
9 Miraglia S,Godfrey W,Yin A H et al.A novel five transmembrane hematopoietic stem cell antigen:isolation,characterization,and molecular cloning[J].Blood,1997;90:5013-5021.
10 Bailey A S,Fleming W H.Converging roads:evidence for an adult hemangioblast[J].Exp Hematol,2003;31:987-993.
11 Werner N,Kosiol S,Schiegl T et al.Circulating endothelial progenitor cells and cardiovascular outcomes[J].N Engl J Med,2005;353:999-1007.
12 Gian Paolo Fadini,Douglas Losordo,Stefanie Dimmeler.Critical reevaluation of endothelial progenitor cell phenotypes for therapeutic and diagnostic use[J].Circulation Research,2012;110:624-637.
13 Hill J M,Zalos G,Halcox J P et al.Circulating endothelial progenitor cells,vascular function,and cardiovascular risk[J].N Engl J Med,2003;348:593-600.
14 Kalka C,Masuda H,Takahashi T et al.Transplanation of ex vivo expandedendothelial progenitor cells for therapeutic neovascularization[J].Proc Natl Acad Sci USA,2000;97:3422-3427.
15 Tomoyuki Matsumoto,Ryosuke Kuroda,Yutaka Mifune et al.Circulating endothelial/skeletal progenitor cells for bone regeneration and healing[J].Bone,2008;43:434-439.
16 Matsumoto T,Mifune Y,Kawamoto A et al.Fracture induced mobilization and incorporation of bone marrow-derived endothelial progenitor cells for bone healing[J].J Cell Physiol,2008;215:234-242.
17 Mifune Y,Matsumoto T,Kawamoto A et al.Local delivery of granulocyte colony stimulating factor-mobilized CD34-positive progenitor cells using bioscaffold for modality of unhealing bone fracture[J].Stem Cells,2008;26:1395-1405.