1-(4-吡啶基)苯基-3,5-二[4-(9′H-9′-咔唑基)苯基]苯的合成及其光学性能
2013-11-19朱伟为周学华余黎明黄海方高希存
朱伟为, 周学华, 余黎明, 黄海方, 高希存
(南昌大学 理学院 化学系,江西 南昌 330031)
磷光材料能够提高有机电致发光器件量子效率,因此得到广泛研究[1~3]。目前,应用于电致磷光器件的材料多为稀有金属有机配合物,如铱、铂配合物,采用的都是以2-苯基吡啶及其衍生物引入“吸”“供”电子基团[4,5],改变配合物最低未占电子轨道和最高已占分子轨道使其配合物的性质发生改变,从而达到发光颜色不同的磷光材料。并得到很好的外量子效率的OLED器件。
咔唑基团上的N原子具有较强的给电子能力从而体现了较好的电正性,在不断给出电子的过程中实现空穴迁移性,并且一般都有很高的空穴迁移率[(10-3~10-4) cm2·V-1[6,7]]。
本文在文献[8~11]方法的基础,经过重氮化,Ullmann,硼酸化和Suzuki偶联反应,将咔唑,对二溴苯,4-溴苯胺及二苯基吡啶引入到一个化合物中,合成了一个新型的具有星状结构的空穴传输和主




Scheme1
体摻杂功能的材料——1-(4-吡啶基)苯基-3,5-二[4-(9′H-9′-咔唑基)苯基]苯(6, Scheme 1),其结构经1H NMR, MS和元素分析表征。研究了6在二氯甲烷中的紫外吸收光谱和荧光光谱。结果表明,6在237 nm, 293 nm和345 nm处有较强吸收;6的最大发射波长在413 nm。
1 实验部分
1.1 仪器与试剂
X-4型微显熔点仪(温度未校正);Avance-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标); PE Lambda 35型紫外-可见光谱仪(UV); F-4500型荧光光谱仪;ZQ4000/2695型高效液相色谱-质谱联用仪;Flash EA 1112型元素分析仪;阶梯升华仪。
咔唑,对二溴苯,4-溴苯胺,上海达瑞公司;三甲基硼酸酯,正丁基锂,Alfa Aesa公司;1,10-邻菲啰啉,分析纯,国药集团上海化学试剂有限公司;1,3,5-三溴苯,南海凯美瑞化工有限公司。
1.2 合成
(1) 9-(4-溴苯基)-9H-咔唑(1)合成
在反应瓶中依次加入咔唑(R-H)5.0 g(30 mmol),对二溴苯21.24 g(90 mmol),无水碳酸钾37.26 g(90 mmol),碘化亚铜1.91 g(10 mmol), 1,10-邻菲啰啉1.98 g(10 mmol)和无水邻二氯苯180 mL,通氮气保护,搅拌下缓慢升温至回流反应48 h。冷却至室温,抽滤,滤饼经硅胶柱层析[200目~300目(下同),洗脱剂:A=V(石油醚) ∶V(二氯甲烷)=20 ∶1]分离得固体,经升华得白色固体1 7.56 g,产率79.2%, m.p.153 ℃~155 ℃(152 ℃~155 ℃[12]);1H NMRδ: 8.15(d,J=6.80 Hz, 2H), 7.74(d,J=6.72 Hz, 2H), 7.47~7.40(m, 6H), 7.28(d,J=16.40 Hz, 2H); Anal.calcd for C18H12NBr:C 67.10, H 3.56, N 4.37; found C 68.14, H 3.75, N 4.35。
(2) 4-(9H-9-咔唑基)苯硼酸(2)的合成
在反应瓶中加入1 5.00 g(16 mmol)和无水THF 80 mL,通氮气保护,搅拌下快速冷却至-78 ℃,缓慢滴加正丁基锂12.96 mL(20.8 mmol)(约30 min),反应1 h;迅速滴加硼酸甲酯6.68 mL(60 mmol),反应3 h~4 h;缓慢升至0 ℃,滴加2 mol·L-1盐酸70 mL,滴毕,反应3 h。用乙醚(3×50 mL)萃取,合并有机相,旋干后经硅胶柱色谱[洗脱剂:V(乙酸乙酯) ∶V(二氯甲烷)=5 ∶2]纯化得白色固体2 3.61 g,产率83%, m.p.263 ℃~284 ℃;1H NMRδ: 8.57~8.55(d,J=8.12 Hz, 1H), 8.19~8.14(m, 2H), 8.00~7.98(d,J=8.64 Hz, 1H), 7.82~7.80(d,J=8.00 Hz, 1H), 7.65~7.63(d,J=8.24 Hz, 1H), 7.58~7.56(d,J=8.40 Hz, 1H), 7.48~7.40(m, 3H), 7.36~7.28(m, 2H)。
(3) 2-(4-溴苯基)吡啶(3)的合成
在反应瓶中加入对溴苯胺25 g(0.15 mol),浓盐酸40 mL和去离子水20 mL,搅拌下缓慢升温至70 ℃使其完全溶解;于-5 ℃缓慢滴加饱和亚硝酸盐(9 g)溶液(温度保持在0 ℃以下),滴毕得重氮盐溶液A。
在反应瓶中加入吡啶,搅拌下于约40 ℃慢慢滴加A,滴毕,于40 ℃以下反应4 h~5 h。用20%NaOH溶液调至pH>10,反应24 h。冷却至室温,用二氯甲烷(3×40 mL)萃取,合并有机相,旋干后经硅胶柱色谱(洗脱剂:A=6 ∶2)纯化得白色针状晶体3 10.6 g,收率35.6%, m.p.61 ℃~63 ℃;1H NMRδ: 8.68~8.69(d, 1H), 7.87~7.89(d, 2H), 7.75~7.76(t, 1H), 7.70~7.72(t, 1H), 7.60~7.62(d, 2H), 7.24(s, 1H); Anal.calcd for C11H8NBr:C 56.41, H 3.42, N 5.98; found C 56.72, H 3.77, N 6.23。
(4) 4-(2-吡啶基)苯硼酸(4)的合成
在反应瓶中加入3 9.2(20 mmol))和无水THF 150 mL,搅拌的同时充入氮气排氧,迅速冷却至-78 ℃,充氮气排氧30 min以上;缓慢滴加正丁基锂17.92 mL(52 mmol),滴毕,于-78 ℃反应1 h;快速加入硼酸三甲酯13.64 mL(120 mmol),反应4 h。缓慢升至0 ℃,滴加2 mol·L-1盐酸至pH 4~5,反应4 h。自然升至室温,用乙醚(3×50 mL)萃取,旋干溶剂后经硅胶柱色谱[洗脱剂:B=V(石油醚) ∶V(乙酸乙酯)=3 ∶1]纯化得白色固体4 3.6 g,收率46%, m.p.238 ℃~240 ℃;1H NMRδ: 8.73~8.77(d, 1H), 8.03~8.05(d, 2H), 7.84~7.86(t, 2H), 7.70~7.72(d, 2H), 7.28(s, 1H)。
(5) 1-(4-吡啶基)-苯基-3,5-二溴苯(5)的合成
在反应瓶中依次加入4 5 g(25.1 mmol), 1,3,5-三溴苯21.8 g(69.9 mmol),碳酸钾9.58 g,乙醇30 mL,水20 mL和甲苯50 mL,搅拌的同时充氮气30 min以上。加入Pd(PPh3)40.8 g,回流(85 ℃)反应24 h。停止充氮气,自然升至室温,加适量水,用甲苯(3×30 mL)萃取,合并有机相,旋干后经硅胶柱色谱(洗脱剂:B=4 ∶1)纯化得白色固体5 6.7 g, m.p.115 ℃~117 ℃,收率83.5%;1H NMRδ: 8.72~8.73(d, 1H), 8.08~8.10(d, 2H), 7.77~7.78(d, 2H), 7.7(s, 2H), 7.73~7.75(d, 3H), 7.28(s, 1H)。
(6) 6的合成
在反应瓶中依次加入57.74 g(20 mmol),211.48 g(40 mmol),碳酸钾8.32 g,乙醇40 mL,水15 mL及甲苯80 mL,搅拌的同时充氮气30 min以上。加入Pd(PPh3)40.6 g,回流(85 ℃)反应24 h。停止充氮气,自然降至室温,加适量水,用甲苯(3×50 mL)萃取,合并有机相,旋干后经硅胶柱色谱(洗脱剂:B=3 ∶1)纯化得白色固体6,产率82.7%, m.p.236 ℃~238 ℃;1H NMRδ: 8.75~8.77(d, 1H), 8.18~8.20(d, 6H), 7.99~8.02(d, 7H), 7.91~7.93(d, 2H), 7.81~7.84(m, 2H), 7.73~7.75(d, 4H), 7.53~7.55(d, 4H), 7.44~7.48(t, 4H), 7.29~7.35(m, 4H), 7.26~7.28(s, 3H); ESI-MSm/z(%): 714.3[M+, 100]; Anal.calcd for C53H35N3: C 89.17, H 4.94, N 5.89; found C 89.60, H 5.16, N 5.24。
2 结果与讨论
2.1 合成
(1) 3的合成
在3的合成中,考察了吡啶的用量[r=n(对溴苯胺) ∶n(吡啶)]和反应温度对3产率的影响,结果分别见表1和表2。由表1可见,当r=1或2时,生成的重氮盐容易自身偶联,产率低。

表1 r对3收率的影响*Table 1 Effect of r on the yield of 3
*溴苯胺0.15 mol,其余反应条件同1.2(3)
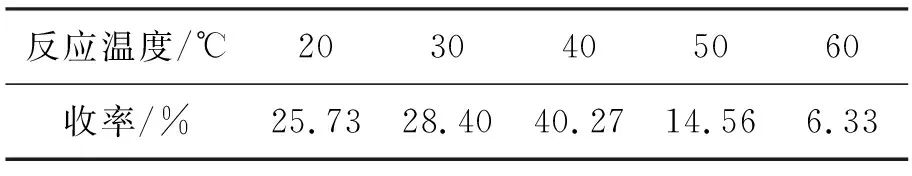
表2 反应温度对3收率的影响*Table 2 Effect of temperature on the yield of 3
*溴苯胺0.15 mol,r=10,其余反应条件同1.2(3)
由表2可见,温度控制也很重要。温度过高或过低都容易产生更多的副产物。除此之外,重氮盐A的滴加速度要慢,太快也会加速重氮盐的偶联。
综上所述,合成3的最佳反应条件为:对溴苯胺0.15 mol,r=10,于40 ℃反应24 h,滴加重氮盐溶液速度(1滴~2滴)·s-1,收率30.27%。
(2) 5的合成
在5的合成中,在加入Pd(PPh3)4前要将反应容器中的氧排尽,否则催化剂容易中毒失活。同时要注意均三溴苯要过量,因为4会进一步与其他位号的溴进一步偶联。反应时间不能太长,否则4会进一步发生偶联反应且硼酸本身也会自身偶联,以8 h~9 h为最佳。
2.2 光学性能
5和6在二氯甲烷中的UV-Vis和荧光光谱(FL)分别见图1和图2。
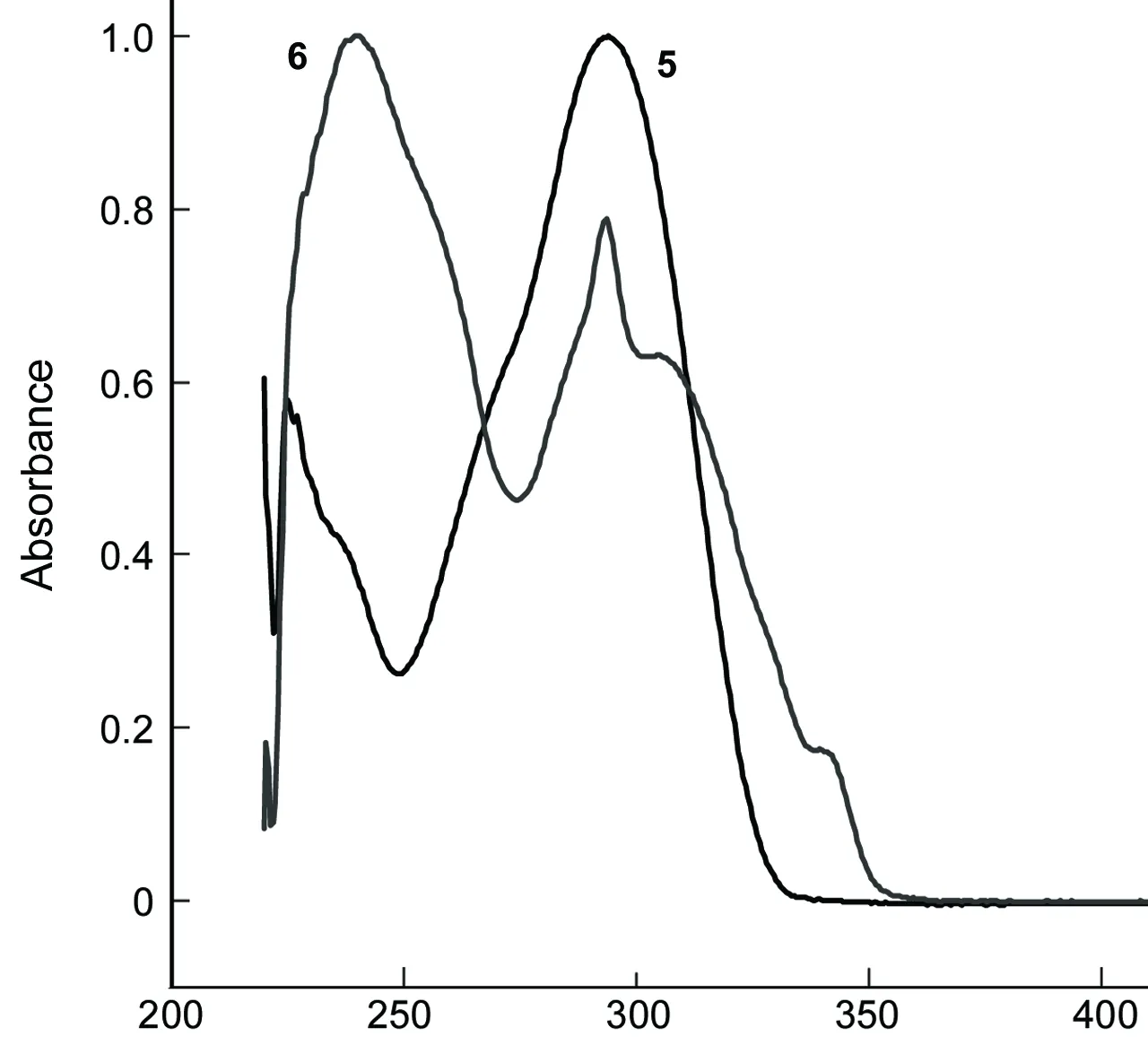
λ/nm图1 5和6的UV-Vis谱图*Figure 1 UV-Vis spectra of 5 and 6*二氯甲烷为溶剂,c=5×10-5 mol·L-1

λ/nm图2 5和6的FL谱图*Figure 2 FL spectra of 5 and 6*同图1
由图1可见,6在237 nm, 293 nm和345 nm有较强的吸收,而5则在225 nm和295 nm有较强吸收。这是由于芳环上的电子π- π*跃迁所以能在高能区有吸收峰,在低能区由于氮原子上的孤对电子和芳环之间n-π*跃迁所以有吸收峰。6相对5的吸收波长有明显的红移,这是因为6在5的基础上引入两个咔唑基团,而咔唑有很强的共轭体系,这样就加大了电子离域的范围,致使电子跃迁所需要的能量降低,导致吸收波长向长波方向移动即红移。
从图2可见,5的最大发射峰在363 nm,由于6引入咔唑以后共轭体系增加,导致LUMO和HOMO的能垒降低,导致发射峰的位置发生红移至413 nm。
3 结论
以咔唑、对二溴苯、4-溴苯胺、1,3,5-三溴苯为原料,经重氮化、Ullmann反应、硼酸化、Suzuki偶联反应合成了一种新的星形磷光配体——1-(4-吡啶基)苯基-3,5-二[4-(9′H-9′-咔唑基)苯基]苯,其有较大的空间结构,空穴传输及较强的供电子效应,能很好的提高磷光材料的性能,改良器件结构的作用,可能会是有机电致发光器件的首选材料。
[1] Kohler A, Wilson J S, Friend R H. Fluorescence andphosphorescence in organic materials[J].Adv Mater,2002,14(10):701-707.
[2] Imai K, Wakimoto T, Shirota Y,etal. Electroluminescent device[P].US 5 374 489,1994.
[3] Veinot J G C, M arks T J. Toward the ideal organ iclightem itting diode.The versatility and utility of inter facial tailoring by cross linked siloxane interlayers[J].Acc Chem Res,2005,38:632-643.
[4] Chen, H Tanabe, X C Li,etal. Novel organic hole transport material with very high Tg for light-emitting diodes[J].Synth Met,2003,132(2):173-176.
[5] Michae l S Lowry, W illiam R H udson, Robert A Pasca,etal. Accele rated lum inophore discovery throughcomb inatorial synthesis[J].J Am Chem Soc,2004,126:14129-14135.
[6] Sandee A J, Williams C K, Evans N R,etal. Solution processible conjuated electrophosphorescent polymers[J].J Am Chem Soc,2004,126(22):7041-7048.
[7] 王俊,李天全,秦玉楠. 含钼杂多酸催化剂在有机合成中的应用[J].中国钼业,2005,29(2):33-37.
[8] 彭化南,杨长剑,王江淮,等. 4-[(4′-N,N-二苯基)苯基]-2,2′二联吡啶的表征与合成[J].化学试剂,2008,30(8):571-573.
[9] 王江淮,杨长剑,彭化南,等. 2,5-二[4′-9H-9-咔唑基苯基]吡啶的合成与表征[J].化学试剂,2008,(4):280-282.
[10] Fang Wu, Wenjing Tian, Zhiming Zhang,etal. Organic electroluminescent device based on balanced carriers injection and transportation[J].Thin Solid Films,2000,363(1~2):214-217.
[11] Dzich R, Salbeck J. Synthesis and characterization of new oxadiazoleamine basedspiro-inked fluorescenceyes[J].Synthetic Metals,2003,138(1/2):21-31.
[12] Vishwanath G Deshmane, Parag R Gogate, Aniruddha B Pandit. ltrasound assisted synthesis of isopropyl esters from palm fatty cid distillate[J].Ultrasonics Sonochemistry,2009,16(3):345-350.
