新型N-取代四氢噻吩并[3,2-c]吡啶类衍生物的合成及其抗血小板聚集活性
2013-11-19陈立功廖上腾刘登科
刘 颖, 陈立功, 廖上腾, 刘登科
(1. 天津大学 化工学院,天津 300072; 2. 天津药物研究院 天津市新药设计与发现重点实验室,天津 300193)
近年来,作用于ADP受体的四氢噻吩并吡啶类药物已成为抗血栓治疗的主要药物,但该类药物中的噻氯匹定、氯吡格雷、普拉格雷在有效性和安全性方面还有明显的不足。研究人员们又设计并合成了大量新型的ADP受体拮抗剂类化合物[1~9],以期找到更加优良的候选药物。
哌嗪类衍生物作为一类重要的医药中间体广泛应用于镇静催眠药物、抗组胺药物、镇咳药物、抗微生物药物、抗血小板药物[10,11]。其毒性小,易形成多个氢键或离子键,能有效调节药物的脂水分配系数和酸碱平衡常数。将其引入分子中,能有效增加分子的碱性和水溶性,从而增强分子的活性[12]。
本文设计在保留明确具有抗血小板活性的噻吩并吡啶药效团的基础上,引入哌嗪基团,以期找到更佳的候选药物。以4,5,6,7-四氢噻吩并[3,2-c]吡啶为起始原料,设计并合成了一系列新型的含哌嗪结构的噻吩并吡啶类化合物(3a~3p,Scheme 1),其结构经1H NMR,13C NMR, IR和ESI-HR-MS表征。并对其抗血小板聚集活性进行了研究。

Scheme1
1 实验部分
1.1 仪器与试剂
YRT-3型数字显示熔点仪(温度未校正);ZF-20D型暗箱式紫外分析仪;Bruker 400型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Bruker Vector 22型傅立叶变换红外光谱仪(KBr压片或涂膜法);VG ZAB-HS型质谱仪;CombiFlash Rf System型快速制备色谱;Lab Alliance S1500型高效液相色谱仪;PAM-3型双通道血小板聚集仪。
薄层层析硅胶板GF-254,青岛海洋化工厂;4,5,6,7-四氢噻吩并[3,2-c]吡啶盐酸盐,临海市利民化工有限公司;1a~1p,Alfa天津化学有限公司;其余所用试剂均为分析纯或化学纯。
1.2 合成
(1) 1-氯乙酰基取代哌嗪的合成(以2a为例)
在反应瓶中加入氯乙酰氯1.47 g(13 mmol)和二氯甲烷10 mL,搅拌下加入研磨的无水碳酸钾2.76 g(20 mmol),于-10 ℃缓慢滴加2,3-二氯苯基)哌嗪(1a)2.31 g(10 mol)的二氯甲烷(20 mL)溶液,滴毕,于15 ℃反应3.5 h(TLC监测)。用饱和食盐水(3×30 mL)洗涤,无水硫酸钠干燥,旋蒸脱溶得无色油状液体1-氯乙酰基-4-(2,3-二氯苯基)哌嗪(2a)2.8 g,纯度81.3%(HPLC,下同),直接用于下步反应。
按类似方法合成油状液体2b~2p。其颜色和纯度分别为:2b: 无色,84.9%;2c:淡黄色,79.5%;2d:黄色,81.9%;2e:无色,82.5%;2f:黄色,78.5%;2g:无色,87.4%;2h:无色,84.3%;2i:无色,75.9%;2j:淡黄色,79.6%;2k:淡黄色,71.8%;2l:淡黄色,78.8%;2m:黄色,84.2%;2n:淡黄色,77.0%;2o:淡黄色,75.3%;2p:黄色,78.6%。
(2) 3的合成(以3a为例)
在反应瓶中加入2a3.1 g(10 mmol)和二氯甲烷30 mL,搅拌下加入三乙胺 4.0 g(40 mmol);分批加入4,5,6,7-四氢噻吩并[3,2-c]吡啶盐酸盐1.76 g(10 mmol),加毕,回流反应6 h(TLC监测)。用饱和食盐水(3×30 mL)洗涤,用无水硫酸钠干燥,旋蒸脱溶得无色油状液体,经快速制备色谱[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=2 ∶1]纯化得1-(2, 3-二氯苯基)-4-{[(4,5,6,7-四氢噻吩并[3,2-c]吡啶-5-基)乙基]羰基}哌嗪(3a)2.6 g。
按类似方法合成3b~3p。
1.3 3的生物活性测试[13]
选用健康雄性Wistar大鼠(体重200 g~250 g),随机分两组。每批均设正常及氯吡格雷对照组,灌胃给药,剂量30 mg·kg-1。给药容积均为10 mL·kg-1·bw-1,正常对照组给予等量0.5%枸橼酸钠(CMC-Na),给药后2 h,腹腔注射40 mg·kg-1戊巴比妥钠(1 mL·kg-1)麻醉,腹主动脉采血,用3.8%CMC-Na抗凝,分别制备富血小板血浆(PRP)和贫血小板血浆(PPP),测定ADP(终浓度:1.08 μmol·L-1)诱导的血小板最大聚集百分率(见表3)。
2 结果与讨论
3的实验结果,ESI-HR-MS和IR数据见表1,NMR数据见表2。
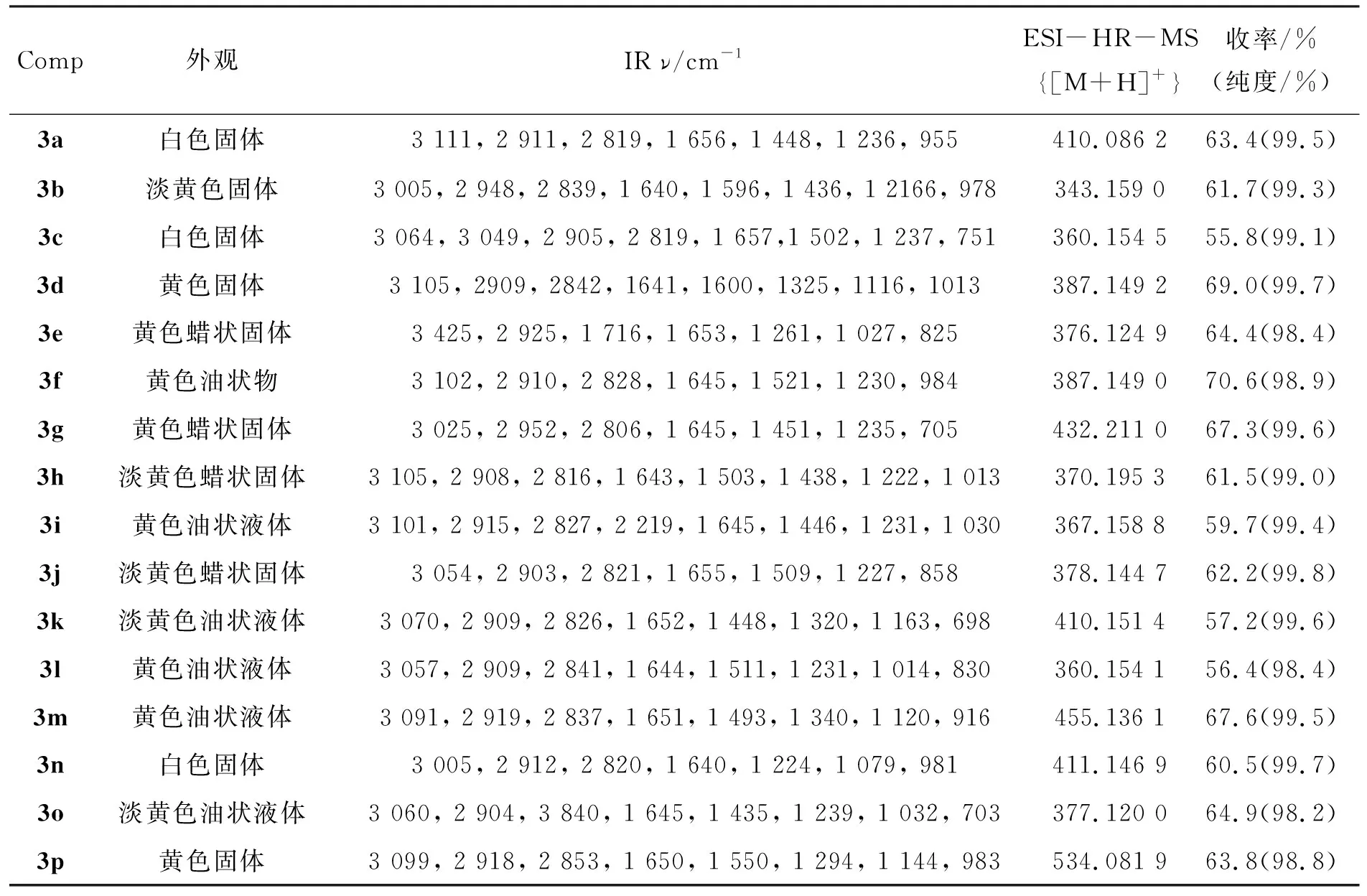
表1 3的实验数据,ESI-MS和IR数据Table 1 Experimental results, ESI-MS and IR data of 3

表 2 3的NMR数据Table 2 NMR data of 3
续表2

Comp1H NMR δ(J/Hz)13C NMR δ3e2.77(s, 4H), 3.14~3.15(m, J=0.007, 4H), 3.39(s, 2H), 3.54(s, 2H), 3.59(s, 2H), 3.67(s, 2H), 6.77~6.79(m, J=10.4, 2H), 6.86~6.88(m, J=10.0, 1H), 6.93~6.94(m, J=3.6, 1H), 7.17~7.19(d, J=8.0, 1H), 7.21~7.24(m, J=12.0, 1H)25.32, 41.27, 45.08, 48.08, 48.62, 50.34, 52.66, 60.07, 114.30, 115.28, 118.78, 123.31, 125.79, 130.82, 132.95, 134.06, 134.26, 152.37, 168.043f2.78(s, 4H), 2.98(s, 4H), 3.39(s, 2H), 3.55(s, 2H), 3.59(s, 2H), 3.67(s, 2H), 6.77~6.78(d, J=5.2, 1H), 7.12~7.15(m, J=15.2, 1H), 7.23~7.24(d, J=5.2, 1H), 7.28~7.30(d, J=8.4, 1H), 7.55~7.59(m, J=16.8, 1H), 7.79~7.82(dd, J=9.6, 1H)24.86, 41.18, 45.08, 49.86, 51.06, 51.64, 52.17, 59.59, 59.66, 121.68, 122.29, 122.80, 125.31, 132.51, 133.62, 133.71, 143.04, 144.98, 167.753g2.26~2.28(m, J=8.4, 4H), 2.74(s, 4H), 3.37(s, 2H), 3.50~3.53(m, J=15.2, 6H), 4.29(s, 1H), 6.74~6.76(d, J=5.2, 1H), 7.15~7.19(t, J=14.4, 2H), 7.22~7.23(d, J=5.2, 1H), 7.26~7.30(t, J=15.2, 4H), 7.41~7.43(d, J=7.2, 4H)24.86, 41.18, 45.08, 49.84, 51.26, 51.85, 52.15, 59.57~59.64(d), 122.74, 125.25, 126.81, 127.52, 128.20, 128.42, 132.44, 133.62, 142.35, 167.38, 170.143h2.19(s, 3H), 2.21(s, 3H), 2.73(s, 4H), 2.78(s, 4H), 3.39(s, 2H), 3.55(s, 2H), 3.59(s, 2H), 3.67(s, 2H), 6.78~6.79(d, J=5.2, 1H), 6.84~6.86(d, J=8.0, 1H), 6.90~6.93(d, J=8.4, 1H), 6.96(s, 1H), 7.24~7.26(d, J=4.8, 1H)17.29, 20.23, 24.87, 41.67, 45.65, 49.85, 51.54, 52.06, 52.17, 59.64, 118.80, 122.84, 125.34, 126.86, 131.39, 131.68, 131.91, 132.50, 133.66, 148.44, 167.623i2.76(s, 4H), 3.08(s, 4H), 3.38(s, 2H), 3.53(s, 2H), 3.62(s, 2H), 3.71s, 2H), 6.74~6.76(d, J=4.8, 1H), 7.05~7.11(m, J=23.6, 2H), 7.21~7.22(d, J=4.8, 1H), 7.53~7.57(t, J=15.6, 1H), 7.65~7.67(d, J=7.6, 1H)25.26, 41.58, 45.58, 50.26, 51.38, 52.05, 52.57, 60.00, 105.39, 118.45, 119.64, 122.64, 123.22, 125.73, 132.91, 134.01, 134.52~134.63(d), 155.26, 168.173j2.86~2.91(m, J=19.6, 4H), 2.99(s, 4H), 3.43(s, 2H), 3.64(s, 2H), 3.78~3.81(m, J=9.2, 4H), 6.71~6.73(d, J=5.2, 1H), 6.77~6.79(m, J=7.6, 1H), 6.81~6.85(m, J=18.8, 1H), 6.87~6.89m, J=8.8, 1H), 7.08~7.09(d, J=4.8, 1H)25.63, 42.12, 46.04, 50.67, 51.10, 51.77, 53.16, 61.02, 104.76~105.27(m), 110.86~111.11(q), 119.99~120.12(q), 122.95, 125.31, 133.30~133.51(d), 136.35~136.47(q), 154.64~154.76(d), 157.13~157.26(t), 159.57~159.68(d), 168.423k2.78(s, 4H), 3.21(s, 4H), 3.41(s, 2H), 3.56(s, 2H), 3.63(s, 2H), 3.71(s, 2H), 6.76~6.78(d, J=4.8, 1H), 7.06~7.07(d, J=7.2, 1H), 7.18~7.20(m, J=8.0, 2H), 7.22~7.23(d, J=4.8, 1H), 7.38~7.42(t, J=15.6, 1H)25.59, 41.56, 45.35, 48.30, 48.84, 50.60, 52.93, 60.39, 111.91~111.95(d), 115.55~115.59(d), 119.60, 123.51, 126.00, 126.42, 130.51~130.59(d), 130.82, 133.23, 134.33, 151.65, 168.333l2.77(s, 4H), 3.03(s, 4H), 3.39(s, 2H), 3.54(s, 2H), 3.61(s, 2H), 3.68(s, 2H), 6.76~6.769(d, J=4.8, 1H), 6.90~6.94(m, J=13.6, 2H), 7.00~7.05(m, J=17.6, 2H), 7.22~7.23(d, J=5.2, 1H)24.88, 41.02, 44.89, 49.14, 49.68, 49.87, 52.21, 59.64, 115.13, 115.35, 117.54~117.62(d), 122.83, 125.32, 132.51, 133.64, 147.63~147.64(d), 155.04, 157.39, 167.54
续表2

Comp1H NMR δ(J/Hz)13C NMR δ3m2.79(s, 4H), 3.08(s, 4H), 3.41(s, 2H), 3.55(s, 2H), 3.62(s, 2H), 3.72(s, 2H), 6.75~6.77(d, J=5.2, 1H), 7.21~7.22(d, J=5.2, 1H), 7.52~7.54(d, J=8.8, 1H), 8.33~8.37(m, J=16.0, 2H)25.58, 41.85, 45.82, 50.60, 52.74, 52.90, 53.36, 60.32, 122.40, 123.12, 123.49, 124.31~124.47, 125.12, 126.00, 129.03, 133.22, 134.31, 142.50, 157.04, 168.543n2.78(s, 4H), 3.41(s, 2H), 3.55~3.59(m, J=13.6, 4H), 3.63~3.66(m, J=14.0, 6H), 6.77~6.78(d, J=5.2, 1H), 6.92~6.94(d, J=9.2, 1H), 7.23~7.25(d, J=4.8, 1H), 7.76~7.79(q, J=11.6, 1H), 8.39~8.40(m, J=1.6, 1H)24.87, 40.75, 43.84, 44.46, 49.91, 52.18, 59.62, 106.34, 122.83, 125.34, 132.51 ,133.64, 134.44, 134.47, 145.12, 145.16, 159.99, 167.853o2.77(s, 4H), 3.21(s, 4H), 3.39(s, 2H), 3.55(s, 2H), 3.627(s, 2H), 3.69(s, 2H), 6.75~6.79(d, J=5.2, 1H), 6.94~6.97(m, J=12.4, 1H), 7.20~7.21(d, J=5.2, 1H), 7.72~7.74(m, J=7.6, 1H), 8.17~8.19(m, J=4.8, 1H)24.91, 41.02, 44.99, 48.71, 49.18, 49.89, 52.20, 59.72, 118.62, 121.65, 122.75, 125.27, 132.48, 133.59, 138.95, 145.88, 157.41, 167.653p2.75~2.80(m, J=19.6, 4H), 3.01~3.03(m, J=9.2, 4H), 3.38(s, 2H), 3.47(s, 2H), 3.52(s, 2H), 3.55(s, 2H), 6.77~6.78(d, J=4.8, 1H), 7.25~7.26(d, J=5.2, 1H), 8.57(s, 1H)24.75, 41.31, 45.46, 49.76, 50.20, 50.58, 52.16, 59.56, 122.60, 122.69~122.76(d), 123.02, 125.24, 126.57~126.62(d), 127.51, 132.44, 133.49, 140.79, 144.67, 149.34, 167.85
2.1 合成
2的合成中利用正交实验设计的方法,进行了条件的摸索,确定了加料顺序为将哌嗪原料溶解或稀释后滴加于稍过量的氯乙酰氯中,这样可以保证哌嗪基本上反应完全,2不需纯化处理即可直接用于下一步反应。氯乙酰氯不可过量太多,否则洗涤萃取不完全,将其带入下步反应会与噻吩并吡啶反应生成新的副产物。
考察了缚酸剂(三乙胺、无水碳酸钾、吡啶、氢氧化钠、氢氧化钾)对反应的影响。实验结果表明,无水碳酸钾的催化效果最好,尤其将其研磨后更佳。氯乙酰氯和哌嗪反应会大量放热,因此将哌嗪稀释后于低温下(-10 ℃)缓慢滴加入反应体系可大大减少副产物的生成,使得2不需要经过重结晶、柱分离等纯化过程纯度即可达70%以上。
2.2 3的生物活性
3的生物活性实验结果见表3。从表3可见,3a~3p均有一定的抗血小板聚集作用,其中3a,3c,3i,3j活性较强,其对血小板聚集的抑制百分率分别为66.8%, 69.5%, 70.4%和65.2%。3i的活性达到阳性药氯吡格雷的80%以上,值得进一步研究。

表3 3的抗血小板聚集活性Table 3 Anti-platelet aggregation activities of 3
[1] 成碟,刘颖,刘登科,等. 含有取代哌嗪及哌啶结构的噻吩并吡啶类化合物的合成及活性研究[J].中国药学杂志,2009,44(22):1752-1754.
[2] Cheng D, Liu D K, Liu M,etal. Synthesis and activity evaluation of some novel derivatives of 4,5,6,7-tetrahydrothieno[3,2-c]-pyridine[J].Chinese chemical letters,2008,19:689-692.
[3] Cheng D, Liu D K, Liu M,etal. Synthesis,activity evaluation and 3D-QSAR study of some novel derivatives of 4,5,6,7-tetrahydrothieno[3,2-c]pyridine[J].Chinese chemical letters,2008,19:1075-1079.
[4] 周云松,王平保,刘颖,等. 噻吩并四氢吡啶衍生物的合成及其抗血小板聚集活性研究[J].药学学报,2011,46(1):70-74.
[5] 陈继方,王兵,刘颖,等. 氯吡格雷类似物的合成及其抗血小板聚集活性[J].合成化学,2010,18(5):586-590.
[6] 刘登科,王平保,赵专友,等. 噻吩并吡啶取代的乙酰肼衍生物[P].中国 200 510 016 205.X,2005.
[7] 刘登科,刘颖,岳南,等. 一类含腈基的噻吩并吡啶酯类衍生物、其制备方法和用途[P].中国 201 010 171 152.X,2010.
[8] 支爽,郑帼,刘冰妮,等.N-取代-2-{4, 5, 6, 7-四氢噻吩并[3,2-c]吡啶-5-基}乙酰胺的合成及其抗血小板聚集活性[J].合成化学,2012,20(3):312-315.
[9] 刘颖,支爽,穆帅,等. 新型N-取代-2-(2-氯苯基)-2-{6, 7-二氢噻吩并[3,2-c]吡啶-5(4H)-基}乙酰胺的合成及其抗血小板聚集活性[J].合成化学,2011,19(6):718-722.
[10] Husbands S M, Izenwasser S, Kopajtic T,etal. Structure-activity relationships at the monoamine transporters and σreceptors for a novel series of 9-[3-(cis-3, 5-dimethyl-1-piperaziny1) -propy1]carbaz-ole(Rimcazole)analogues[J].Journal of Medicinal Chemistry,1999,42(21):4446-4455.
[11] 陈冬梅,陈凯,汪海. 吗啉环和哌嗪环类衍生物的抗血栓作用及其分子机制[J].药学学报,2003,38(9):641-645.
[12] 蔡佳利,卢一卉,甘淋玲,等. 含哌嗪类抗微生物药物研究进展[J].中国抗生素杂志,2009,34(8):454-462.
[13] Savi P, Herbert J M, Pflieger A M,etal. Importance of hepatic metabolism in the antiaggregating activity of the thienopyridine clopidogrel[J].Biochemical Pharmacology,1992,44(3):527-532.
